Какой химический элемент был открыт при наблюдении за солнечным затмением
Гелий впервые был идентифицирован как химический элемент в 1868 П. Жансеном при изучении солнечного затмения в Индии. При спектральном анализе солнечной хромосферы была обнаружена ярко-желтая линия, первоначально отнесенная к спектру натрия, однако в 1871 Дж. Локьер и П. Жансен доказали, что эта линия не относится ни к одному из известных на земле элементов. Локьер и Э. Франкленд назвали новый элемент гелием от греч. <гелиос>, что означает солнце. В то время не знали, что гелий - инертный газ, и предполагали, что это металл. И только спустя почти четверть века гелий был обнаружен на земле. В 1895, через несколько месяцев после открытия аргона, У. Рамзай и почти одновременно шведские химики П. Клеве и Н. Ленгле установили, что гелий выделяется при нагревании минерала клевеита. Год спустя Г. Кейзер обнаружил примесь гелия в атмосфере, а в 1906 гелий был обнаружен в составе природного газа нефтяных скважин Канзаса. В том же году Э. Резерфорд и Т. Ройдс установили, что a-частицы, испускаемые радиоактивными элементами, представляют собой ядра гелия.

1.Определить экваториальные координаты следующих звёзд: 1) α- Щита 2) β-Близнецов 3) α-Скорпиона 2. Выразите в часовой мере 90° и 105°. 3.Выразите в у … гловой мере прямое восхождение, равное 1) 6 ч 12 мин; 2) 10 ч 42 мин.
На Земле 21 июня наблюдалось частное лунное затмение. На какое число попадает ближайшее к этой дате новолуние?
На Солнце наблюдается пятно с гелиографической широтой φ=19∘ (гелиографическая широта — аналог земной широты, отсчитывается от экватора Солнца). Зная, … что радиус Солнца равен 696000 км, а период вращения на указанной широте равен P=24.7 земных суток, найдите линейную скорость движения пятна. Ответ выразите в км/с, сплюснутостью Солнца пренебречь.
Как называется созвездие, в котором находятся Марс и Юпитер? Как называется главная (самая яркая) звезда созвездия, в котором находятся эти планеты? Г … де находится Марс и Юпитер на картинке?
Известно, что высота однородной атмосферы одной из планет h=30 км при средней плотности атмосферы ρ=6 кг/м3. Средняя плотность вещества самой планеты … в n=800 раз больше плотности атмосферы, а радиус планеты R=6000 км. Во сколько раз масса атмосферы меньше массы этой планеты?
Задача 4. Установить подвижную карту звёздного неба на день и час наблюдения и назвать созвездия, расположенные в южной части неба от горизонта до пол … юса мира; на востоке – от горизонта до полюса мира.Задача 5. Найти созвездия, расположенные между точками запада и севера, 10 октября в 21 час. Проверить правильность определения визуальным наблюдением звёздного неба.Задача 6. Найти на звёздной карте созвездия с обозначенными в них туманностями и проверить, можно ли их наблюдать невооруженным глазом глазом на день и час выполнения лабораторной работы.Задача 7. Определить, будут ли видны созвездия Девы, Рака. Весов в полночь 15 сентября? Какое созвездие в это же время будет находиться вблизи горизонта на севере?Задача 8. Определить, какие из перечисленных созвездий: Малая Медведица, Волопас, Возничий, Орион - для вашей широты будут незаходящими?Задача 9. На карте звёздного неба найти пять любых перечисленных созвездий: Большая Медведица, Малая Медведица, Кассиопея, Андромеда, Пегас, Лебедь, Лира, Геркулес, Северная корона – и определить приближённо небесные координаты (склонение, и прямое восхождение) a-звёзд этих созвездий.Задача 10. Определить, какие созвездия будут находиться вблизи горизонта на Севере, Юге, Западе и Востоке 5 мая в полночь.
Какое образование на Юпитере говорит о его остывании?
На Земле 21 июня наблюдалось частное лунное затмение. На какое число попадает ближайшее к этой дате новолуние? 22 мая 7 июня 21 июня 9 июля 20 июля
Задание 4. Клон 2. На Земле 14 июня наблюдалось частное солнечное затмение. Какая дата в списке попадает ближе всего к ближайшему к 14 июня полнолуни … ю? 29 мая 31 мая 15 июня 2 июля 14 июля 15 июля

Норман Локьер в1868 году, исследуя свет, излучаемый атомами в протуберанцах — огромных выбросах плазмы с поверхности Солнца, — Локьер заметил ряд прежде неизвестных спектральных линий (см. Спектроскопия) . Попытки получить такие же линии в лабораторных условиях окончились неудачей, из чего Локьер сделал вывод, что он обнаружил новый химический элемент. Локьер назвал его гелием, от греческого helios — «Солнце»

Новые вопросы в Химия
Біліміңді тексер 1. Химиялық элемент дегеніміз не? Химиялық элемент және жай зат ұғымдарының айырмашылығы қандай? 2. Келесі тұжырымдардың қайсысында х … имиялық элемент, қайсысында жай зат туралы сөз болады? а) азот пен оттек ауаның негізін құрайды; ә) жер қыртысының жартысы оттектің үлесіне тиеді; б) азот өсімдіктің өсуіне қажет; в) гелий ең алғаш Күннен табылды. 3. Жай заттар қандай үлкен екі топқа бөлінеді және олардың бір- бірінен айырмашылығы неде? 4. Химиялық элементтерді қалай таңбалайтынын білесің бе? 5. Атомдық нөмірлері 6, 8, 12, 18, 22, 33, 29, 79, 80-ге тең химиялық элементтерді периодтық жүйеден тауып көрсетіп, оларды атай аласың ба? 6. Периодтық жүйеде а) ғаламшарлар; ә) атақты ғалымдар; б) мем- лекет; в) қалалар құрметіне аталған элементтер бар ма? 7. Күкірт сөзін пайдаланып, бірінде күкірт жай зат, екіншісінде химиялық элемент екенін білдіретін екі сөйлем құрастыр.
Мирас ата-анасын таңғалдырып, оларға фокус көрсетуді шешті. Ол әкесіне күміснитратына шырша түріндегі мыс сымды салуды ұсынды. Біраз уақыттан кейін мы … ссымның беті шықтанып, күміс ұлпалы шыршаға айналды.а) Мыс сым күміс ұлпалы шыршаға қалай айналғанын түсіндіріңдер.ә) Химиялық реакция теңдеуін жазыңдар.6) Мыс сымдарын басқа металдан жасауға бола ма? Егер болса, онда қандайметалдар, мысалдарын жазыңдар.
Галий элементінің пратон, нейтрон, электрон сандарын есепте және энергетикалық деңгейге орналастыр? 100 балл срочоноооо!
в ходе некой реакции окисления концентрация одного из реагирующих веществ снизилась с 0,24 моль/л до 0,06 моль/л. Определить время протекания химическ … ой реакции, если скорость реакции 0,09 моль/(л×с)
5. Сопоставьте реагенты и продукты реакции: Реагенты Продукты а) железо + серная кислота 1) сульфат железа (II) + водород б) ртуть + соляная кислота 2 … ) не реагирует в) барий + серная кислота 3) хлорид бария + водород 4) сульфат бaрия + водород 5) хлорид ртути (II) + водород
Дана реакция, для данной реакции определите, сколько теплоты выделится при сгорании 2.5 моль углерода C(тв) + O2(г) = CO2(г) + 402 кДж
Химический элемент, лёгкий, бесцветный, не имеющий запаха, химически инертный газ.
ГЕ́ЛИЙ, -я, муж. Химический элемент, инертный газ без цвета и запаха, самый лёгкий газ после водорода.
| прил. гелиевый, -ая, -ое.
ГЕ́ЛИЙ, -я, м
Химический элемент, инертный газ без цвета и запаха, самый легкий газ после водорода.
Гелий получают из природных газов; применяют в криогенной технике, для создания инертных сред, в аэронавтике - для заполнения аэростатов, воздушных шаров и др.
ГЕ́ЛИЙ -я; м. [от греч. hēlios - солнце]. Химический элемент (He), не имеющий запаха химически инертный газ, самый лёгкий после водорода.
◁ Ге́лиевый, -ая, -ое. Г-ое ядро.
Ге́лий (лат. Helium), химический элемент VIII группы периодической системы, относится к благородным газам; без цвета и запаха, плотность 0,178 г/л. Сжижается труднее всех известных газов (при -268,93ºC); единственное вещество, которое не отвердевает при нормальном давлении, как бы глубоко его ни охлаждали. Жидкий гелий - квантовая жидкость, обладающая сверхтекучестью ниже 2,17ºК (-270,98ºC). В небольшом количестве гелий содержится в воздухе и земной коре, где он постоянно образуется при распаде урана и других α-радиоактивных элементов (α-частицы - это ядра атомов гелия). Значительно более распространён гелий во Вселенной, например на Солнце, где он впервые был открыт (отсюда название: от греч. hēlios - Солнце). Получают гелий из природных газов. Применяют в криогенной технике, для создания инертных сред, в аэронавтике (для заполнения стратостатов, воздушных шаров и др.).
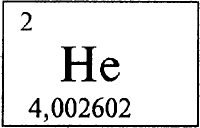
ГЕЛИЙ - ГЕ́ЛИЙ (лат. Helium), He (читается «гелий»), химический элемент с атомным номером 2, атомная масса 4,002602. Относится к группе инертных, или благородных, газов (группа VIIIA периодической системы), находится в 1-м периоде.
Природный гелий состоит из двух стабильных нуклидов: 3 Не (0,00013% по объему) и 4 Не. Почти полное преобладание гелия-4 связано с образованием ядер этого нуклида при -радиоактивном распаде урана, тория, радия и других атомов, происходившем в течение длительной истории Земли.
Радиус нейтрального атома гелия 0,122 нм. Электронная конфигурация нейтрального невозбужденного атома 1s 2 . Энергии последовательной ионизации нейтрального атома равны, соответственно, 24,587 и 54,416 эВ (у атома гелия самая высокая среди нейтральных атомов всех элементов энергия отрыва первого электрона).
Простое вещество гелий - легкий одноатомный газ без цвета, вкуса, запаха.
История открытия
Открытие гелия началось с 1868, когда при наблюдении солнечного затмения астрономы француз П. Ж. Жансен (см. ЖАНСЕН Пьер Жюль Сезар) и англичанин Д. Н. Локьер (см. ЛОКЬЕР Джозеф Норман) независимо друг от друга обнаружили в спектре солнечной короны (см. СОЛНЕЧНАЯ КОРОНА) желтую линию (она получила название D3-линии), которую нельзя было приписать ни одному из известных в то время элементов. В 1871 Локьер объяснил ее происхождение присутствием на Солнце нового элемента. В 1895 англичанин У. Рамзай (см. РАМЗАЙ Уильям) выделил из природной радиоактивной руды клевеита газ, в спектре которого присутствовала та же D3-линия. Новому элементу Локьер дал имя, отражающее историю его открытия (греч. Helios-солнце). Поскольку Локьер полагал, что обнаруженный элемент - металл, он использовал в латинском названии элемента окончание «lim» (соответствует русскому окончанию «ий»), которое обычно употребляется в названии металлов. Таким образом, гелий задолго до своего открытия на Земле получил имя, которое окончанием отличает его от названий остальных инертных газов.
Нахождение в природе
Технология получения гелия очень сложна: его выделяют из природных гелионосных газов, пользуясь методом глубокого охлаждения. Месторождения таких газов имеются в России, США, Канаде и ЮАР. Гелий содержится также в некоторых минералах (монаците, торианите и других), при этом из 1 кг минерала при нагревании можно выделить до 10 л гелия.
Физические свойства
Гелий - легкий негорючий газ, плотность газообразного гелия при нормальных условиях 0,178 кг/м 3 (меньше только у газа водорода). Температура кипения гелия (при нормальном давлении) около 4,2К (или -268,93 °C, это - самая низкая температура кипения).
При нормальном давлении жидкий гелий не удается превратить в твердое вещество даже при температурах, близких к абсолютному нулю (0К). При давлении около 3,76 МПа температура плавления гелия 2,0К. Наименьшее давление, при котором наблюдается переход жидкого гелия в твердое состояние - 2,5МПа (25 ат), температура плавления гелия при этом около 1,1 К (-272,1 °C).
В 100 мл воды при 20 °C растворяется 0,86 мл гелия, в органических растворителях его растворимость еще меньше. Легкие молекулы гелия хорошо проходят (диффундируют) через различные материалы (пластмассы, стекло, некоторые металлы).
Для жидкого гелия-4, охлажденного ниже -270,97 °C, наблюдается ряд необычных эффектов, что дает основание рассматривать эту жидкость как особую, так называемую квантовую, жидкость. Эту жидкость обычно обозначают как гелий-II в отличие от жидкого гелия-I - жидкости, существующей при чуть более высоких температурах. График изменения теплоемкости жидкого гелия с изменением температуры напоминает греческую букву лямбда (l). Температура перехода гелия-I в гелий-II 2,186 К. Эту температуру часто называют l-точкой.
Жидкий гелий-II способен быстро проникать через мельчайшие отверстия и капилляры, не обнаруживая при этом вязкости (так называемая сверхтекучесть (см. СВЕРХТЕКУЧЕСТЬ) жидкого гелия-II). Кроме того, пленки гелия-II быстро перемещаются по поверхности твердых тел, в результате чего жидкость быстро покидает тот сосуд, в который она была помещена. Это свойство гелия-II называют сверхползучестью. Сверхтекучесть гелия-II открыта в 1938 советским физиком П. Л. Капицей (см. КАПИЦА Петр Леонидович) (Нобелевская премия по физике, 1978). Объяснение уникальным свойствам гелия-II дано другим советским физиком Л. Д. Ландау (см. ЛАНДАУ Лев Давидович) в 1941-1944 (Нобелевская премия по физике, 1962).
Никаких химических соединений гелий не образует. Правда, в разреженном ионизированном гелии удается обнаружить достаточно устойчивые двухатомные ионы Не2 + .
Гелий используют для создания инертной и защитной атмосферы при сварке, резке и плавке металлов, при перекачивании ракетного топлива, для заполнения дирижаблей и аэростатов, как компонент среды гелиевых лазеров. Жидкий гелий, самая холодная жидкость на Земле, - уникальный хладагент в экспериментальной физике, позволяющий использовать сверхнизкие температуры в научных исследованиях (например, при изучении электрической сверхпроводимости (см. СВЕРХПРОВОДИМОСТЬ)). Благодаря тому, что гелий очень плохо растворим в крови, его используют как составную часть искусственного воздуха, подаваемого для дыхания водолазам. Замена азота на гелий предотвращает кессонную болезнь (см. КЕССОННАЯ БОЛЕЗНЬ) (при вдыхании обычного воздуха азот под повышенным давлением растворяется в крови, а затем выделяется из нее в виде пузырьков, закупоривающих мелкие сосуды).
ГЕЛИЙ (лат. Helium) - Не, химический элемент VIII группы периодической системы, атомный номер 2, атомная масса 4,002602, относится к благородным газам; без цвета и запаха, плотность 0,178 г/л. Сжижается труднее всех известных газов (при -268,93 .С); единственное вещество, которое не отвердевает при нормальном давлении, как бы глубоко его ни охлаждали. Жидкий гелий - квантовая жидкость, обладающая сверхтекучестью ниже 2,17 К (-270,98 .С). В небольшом количестве гелий содержится в воздухе и земной коре, где он постоянно образуется при распаде урана и других ?-радиоактивных элементов (?-частицы - это ядра атомов гелия). Значительно более распространен гелий во Вселенной, напр., на Солнце, где он впервые был открыт (отсюда название: от греч. helios - Солнце). Получают гелий из природных газов. Применяют в криогенной технике, для создания инертных сред, в аэронавтике (для заполнения стратостатов, воздушных шаров и др.).
Химический элемент, бесцветный, не имеющий запаха химически инертный газ, самый легкий после водорода.
[От греч. ‛ήλιος - солнце]
He (helium), химический элемент из семейства благородных (инертных) газов He, Ne, Ar, Kr, Xe, Rn, составляющих VIIIA подгруппу в периодической системе элементов, или, как ее еще называют, нулевую группу.
История открытия. Гелий впервые был идентифицирован как химический элемент в 1868 П.Жансеном при изучении солнечного затмения в Индии. При спектральном анализе солнечной хромосферы была обнаружена ярко-желтая линия, первоначально отнесенная к спектру натрия, однако в 1871 Дж.Локьер и П.Жансен доказали, что эта линия не относится ни к одному из известных на земле элементов. Локьер и Э.Франкленд назвали новый элемент гелием от греч. "гелиос", что означает солнце. В то время не знали, что гелий - инертный газ, и предполагали, что это металл. И только спустя почти четверть века гелий был обнаружен на земле. В 1895, через несколько месяцев после открытия аргона, У.Рамзай и почти одновременно шведские химики П.Клеве и Н.Ленгле установили, что гелий выделяется при нагревании минерала клевеита. Год спустя Г.Кейзер обнаружил примесь гелия в атмосфере, а в 1906 гелий был обнаружен в составе природного газа нефтяных скважин Канзаса. В том же году Э.Резерфорд и Т.Ройдс установили, что a-частицы, испускаемые радиоактивными элементами, представляют собой ядра гелия.
Распространенность в природе. Содержание гелия в мировом пространстве составляет 28% (второе место после водорода). Гелий - основной компонент звездной материи. В результате углеродного цикла (сложная цепь ядерных реакций), впервые изученного Х.Бете в 1939, водород в звездном веществе превращается в гелий, при этом происходит значительное выделение энергии (см. также ЯДЕРНЫЙ СИНТЕЗ). В земной атмосфере гелий составляет всего 0,0005% об., так как он чрезвычайно легок и слабо удерживается гравитационным полем земли. Гелий образуется при распаде тяжелых радиоактивных элементов, находящихся в расплавленном земном ядре, и медленно диффундирует через земную мантию. Тепловая энергия, выделяющаяся при ядерных процессах, поддерживает ядро земли в расплавленном состоянии. Природный метан, добываемый из скважин, содержит ок. 1,75% гелия и 0,5% CO2. После удаления CO2, глубокого охлаждения природного газа до -185° C и сжатия образуется жидкий метан, а в газовой фазе остаются гелий и азот. Метод глубокого охлаждения позволяет получать гелий чистотой 98% и выше.
Свойства. Гелий имеет одну-единственную электронную оболочку, занятую двумя электронами, т.е. его оболочка полностью заполнена электронами, которые испытывают сильное притяжение ядра, а значит, очень устойчивы; поэтому гелий не вступает в химические реакции, не образует химические соединений и не имеет степеней окисления. Гелий - бесцветный одноатомный газ без запаха; он не вступает в реакции ни с одним химическим элементом, и его атомы не соединяются даже между собой. Наиболее распространенный изотоп 4He содержит в ядре два протона и два нейтрона, поэтому его массовое число равно 4. Более редкий изотоп 3He с одним нейтроном был открыт в 1939 Л.Альваресом и Р.Кернегом. Содержание 3He составляет 10-5% гелия, находящегося в природном газе, добываемом из скважин. 3He получается в ядерных реакциях при распаде трития (3H-изотоп водорода). Гелий - необычное вещество, по свойствам он близок к состоянию идеального газа. СВОЙСТВА
Атомный номер 2 Атомная масса 4,0026 Плотность, г/см3 0,178 Температура плавления, ° С -272,2 (при 26 атм) Температура кипения, ° С -268,93 Критическая температура, К 5,25 Критическое давление, МПа 0,23 Содержание в земной коре, % 0,0000003
Жидкий и твердый гелий. Жидкий гелий обладает рядом уникальных свойств; он имеет самую низкую температуру кипения: 4He кипит при 4,22 K, а 3He - 3,19 K. Это свойство гелия используют для создания низких температур. Гелий - единственное вещество на земле, которое при нормальном давлении не кристаллизуется вблизи абсолютного нуля, что объясняется слабым межатомным взаимодействием и квантовыми свойствами. Жидкий гелий бесцветен, очень текуч и имеет очень низкое поверхностное натяжение. Изотопы гелия в жидком состоянии сильно различаются. Так, 4He имеет две формы: при температурах выше 2,18 K существует 4He, а ниже 2,18 K происходит необычный переход (фазовый переход второго рода) в 4He-II. Если пустой стеклянный сосуд погрузить в 4He-II, то жидкость будет медленно подниматься вверх по стенкам и перетекать внутрь до выравнивания уровней жидкости снаружи и внутри. Если сосуд приподнять, то процесс пойдет обратно до нового выравнивания уровней жидкостей. Это - пленочное движение; оно характерно только для 4He-II. Другое аномальное свойство 4He-II - способность жидкости перетекать из области более низких температур в область более высоких. 4He-II обладает сверхтекучестью (явление сверхтекучести открыл П.Л.Капица в 1938) - свойством, известным только для жидкого гелия. Явление сверхтекучести объясняется на основе двухжидкостной модели. Согласно ей, 4He-II состоит из двух полностью взаимопроникающих жидкостей - нормальной и сверхтекучей; последняя является идеальной жидкостью и не испытывает сопротивления при протекании через узкие капилляры. Согласно теории, в 4He-II существуют необычные температурные волны (второй звук). Объяснение аномалий 4He-II дается на основе представлений квантовой механики. Жидкие 3He и 4He называются квантовыми жидкостями. 4He не имеет ядерного спина, а у 3He он равен 1/2 в единицах постоянной Планка. Удивительное различие состоит также в том, что 4He-II - сверхтекучая жидкость, а сопротивление текучести 3He резко возрастает с уменьшением температуры. Гелий-3 становится, однако, сверхтекучим при температуре примерно 0,001 К, как было открыто в 1972. Это явление аналогично явлению сверхпроводимости, которая рассматривается как сверхтекучесть "электронной жидкости" (см. также СВЕРХПРОВОДИМОСТЬ). В 3He обнаружен новый тип звука при очень низких температурах, нулевой звук, предсказанный Л.Д.Ландау и относящийся к волнам, характерным для ионизованных газов (плазмы).
См. также СВЕРХТЕКУЧЕСТЬ. Растворы изотопов гелия также необычны. Ниже 0,9 K раствор спонтанно делится на две части, образуя раствор, обогащенный 3He и текущий над раствором, обогащенным 4He. 6% 3He растворимы в 4He, но 4He не растворяется в 3He при абсолютном нуле. Твердый гелий можно получить сжатием 4He до 25 атм или 3He до 34 атм при низких температурах. Твердый гелий - кристаллическое прозрачное вещество, причем границу между твердым и жидким гелием трудно обнаружить, так как их рефракции близки.
Применение. Гелий является важным источником низких температур. При температуре жидкого гелия тепловое движение атомов и свободных электронов в твердых телах практически отсутствует, что позволяет изучать многие новые явления, например сверхпроводимость в твердом состоянии. Газообразный гелий используют как легкий газ для наполнения воздушных шаров. Поскольку он негорюч, его добавляют к водороду для заполнения оболочки дирижабля. Так как гелий хуже растворим в крови, чем азот, большие количества гелия применяют в дыхательных смесях для работ под давлением, например при морских погружениях, при создании подводных тоннелей и сооружений. При использовании гелия декомпрессия (выделение растворенного газа из крови) у водолаза протекает менее болезненно, менее вероятна кессонная болезнь, исключается такое явление, как азотный наркоз, - постоянный и опасный спутник работы водолаза. Смеси He-O2 применяют, благодаря их низкой вязкости, для снятия приступов астмы и при различных заболеваниях дыхательных путей. Гелий используют как инертную среду для дуговой сварки, особенно магния и его сплавов, при получении Si, Ge, Ti и Zr, для охлаждения ядерных реакторов. Другие применения гелия - для газовой смазки подшипников, в счетчиках нейтронов (гелий-3), газовых термометрах, рентгеновской спектроскопии, для хранения пищи, в переключателях высокого напряжения. В смеси с другими благородными газами гелий используется в наружной неоновой рекламе (в газоразрядных трубках). Жидкий гелий выгоден для охлаждения магнитных сверхпроводников, ускорителей частиц и других устройств. Необычным применением гелия в качестве хладагента является процесс непрерывного смешения 3He и 4He для создания и поддержания температур ниже 0,005 K.
Фастовский В.Г. и др. Инертные газы. М., 1972
ГЕЛИЙ (Helium), He, химический элемент VIII группы периодической системы, атомный номер 2, атомная масса 4,002602; относится к благородным газам; самое низкокипящее вещество (tкип -268,93°C), единственное не отвердевающее при нормальном давлении; квантовая жидкость, обладающая сверхтекучестью ниже - 270,98°C. Г. - самый распространенный после водорода элемент космоса. Используют гелий как защитную среду в металлургии, ракетной технике, при производстве полупроводниковых и других материалов, как компонент среды газовых лазеров, газ-носитель в хроматографии, теплоноситель в ядерных реакторах и др. Открыт гелий в атмосфере Солнца английским астрофизиком Н. Локьером и французским астрономом Ж. Жансеном в 1868, впервые выделен английскими физиками У. Рамзаем и В. Круксом в 1895.
Читайте также:


