Тест 8 щелочные металлы
Тесты по химии 11 класс. Тема: "Металлы"
Правильный вариант ответа отмечен знаком +
1. В какой группе находится металл полоний:
2. К четвертой группе относится элемент:
3. Как проходит условная граница между между металлическими и неметаллическими элементами:
4. Металлургический процесс включает в себя:
+ восстановление ионов металла
- окисление ионов неметалла
- восстановление ионов неметалла
5. Пирометаллургией является:
+ процесс получения металлов из их соединений при высокой температуре
- процесс получения неметаллов из их соединений при низкой температуре
- процесс получения неметаллов из их соединений при высокой температуре
6. В пирометаллургии используются:
- как восстановители, так и окислители
7. При алюмотермии используют металл:
8. В гидрометаллургии получают:
+ металлы из растворов их соединений
- неметаллы из растворов их соединений
- воду из растворов их соединений
9. В электрометаллургии используется процесс:
- обработка при предельно высокой температуре
- реакция замещения и соединения
тест 10. При электролизе восстановителем является:
11. Чем определяются физические свойства металлов:
+ типом кристаллической решетки
- количеством протонов, электронов, нейтронов
- расположением в определенной группе или подгруппе
12. Отличием атомов металлов от неметаллов можно назвать:
+ содержат небольшое количество электронов на внешнем уровне, большой радиус и низкая электроотрицательность
- содержат большое количество электронов на внешнем энергетическом уровне, маленький радиус и высокая электроотрицательность
- содержат большое количество электронов на внешнем энергетическом уровне, большой радиус и высокая электроотрицательность
13. Металлической является связь:
+ между ионами металлов
- между ионами неметаллов
- между ионами металла и неметалла
14. Для какого агрегатного состояния не характерна металлическая связь:
- для жидкого состояния
- для твердого состояния
15. Чем обусловлена электропроводность металлов?
+ наличием свободных электронов
- наличием свободных нейтронов
- наличием свободных протонов
16. С повышением температуры электропроводность:
- может как повышаться, так и понижаться
17. Электропроводность увеличивается от:
+ ртути к серебру
- алюминия к цинку
18. Максимальной теплопроводностью обладает:
19. Наиболее пластичным металлом называют:
тест-20. Твердым веществом при нормальных условиях не является:
21. Самым твердым металлом является:
- щелочно – земельные металлы
22. Самым тяжелым металлом является:
23. Самым тугоплавким металлом является:
24. К черным металлам можно отнести:
25. Какие степени окисления имеют металлы:
- как положительные, так и отрицательные
26. Металлы в соединениях проявляют свойства:
- окислительно – восстановительные свойства
27. Какая закономерность уменьшения восстановительных свойств металлов:
+ слева направо, снизу-вверх
- справа налево, сверху вниз
28. На данном изображении представлена:
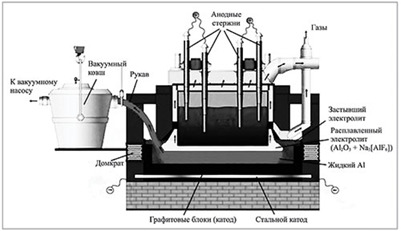
+ схема получения алюминия электролизом
- схема получения железа электролизом
- схема получения гидроксида алюминия электролизом
29. Чем левее находится металл в ряду, тем:
+ больше его восстановительная способность
- меньше его восстановительная способность
- больше его окислительная способность
тест_30. Лантаноиды на внешнем энергетическом уровне содержат по:
31. Сколько примерно имеются металлов в периодической системе Менделеева:
+ более девяти ста
- менее восьми ста
- менее двадцати ста
32. Во сколько раз литий легче осмия:
+ в сорок пять раз
- в шестьдесят раз
- в семьдесят раз
33. Провода высоковольтных изготавливают из:
34. Бронза является сплавом:
- железа и алюминия
- вольфрама и серебра
35. На данном рисунке представлена:
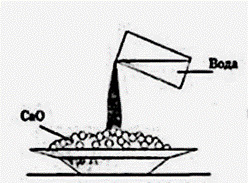
+ реакция гашения извести водой
- реакция соединения калия с хлором
- окисление перманганата калия
36. При взаимодействии с кислородом металлы образуют:
37. При взаимодействии щелочноземельных металлов с водой образуются:
- альдегиды и кетоны
38. Оксидом железа можно назвать:
39. В алюминотермии используется:
тест*40. Взаимодействие металлов с оксидами является реакцией:
Тест по теме Щелочные металлы
N.B. Разделение на темы вопросов по химии носит приблизительный характер, так как сам формат большинства вопросов ЕГЭ по химии исключает возможность однозначного отнесения вопроса к одной определённой теме.
7068. В пробирку с раствором вещества X добавили по каплям раствор вещества Y. При этом сначала наблюдали выпадение осадка, а затем - его растворение.
Из предложенного перечня выберите два вещества, которые могут вступать в описанную реакцию.

Верный ответ: 13
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7068.
7233. Гидрокарбонат натрия смешали с раствором гидроксида натрия. К полученному раствору добавили раствор бромида хрома(III), наблюдали выпадение осадка и выделение газа. Осадок отделили и поместили в раствор, содержащий пероксид водорода и гидроксид натрия, и нагрели. Полученную соль поместили в раствор азотной кислоты и наблюдали изменение окраски раствора.
Напишите уравнения описанных реакций.
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7233.
7268. Через раствор гидроксида калия пропустили сначала недостаточное, а затем избыточное количество углекислого газа. Полученную соль обработали разбавленной азотной кислотой. Полученный раствор выпарили досуха, а остаток прокалили.
Напишите уравнения четырёх описанных реакций.
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7268.
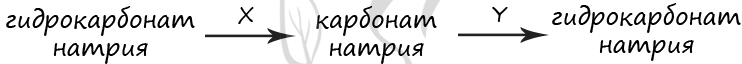
1) соляная кислота
2) карбонат кальция
3) гидроксид натрия
4) углекислый газ
5) карбонат бария
Верный ответ: 34
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7386.
7488. В пробирку с раствором вещества X добавили раствор кислоты Y. В результате произошла реакция, которую описывает следующее сокращённое ионное уравнение:
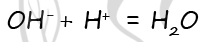
1) серная кислота
2) гидроксид бария
3) сульфид калия
4) угольная кислота
5) гидроксид натрия
Верный ответ: 51
P.S. Нашли ошибку в задании? Пожалуйста, сообщите о вашей находке ;)
При обращении указывайте id этого вопроса - 7488.
Щелочные металлы: расположение в псхэ, свойства и применение

Внимание! Все тесты в этом разделе разработаны пользователями сайта для собственного использования. Администрация сайта не проверяет возможные ошибки, которые могут встретиться в тестах.
Список вопросов теста
Вопрос 1
Щелочные металлы - это элементы .
- первой А группы
- второй А группы
- третьей А группы
Вопрос 2
Почему щелочные металлы в свободном виде в природе не существуют?
- хорошо смешиваются с другими веществами
- их очень мало
- из-за очень высокой активности
Вопрос 3
Щелочные металлы хранят под слоем
- дистиллированной воды
- ацетона
- керосина
Вопрос 4
Щелочные металлы проявляют только степень окисления
Вопрос 5
При реакции лития с кислородом образуется
- надпероксид лития
- пероксид лития
- оксид лития
Вопрос 6
При реакции натрия с кислородом образуется
- надпероксид натрия
- пероксид натрия
- оксид натрия
Вопрос 7
Каустическая сода - это
- гидроксид калия
- гидроксид натрия
- гидроксид лития
Вопрос 8
Верны ли следующие высказывания?
- хлорид натрия - это поваренная соль, ценное химическое сырьё. электролизом его раствора получают гидроксид натрия, хлор, водород.
- хлорид калия - это пищевая приправа, необходимый компонент пищи.
- гидрокарбонат натрия - это пищевая или питьевая сода
Вопрос 9
В какой цвет катионы металлов окрашивают пламя спиртовки?
Вопрос 10
Выберите все металлы, которые относятся к щелочным
Вопрос 11
Сколько электронов содержат на внешнем энергетическом уровне атомы щелочных металлов
- 1 электрон
- 2 электрона
- 3 элетрона
Вопрос 12
Выберите важнейшие природные соединения щелочных металлов
- железный колчедан
- сильвин
- сильвинит
- медный купорос
- галит
Вопрос 13
Определите вещество по описанию: Это один из компонентов чёрного пороха. Таким пороховым зарядом снаряжали пушки, ружья. Но теперь у этого вещества вполне "мирные профессии" - его используют в качестве удобрения, в производстве стёкол, как консервант в пищевой промышленности.
- Карбонат калия
- Сульфат натрия
- Нитрат калия
Вопрос 14
Определите о каком веществе идт речь:" Используют в качестве удобрения, для получения гидроксида калия. Стёкла и линзы, выточенные из больших кристаллов этого вещества , применяют в специальных оптических приборах, поскольку они пропускают ультрофиолетовое излучение. "
Тест 8 щелочные металлы
Тесты по химии 9 класс. Тема: "Щелочные металлы"
1. К какой группе относятся щелочные металлы:
2. Какой элемент можно отнести к щелочным металлам:
3. Оксиды щелочных металлов при взаимодействии с водой образуют:
4. Какая степень окисления на внешнем энергетическом уровне у щелочных металлов:
5. Щелочные металлы являются:
- как восстановителями, так и окислителями
6. От лития к цезию:
+ увеличивается радиус атомов и уменьшается электроотрицательность
- уменьшается радиус атома и уменьшается электроотрицательность
- увеличивается радиус атома и увеличивается электроотрицательность
7. Какой цвет имеют щелочные металлы:
8. Кто впервые получил калий и натрий:
9. Формулой глауберовой соли является:
- KCl * MgCl2 * 6 H2O
тест 10. Каким путем получают щелочные металлы:
11. С галогенами щелочные металлы образуют:
12. При сгорании на воздухе какой металл образует оксид:
13. Какой металл образуется пероксид:
14. При взаимодействии металла с водородом образуется:
15. При каких условиях хранят натрий и калий:
+ под слоем керосина
- под слоем подсолнечного масла
- под слоем металлической пластинки
16. В какой цвет окрашивает катион лития пламя горелки:
17. Воздействие щелочи проявляется:
18. Поваренную соль используют:
+ для приготовления пищи
- для дезинфекции поверхностей
- в качестве анальгетического средства
19. Какая концентрация хлорида натрия содержится в физиологическом растворе:
тест-20. Главным внеклеточным ионом является:
21. Калийные удобрения используют в:
- в машинном производстве
- в пищевой промышленности
22. Температура плавления увеличивается:
+ от цезия к литию
- от лития к цезию
- от натрия к калию
23. Реакцией образования пероксида натрия является:
+ 2 Na + O2 = Na 2 O2
- 2 K + O2 = K2 O 2
- 4 Li + O2 = 2 Li O
24. Какая степень окисления в пероксидах:
25. Из пероксида натрия можно получить:
26. Реакцией получения пероксида натрия является:
+ Na2O2 + H2O = 2NaOH + H2O2
- 6 Li + N2 = 2Li3N
- 2Cs + 2H20 = 2CsOH + H2 (газ)
27. При взаимодействии лития с азотом образуется:
28. Каустической содой называют:
29. Гидроксид калия используется в:
- для очистки нефти и масел
- в производстве искусственных волокон
тест_30. Химические свойства щелочных металлов определяются:
- природой как катиона, так и аниона
31. На данной фотографии изображено пламя при горении металла. Какой металл горит в данном случае?

32. Электролизом хлорида натрия получают:
33. Из хлорида калия изготавливают:
34. Технической содой называют:
35. Питьевой содой можно назвать:
36. При нагревании гидрокарбонат разлагается на:
+ NaHCO3 = t = Na2CO3 + H20 + CO 2 (газ)
- NaHCO3 =t= H2CO3 + NaOH + O2 (газ)
- NaHCO3 = Na2CO3 + NaOH + CO2 (газ)
37. Гидрокарбонат натрия используют:
+ при изготовлении кондитерского блюда
- при производстве антидепрессантов
38. Карбонат калия обычно называют:
39. В каком году Иоганн Рудольф Глаубер открыл сульфат натрия:
Щелочные металлы
Вопросы теста "Щелочные металлы" соответствуют вопросам ЕГЭ по данной теме. Времени 15 минут. Система оценивания 5-бальная. Удачи!
Установите соответствие между исходными(-ым) веществами(-ом), вступающими(-им) в реакцию, и продуктами этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- А) KHCO3 и HCl
- Б) KHCO3 и KOH
- В) Cl2 и KOH → (t°)
- Г) KHCO3 → (t°)
- А) Al2O3
- Б) NaOH
- В) H2S
- Г) I2
Из предложенного перечня типов реакций выберите два, к которым можно отнести реакцию, протекающую между растворами гидроксида калия и хлорида меди(II):
- практически необратимая
- реакция обмена
- окислительно-восстановительная
- реакция гидролиза
- реакция нейтрализации
Установите соответствие между схемой реакции и продуктами, которые образуются в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- А) KOH + Cl2 → (t°)
- Б) KOH + Cl2 → (0 °C)
- В) KClO3 → (t°, кат.)
- Г) KClO3 → (t°)
Задана следующая схема превращений веществ:
Определите, какие из указанных веществ являются веществами X и Y.
- 1) ZnSO4
- 2) ZnO
- 3) K2[Zn(OH)4]
- 4) (ZnOH)2S
- 5) ZnS
В пробирку с раствором вещества X добавили по каплям раствор вещества Y. При этом сначала наблюдали выпадение осадка, а затем - его растворение.
- 1) SnCl2
- 2) NH4Cl
- 3) NaOH
- 4) H2SO4
- 5) MgCl2
В пробирку с раствором вещества X добавили раствор кислоты Y. В результате произошла реакция, которую описывает следующее сокращённое ионное уравнение:
Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанную реакцию.
- 1) серная кислота
- 2) гидроксид бария
- 3) сульфид калия
- 4) угольная кислота
- 5) гидроксид натрия
В схеме превращений, протекающих в водном растворе
веществами «X» и «Y» соответственно являются
- 1) соляная кислота
- 2) карбонат кальция
- 3) гидроксид натрия
- 4) углекислый газ
- 5) карбонат бария
Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Читайте также:
