Строение и физические свойства металлов
Характерными свойствами металлов являются наличие металлического блеска и пластичности, высокая электро- и теплопроводность. Характерные свойства металлов обусловлены их строением.
Атомы металлов не однородны. Атом состоит из положительно заряженного тяжелого ядра, и окружающих ядро отрицательно заряженных электронов. Число электронов равно порядковому номеру элемента в таблице Д.И. Менделеева. В ядре атома находятся положительно заряженные элементарные частицы, называемые протонами. Количество протонов равно количеству окружающих ядро электронов. Кроме протонов, в ядре находятся тяжелые электрически нейтральные частицы – нейтроны. Масса электрона в 1840 раз меньше массы протона или нейтрона. Таким образом, вся масса атома сосредоточена в его ядре.
Электроны быстро вращаются вокруг ядра. Внешние, так называемые валентные, электроны у всех металлов относительно слабо связаны с ядром. Слабой связью внешних валентных электронов с ядром и объясняются характерные металлические свойства.
Замечание
Между понятием «металл» как химический элемент и как вещество есть некоторая разница. Химия делит все элементы на металлы и неметаллы по их поведению в химических реакциях. Теория металлического состояния рассматривает крупные скопления атомов металлов, в котором они обладают характерными металлическими свойствами: пластичностью, высокой тепло- и электропроводностью, металлическим блеском. Эти свойства характерны для больших групп атомов. У отдельных атомов таких свойств нет.
Атомы в металле находятся в ионизированном состоянии. Атомы металлов, отдавая часть внешних валентных электронов, превращаются в положительно заряженные ионы. Свободные электроны непрерывно перемещаются между ними, образуя подвижный электронный газ.
При комнатной температуре все металлы, кроме ртути, представляют собой твердые тела, имеющие кристаллическое строение. Для кристаллов характерно строго определенное расположение в пространстве ионов, образующих кристаллическую решетку.
Металлы имеют кристаллические решетки различных типов. Каждая кристаллическая решетка может быть охарактеризована элементарной кристаллической ячейкой.
Элементарная кристаллическая ячейка – наименьший комплекс атомов, повторяя который многократно, можно построить весь кристалл.
У металлов чаще всего встречаются три типа элементарных кристаллических ячеек:
В кубической объемноцентрированной (ОЦК) решетке восемь ионов располагаются по вершинам и один в центре куба, на пересечении диагоналей. Объемноцентрированную кубическую решетку имеют кристаллы железа при комнатной температуре, хрома, вольфрама, молибдена, ванадия и др. Эта решетка характеризуется всего одним параметром решетки – расстоянием между центрами двух ионов, расположенных по одному ребру, обозначенным на рисунке а.
Многие металлы, используемые в технике, имеют гранецентрированную кубическую решетку. В элементарной решетке гранецентрированного куба ионы расположены по вершинам куба и в центре каждой грани (на пересечении ее диагоналей). Центр куба остается свободным. Такую кристаллическую решетку имеют кристаллы меди, никеля, алюминия, свинца, серебра и др. гранецентрированная решетка также характеризуется одним параметром – длиной ребра куба а.
Элементарная ячейка гексагональной плотноупакованной решетки представляет собой шестигранную призму. По основаниям призмы расположены правильные шестиугольники по вершинам которых и в их центрах находятся ионы. Посередине между основаниями вклинивается правильный треугольник с ионами по вершинам.
Гексагональная решетка характеризуется двумя параметрами: а и с. Наибольшая плотность упаковки достигается при соотношении параметров с/а = 1.633. Гранецентрированная решетка с таким соотношением параметров называется гранецентрированной плотноупакованной. Такую решетку имеют титан, цирконий, кобальт, цинк, магний и др.
Строение металлических сплавов
Под металлическим сплавом понимают вещество, получаемое сплавлением двух или более элементов, обладающее характерными металлическими свойствами.
Металлические сплавы получают сплавлением элементов – металлов или металлов с неметаллами при преимущественном содержании металлов. Строение сплавов сложнее, чем чистых металлов.
При кристаллизации жидкого сплава могут получаться твердые металлические сплавы с различным строением.
Механическая смесь двух чистых металлов А и В получается в том случае, когда в процессе кристаллизации сплава из жидкого состояния разнородные атомы не входят в общую кристаллическую решетку. В механической смеси каждый металл образует самостоятельные кристаллы. Кристаллы каждого их металлов, находящиеся в этом сплаве, обладают теми же строением и свойствами, которыми они обладают в куске чистого металла.
Твердый раствор – сплав, у которого атомы растворимого элемента размещены в кристаллической решетке растворителя. На микрошлифе твердого раствора кристаллы после травления выглядят одинаково. В кристаллах твердого раствора существует только один тип кристаллической решетки. Растворителем является тот элемент, кристаллическую решетку которого имеет твердый раствор. Растворимый элемент может либо замещать элемент-растворитель в узлах кристаллической решетки, либо располагаться в междоузлиях. По типу расположения атомов растворимого элемента в кристаллической решетке твердые растворы делят на две группы: замещения и внедрения.
Твердые растворы внедрения образуют металлы с неметаллами. Атомы неметаллов меньше атомов металлов. Поэтому атомы неметаллов могут располагаться в междоузлиях кристаллической решетки металлов. Внедрившийся атом вызывает искажение решетки металла-растворителя. Все твердые растворы внедрения – растворы с ограниченной растворимостью.
Химические соединения металлы образуют как с металлами так и с неметаллами. Химическое соединение характеризуется определенной температурой плавления, скачкообразным изменением свойств при изменении состава. Химические соединения металлов с неметаллами образуются при строго определенных соотношениях входящих в них элементов, соответствующих нормальным валентностям. Химические соединения обладают повышенной твердостью и пониженной пластичностью. Кристаллическая решетка химического соединения имеет сложное строение.
Диаграмма состояния
Диаграмма состояния представляет собой графическое изображение состояния сплава. Если изменится состав сплава, его температура, давление, то состояние сплава изменится, и это находит отражение в диаграмме состояния.
Диаграмма состояния показывает устойчивые состояния, которые при данных условиях обладают минимальным уровнем свободной энергии. Поэтому диаграмма состояния может также называться диаграммой равновесия, поскольку показывает, какие при данных условиях существуют равновесные фазы. Следовательно, и изменения в состоянии, которые отображены на диаграмме, относятся к равновесным условиям, т.е. при отсутствии перенагрева или переохлаждения. Так как превращения в отсутствии перенагрева или переохлаждения в действительности не могут совершаться, поэтому диаграмма состояния представляет собой теоретический случай.
Общие закономерности сосуществования устойчивых фаз, отвечающих теоретическим условиям равновесия, описываются правилом фаз или законом Гиббса.
Закон Гиббса дает количественную зависимость между степенью свободы системы и количеством фаз и компонентов.
Фазой называется однородная часть системы, отделенная от других частей системы (фаз) поверхностью раздела, при переходе через которую химический состав или структура вещества изменяется скачком.
Однородная жидкость – однофазная система.
Смесь двух видов кристаллов – двухфазная система.
Компонентами называются вещества, образующие систему.
Чистый металл – однокомпонентная система.
Сплав двух металлов – двухкомпонентная система.
Среди диаграмм состояния металлических сплавов самое большое значение имеет диаграмма состояния системы железо-углерод. Это объясняется наиболее широким применением в технике железоуглеродистых сплавов.
Диаграмма железо-углерод относится к диаграммам состояния для сплавов с ограниченной растворимостью. Диаграмма железо-углерод, как ясно из названия, должна распространяться от железа до углерода. Железо образует с углеродом ряд химических соединений, но надежно установлено лишь одно Fe3C – карбид железа или цементит. Каждое устойчивое химическое соединение можно рассматривать как компонент, а диаграмму изучать по частям.
Следовательно, рассматривая диаграмму железо-углерод на участке от железа до цементита, мы можем компонентами системы считать железо и цементит.
Рассмотрим свойства отдельных компонентов.
Железо. Температура плавления 1539 °С. Железо аллотропическое вещество. Атомы элемента могут образовывать, если исходить только из геометрических соображений, любую кристаллическую решетку. Однако устойчивым, а, следовательно, реально существующим типом является решетка, обладающая наиболее низким запасом свободной энергии.
В ряде случаев (и для железа в том числе) при изменении температуры или давления может оказаться, что для одного и того же металла более устойчивой будет другая решетка, чем та, которая была при другой температуре или давлении.
Так для железа характерны две кристаллические решетки:
• объемноцентрированный куб;
• гранецентрированный куб.
Существование одного металла в нескольких кристаллических формах носит название полиморфизма или аллотропии. Различные кристаллические формы одного и того же вещества называются полиморфными или аллотропическими модификациями. Аллотропические формы обозначаются греческими буквами α, β, γ и т.д., которые в виде индексов добавляются к символу, обозначающему элемент. Аллотропическая форма, существующая при самой низкой температуре, обозначается через α, следующая через β и т.д. Превращение одной аллотропической формы в другую при нагреве чистого металла сопровождается поглощением тепла и происходит при постоянной температуре. На термической кривой превращение отмечается горизонтальным участком. При охлаждении происходит выделение тепла теоретически при той же температуре, что и при нагреве, но практически при более низкой вследствие переохлаждения.
Явление полиморфизма основано на едином законе об устойчивости состояния с наименьшим запасом энергии.
Запас свободной энергии зависит от температуры. Поэтому в одном интервале температур более устойчивой является модификация α, а в другом модификация γ.
Железо имеет две температуры полиморфного превращения: 911 и 1392 °С.
Особо следует рассмотреть образование растворов углерода в железе. Растворимость С в Fe существенно зависит от того, в какой кристаллической форме существует железо.
Диаметр атома углерода (в свободном состоянии) равен 1.54 A. В объемноцентрированной решетке имеется 12 свободных мест в середине ребер. Диаметр такого свободного места 0.62 A. Такой объем явно недостаточен для помещения в нем атома углерода.
В гранецентрированной кристаллической решетке в центре имеется пора диаметром 1.02 A. В этой поре атом углерода может поместиться, вызывая естественно некоторое увеличение размера решетки γ-железа.
Таким образом, геометрические соображения подсказывают, что α-железо не растворяет, а γ-железо растворяет углерод. В действительности α-железо растворяет углерод, но в очень небольшом количестве ≈ 0.02%.
Твердый раствор углерода в α-железе называется ферритом, а в γ-железе аустенитом.
Цементит. Цементит – это химическое соединение углерода с железом (карбид железа Fe3C).
Так как растворимость углерода в α-железе мала, то при нормальных температурах в подавляющем большинстве случаев в структуру стали входят высокоуглеродистые фазы в виде цементита.
Кристаллическая структура цементита очень сложна.
Температура плавления цементита 1600 °С. Аллотропических превращений не испытывает. Цементит имеет высокую прочность ~ 800 НВ и практически нулевую пластичность.
Цементит — соединение неустойчивое и при определенных условиях распадается с образованием свободного углерода в виде графита. Процесс имеет огромное практическое значение.
Историческая справка. Начало изучению диаграммы железо-углерод (а также железоуглеродистых сплавов и процессов термической обработки) было положено работой Чернова Д.К. «Критический обзор статей Лаврова и Калакуцкого о стали и стальных орудиях и собственные исследования Д.К.Чернова по этому же предмету», опубликованной в 1868 году. Этот год можно считать годом возникновения науки металловедения.
В этой работе Чернов впервые указал на существование в стали критических точек, и на зависимость их положения от содержания углерода. Таким образом, Чернов дал первое представление о диаграмме железо-углерод.
Диаграмма железо-цементит имеет двойную концентрационную ось абсцисс. Содержание углерода и содержание цементита.
Линия ABCD является ликвидусом. Это линия – геометрическое место точек начала кристаллизации. Линия AHJECF – солидус. Геометрическое место точек конца кристаллизации.
Так как железо с углеродом образует химическое соединение Fe3C, и еще имеет две аллотропические формы α и γ следовательно в системе существуют следующие фазы:
• жидкость (жидкий раствор углерода в железе) располагается выше линии ликвидус и обозначается Ж;
• цементит Fe3C – вертикаль DFKL, обозначается Ц;
• феррит – структурная составляющая, которая представляет собой α-железо, растворяющая в незначительном количестве углерод, область феррита левее линий GPQ и AHN, обозначается Feα;
• аустенит – структура, представляющая собой твердый раствор углерода в γ-железе, область аустенита на диаграмме NJESG, обозначается Feγ.
Три горизонтальные линии на диаграмме HJB, ECF, PSK указывают на протекание трех нонвариантных реакций. Вариантность – это число степеней свободы системы. Если число степеней свободы равно нулю (нонвариантная система), то нельзя изменить внешние и внутренние факторы системы (температуру, давление, концентрацию) без того, чтобы это не вызвало изменение числа фаз.
При 1499 °С (линия HJB) протекает перитектическая реакция:
Ж + Feα → Feγ
Перитектическая реакция представляет собой реакцию, когда жидкость реагирует с ранее выпавшими кристаллами и образует новый вид кристаллов.
В результате перитектической реакции образуется аустенит. Реакция имеет место только у сплавов, содержащих углерода от 0.1 до 0.5%.
При температуре 1147 °С (горизонталь ECF) протекает эвтектическая реакция:
Ж → Feγ + Ц
Эвтектическая реакция – реакция кристаллизации одновременно двух (или более) видов кристаллов из жидкости. Механическая смесь двух (или более) видов кристаллов называется эвтектикой. В результате этой реакции образуется эвтектическая смесь. Эвтектическая смесь аустенита и цементита называется ледебуритом. Эта реакция протекает у всех сплавов, содержащих углерода > 2.14%.
При температуре 727 °С (горизонталь PSK) протекает эвтектоидная реакция:
Feγ → Feα + ЦII
Превращение протекает аналогично кристаллизации эвтектики, но исходным раствором является не жидкость, а твердый раствор.
Такое превращение называется эвтектоидным, а смесь полученных кристаллов эвтектоидом. Эвтектоидная смесь феррита и цементита называется перлитом и имеет вид перламутра. У всех сплавов, содержащих свыше 0.02% углерода, т.е. практически у всех промышленных железоуглеродистых сплавов имеет место перлитное (эвтектоидное) превращение.
Кристаллы выделившиеся из твердого раствора называются вторичными кристаллами и обозначаются символом II (например Цп) в отличие от первичных кристаллов, выделяющихся из жидкости.
У всех сплавов, содержащих менее 2.14% углерода, в результате первичной кристаллизации получается структура аустенита; у всех сплавов содержащих более 2.14% углерода, структура состоит из ледебурита с избыточным аустенитом или цементитом.
Это различие в структуре при высоких температурах и создает существенное отличие в технологических и механических свойствах сплавов.
Наличие эвтектики делает сплав нековким, вместе с тем более низкая температура плавления высокоуглеродистых сплавов облегчает применение их как литейных материалов.
Железоуглеродистые сплавы, содержащие менее 2.14% углерода называются сталями, а более 2.14% — чугунами.
Что такое металлы и их строение
Определение металлов можно дать с позиций химии, физики и техники.
В химии металлы — это химические элементы, находящиеся в левой части периодической системы элементов Д. И. Менделеева, которые обладают особым механизмом взаимодействия валентных электронов (ионов) с ядром как в самих металлах, так и при вступлении в химические реакции с другими элементами, в том числе с металлами.
Физика характеризует металлы как твердые тела, обладающие цветом, блеском, способностью к плавкости (расплавлению) и затвердеванию (кристаллизации), тепло- и электропроводностью, магнитными и другими свойствами.
В технике металлы — это конструкционные материалы, обладающие высокой обрабатываемостью (ковкостью, штампуемостью, обрабатываемостью резанием, паяемостью, свариваемостью и др.), прочностью, твердостью, ударной вязкостью и рядом других ценных свойств, благодаря которым они находят широкое применение.
Русский ученый М. В. Ломоносов (1711 — 1765), исследуя металлы и неметаллы в своем труде «Первые основания металлургии или рудных дел», дал металлам определение: «Металлом называется светлое тело, которое ковать можно. Таких тел находим только шесть: золото, серебро, медь, олово, железо и свинец». Это определение М. В. Ломоносов дал в 1773 г., когда известны были только шесть металлов.
Из металлов, добываемых из недр земли, получают большую группу конструкционных материалов, применяемых в различных отраслях промышленности. В природе одни металлы встречаются в чистом, самородном виде, другие — в виде оксидов (соединений металла с кислородом), нитридов и сульфидов, из которых состоят различные руды этих металлов.
Самыми распространенными металлами, применяемыми в качестве конструкционных материалов, являются железо, алюминий, медь и сплавы на основе этих металлов.
К металлам относятся более 80 элементов периодической системы Менделеева. Все эти металлы подразделяются на две большие группы: черные металлы и цветные металлы.
Характерными признаками черных металлов являются темно-серый цвет, блеск, высокие плотность и температура плавления, твердость, прочность, вязкость и полиморфизм (аллотропия). По физикохимическим свойствам черные металлы подразделяют на пять групп:
- железистые (железо, кобальт, никель, марганец);
- тугоплавкие (вольфрам, рений, тантал, молибден, ниобий, ванадий, хром, титан и др.);
- урановые — актиниды (уран, торий, плутоний и др.);
- редкоземельные — лантаниды (лантан, церий, иттрий, скандий и др.);
- щелочно-земельные (литий, натрий, калий, кальций и др.).
Из этих пяти групп черных металлов особенно широкое применение в промышленном производстве находят железистые и тугоплавкие металлы.
Железистые металлы, кроме марганца, называют еще ферромагнетиками. Ферромагнетики способны намагничиваться и притягивать металлы своей группы.
К тугоплавким относятся металлы, которые имеют температуру плавления выше температуры плавления железа (1 539 °С): титан — 1 667 °С, ванадий — 1 902 °С, хром — 1 903 °С, молибден — 2 615 °С, ниобий — 2 460 °С, тантал — 2 980 °С, вольфрам — 3 410 °С. Тугоплавкие металлы в основном применяются как легирующие элементы в производстве жаропрочных, жаростойких, теплостойких и специальных сплавов, в том числе твердых сплавов и высоколегированных сталей.
2. Строение металлов
Атомно-кристаллическая структура металлов. Как известно, все вещества состоят из атомов, в том числе и металлы. Каждый металл (химический элемент) может находиться в газообразном, жидком или твердом агрегатных состояниях. Каждое агрегатное состояние будет иметь свои особенности, отличные друг от друга. В газообразном металле расстояние между атомами велико, силы взаимодействия малы и атомы хаотично перемещаются в пространстве; газ стремится к расширению в сторону большего объема. При понижении температуры и давления вещество переходит в жидкое состояние. Свойства жидкого вещества резко отличаются от свойств газообразного. В жидком металле атомы сохраняют лишь так называемый ближний порядок атомов, т. е. в объеме расположено небольшое количество атомов, а не атомы всего объема. При понижении температуры жидкий металл переходит в твердое состояние, которое имеет строгую закономерность расположения атомов.
Если условно провести вертикальные и горизонтальные линии связи через центры атомов, можно увидеть, что у металлов в твердом состоянии атомы расположены в строго определенном порядке и представляют собой множество раз повторяющиеся элементарные геометрические фигуры — параллелепипеды (рис. 1). Наименьшую геометрическую фигуру называют элементарной ячейкой. Элементарные ячейки, расположенные на горизонтальных и вертикальных кристаллографических плоскостях (рис. 2), образуют пространственную кристаллическую решетку.
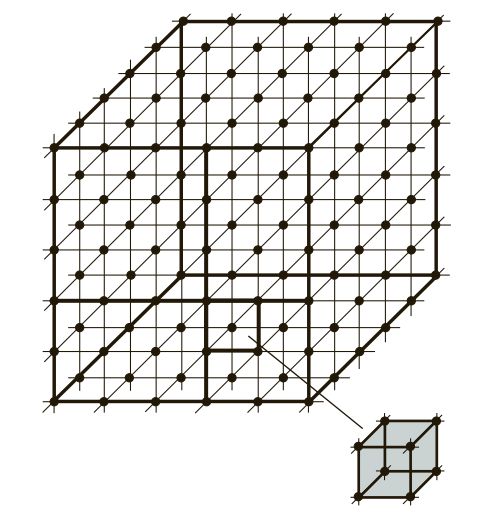
Рис. 1. Схема расположения элементарных геометрических ячеек в атомных решетках металлов и сплавов
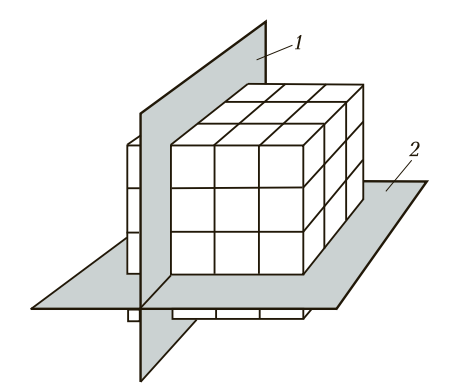
Рис. 2. Расположение кристаллографических плоскостей: 1 и 2 — соответственно горизонтальная и вертикальная кристаллографические плоскости
Элементарные кристаллические решетки характеризуют следующие основные параметры: расстояние между атомами по осям координат (по линиям связи), углы между линиями связи, координационное число — число атомов, находящихся на наиболее близком и равном расстоянии от любого атома в решетке. Форму элементарной ячейки рассматривают по кристаллографическим плоскостям в трех измерениях.
Таким образом, любой металл можно представить не как однородную цельную массу, а как массу, сложенную из множества элементарных ячеек. Блок элементарных атомных кристаллических ячеек образует атомно-кристаллическую ячейку (решетку). Если выделить эту элементарную ячейку, то в зависимости от металла получим следующие типы кристаллических ячеек (рис. 3): куб (К), объемно-центрированный куб (ОЦК), гранецентрированный куб (ГЦК), гексагональная плотноупакованная ячейка (ГПУ), гексагональная простая ячейка (Г) и др.
Простая кубическая ячейка (рис. 3, а) характерна для неметаллов, которые обладают наибольшими плотностью и удельным весом, и имеет восемь атомов, которые расположены в каждой вершине куба.
Объемно-центрированная кубическая ячейка (рис. 3, б ) состоит из восьми атомов, которые расположены по одному атому в каждой вершине куба, и одного, находящегося в центре куба на равных расстояниях от его граней. Эту форму атомной кристаллической ячейки имеют железо модификации Fe-α, ванадий, вольфрам, молибден, тантал и хром, т. е. в основном черные металлы.
Гранецентрированная кубическая ячейка (рис. 3, в) имеет 14 атомов — по одному атому в каждой вершине куба (восемь атомов) и по одному атому в центре каждой грани (шесть атомов). Гранецентрированную кубическую ячейку имеют алюминий, железо модификации Fe-γ, золото, кобальт, медь, никель, платина и серебро, в основном это цветные металлы и часть черных металлов.
Гексагональная плотноупакованная ячейка (рис. 3, г) состоит из 17 атомов. Форма геометрического тела, которую образуют эти атомы, является шестигранной призмой. При этом по шесть атомов расположены в каждой вершине верхнего и нижнего оснований, по одному атому в центре этих оснований и три атома в центре одной их трех граней (через грань). Гексагональную плотноупакованную ячейку имеют бериллий, кадмий, магний, ванадий, тантал.
Простая гексагональная ячейка (рис. 3, д) состоит из 12 атомов, которые расположены в вершинах верхнего и нижнего оснований шестигранной призмы. Такую кристаллическую ячейку имеют ртуть и цинк.
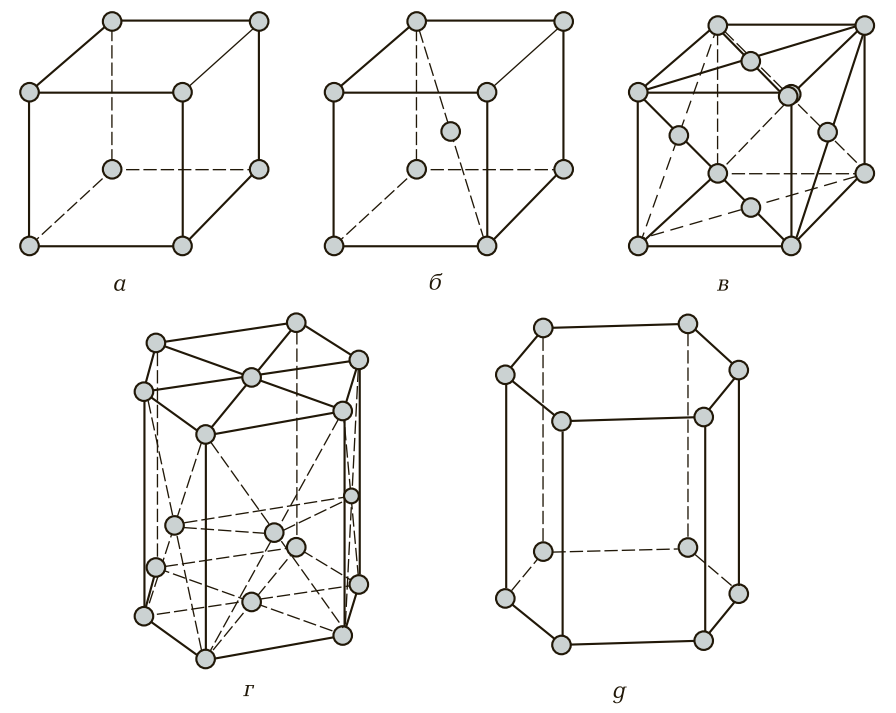
Рис. 3. Геометрические формы элементарных кристаллических ячеек: а — куб; б — объемно-центрированный куб; в — гранецентрированный куб; г — гексагональная плотноупакованная ячейка; д — гексагональная простая ячейка
Связь между атомами в кристаллической решетке и между решетками осуществляется за счет так называемой металлической связи. От прочности этой связи зависят прочность и твердость металлов. Чем выше эта связь, тем бо´льшую прочность и твердость имеют металлы. Механизм связи между атомами в решетке и между решетками имеет сложную физико-химическую природу.
В практике идеальное расположение кристаллических решеток обычно не наблюдается. Кристаллы, образуемые кристаллическими решетками, имеют искаженную геометрическую форму и различную величину.
Анизотропия металлов. Анизотропия (от гр. anisos — неравный и tropos — направление) — неодинаковость физических свойств среды (тела) в различных направлениях. Анизотропия предполагает зависимость свойств металлов от направления по плоскостям атомно-кристаллических решеток. Чем больше в плоскости атомов, тем выше свойства металлов. В горизонтальных плоскостях в любой форме атомно-кристаллических решеток больше, чем в вертикальных плоскостях. Следовательно, прочность металлов, испытанная в горизонтальном направлении, выше, чем в вертикальном. Анизотропия проявляется в процессе обработки конструкционных материалов давлением (проката, волочения, штамповки и других технологических способов получения заготовок и изделий).
На рис. 2 кристаллографические плоскости совпадают с линиями связи, проходящими через атомы металла. Форма элементарной кристаллической ячейки, расстояние между атомами и прочность металлической связи определяют физические, механические и технологические свойства металлов. Если исследуемый металл рассматривать по трем кристаллографическими плоскостям, по линиям связи между атомами, то можно заметить, что свойства по этим трем измерениям будут различны. Число атомов в этих плоскостях неодинаково. Металлическая связь между горизонтально и вертикально расположенными атомами также неодинакова. Это, в свою очередь, приводит к различной прочности металлов в продольном и поперечном направлениях. Например, предел прочности меди в продольном направлении будет в 2 раза больше, чем в поперечном.
Все металлы анизотропны, так как они состоят из кристаллов. Кристаллическое строение металлов обусловливает пластическую деформацию, т. е. изменение внешней формы и размеров под действием нагрузок без разрушения. Способность металлов и сплавов пластически деформироваться положена в основу их обработки давлением (прокатка, волочение, ковка, штамповка и прессование). При обработке давлением, например прокатке (рис. 4, а), происходит перемещение одного слоя атомных решеток по другому по кристаллографическим плоскостям (рис. 4, б).
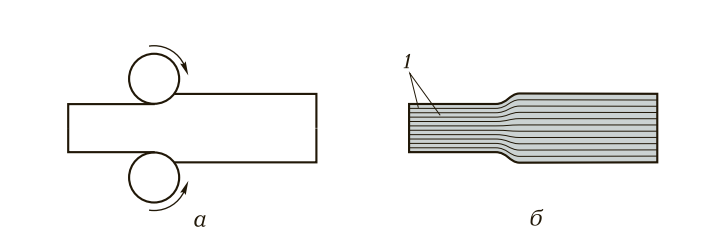
Рис. 4. Схема деформации металлов и сплавов (прокатка): а — деформация; б — скольжение металлов по кристаллографическим плоскостям в процессе деформации; 1 — кристаллографические плоскости
В процессе деформации металла при прокатке происходит не только изменение поперечных и продольных размеров заготовок, но и изменение микроструктуры металла.
Зерна под действием давления прокатных валков искажаются, приобретая продолговатую или пластинчатую форму, а затем преобразуются в волокна. Изменение микроструктуры металла в процессе деформации условно показано на рис. 5.
Процесс кристаллизации. Рассмотрим, как происходит образование кристаллов у чистых металлов. Установлено, что процесс кристаллизации металлов из жидкого состояния в твердое идет в две стадии:
- образование центров кристаллизации;
- рост кристаллов вокруг этих центров (рис. 6).
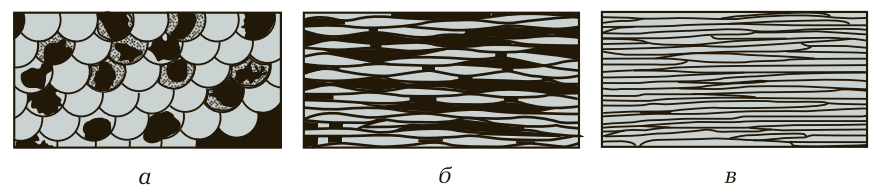
Рис. 5. Изменение микроструктуры металла в процессе деформации: а — микроструктура металла до деформации; б — микроструктура металла после первой операции деформации; в — микроструктура металла после окончательной деформации
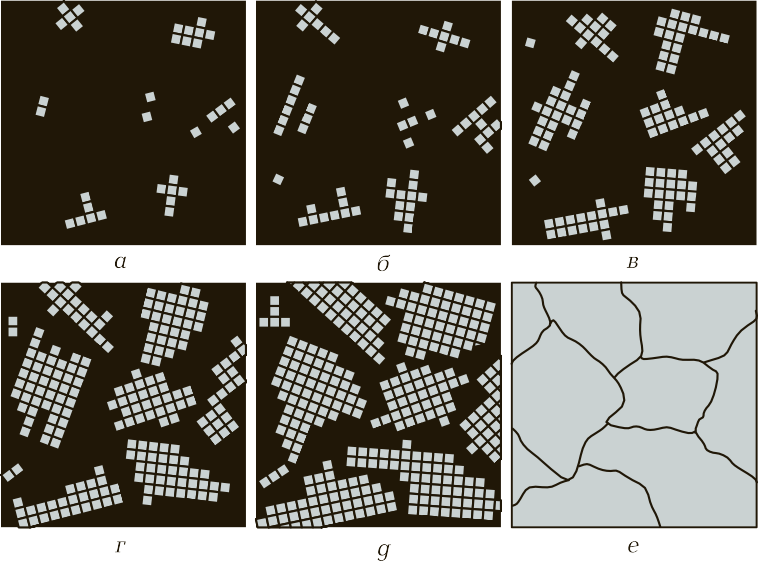
Рис. 6. Процесс кристаллизации металлов и сплавов: а — е — последовательные этапы процесса
Далее вновь появляются новые центры, и происходит рост твердой фазы вокруг первичных и вторичных центров. Процесс происходит до того момента, пока образованные таким образом кристаллы не будут соприкасаться друг с другом и не будет наличия жидкой фазы металла (см. рис. 6, г — е). Когда образование кристалла идет в жидкой фазе (в расплавленном металле), он будет иметь правильную форму, т. е. состоять из определенных геометрических фигур правильной формы. Когда кристаллы начинают соприкасаться друг с другом, а процесс затвердевания еще не закончен, тогда происходят искажения формы зерен. В практике замечено, что когда идет быстрое охлаждение, образуются мелкие зерна — мелкозернистая структура. При медленном охлаждении появление новых центров кристаллизации замедляется, но происходит рост зерна вокруг первичных центров кристаллизации. В этом случае металл будет иметь крупнозернистую структуру.
Процесс образования кристаллов в жидком состоянии и перехода металла в твердое состояние называется первичной кристаллизацией. Величина и форма зерна влияет на механические свойства металлов. Чем зерна мельче и чем правильнее их форма, тем большую твердость и прочность будет иметь металл. Чем зерна больше и чем искаженнее их форма, тем ниже твердость и прочность металла.
Аллотропия металлов. Такие металлы, как железо, кобальт, никель и др., обладают способностью изменять кристаллическую решетку при нагревании в твердом состоянии. Процесс изменения кристаллических решеток в твердом состоянии называется вторичной кристаллизацией, или аллотропией, а состояние вещества (металла) при наличии нескольких кристаллических решеток при изменении параметров (давления, температуры) — аллотропическими модификациями, или полиморфизмом. Такие металлы, как железо, молибден, вольфрам, литий в твердом состоянии при нормальной температуре имеют объемно-центрированную кубическую ячейку; алюминий, медь, серебро в твердом состоянии при нормальной температуре имеют форму гранецентрированной кубической ячейки.
На рис. 7 представлены кривые нагрева и охлаждения металла (на примере марганца). Аллотропные состояния (модификации), имеющие те или иные кубические ячейки, обозначаются греческими буквами. Первоначальное аллотропное состояние при нормальной температуре обозначается буквой α, при дальнейших повышении температуры и перекристаллизации металла — буквами β, γ, δ и т. д. При охлаждении металлов и сплавов процесс аллотропного превращения происходит в обратном порядке, как правило при тех же температурах.
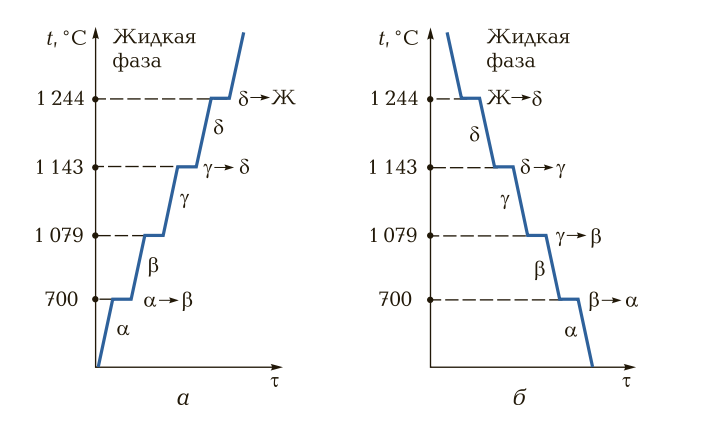
Рис. 7. Кривые нагрева (а) и охлаждения (б) марганца: t — температура; τ — время
Металлы

К металлам относится большая часть элементов периодической системы – 82 химических элементов. Какими свойствами они обладают, и чем отличаются от неметаллов?
Общая характеристика
Металлами называют группу элементов, в виде простых веществ, которые обладают металлическими свойствами (пластичность, ковкость, блеск, электронная проводимость и т. д.)
Основное отличие элементов-металлов – они обладают только восстановительными свойствами, а в реакциях могут только окисляться. В соединениях они могут иметь только положительные степени окисления как в элементарных положительно заряженных ионах, так и в сложных ионах, где они образуют положительные центры.
Рис. 1. Список металлов.
Как правило, на внешнем уровне элементов металлов находится небольшое число электронов (1-3), значения электроотрицательности невысокие. К металлам относятся все s-элементы (кроме водорода и гелия), d- и f-элементы, а также p-элементы под чертой бор-астат. Для типичных металлов характерен большой размер атомов, что способствует легкости отдачи валентных электронов. Образующиеся положительные ионы устойчивы, так как имеют завершенную внешнюю электронную оболочку.
Физические и химические свойства
Все металлы, кроме ртути, при нормальных условиях в виде простых веществ находятся в твердом агрегатном состоянии и образуют металлическую кристаллическую решетку.

Рис. 2. Металлы в таблице Д.И. Менделеева.
Таблица «Металлы»
В следующей таблицы представлены группы основных металлов:
| Группа металлов | Металл |
| Щелочные | литий, натрий, калий и т.д. |
| Щелочноземельные | кальций, стронций, барий и т.д. |
| Переходные | уран, титан, железо, платина и т.д. |
| постпереходные | алюминий, свинец, олово и т.д. |
| Тугоплавкие | молибден, вольфрам |
| Цветные | медь, титан, магний и т.д. |
| Благородные | золото, серебро и т.д. |
Металлы пластичны и ковки, особенно если на внешнем электронном уровне атомов по одному электрону: слои атомов перемещаются относительно друг друга без разрушения кристаллической решетки (щелочные металлы, медь, серебро, золото). В атомах непластичных хрупких металлов хрома и марганца – большое число валентных электронов.
Плотность, твердость, температура плавления металлов изменяются в широком диапазоне и зависят от атомной массы, строения атома и геометрии кристаллической решетки. Самый легкий металл – литий (плотность 0,53 г/см 3 ), самый тяжелый – осмий (плотность 22,5 г/см 3 ). Металлы с плотностью больше 5 г/см 3 относят к тяжелым, меньше 5 г/см 3 – к легким металлам.
Самая низкая температура плавления у ртути (-39 градусов по Цельсию), самый тугоплавкий металл – вольфрам (температура плавления 3410 градусов по Цельсию.) Энергия атомизации вольфрама составляет 836 кДж/моль, а температура кипения его 5930 градусов.
Металлы вступают в реакцию как с простыми, так и со сложными веществами. Как типичные восстановители металлы реагируют почти со всеми неметаллами-окислителями (кислород, сера, азот и т. д.):
Также металлы реагируют с такими сложными веществами, как оксиды и гидроксиды, разбавленные растворы кислот, с растворенными в воде щелочами.
В пределах одного и того же периода металлические свойства ослабевают, а неметаллические усиливаются; в пределах одной и той же группы (в главной подгруппе) металлические свойства усиливаются, а неметаллические ослабевают

Рис. 3. Металлы главных подгрупп.
Нахождение металлов и способы их получения
Самый распространенный на земле элемент-металл – алюминий. За ним следуют железо, кальций, натрий.
Некоторые металлы встречаются в природе в самородном состоянии (золото, ртуть, платина), но в основном они находятся в природе в виде оксидов и солей.
Получение металлов происходит с помощью металлургии (получение из руд), пирометаллургии (получение с помощью реакции восстановления при высокой температуре), гидрометаллургии (извлечение из руд в виде растворимых соединений), электрометаллургии (получение металлов электролизом расплавов и растворов их соединений).
Что мы узнали?
Металлы – вещества, которые обладают высокой электро- и теплопроводностью, ковкостью, пластичностью и металлическим блеском. В данной статье по химии 9 класса рассматриваются их физические и химические свойства, формулы класса металлов, а также способы получения.
Физические свойства металлов

Физические свойства металлов отличают их от неметаллов. Все металлы, кроме ртути, – твёрдые кристаллические вещества, являющиеся восстановителями в окислительно-восстановительных реакциях.
Положение в таблице Менделеева
Металлы занимают I-II группы и побочные подгруппы III-VIII групп. Металлические свойства, т.е. способность отдавать валентные электроны или окисляться, увеличиваются сверху вниз по мере увеличения количества энергетических уровней. Слева направо металлические свойства ослабевают, поэтому наиболее активные металлы находятся в I-II группах, главных подгруппах. Это щелочные и щелочноземельные металлы.
Определить степень активности металлов можно по электрохимическому ряду напряжений. Металлы, стоящие до водорода, наиболее активны. После водорода стоят слабоактивные металлы, не вступающие в реакцию с большинством веществ.
Строение
Вне зависимости от активности все металлы имеют общее строение. Атомы в простом металле расположены не хаотично, как в аморфных веществах, а упорядоченно – в виде кристаллической решётки. Удерживает атомы в одном положении металлическая связь.
Такой вид связи осуществляется за счёт положительно заряженных ионов, находящихся в узлах кристаллической ячейки (единицы решётки), и отрицательно заряженных свободных электронов, которые образуют так называемый электронный газ. Электроны отделились от атомов, превратив их в ионы, и стали перемещаться в решётке хаотично, скрепляя ионы вместе. Без электронов решётка бы распалась за счёт отторжения одинаково заряженных ионов.
Различают три типа кристаллической решётки. Кубическая объемно-центрированная состоит из 9 ионов и характерна хрому, железу, вольфраму. Кубическая гранецентрированная включает 14 ионов и свойственная свинцу, алюминию, серебру. Из 17 ионов состоит гексагональная плотноупакованная решётка цинка, титана, магния.
Свойства
Строение кристаллической решётки определяет основные физические и химические свойства металлов. Металлы блестят, плавятся, проводят тепло и электричество. Промышленность и металлургия нашли применение физическим свойствам металлов в изготовлении деталей, фольги, корпусов машин, зеркал, бытовой и промышленной химии. Особенности металлов и их использование представлены в таблице физических свойств металлов.
Свойства
Особенности
Примеры
Применение
Способность отражать солнечный свет
Наиболее блестящими металлами являются Hg, Ag, Pd
Лёгкие – имеют плотность меньше 5 г/см 3
Na, K, Ba, Mg, Al. Самый лёгкий металл – литий с плотностью 0,533 г/см 3
Изготовление облицовки, деталей самолётов
Тяжёлые – имеют плотность больше 5 г/см 3
Sn, Fe, Zn, Au, Pb, Hg. Самый тяжёлый – осмий с плотностью 22,5 г/см 3
Использование в сплавах
Способность изменять форму без разрушений (можно раскатать в тонкую фольгу)
Наиболее пластичные – Au, Cu, Ag. Хрупкие – Zn, Sn, Bi, Mn
Формовка, сгибание труб, изготовление проволоки
Мягкие – режутся ножом
Изготовление мыла, стекла, удобрений
Твёрдые – сравнимы по твёрдости с алмазом
Самый твёрдый – хром, режет стекло
Изготовление несущих конструкций
Легкоплавкие – температура плавления ниже 1000°С
Hg (38,9°С), Ga (29,78°С), Cs (28,5°С), Zn (419,5°C)
Производство радиотехники, жести
Тугоплавкие – температура плавления выше 1000°С
Cr (1890°С), Mo (2620°С), V (1900°С). Наиболее тугоплавкий – вольфрам (3420°С)
Изготовление ламп накаливания
Способность передавать тепло другим телам
Лучше всего проводят ток и тепло Ag, Cu, Au, Al
Приготовление пищи в металлической посуде
Способность проводить электрический ток за счёт свободных электронов
Передача электричества по проводам
Из урока 9 класса узнали о физических свойствах металлов. Кратко рассмотрели положение металлов в периодической таблице и особенности строения кристаллической решётки. Благодаря строению металлы обладают пластичностью, твёрдостью, способностью плавиться, проводить электрический ток и тепло. Свойства металлов неоднородны. Различают лёгкие и тяжёлые металлы, лёгкоплавкие и тугоплавкие, мягкие и твёрдые. Физические свойства используются для изготовления сплавов, электрических проводов, посуды, мыла, стекла, конструкций различной формы.
Лекция по теме "СТРОЕНИЕ,СВОЙСТВА МЕТАЛЛОВ И МЕТОДЫ ИХ ИСПЫТАНИЯ"
Металлы – один из классов конструкционных материалов, характеризующийся определенным набором свойств:
К физическим свойствам металлов относят плотность, температуру плавления, цвет, блеск, непрозрачность, теплопроводность, электропроводность, тепловое расширение. По плотности металлы разделяют на легкие (до 3000 кг/м 3 ) и тяжелые (от 6000 кг/м 3 и выше); по температуре плавления — на легкоплавкие (до 973 К) и тугоплавкие (свыше 1173 К). Каждый металл или сплав обладает определенным, присущим ему цветом.
Прочность — способность металла в определенных условиях и пределах не разрушаясь воспринимать те или иные воздействия, нагрузки. Это свойство учитывается при изготовлении и проектировании изделий, выборе того или иного металла, сплава. Наибольшее напряжение, которое может выдержать металл, не разрушаясь, называют пределом прочности, или временным сопротивлением разрыву. Образцы для измерения прочности подвергают испытанию на специальной разрывной машине, которая постепенно, с возрастающей силой растягивает образец до полного разрыва.
Упругость — свойство металла восстанавливать свою форму после прекращения действия внешних сил, вызвавших деформацию. Наибольшее напряжение, после которого металл возвращается к своей первоначальной форме, называют пределом упругости. Если при дальнейшем повышении нагрузки напряжение превышает предел упругости и удлинение сохраняется после разгрузки образца, такое состояние называют остаточным удлинением. Далее наступает предел текучести, т.е. образец продолжает удлиняться без увеличения нагрузки.
Пластичность — свойство металла под действием внешних сил изменять, не разрушаясь, свою форму и размеры и сохранять остаточные (пластические) деформации после устранения этих сил . Данное свойство также определяется и измеряется на разрывной машине. Высокой пластичностью обладают золото, серебро, платина и их сплавы. Менее пластичны медь, алюминий, свинец. Это свойство металлов имеет большое значение в давильном и штамповочном производстве, волочении, прокатке.
Твердость — свойство металлов сопротивляться проникновению в них другого тела под действием внешней нагрузки, что необходимо учитывать при выборе инструментов для обработки металлов резанием. Например, важно знать твердость обрабатываемого металла, чтобы подобрать соответствующую фрезу или сверло. Испытания металлов на твердость проводят на специальных приборах — твердометрах.
Выносливость — свойство металлов сопротивляться действию повторных нагрузок . Температурные условия значительно влияют на механические свойства металлов: при нагревании их прочность понижается, а пластичность увеличивается; при охлаждений некоторые металлы становятся хрупкими, например, сталь некоторых марок, цинк и его сплавы. Нехладноломкими являются алюминий и медь.
Хрупкость — некоторые металлы обладают хрупкостью и при нормальных условиях, примером является серый чугун. В производстве изделий учитывается способность металлов поддаваться обработке, т.е. такие их технологические свойства, как ковкость, жидкотекучесть, литейная усадка, свариваемость, спекаемость, обрабатываемость резанием и некоторые другие.
Ковкость — способность металлов подвергаться ковке и другим видам обработки давлением (прокатке, прессованию, волочению, штамповке). Металлы могут коваться в холодном состоянии (золото, серебро, медь), а также в горячем (сталь).
Износостойкость – способность материала сопротивляться поверхностному разрушению под действием внешнего трения.
Коррозионная стойкость – способность материала сопротивляться действию агрессивных кислотных, щелочных сред.
Жаростойкость – это способность материала сопротивляться окислению в газовой среде при высокой температуре.
Жаропрочность – это способность материала сохранять свои свойства при высоких температурах.
Хладостойкость – способность материала сохранять пластические свойства при отрицательных температурах.
Антифрикционность – способность материала прирабатываться к другому материалу.
Жидкотекучесть — свойство расплавленного металла заполнять литейную форму. Высокой жидкотекучестью обладают цинк и его сплавы, чугун, бронза, олово, силумин (сплав алюминия с кремнием), латунь, некоторые магниевые сплавы. Низкой жидкотекучестью обладают сталь, красная медь, чистое серебро.
Литейная усадка —уменьшение объема металла при переходе из жидкого состояния в твердое. Это необходимо учитывать при изготовлении формы для отливки. Отливка получается всегда меньше модели, по которой сделана форма. Металлы с большой усадкой для литья почти не используют.
Свариваемость — способность металла прочно соединяться путем местного нагрева и расплавления свариваемых кромок изделия. Сплавы свариваются труднее, чистые металлы — легче. Легко свариваются изделия из малоуглеродистой стали. Плохо поддаются сварке чугун и высокоуглеродистые легированные стали.
Из химических свойств металлов и их сплавов наиболее важными в производстве художественных изделий являются растворение (взаимодействие с кислотами и щелочами) и окисление (антикоррозийная стойкость, т.е.стойкость к воздействию окружающей среды — газов, воды и т.д.).
Растворение (разъедание) — способность металлов растворяться в сильных кислотах и едких щелочах. Это свойство широко используется в различных областях производства художественных изделий. Растворение бывает частичное и полное. Частичное применяется для создания чистой поверхности изделия.
Окисление — способность металлов соединяться с кислородом и образовывать окислы металлов.
Данные свойства обусловлены особенностями строения металлов.
Все металлы, затвердевающие в нормальных условиях, представляют собой кристаллические вещества, то есть укладка атомов в них характеризуется определённым порядком – периодичностью, как по различным направлениям, так и по различным плоскостям. Этот порядок определяется понятием кристаллическая решётка.
Другими словами, кристаллическая решетка это воображаемая пространственная решетка, в узлах которой располагаются частицы, образующие твердое тело.
Элементарная ячейка – элемент объёма из минимального числа атомов, многократным переносом которого в пространстве можно построить весь кристалл.
Элементарная ячейка характеризует особенности строения кристалла. Основными параметрами кристалла являются:
· размеры ребер элементарной ячейки. a, b, c – периоды решетки – расстояния между центрами ближайших атомов. В одном направлении выдерживаются строго определенными.
· углы между осями ().
· координационное число (К) указывает на число атомов, расположенных на ближайшем одинаковом расстоянии от любого атома в решетке.
· базис решетки количество атомов, приходящихся на одну элементарную ячейку решетки.
Рис. Схема кристаллической решетки
Классификация возможных видов кристаллических решеток была проведена французским ученым О. Браве, соответственно они получили название «решетки Браве». Всего для кристаллических тел существует четырнадцать видов решеток, разбитых на четыре типа;
· примитивный – узлы решетки совпадают с вершинами элементарных ячеек;
· базоцентрированный – атомы занимают вершины ячеек и два места в противоположных гранях;
· объемно-центрированный – атомы занимают вершины ячеек и ее центр;
· гранецентрированный – атомы занимают вершины ячейки и центры всех шести граней
В металлических материалах, как правило, формируются три типа кристаллических решеток: объемноцентрированная кубическая (ОЦК), гранецентрированная кубическая (ГЦК) и гексагональная плотноупакованная (ГП). Элементарные ячейки ОЦК, ГЦК и ГП решеток показаны на рис. 9.

Рис. Типы кристаллических решеток металлов.
а) Г.Ц.К, б) О.Ц.К., в) Г.П.У.
Основными типами кристаллических реш¨ток являются:
- Объемно - центрированная кубическая (ОЦК), атомы располагаются в вершинах куба и в его центре
- Гранецентрированная кубическая (ГЦК), атомы располагаются в вершинах куба и по центру каждой из 6 граней
- Гексагональная, в основании которой лежит шестиугольник:
- простая – атомы располагаются в вершинах ячейки и по центру 2 оснований (углерод в виде графита);
- плотноупакованная (ГПУ) – имеется 3 дополнительных атома в средней плоскости (цинк).
ОЦК решетку имеют такие металлы, как вольфрам, молибден, ниобий, низкотемпературные модификации железа, титана, щелочные металлы и ряд других металлов. Серебро, медь, алюминий, никель, высокотемпературная модификация железа и ряд других металлов имеют ГЦК решетку. ГП решетка у магния, цинка, кадмия, высокотемпературной модификации титана.
2. Физическая природа деформации металлов
Деформацией называется изменение формы и размеров тела под действием напряжений.
Напряжение – сила, действующая на единицу площади сечения детали.
Напряжения и вызываемые ими деформации могут возникать при действии на тело внешних сил растяжения, сжатия и т.д.,
Деформация металла под действием напряжений может быть упругой и пластической.
Упругой называется деформация, полностью исчезающая после снятия вызывающих ее напряжений.
При упругом деформировании изменяются расстояния между атомами металла в кристаллической решетке. Снятие нагрузки устраняет причину, вызвавшую изменение межатомного расстояния, атомы становятся на прежние места, и деформация исчезает.
Упругая деформация на диаграмме деформации характеризуется линией ОА (рис.).
Рис. Диаграмма зависимости деформации металла от действующих напряжений
Зависимость между упругой деформацией и напряжением выражается законом Гука
где: Е - модуль упругости.
Пластической или остаточной называется деформация после прекращения действия вызвавших ее напряжений.
В результате развития пластической деформации может произойти вязкое разрушение путем сдвига.
Механические свойства определяют поведение материала при деформации и разрушении от действия внешних нагрузок.
В зависимости от условий нагружения механические свойства могут определяться при:
статическом нагружении – нагрузка на образец возрастает медленно и плавно.
динамическом нагружении – нагрузка возрастает с большой скоростью, имеет ударный характер.
Прочность – способность материала сопротивляться деформациям и разрушению.
Испытания проводятся на специальных машинах, которые записывают диаграмму растяжения, выражающую зависимость удлинения образца (мм) от действующей нагрузки Р, т.е. .
Но для получения данных по механическим свойствам перестраивают: зависимость относительного удлинения от напряжения
Твердость – это сопротивление материала проникновению в его поверхность стандартного тела (индентора), не деформирующегося при испытании.
3. Методы определения твердости
О твердости судят либо по глубине проникновения индентора (метод Роквелла), либо по величине отпечатка от вдавливания (методы Бринелля, Виккерса, микротвердости).
Наибольшее распространение получили методы Бринелля, Роквелла, Виккерса. Схемы испытаний представлены на рис. 7.1.
Рис. Схемы определения твердости: а – по Бринеллю; б – по Роквеллу; в – по Виккерсу
3.1. Твердость по Бринеллю ( ГОСТ 9012)
Испытание проводят на твердомере Бринелля (рис.7.1 а)
В качестве индентора используется стальной закаленный шарик диаметром D 2,5; 5; 10 мм, в зависимости от толщины изделия.
Нагрузка Р, в зависимости от диаметра шарика и измеряемой твердости: для термически обработанной стали и чугуна – , литой бронзы и латуни – , алюминия и других очень мягких металлов – .
Продолжительность выдержки: для стали и чугуна – 10 с, для латуни и бронзы – 30 с.
Полученный отпечаток измеряется в двух направлениях при помощи лупы Бринелля.
Твердость определяется как отношение приложенной нагрузки Р к сферической поверхности отпечатка F:
Стандартными условиями являются D = 10 мм; Р = 3000 кгс; = 10 с. В этом случае твердость по Бринеллю обозначается НВ 250, в других случаях указываются условия: НВ D / P / , НВ 5/ 250 /30 – 80.
3.2. Метод Роквелла ГОСТ 9013
Основан на вдавливании в поверхность наконечника под определенной нагрузкой (рис. 7.1 б)
Индентор для мягких материалов (до НВ 230) – стальной шарик диаметром 1/16” (1,6 мм), для более твердых материалов – конус алмазный.
Нагружение осуществляется в два этапа. Сначала прикладывается предварительная нагрузка (10 ктс) для плотного соприкосновения наконечника с образцом. Затем прикладывается основная нагрузка Р1, втечение некоторого времени действует общая рабочая нагрузка Р. После снятия основной нагрузки определяют значение твердости по глубине остаточного вдавливания наконечника h под нагрузкой.
В зависимости от природы материала используют три шкалы твердости (табл. 7.1)
Шкалы для определения твердости по Роквеллу
3.3. Метод Виккерса
Твердость определяется по величине отпечатка (рис.7.1 в).
В качестве индентора используется алмазная четырехгранная пирамида.с углом при вершине 136 o .
Твердость рассчитывается как отношение приложенной нагрузки P к площади поверхности отпечатка F:
Нагрузка Р составляет 5…100 кгс. Диагональ отпечатка d измеряется при помощи микроскопа, установленного на приборе.
Преимущество данного способа в том, что можно измерять твердость любых материалов, тонкие изделия, поверхностные слои. Высокая точность и чувствительность метода.
Способ микротвердости – для определения твердости отдельных структурных составляющих и фаз сплава, очень тонких поверхностных слоев (сотые доли миллиметра).
Аналогичен способу Виккерса. Индентор – пирамида меньших размеров, нагрузки при вдавливании Р составляют 5…500 гс
3.4. Метод царапания.
Алмазным конусом, пирамидой или шариком наносится царапина, которая является мерой. При нанесении царапин на другие материалы и сравнении их с мерой судят о твердости материала.
Можно нанести царапину шириной 10 мм под действием определенной нагрузки. Наблюдают за величиной нагрузки, которая дает эту ширину.
3.5. Динамический метод (по Шору)
Шарик бросают на поверхность с заданной высоты, он отскакивает на определенную величину. Чем больше величина отскока, тем тверже материал.
Читайте также:
