Сравнительная таблица металлов и неметаллов
Тема урока совпадает с темой календарно-тематического планирования.
Цель урока: сформировать понятие о положении металлов и неметаллов в ПС, строении их атомов, физических и химических свойствах металлов и неметаллов и их окислительных и восстановительных способностях.
Задачи урока: - образовательные: - сформировать понятие о строении и свойствах металлов и неметаллов; - научить использовать приобретённые знания для объяснения явлений окружающей среды; - проверить знания о строении металлов и их физических свойствах. - развивающие: - совершенствовать умения записывать уравнения химических реакций; применять знания; - развивать познавательную активность учащихся, вырабатывать умение анализировать, делать выводы; - создать условия для развития познавательного интереса к предмету, эмоциональные ситуации удивления, занимательности. - воспитательные: - воспитывать экологическую культуру (на примере последствий загрязнения окружающей среды некоторыми неметаллами и тяжелыми металлами); - воспитывать коммуникативные компетенции, умение высказывать собственное мнение, сотрудничать в группе.
Тип урока: комбинированный, традиционный, изучение нового материала.
Форма урока: урок систематизации полученных ранее знаний
Методы и приемы: приемы активизации познавательной деятельности учащихся; групповая деятельность; исследовательская деятельность; ИКТ (презентация).
Средства обучения: компьютер; периодическая система химических элементов Д.И. Менделеева; коллекции металлов и неметаллов; учебник «Химия» для 10 класса естественно-математического направления, авторы Н.Н. Нурахметов, К.Бекишев, Н.А Заграничная и др., Алматы: Мектеп, 2014 г.
Основные понятия: окислитель, восстановитель, электроотрицательность, аллотропия.
Организационный момент ц .
I. Подготовка учащихся к активному и сознательному усвоению нового материала.
II. Актуализация знаний (выявление уровня ЗУН и корректировка, первичное закрепление и контроль):
1) Характеристика элемента металла и неметалла
ü Положение металлов и неметаллов в ПСХЭ Д.И. Менделеева
ü Нахождение в природе
ü Строение атомов металлов и неметаллов
ü Окислительно-восстановительные возможности атомов металлов и неметаллов
ü Изменение свойств атомов металлов и неметаллов в периоде и группе
2) Характеристика простых веществ металлов и неметаллов
ü Строение металлов и неметаллов
ü Физическиесвойства металлов и неметаллов
ü Химические свойства металлов и неметаллов
III. Закрепление.
IV . Подведение итогов урока.
Организационный этап.
I. Актуализация знаний.
Несмотря 1 на то, что урок проводится в 10 классе, можно предложить учащимся загадки по теме урока. – Ребята, вам будут предложены загадки, которые нужно отгадать.
1.В чем горят дрова и газ,
Фосфор, водород, алмаз?
Дышит чем любой из нас
Каждый миг и каждый час?
Без чего мертва природа?
Правильно, без …(кислорода 1 )
2.Удивить готов он нас -
Он и уголь, и алмаз,
Он в карандашах сидит,
Потому что он — графит.
Грамотный народ поймет
То, что это …(углерод 1 )
3. Быть символом не каждому дано,
Но именем моим не без причины
Назвали руки, дождь, тельца, руно,
Сечение и мнений середину.
И в честь меня был назван даже век,
Когда был очень счастлив человек.
Что нынче в имени моем? А встарь
Считали все, что я - металлов царь. (ЗОЛОТО 1 )
4. Из глины я обыкновенной,
Но я на редкость современный.
Я не боюсь электротока,
Бесстрашно в воздухе лечу;
Служу на кухне я без срока -
Мне все задачи по плечу.
Горжусь своим я именем:
Зовусь я (АЛЮМИНИЙ 1 )
- Как вы думаете, к каким элементам относятся 1 эти элементы? Следовательно ц , какова тема нашего урока? Верно, сегодня на уроке мы будем говорить о металлах и неметаллах. Итак, запишите тему нашего урока: «Сравнительная характеристика металлов и неметаллов, их физические и химические свойства». (На слайде показана тема урока и цель).
Изучение нового материала.
- Действительно, все ц элементы делятся на две большие группы: металлы и неметаллы. Еще в древности люди обращали внимание на то, что известным в то время металлам в присущи определенные признаки, такие как металлический блеск, ковкость, теплопроводность, пластичность. Эти общие существенные и отличительные признаки стали характеризовать весь класс металлов. Так в результате такого обобщения появилось понятие «металл». А противоположностью этого понятия стало такое понятие как «неметалл».
- Вообще же в химии принято делить все элементы на металлы и неметаллы в зависимости от химических и физических свойств простых веществ (т.е от способа, которым осуществляется связывание отдельных атомов в простом веществе). Если связь металлическая, то соответственно простое вещество – металл с набором свойств. Неметаллам в определение дать труднее из-за их разнообразия. Главным у критерием может служить отсутствие ВСЕХ (без исключения) свойств металлов.
Но мы то с вами не «древние» люди, и легко вспомним определение понятий элементов металлов и неметаллов.
Неметаллы – хим ические ц элементы, атомы которых принимают электроны для завершения внешнего энергетического уровня 4 и более электронов и малому радиусу 3 атомов , отрицательно образуя при этом отрицательно заряженные ионы (анионы). Исключение составляют водород (1s 1 ) и гелий (1s 2 ), которые тоже рассматривают как неметаллы. Неметаллы обычно обладают большим спектром степеней окисления в своих соединениях. Металлы – это химические элементы, атомы которых отдают электроны внешнего (предвнешнего) электронного слоя, превращаясь при этом в положительно заряженные ионы (катионы).
1. Положение металлов и неметаллов в ПСХЭ.
В настоящее у время известно 88 элементов, относящихся к металлам и 22 элемента, включая инертные газы, - к неметаллам.
-Все Неметаллы (кроме Н) находятся в верхнем правом углу ПС над диагональю В - Si – As – Te - Аt. Металлы, соответственно, - в левом нижнем углу. Окислительные свойства неметаллов по ПСХЭ усиливаются к концу периода и к началу группы главной подгруппы. Элементы, расположенные вблизи диагонали (назовите – Ве, А l , Ti , Ge ) – являются амфотерными. Если металлы занимают полностью 1-2 группы ПС, то неметаллы расположены вместе с металлами в главных подгруппах 3 - 8 групп.
2. Нахождение в природе.
- Металлов, как вы поняли, в природе в значительно больше, чем неметаллов в . Металлы в природе встречаются в 3-х формах:
1. в свободном виде;
2. как в свободном виде, так и соединениях;
3. только в виде соединений.
Самый в распространенный у металл на Земле – алюминий (более 8% от земной коры).
Только в соединениях – щелочные, щелочно-земельные металлы, как в свободном виде, так и виде соединений – никель, олово, свинец, главным в образом в виде соединений – медь, серебро, ртуть; только в свободном в виде – золото и платина.
Неметаллы в в природе бывают самородными м (азот и кислород в составе воздуха), сера в земной коре. Чаще всего – в виде соединений а (в первую очередь – это вода и растворенные в ней минеральные соли, затем – минералы и горные породы. Самыми распространенными м из неметаллов являются – кремний, водород и кислород, а редкими являются – иод, селен и теллур и мышьяк.
- 3. А) Каковы ми же особенности ми строения ап атомов неметаллов?
- на внешнем уровне имеют от 4 до 8 электронов
- небольшой радиус атомов
- стремятся принять электроны
- характерные связи: ионная и ковалентная
- все неметаллы – р-элементы.
Способность принимать электроны – это проявление окислительных свойств атомов элементов.
В) Особенности м строения атомов с металлов:
- имеют сравнительно большие размеры (радиусы), поэтому и их внешние электроны значительно удалены от ядра и слабо с ним связаны. 2.
- наличие на внешнем энергетическом уровне 1—3 электронов.
- характерный тип химической связи – металлическая. Это означает, что валентные электроны слабо связаны с конкретным атомом, поэтому в узлах кристаллических решеток находятся + ионы, между ними – свободно вращаются электроны, образуя так называемый «электронный газ»;
- металлы делятся на s -, p -, d - и f -элементы.
Самое характерное химическое свойство всех металлов — их восстановительная способность, т. е. способность атомов легко отдавать внешние электроны, превращаясь в положительные ионы .
4. Характеристика простых веществ металлов и неметаллов.
Какое понятие используется для количественной характеристики неметаллов? (ЭО)
Сравнивая значения ЭО неметаллов, можно сделать вывод, что один и тот же элемент в зависимости от расположения в ряду ЭО по отношению к одним элементам проявляет себя как окислитель, к другим – как восстановитель. Ниже всего значения ЭО – у металлов, выше всего – у неметаллов. Это мера неметалличности.
5. Физические и химические свойства металлов . Поработаем с учебником и раздаточным материалом (коллекции металлов и неметаллов, заранее на столы раздаются коллекции металлов и неметаллов, по возможности на каждую пару). Вам предлагается провести небольшое исследование. Сравните физические свойства полученных образцов металлов и неметаллов. Заполните в виде таблицы. В таблице должны быть отражены следующие моменты:
На задание дается около 8 минут, затем на слайде проверяем записи учеников.
6. Общие химические свойства металлов и неметаллов. – Металлы проявляют следующие химические свойства, характерные для большинства представителей этой группы (металлов). Все металлы – сильные восстановители. В реакциях отдают свои электроны, превращаясь в положительно заряженные ионы – катионы. Взаимодействуют с неметаллами, с водой (не все металлы, рассмотрим более подробно на следующих уроках), реагируют с кислотами (за исключением некоторых представителей) и некоторыми солями. Запишем в виде схемы:

Для неметаллов характерны следующие общие химические свойства: если металлы проявляют себя исключительно восстановителями, то неметаллы могут проявлять и окислительные и восстановительные свойства в зависимости от природы взаимодействующего вещества. Среди неметаллов есть исключения, например фтор, который проявляет себя только как окислитель.

1.Назовите расположение металлов и неметаллов в ПСХЭ Д.И.Менделеева. (неметаллы расположены в верхнем правом углу ПС от линии бор-астат, остальные элементы - металлы).
2. Разделите элементы на две группы:
Se, Ca, Zn, Fr, As, Ar, Li, Rn, N, Sr.
А) Металлы : Ca, Zn, Fr, Li, Sr.
Б ) Неметаллы : Se, As, Ar, Rn, N
3. В чем заключается особенность физических свойств металлов, характерных только для них (ковкость, электропроводность, металлический блеск и т.д)? (данная особенность связана с наличием металлической кристаллической решетки у металлов).
VI . Рефлексия . Что я узнал сегодня на уроке?
Что для меня уже известный факт?
Чтобы я хотел еще узнать?
Металлы и неметаллы
Наш мир наполняют различные простые вещества – металлы или неметаллы. При существовании 120 химических элементов, Вселенную наполняют более 400 простых веществ. Этот парадокс связан с понятием аллотропии – явлением образования одним химическим элементом двух и более простых веществ. Например, атом кислорода может формировать молекулярный кислород О2 и озон О3.
План урока:
Физические свойства металлов
Металлы – химические элементы, атомы которых в процессе реакции стремятся отдавать электроны. Они обладают металлической кристаллической решеткой и общими физическими свойствами. На данный момент известно более 87 металлов.
Для металлов характерен ряд свойств:
- твердость (кроме ртути, которая представляет собой жидкость);
- металлический блеск;
- проводимость электрического тока и тепла;
- пластичность.
Металлы при ударах не разрушаются, а меняют форму. С этой особенностью связано то, что из них производят проволоку, металлические листы и др. Развитие бронзового и железного века связано с производством товаров из металлов.
Физические свойства неметаллов
Неметаллы – химические элементы, атомы которых стремятся принять чужие электроны. Для них характерны атомные и молекулярные кристаллические решетки. Для атомов неметаллов не характерны общие физические свойства. На данный момент существует 22 неметалла.
Для неметаллов характерен ряд свойств:
- хрупкость (неметаллы нельзя ковать);
- отсутствие блеска;
- непроводимость электрического тока и тепла.
Расположение металлов и неметаллов в периодической таблице Д.И. Менделеева
Определить, является простое вещество металлом или неметаллом, можно с помощью периодической таблицы Менделеева. Металлы располагаются ниже диагонали «водород-бор- кремний-мышьяк-теллур-астат», а неметаллы выше.
Красные ячейки – неметаллы, синие – металлы
Элементы, расположенные вблизи диагонали, обладают смешанными свойствами: проявляют как металлические, так и неметаллические свойства. Они называются полуметаллами.
Красные ячейки – полуметаллы
Полуметаллы имеют ковалентную кристаллическую решетку при наличии металлической проводимости (электропроводности). Валентных электронов у них либо недостаточно для образования полноценной ковалентной связи, либо они не удерживаются достаточно прочно из-за больших размеров атома. Поэтому связь в ковалентных кристаллах этих элементов имеет частично металлический характер.
Закономерности в таблице Д.И. Менделеева
Каждый атом состоит из протонов, нейтронов и электронов. Протоны и нейтроны находятся в ядре, который несет положительный заряд. Вокруг ядра движутся отрицательно заряженные электроны. Атомный номер указывает на количество протонов.
Чем больше заряд ядра, тем сильнее к нему притягиваются электроны. Т.о., атому сложнее отдавать электроны. Поэтому в периоде слева направо, с увеличением порядкового номера металлические свойства ослабевают, а неметаллические – усиливаются.
Неметаллы стремятся принять электроны от других атомов. Период в таблице указывает на количество электронных уровней. По мере увеличения числа орбиталей электроны отдаляются от ядра и атому сложнее удерживать электроны на последних уровнях. Т.о., в группе сверху вниз количество орбиталей возрастает, поэтому металлические свойства усиливаются, а неметаллические – уменьшаются.
Способы получения металлов
Большую часть металлов получают из оксидов при нагревании.
Металлы, имеющие на внешнем уровне один-два электрона, получают с помощью электролиза расплавов.
Химические свойства металлов
Все металлы проявляют восстановительные свойства. Легкость в отдачи внешнего электрона применяется в фотоэлементах. Степень активности определяется рядом активности. У самых активных на внешнем уровне располагается по одному электрону.
Общие химические свойства металлов выражаются в реакциях со следующими соединениями.
Активные металлы реагируют с галогенами и кислородом. С азотом взаимодействуют только литий, кальций и магний. Большинство металлов при взаимодействии с кислородом образуют оксиды, а наиболее активные металлы – пероксиды (N2O2).
2 Ca + MnO2 → 2 CaO + Mn(нагревание)
Водород в кислотах вытесняют только те металлы, которые в ряду напряжений стоят до водорода.
Более активные металлы вытесняют из соединений менее активные.
- Химические свойства щелочных и щелочно-земельных металлов (реакции с водой)
2 Na + 2 H2O → 2 NaOH + H2
Способы получения неметаллов
Неметаллы синтезируют из природных соединений с помощью электролиза.
2 KCl → 2 K + Cl2
Также неметаллы получают в результате окислительно-восстановительных реакций.
SiO2 + 2 Mg → 2 MgO + Si
Химические свойства неметаллов
Неметаллы проявляют окислительные свойства. Самый активный неметалл – фтор. Он бурно реагирует со всеми веществами, а некоторые реакции сопровождаются горением и взрывом. В атмосфере фтора горят даже вода и платина. Фтор окисляет кислород и образует фторид кислорода OF2.
Неметаллы вступают в реакции со следующими веществами.
3 F + 2 Al → 2 AlF3 (нагревание)
S + Fe →FeS (нагревание)
Меньшей активностью обладают такие неметаллы как бор, графит, алмаз. Они могут проявлять восстановительные свойства.
2 C + MnO2 → Mn + 2 CO
Коррозия металла
Коррозия – это процесс разрушения металлов или металлических конструкций под действием кислорода, воды и вредных примесей. Не все металлы подвергаются коррозии. Их стойкость зависит от ряда факторов.
- На благородных металлах не образуется коррозия.
- На поверхности алюминия, титана, цинке, хрома и никеля есть оксидная пленка, которая предотвращает процессы коррозии.
Различают несколько видов коррозии – химическую и электрохимическую.
Химическая коррозия
Химическая коррозия сопровождается химическими реакциями. Она образуется под действием газов.
Электрохимическая коррозия
Электрохимическая коррозия – процесс разрушения металлов или металлических конструкций, который сопровождается электрохимическими реакциями. В большинстве металлов находятся примеси. В процессе коррозии электродами могут служить не только металлы, но и его примеси.
Например, в железе могут находиться примеси олова. В этом случае на аноде электроны переносятся от олова к железу и металлы растворяются, т.е. железо подвергаются коррозии. На катоде восстанавливается водород из воды или растворенного кислорода. Электрохимическая коррозия может сопровождаться следующими процессами.
Анод: Fe 2+ - 2e → Fe 0
Катод: 2H + + 2e → H2
Способы защиты от коррозии
В промышленности популярны различные методы защиты металлов от коррозии.
Покрытия защищают поверхности от действия окислителей. Ими служат различные вещества:
- покрытие менее активным металлом (железо покрывают оловом);
- краски, лаки, смазки.
- Создание специальных сплавов
Физические свойства сплавов и чистых металлов отличаются. Поэтому для повышения стойкости в сплав необходимо добавить дополнительные металлы.
Биологическая роль металлов и неметаллов
В организмах содержится множество различных металлов и неметаллов. Различных химических элементов в организме может не хватать, поэтому приходится потреблять их извне.Химические элементы можно разделить на две большие группы – макроэлементы и микроэлементы.
К макроэлементам относятся вещества, содержание которых в организме превышает 0,005 %. Эта группа включает водород, углерод, кислород, азот, натрий, магний, фосфор, сера, хлор, калий, кальций.Микроэлементы – элементы, содержание которых не превышает 0,005%. К ним относятся железо, медь, селен, йод, хром, цинк, фтор, марганец, кобальт, молибден, кремний, бром, ванадий, бор. Каждый макро- и микроэлемент в организме выполняет определенную функцию.
Применение металлов и неметаллов
В синтезе химических препаратов и лекарств применяются чистые металлы и неметаллы. В органической химии металлы используются в качестве катализаторов, а также при получении металлорганических соединений. Неметаллы служат исходным сырьем для получения чистых кислот и других химических соединений.
Периодическая система химических элементов
В этом разделе Вы познакомитесь подробно с периодической системой химических элементов (ПСХЭ). Рассмотрим: почему она носит такое название, почему её называют универсальной шпаргалкой, какие сведения можно получить, используя её на уроках не только химии, но и физики.
Классификация химических элементов
Начнём с истории создания ПСХЭ. В определённый момент XIX века, когда наука значительно шагнула вперёд и достаточно быстрыми темпами открывались новые химические элементы, возникла необходимость рассортировать их. Несмотря на то, чтои все они отличались по своим свойствам, в процессе изучения можно было выделить общие их свойства.
Год открытия периодической системы считается 1869. Она была колоссальным успехом того времени, а так же не теряет актуальность и на данный момент.
Но давайте всё рассмотрим по порядку, ведь над проблемой систематизации на протяжении многих лет работало много учёных, которые внесли большой вклад в развитие науки. В силу разных причин, они не смогли в полной мере классифицировать элементы.
Так, самая первая попытка была разделить на металлы и неметаллы, автором которой был шведский учёный Йёнс Якоб Берцелиус.
Что характерно для металлов?
Представим перед собой, предметы с железа, золота, алюминия. Что первое мы можем сказать о свойствах этих металлов? Все они имеют металлический блеск.
Также они (за исключением ртути) при нормальных условиях находятся в твёрдом виде. Имеют хорошую электропроводность и теплопроводность, высокую плотность. Эти признаки объединяют группу металлов.
Как мы можем описать неметаллические вещества?
Какие они будут иметь общие характеристики? В простых соединениях неметаллы могут быть как газы (кислород О2, хлор Cl2, азот N2), жидкости (бром Br2), так и твёрдые вещества (алмаз – самоё твёрдое вещество, образован Углеродом С, также сера S, кремний Si, фосфор Р, йод I2).Они могут быть не только разного агрегатного состояния, но и иметь разнообразную окраску.
Но, не смотря на такие резкие отличия между ними, возможно выделить общие черты: они диэлектрики и не пластичны. Большинство неметаллов имеют молекулярное строение. Данная классификация актуальна и в наше время.
Над классификацией элементов трудилось много учёных разных стран. Работая независимо друг от друга, они обнаружили интересный факт, что свойства элементов зависят от их атомной массы.
Немецкий химик И.В. Деберейнер отметил, что некоторые элементы сходны свойствами, и их можно объединить в группы, название которым дал – триады. Масса одного из элементов является средним арифметическим элементов с максимальной и минимальной массой в группе.
Недостатком данной систематизации является то, что данным способом удалось получить всего 5 триад. Не трудно подсчитать, что систематизировано было всего 15 элементов, а остальные 56 элементов не вписывались в его классификацию. Однако Деберейнер один из немногих заметил связь между свойствами и атомной массой элемента.
Ещё один необычный способ предложил французский химик А.Э. Шанкартуа. За основу он взял спираль и на её витках разместил элементы в порядке возрастания их атомных масс. Другое название она получила «Теллуровый винт», потому что заканчивалась Теллуром. Заслугой «спирали-винта» было обращение внимания на подобные свойства Водорода и галогенов (Cl, Br, I). Таким образом удалось систематизировать 50 элементов.
Как совершенству нет предела, так и фантазиям учёных. Так английский учёный Джон Ньюлендс связал элементы с музыкой, он предоставил их в виде нот и заострил своё внимание на том, что каждый восьмой повторяет свойства первого.
Как оказалось, и эта классификация имеет недочёты, во-первых, она не располагала местом для новых элементов, а, во-вторых, в одно семейство попадали элементы с разными свойствами, которые не имели ничего общего: Cl и Pt, S, Fe и Au. Однако данная систематизация имела и положительные моменты, учёные заметили, что периодичность возникает на 8 элементе по счёту, также появилось понятие порядковый номер.
Отдельно хочется выделить немецкого учёного Лотара Мейера. Он разместил 28 элементов в виде таблицы. В принцип создания таблицы он заложил атомную массу, её увеличение, а также выделил столбцы элементов с одинаковой валентностью.
Ему понадобилось почти шесть лет, чтобы усовершенствовать свою таблицу и расположить остальные элементы, которые он не учёл в версии таблицы, выданной в 1864 году. Ошибка Мейера заключалась в том, что не было никаких обобщений и выводов, но как видно, он был близок к открытию не только периодической системы, но и закона.
Схема показывает, что учёные не одно десятилетие работали над созданием упорядоченной таблицы для элементов. Необходим был фундаментальный закон, который будет применим в естествознании.
В 1869 году русский учёный Дмитрий Менделеев создаёт периодическую систему. Об истории написания таблицы существует множество легенд, как и самом учёном. Менделеев был достаточно многогранной личностью, он трудился в разных сферах науки. Открыл секрет изготовления бездымного пороха, придумал способ передачи нефти, используя трубопровод. К нефти он особенно относился, считая сжигание нефти кощунством, так как она служит источником для получения множества вещества. «Человек-чемодан» можно также услышать о нём, потому что любимым его делом было изготавливать чемоданы. Но самой значимой его заслугой было создание периодической системы, которую, поговаривают, создал он во сне.
Строение периодической системы
Для начала рассмотрим понятия таблица и система. Вы не один раз видели таблицу, она состоит из строк и столбцов. Но почему творение Менделеева имеет названия как таблица, так система да еще и с добавлением периодическая.
В таблице содержится упорядоченная информация в определённом порядке. Система указывает, что сведения связаны между собой. Периодичность означает, что через какой-то промежуток или отрезок происходит повторение свойств.
Как уже известно, в периодической системе находятся элементы. Принцип их расположения - это увеличение их атомной массы.
В таблице имеются строки – это периоды, и столбцы – группы.
Существует несколько вариантов ПСХЭ, так называемый короткий и длинный вариант.
Короткий вариант имеет 8 групп, номера которых указаны римскими цифрами I, II…VIII, содержит главную (А) и побочную (В) группы. Длинный формат вмещает 18 групп, нумерация осуществляется арабскими цифрами I, II…XVIII,
Если посмотреть на таблицу, то видим закономерность, так как абсолютно каждый период будет начинаться активным металлом и заканчиваться инертным газом. Такая периодичность сохраняется 7 раз.
Как видно из таблицы, I период включает 2 элемента, II и III состоят из 8, IV и V содержат 18, самые большие – это VI и VII вмещают 32 элемента (VII период незаконченный).
В периоде с ростом атомной массы металлические свойства уменьшаются, неметаллические – увеличиваются.
Вертикальные столбцы образуют группы. Это условно компании, где собираются единомышленники. Точнее, располагаются элементы, подобные по своим свойствам.
Обратите внимание, что подобие характерно только в пределах подгруппы. Так, натрий и медь принадлежат одной I группе, но располагаются в разных подгруппах. Натрий – элемент главной подгруппы, медь – побочной. Именно по этой причине они будут иметь разные физические и химические свойства.
В пределах группы с ростом атомной массы металлические свойства увеличиваются, неметаллические – уменьшаются.
Таким образом, периодическую систему можно условно назвать домом химических элементов, где каждый из них занимает своё определённое место (порядковый номер) согласно его свойствам.
Рассмотрим подробнее на примере 2 и 3 периода. Что показывает сравнение: оба периода начинаются с активных металлов Li и Na, для которых характерно существование в виде соединений, в свободном виде могут находиться только под слоем керосина. Они относятся к группе щелочных металлов. Анализируя схему, мы видим, что первые три группы образованны металлами. С IV – VII находятся неметаллы. «Закрывают период» инертные газы.
Особое внимание располагают к себе элементы VI и VII периоды, которые образуют «семейство» лантаноидов (Лантан № 57) и актиноидов (Актиний 89), они формально близки к скандию. Но из-за их количества они вынесены за пределы системы.
Периодический закон Д. И. Менделеева
Проанализировав изменения свойств элементов II и III периода, можно сделать выводы, которые Д. И. Менделеев записал в виде периодического закона.
Благодаря периодическому закону, зная расположение элемента в периодической системе, мы можем прогнозировать свойства веществ. Элементы входят в состав как простых, так и сложных веществ, влияя при этом на их свойства. Обобщить данные тезисы можно в виде таблицы.
Таблица 1. Изменение свойств химических элементов в ПСХЭ
Рассмотрим на примере I группы. Li, Na, K, Cs, Fr собрались в компанию одновалентных металлов, которые образуют основные оксиды состава Ме2О. При взаимодействии с водой образуют щёлочь. Эти характеристики их объединяют. Теперь рассмотрим отличия. Вам уже известно, что в пределах группы с ростом атомной массы металлические свойства увеличиваются.
Как это сказывается на реакционной способности данных металлов?
Интенсивность и скорость реакции калия и лития с водой будет отличаться. Реакция калия будет сопровождаться бурным выделением водорода, в то время как литий будет спокойно реагировать с водой.
Зная формулу и состав высшего оксида, можем предположить его характер. Например, марганец образует оксиды MnO, MnO2, Mn2O7. Таблица поможет нам предположить их свойства.
MnO – будет основным оксидом (ищем аналогию со II группой), ему будет отвечать основание Mn(OH)2. Не трудно догадаться, что MnO2 и Mn2O7 будут кислотными (подобно IV и VII группе), они образуют кислоты H2MnO3 и HMnO4.
Свинец образует два оксида PbO и PbO2. Оксид свинца (II) PbO будет основной, оксид свинца (IV)PbO2– кислотный.
Характеристика элемента по его положению в периодической системе
Зная «прописку» элементов в таблице, мы можем прогнозировать их свойства. Составим план, согласно которому сможем описать свойства элементов, рассматривать будем на примере серы.
Первое, что нам необходимо знать - это какой символ имеет сера, чтобы по нему найти её в ПСХЭ. Обозначение S занимает ячейку 16. (порядковый номер).
Уточняем «прописку». III период, VI группа, главная подгруппа. Зная эти элементарные сведения, мы предполагаем, что это неметалл (принадлежность к VI группе и нахождение в малом ряду даёт нам основание для предположения).
Формула высшего оксида и его свойства. Поскольку сера элемент VI группы, высшая валентность будет равна VI. Формула оксида SO3. Пользуясь таблицей-шпаргалкой, определяем характер – кислотный. С курса физики известно, что противоположности притягиваются. Как плюс притягивает минус, так и кислотные оксиды взаимодействуют с основными, которые образованы элементами-металлами с валентностью I или II. Возьмём, например, барий, который образует оксид и гидроксид, соответственно ВаO и Вa(OH)2.
Формула высшего гидроксида и его свойства. Снова обратимся к нашей шпаргалке, высшие гидроксиды VI группы имеют формулу H2ЭO4, а именно H2SO4. Образованный гидроксид имеет кислотные свойства, для которого свойственны реакции с основными оксидами и основаниями. К примеру, возьмём двухвалентный стронций, формула оксида и гидроксида соответственно SrO и Sr(OH)2.
Как элемент-неметалл образует летучее водородное соединение состава H2S.
На данном примере убеждаемся, что зная расположение элемента в ПСХЭ, можно прогнозировать его свойства, а также свойства веществ, в состав которых он входит.
Металлы и неметаллы: сравнительная характеристика

Все химические элементы условно можно разделить на неметаллы и металлы. Знаете ли вы, по каким признакам они отличаются? Как определить их положение в таблице химических элементов? На эти и другие вопросы вы найдете ответы в нашей статье.
Положение неметаллов и металлов: таблица Менделеева
По внешним признакам и физическим свойствам не всегда можно выяснить, к какой группе относится химический элемент. Свойства металлов и неметаллов можно определить по расположению в периодической таблице.
Для этого нужно зрительно провести диагональ от бора до астата, от 5 до 85 номера. В правом верхнем углу будут преимущественно находиться неметаллы. Их в таблице меньшинство, всего 22 элемента. Металлы находятся в правой части периодической таблицы наверху - в основном в I, II и III группах.
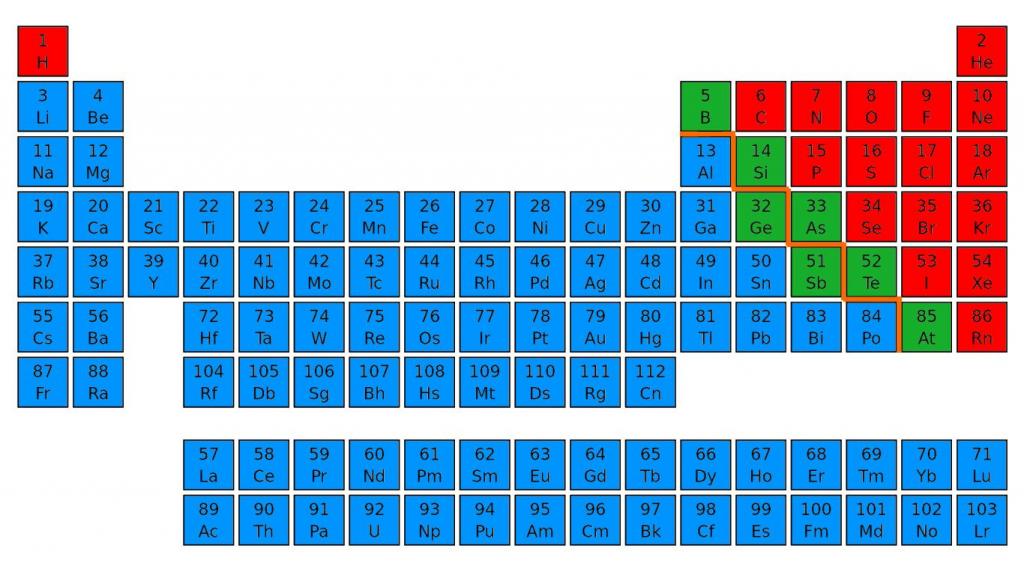
Энергетический уровень
Отличия неметаллов и металлов первоначально обусловлены строением их атомов. Начнем с количества электронов на внешнем энергетическом уровне. У атомов металлов оно варьирует от одного до трех. Как правило, они обладают большим радиусом, поэтому атомы металлов достаточно легко отдают наружные электроны, так как имеют сильные восстановительные свойства.
У неметаллов число электронов на внешнем уровне больше. Это объясняет их окислительную активность. Неметаллы присоединяют недостающие электроны, полностью заполняя энергетический уровень. Самые сильные окислительные свойства проявляют неметаллы второго и третьего периода VI-VII групп.
Заполненный энергетический уровень содержит 8 электронов. Самой большой окислительной способностью обладают галогены с валентностью I. Среди них лидирует фтор, так как у этого элемента нет свободных орбиталей.

Строение металлов и неметаллов: кристаллические решетки
Физические свойства веществ определяются порядком расположения элементарных частиц. Если условно соединить их воображаемыми линиями, то получится структура, которая называется кристаллической решеткой. В ее узлах могут находиться разные структуры: атомы, молекулы или заряженные частицы - ионы.
У некоторых неметаллов формируется атомная кристаллическая решетка, частицы которой соединены ковалентными связями. Вещества с таким строением твердые и нелетучие. К примеру, фосфор, кремний и графит.
В молекулярной кристаллической решетке связь между элементарными частицами слабее. Обычно подобные неметаллы находятся в жидком или газообразном агрегатном состоянии, но в некоторых случаях - это твердые легкоплавкие неметаллы.
В любом образце металла часть атомов теряет наружные электроны. При этом они превращаются в положительно заряженные частицы - катионы. Последние снова соединяются с электронами, образуя нейтрально заряженные частицы - в металлической решетке одновременно находятся катионы, электроны и атомы.

Физические свойства
Начнем с агрегатного состояния. Традиционно принято считать, что все металлы - твердые вещества. Исключением является только ртуть, тягучая жидкость серебристого цвета. Ее пары являются контаминантом - токсичным веществом, вызывающим отравление организма.
Еще одна характерная черта - металлический блеск, который объясняется тем, что поверхность металла отражает световые лучи. Еще одна важная особенность - электро- и теплопроводность. Это свойство обусловлено наличием в металлических решетках свободных электронов, которые в электрическом поле начинают двигаться направленно. Лучше всех проводит тепло и ток ртуть, наименьшими показателями обладает серебро.
Металлическая связь обусловливает ковкость и пластичность. По этим показателям лидирует золото, из которого можно раскатать лист толщиной в человеческий волос.
Чаще всего физические свойства металлов и неметаллов противоположны. Так, последние характеризуются невысокими показателями электро- и теплопроводности, отсутствием металлического блеска. При обычных условиях неметаллы находятся в газообразном или жидком состоянии, а твердые всегда хрупкие и легкоплавкие, что объясняется молекулярным строением неметаллов. Алмаз, красный фосфор и кремний - тугоплавкие и нелетучие, это вещества с немолекулярным строением.

Что такое полуметаллы
В периодической таблице между металлами и неметаллами находится ряд химических элементов, которые занимают промежуточное положение. Их называют полуметаллами. Атомы полуметаллов связаны ковалентной химической связью.
Эти вещества совмещают признаки металлов и неметаллов. К примеру, сурьма является кристаллическим веществом серебристо-белого цвета и вступает в реакцию с кислотами, образуя соли - типичные металлические свойства. С другой стороны, сурьма - очень хрупкое вещество, которое не поддается ковке, а измельчить его можно даже вручную.
Итак, типичные неметаллы и металлы обладают противоположными свойствами, но деление это достаточно условно, поскольку ряд веществ сочетает в себе и те и другие признаки.
Свойства металлов

Возможность отдавать электроны с внешнего энергетического уровня обуславливается восстановительными или металлическими свойствами металлов. Степень окисления металлов в соединениях всегда положительная.
Положение в таблице Менделеева
Металлы занимают левую часть периодической таблицы. В первой и второй группах находятся наиболее активные щелочные и щелочноземельные металлы. Наименее активны благородные металлы (золото, платина, серебро), находящиеся ближе к левому краю.
В периодах слева направо металлические свойства уменьшаются. Это связано с возрастанием количества электронов на внешнем энергетическом уровне и увеличением окислительных свойств.
В группах свойства металлов увеличиваются сверху вниз с увеличением числа энергетических уровней. При большом расстоянии от ядра электроны легче отделяются от атома металла.
Проследить активность металлов можно по электрохимическому ряду напряжений металлов. Стоящие слева от водорода элементы проявляют большую активность, чем металлы, стоящие справа. Наиболее активным металлом является литий.

Рис. 1. Ряд напряжений металлов.
Сравнение с неметаллами
Металлы существенно отличаются от неметаллов физическими и химическими свойствами. Сравнительная характеристика металлов и неметаллов представлена в таблице.
Признак
Металлы
Неметаллы
Есть. Самые блестящие – ртуть, серебро, палладий
Твёрдые (исключение – ртуть)
Газ, жидкость, твёрдое вещество
Являются электропроводниками. Наилучшая электропроводность у серебра, золота, меди, алюминия
Являются изоляторами (исключение – углерод, кремний)
Несмотря на то, что графит – модификация углерода, он имеет металлический блеск и обладает электропроводностью. Йод также напоминает металл характерным блеском.

Рис. 2. Графит.
Физические
Все металлы обладают физическими и механическими свойствами. К физическим свойствам относятся:
- плотность – содержание вещества в единице объёма;
- температура плавления – значение, при котором металл переходит из твёрдого состояния в жидкое;
- электропроводность – способность проводить электрический ток;
- теплопроводность – способность передавать тепло;
- удельная теплоёмкость – количество тепла, необходимое для повышения температуры 1 г металла на 1°С;
- тепловое расширение – увеличение объёма при нагревании;
- магнитные свойства – способность намагничиваться и притягивать другие металлы (свойством обладают железо, кобальт, никель, гадолиний).
В соответствии с температурой плавления все металлы делятся на два типа:
- легкоплавкие – приобретают жидкую форму при температуре в пределах 1000°С (цезий, галлий, ртуть);
- тугоплавкие – плавятся при температуре выше 1000°С (вольфрам, хром, ванадий).
К механическим свойствам относятся:
- пластичность;
- твёрдость;
- упругость;
- прочность.
Механические свойства металлов важны при создании сплавов – смесей металла и неметалла. Получившийся сплав проверяют на работоспособность и подвергают испытаниям – растяжению, ударам и т.д.
Сплавы, в состав которых входит железо, называются чёрными металлами. К цветным металлам относятся сплавы остальных металлов.

Рис. 3. Чёрные и цветные металлы.
Химические
Металлы – сильные восстановители. Элементы, стоящие левее водорода, реагируют с простыми и сложными веществами, образуя соли, кислоты, оксиды и гидроксиды:
Читайте также:

