Переходные металлы почему так называются
химич. элементы I6 и VIIIб подгрупп периодич. системы элементов. В П. м. внутр. оболочки атомов заполнены только частично. Различают d-металлы, у к-рых происходит постепенное заполнение З-d (от Sc до Ni), 4-d (от Y до Pd) и 5-d (от Hf до Pt)-подоболочек, и f-металлы, у к-рых заполняются 4f-подоболочки (редкие земли, или лантаноиды, от Се до Lu) и 5f-подоболочки (актиноиды). Ряд актиноидов начинается с Ас. У Th и последующих элементов заполняется 5f-оболочка. Все актиноиды радиоактивны. Общее число П. м. 61. У меди, когда она двухвалентная, 3d-оболочка не совсем заполнена. Поэтому в CuO ион Cu+ ведёт себя как ион П. м. На этом основании Cu, Ag и Au (металлы la подгруппы) условно также можно считать П. м. Особенности строения электронных оболочек атомов определяют нек-рые специфич. св-ва П. м.: парамагнетизм, ферромагнетизм, антиферромагнетизм, сверхпроводимость, способность к комплектованию, аномалию в изменении таких хар-к межатомной связи в решётке, как упругие константы, теплота сублимации и темп-pa плавления, при увеличении ат. номера элемента.
Физический энциклопедический словарь. — М.: Советская энциклопедия . Главный редактор А. М. Прохоров . 1983 .
Полезное
Смотреть что такое "ПЕРЕХОДНЫЕ МЕТАЛЛЫ" в других словарях:
переходные металлы — Элементы 16 и VIII6 подгруппы Периодич. системы. У атомов п. м. внутр. оболочки заполнены только частично. Различают rf ме таллы, у к рых происходит постепенное заполнение 3
Переходные металлы — (переходные элементы) элементы побочных подгрупп Периодической системы химических элементов Д. И. Менделеева, в атомах которых появляются электроны на d и f орбиталях. [1] В общем виде электронное строение переходных элементов… … Википедия
переходные металлы — [transition metals] элементы Iб и VIIIб подгруппы Периодической системы. У атомов переходных металлов внутренние оболочки заполнены только частично. Различают d металлы, у которых происходит постепенное заполнение 3d (от Se до Ni), 4d (от Y до… … Энциклопедический словарь по металлургии
Металлы платиновой группы — H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr Rb Sr Y … Википедия
Переходные элементы — Переходные металлы (переходные элементы) химические элементы побочных подгрупп I VIII групп Периодической системы элементов Д.И. Менделеева (3 12 групп в длиннопериодном варианте таблицы). Переходные металлы выделяют на основании незавершённости… … Википедия
металлы — Простые вещ ва, обладающие в обычных условиях хар рными св вами: высокой электро и теплопроводностью, отрицат. темп рным коэфф. электропроводности, способностью хорошо отражать электромагн. волны, пластичностью. М. В. Ломоносов определял м. как… … Справочник технического переводчика
ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ — (переходные металлы; хим. элементы, расположенные в побочных подгруппах больших периодов периодической системы; являются d и f элементами. Назв. переходные связано с тем, что в периодах П. э. вклиниваются между s и р элементами. Всего известно 65 … Химическая энциклопедия
МЕТАЛЛЫ — (от греч. metallon, первоначально шахта, руда, копи), простые в ва, обладающие в обычных условиях характерными св вами: высокими электропроводностью и теплопроводностью, отрицательным температурным коэфф. электропроводности, способностью хорошо… … Физическая энциклопедия
ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ — (переходные металлы) химические элементы подгрупп б периодической системы Менделеева. Атомы переходных элементов имеют незавершенные внутренние электронные оболочки. Различают d элементы, у которых происходит заполнение внутренних 3d , 4d , 5d и… … Большой Энциклопедический словарь
ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ — переходные металлы, d и f элементы, хим. элементы, у к рых d и f оболочки частично заполнены электронами. К d элементам относятся металлы подгрупп меди Си, цинка Zn, скандия Sc, титана Ti, ванадия V, хрома Сr, марганца Мп, а также VIII гр.… … Большой энциклопедический политехнический словарь
Переходные элементы: медь, хром, железо
Общая характеристика переходных элементов-металлов
К переходным элементам относятся такие, которые расположены в побочных подгруппах больших периодов периодической системы Д.И. Менделеева. К ним принадлежат d– и f–элементы. Название «переходные» связано с тем, что переходные элементы расположены между s– и р–элементами.
Мы рассмотрим три металла: железо, хром и медь.
Железо — металл VIIIB-группы четвёртого периода. Его особенностью, как и особенностью других переходных металлов, является наличие валентных электронов как на внешнем (4s), так и на предвнешнем (3d) подуровнях.
Хром — металл VIB-группы четвёртого периода. Как и железо, это d-элемент, у которого валентные электроны находятся и на внешнем слое и на предвнешнем подуровне. Помимо этого, в атоме хрома в основном состоянии происходит провал электрона.
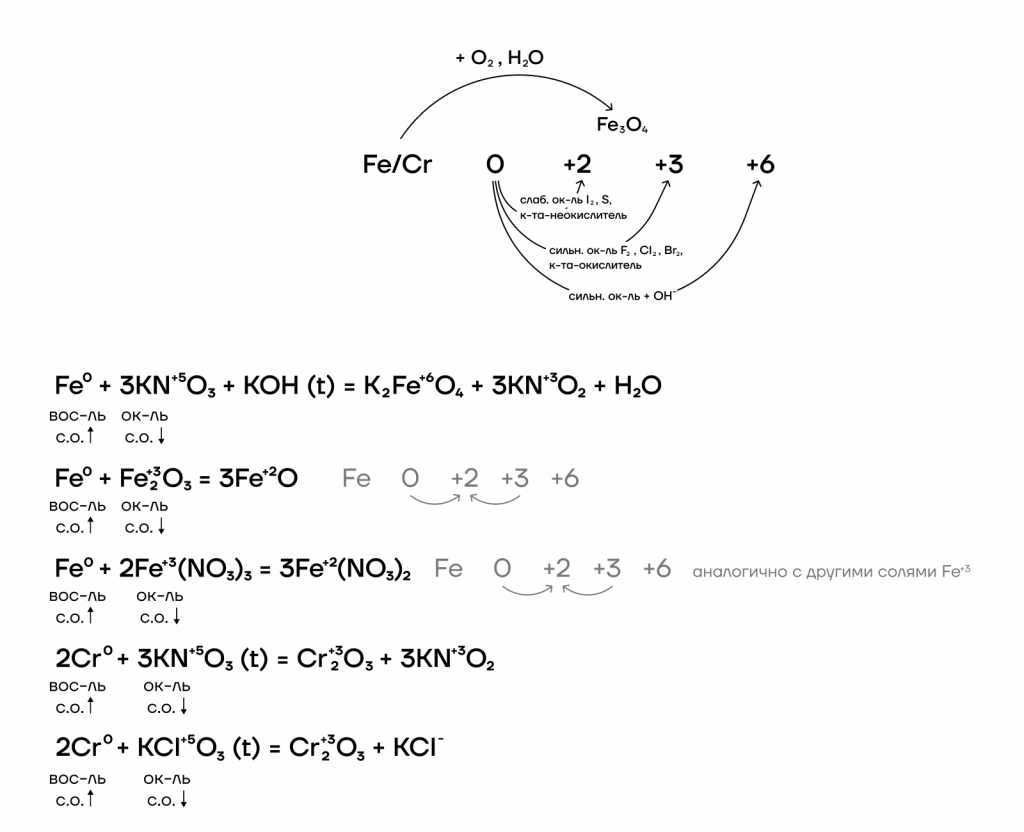
Железо и хром имеют идентичный набор степеней окисления, а также возможных оксидов и гидроксидов: 0, +2, +3, +6.
Медь — металл IB-группы четвёртого периода. Как и в случае других элементов побочных подгрупп, особенностью для неё является наличие валентных электронов как на внешнем (4s), так и на предвнешнем (3d) подуровнях. Как и у хрома, у меди в электронной конфигурации наблюдается провал электрона.
Степени окисления меди следующие:
- низшая степень окисления равна 0, как и у всех металлов;
- высшая равна +2;
- промежуточная равна +1.
Физические свойства
По физическим свойствам железо и хром — совершенно типичные металлы серебристо-белого цвета, которые не растворяются в воде, а на воздухе покрываются прочной оксидной плёнкой.
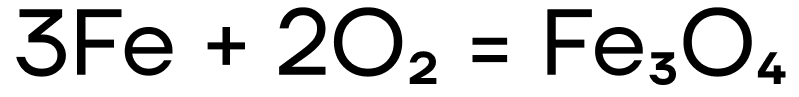
Особенностью железа является его быстрая коррозия (то есть окисление) кислородом во влажном воздухе, а особенностью хрома — высокая твёрдость: он является одним из самых твёрдых металлов.
Медь же — металл красного цвета, один из четырёх металлов, имеющих явную цветовую окраску, которая отлична от серой или серебристой.
Способы получения
Основным способом получения меди, хрома и железа является пирометаллургия, то есть различные реакции, происходящие при высоких температурах.
Химические свойства
- Взаимодействие с простыми веществами
Как и другие металлы, железо и хром способны взаимодействовать со своими противоположностями, неметаллами, с образованием различных бинарных соединений.
При этом неметаллы, являющиеся сильными окислителями, окисляют железо и хром до +3, а неметаллы, являющиеся слабыми окислителями, — только до +2.
Железо и хром не реагируют с водородом и азотом ввиду неактивности последних. При взаимодействии с кислородом железо ржавеет: образуется смесь оксидов железа, то есть железная окалина Fe3O4.
Медь способна также окисляться до разных степеней окисления в зависимости от силы окислителя или его избытка/недостатка.
Железо и хром являются металлами, стоящими в ряду активности до водорода, поэтому они могут вытеснять его из воды с образованием оксидов и вытесненного водорода.
Так как это металлы средней активности (стоящие в промежутке от алюминия до водорода) они реагируют с водой не при нормальных условиях, а при очень высокой температуре.
При взаимодействии с водой железо ржавеет: образуется железная окалина Fe3O4, как и в случае с кислородом.

Медь же находится в ряду активности после водорода, следовательно, она “слабее” водорода и не способна вытеснить такого сильного соперника.
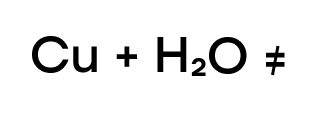
- Реакция с кислотами-неокислителями
Благодаря нахождению железа и хрома до водорода в ряду активности металлов они также способны вытеснять водород из растворов кислот-неокислителей.
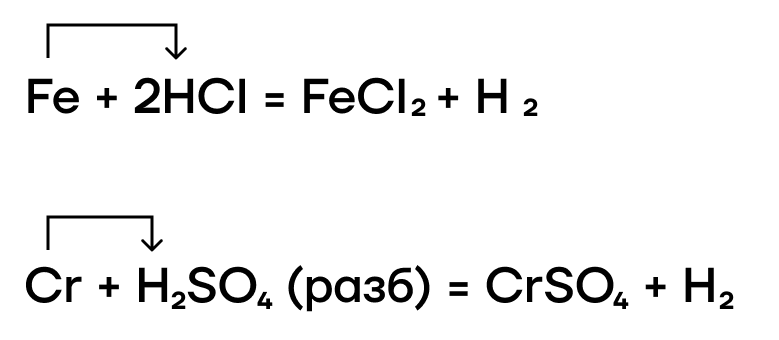
Так же, как и в случае с водой, медь не может вытеснить “качка”-водорода из таких кислот.
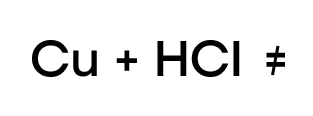
Как и прочие металлы, железо, хром и медь могут вытеснять менее активные металлы из растворов их солей.
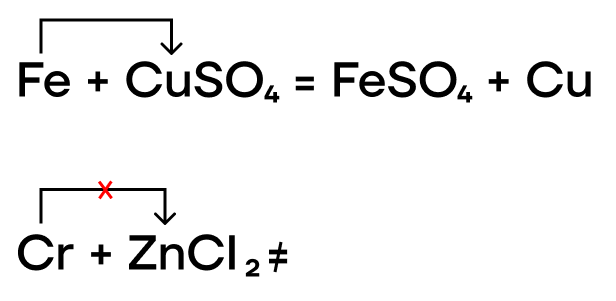
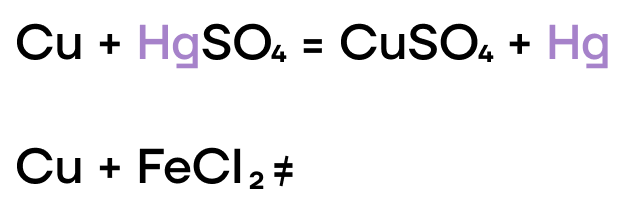
Из-за низких значений электроотрицательности, железо, хром и медь являются типичными восстановителями, а следовательно, способны реагировать с окислителями.
Ниже представлены различные способы повышения степеней окисления железа и хрома и основные реагенты, которые используются.
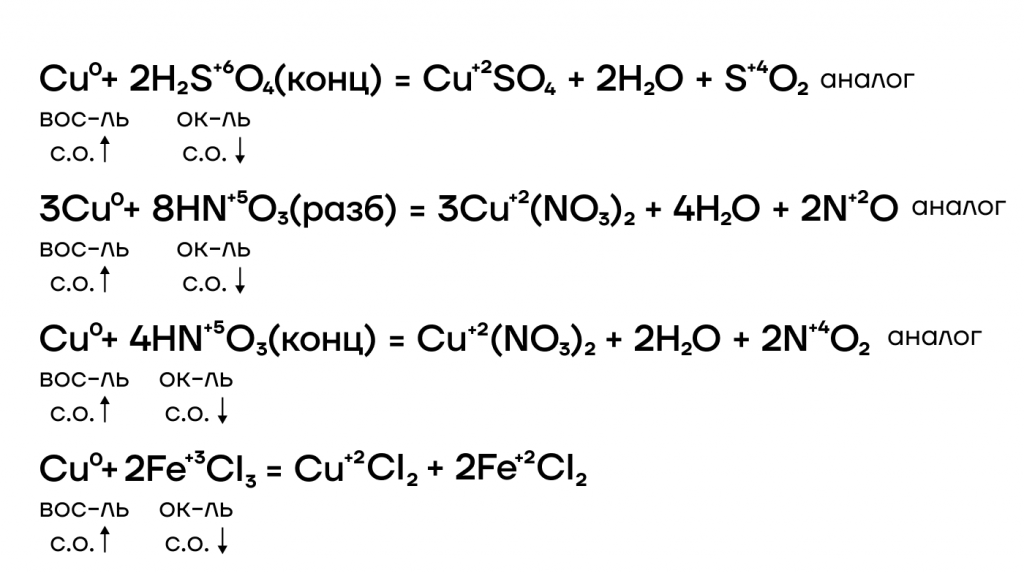
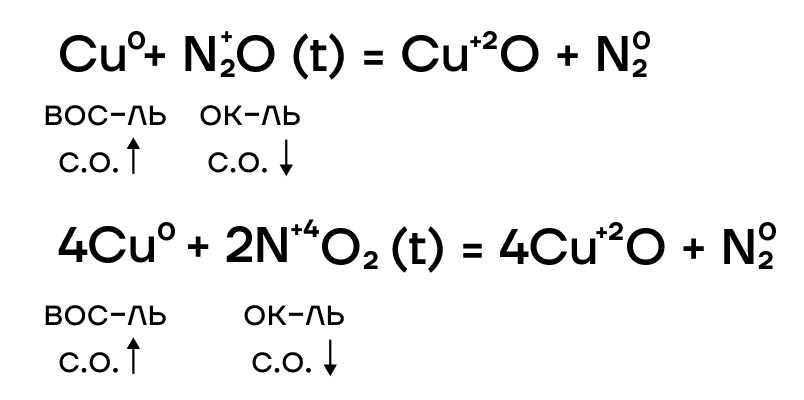
Фактчек
- Медь, железо и хром относятся к переходным металлам, то есть таким, которые расположены в побочных подгруппах больших периодов;
- Возможные степени окисления железа и хрома: 0, +2, +3, +6. Возможные степени окисления меди: 0, +1, +2.
Проверь себя
Задание 1.
У атома какого химического элемента не наблюдается «проскок» электрона?
Задание 2.
С какой солью будет реагировать медь?
- Хлорид натрия;
- Сульфат ртути(II);
- Хлорид железа(III);
- Фосфат кальция.
Задание 3.
Для какого металла характерна степень окисления +1?
Ответы: 1. — 3; 2. — 2; 3. — 4
переходные и непереходные металлы
Переходные металлы (переходные элементы) — химические элементы побочных подгрупп I — VIII групп Периодической системы элементов Д. И. Менделеева (3 — 12 групп в длиннопериодном варианте таблицы) .
Переходные металлы выделяют на основании незавершённости внутренних электронных оболочек их атомов или ионов. Термин «переходные» связан с тем, что в периодах эти элементы располагаются между s- и р-элементами. Переходные металлы, в свою очередь, подразделяют на d-элементы, у которых происходит заполнение 3d-, 4d-, 5d- и 6d-подоболочек, и f-элементы, у которых заполняется 4f- (лантаноиды) либо 5f-подоболочка (актиноиды) . Цинк, кадмий и ртуть, обычно причисляемые к переходным металлам, строго говоря, таковыми не являются, поскольку их катионы имеют завершённый d-подуровень.
Это хром, молибден, вольфрам, марганец и т. д.
Их разделяют на подгруппы
Переходные металлы:
Подгруппа железа
Елена Казакова Высший разум (122206) Конечно, являются. Переходные металлы, в свою очередь, подразделяют на d-элементы, у которых происходит заполнение 3d-, 4d-, 5d- и 6d-подоболочек, и f-элементы, у которых заполняется 4f- (лантаноиды) либо 5f-подоболочка (актиноиды) .
Переходные металлы могут в реакции с водой образовать не только основания, но кислоты. Например: 2Al+6H2O->2Al(OH)3+3H2 (гидроксид алюминия, основание) или 2Al+6H2O->2H3AlO3+3H2 (алюминиевая кислота) . А еще проще как отличать: они в таблице Менделеева подписаны :)
Соединения переходных металлов
Переходные металлы образуют соединения с обычной s-связью металл-углерод, а также p-комплексы с органическими ненасыщенными молекулами. Разнообразие органических лигандов и способов их связывания с металлами определяет многочисленность этих соединений.
В соответствии с типом органического лиганда различают олефиновые (алкеновые) , ацетиленовые (алкиновые) , аллильные, диеновые (или полиеновые) , циклопентадиенильные (включая металлоцены) и ареновые комплексы переходных металлов. Некоторые карборановые группировки также могут вести себя как p-связанные лиганды. Существуют соединения, содержащие одновременно органические лиганды различных типов. Известны также би- и полиядерные МОС, которые могут содержать связи металл - металл (кластеры) .
Переходные металлы способны стабилизировать при координации неустойчивые органические молекулы, ионы и свободные радикалы (комплексы циклобутадиена, триметиленметана, карбенов, карбинов и т. п.) .
С точки зрения теории молекулярных орбиталей, в МОС p-комплексного типа связи лигандов с металлом осуществляются общей системой электронов. Эти делокализованные многоцентровые связи могут охватывать атом металла и часть или все углеродные атомы органического лиганда. Определяющую роль в связывании с металлом играют граничные p-орбитали лиганда. Сильное перекрывание орбиталей металла и лиганда способствует образованию прочной связи. Это возможно, когда энергии взаимодействующих орбиталей близки и орбитали имеют одинаковый знак, т. е. одинаковые свойства симметрии и фазу (принцип изолобалъной аналогии) .
Распределение электронной плотности между атомом металла и лигандом зависит от природы металла, степени его окисления и от строения органического лиганда. При этом изменения результирующих зарядов на атоме металла и лиганде при образовании p-связи невелики, что обусловлено особенностями связей металл - лиганд. Эти связи состоят из двух компонент: донорно-акцепторной и дативной. Первая обусловлена подачей p-электронов лиганда на молекулярные орбитали комплекса, образованные с участием d-орбиталей металла. Вторая – включает обратную подачу d-электронов металла на молекулярные орбитали, образованные за счет перекрывания разрыхляющих (несвязывающих) p*-орбиталей лиганда и d-орбиталей металла.
Стехиометрия многих, хотя и не всех, p-комплексов подчиняется правилу эффективного атомного номера (ЭАН, правило 18 электронов, правило инертного газа, правило Сиджвика) . В соответствии с этим правилом число валентных электронов у металла в комплексе должно равняться числу электронов в оболочке ближайшего к данному металлу инертного газа.
Правило определяет способность атома металла наиболее полно использовать при образовании связи с лигандом свои валентные орбитали nd, (n+1)s и (n+1)р, которые суммарно могут заполнены 18 электронами. Для подсчета ЭАН к числу электронов на внешней оболочке атома (или иона) металла прибавляют число электронов, формально передаваемых атому металла лигандами. Обычно принимают, что s-алкильные, s-арильные лиганды и т. п. отдают атому металла один электрон, олефины – два, h3-аллил – три, диены – четыре, p-циклопентадиенил – пять и т. д. По этому принципу органические лиганды классифицируют на одно-, двух-, трехэлектронные и т. д. Атомы галогена и водорода, а также группы CN, OR, SR формально передают один электрон, СО, R3N, R3P – два, NО – три; связь металл-металл – по одному электрону каждому атому металла. Если энергии орбиталей nd, (n + 1)s и (n + 1)р близки, а орбитали доступны для связывания лигандов, то выполняется правило ЭАН (например, для комплексов V, Cr, Mn, Fe и Со в низших степенях окисления) . Отклонения от правила наблюдаются для комплексов металлов, завершающих d-ряды, напр. Сu, Аg, Аu, или при повышении степени окисления металла, т. е. в тех случаях, когда у
[ссылка заблокирована по решению администрации проекта]
Как все сложна!
Руби фишку, крче!
У непереходных полный комплект электронов вокруг ядра вращается, а у переходных не совсем. Из-за этого они по-разному ведут себя в соединениях и под воздействием внешних факторов, т. е. все что выше написали остальные. Классификаций и разных нюансов в химии до фи ги ща. Именно поэтому я ненавижу Химию, но если потратишь время и подробно изучишь вопрос, то все четко, здесь нужно отдать должное. Однако, если учебник написан зазнайкой от мира науки, то рискуешь сломать себе мозг.
ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ
ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ (переходные металлы; хим. элементы, расположенные в побочных подгруппах больших периодов периодической системы; являются d- и f-элементами. Назв. "переходные" связано с тем, что в периодах переходные элементы вклиниваются между s- и р-элементами. Всего известно 65 переходных элементов, включая элемент 109 в 7-м периоде; 4-, 5- и 6-й периоды содержат по 10 d-элементов, 6-й период включает также 14 f-элементов (лантаноиды); в незавершенном 7-м периоде известно 7 d-элементов, начиная с Ac, и 14 f- элементов (актиноиды). В отличие от s- и p-элементов, у к-рых заполняются внеш. оболочки (соотв. ns- и np-оболочки), у переходных элементов заполняются внутренние (п — 1) d-оболочки (d-элемен-ты) или (n — 2)f-оболочки (f-элементы).
П ереходные элементы, кроме Fe и Ti, мало распространены в земной коре.
Все переходные элементы металлы. Mн. особенности, характерные для d-элементов, наблюдаются также и для f-элементов, к-рые более похожи на d-элементы, чем на s- и р-элементы. О св-вах f-элементов см. Актиноиды, Редкоземельные элементы. Св-ва d-элементов в виде простых в-в весьма разнообразны; так, среди них имеется наиб. легкоплавкий металл-Hg и наиб. тугоплавкий-W. Как правило, d-металлы отличаются высокой энтальпией возгонки, значит, электрич. проводимостью, уникальными магн. св-вами. Химия d-элементов во многом отличается от химии s- и p-элементов, что связано с большим числом степеней окисления d-элементов (напр., Ru проявляет все степени окисления от 0 до +8) и образованием координац. соединений. В отличие от s- и р-элементов, d-элементы имеют много общих черт.
Для каждой декады d-элементов наиб. устойчивы электронные конфигурации d 0 (Sc, Y, La), d 5 (Mn, Tc, Re) и d 10 (Zn, Cd, Hg). По этой причине являются стабильными, напр., Ti 4 + (d 0) , Fe 3+ (d 5 ) и Zn 2+ (d 10 ); напротив, Cr 2+ и Mn 3 + , имеющие конфигурацию d 4 , нестабильны. Особенности d-элементов большой набор их валентных состояний и, как правило, широкие пределы изменения окислит.-восстановит. и др. св-в. По многообразию валентных состояний d-элементы отличаются от всех других, в т. ч. и от f-элементов.
В каждой подгруппе св-ва первых элементов (4-го периода) заметно отличаются от св-в остальных, в пределах каждой подгруппы растет устойчивость высших степеней окисления (напр., наиб. стабильные оксиды d-элементов VI rp. Cr 2 O 3 , MoO 3 , WO 3 ). Для нек-рых d-элементов характерно сходство не только по вертикали, но и по горизонтали; так, Fe, Со и Ni более схожи между собой, чем Fe. Ru и Os.
Большинство соед. d-элементов координационные, в частности карбонилы, "сэндвичевые". Для d-элементов характерно образование кластеров, а также нестехиометрич. соед. (оксиды, сульфиды и др.). Соед. d-элементов, как правило, окрашены. Окраска объясняется расщеплением уровней энергии d-электронов в поле лигандов; это делает возможным переход (при поглощении квантов света) d-электронов с низшего уровня на высший. Доля ковалентной связи в соед. d-элементов больше, чем в соед. s-металлов (но меньше, чем в соед. р-элементов), что сказывается на св-вах соединений переходных элементов они более легкоплавки, более летучи и более подвержены гидролизу, чем аналогичные соед. s-эле-ментов.
Mн. d-элементы в виде металлов имеют очень высокую каталитич. активность, особенно выделяются в этом отношении Pt и Pd; велика каталитич. активность и мн. с оединений П.Э. С И. Дракин
(переходные металлы; хим. элементы, расположенные в побочных подгруппах больших периодов периодической системы; являются d- и f-элементами. Назв. "переходные" связано с тем, что в периодах П. э. вклиниваются между s- и р-элементами. Всего известно 65 П. э., включая элемент 109 в 7-м периоде; 4-, 5- и 6-й периоды содержат по 10 d-элементов, 6-й период включает также 14 f-элементов (лантаноиды); в незавершенном 7-м периоде известно 7 d-элементов, начиная с Ac, и 14 f- элементов (актиноиды). В отличие от s- и p-элементов, у к-рых заполняются внеш. оболочки (соотв. ns- и np -оболочки), у П. э. заполняются внутренние ( п Ч1) d-оболочки (d-элемен-ты) или (n Ч 2)f-оболочки (f- элементы).
П. э., кроме Fe и Ti, мало распространены в земной коре.
Все П. э. металлы. Mн. особенности, характерные для d-элементов, наблюдаются также и для f- элементов, к-рые более похожи на d-элементы, чем на s- и р-элементы. О св-вах f-элементов см. Актиноиды, Редкоземельные элементы. Св-ва d-элементов в виде простых в-в весьма разнообразны; так, среди них имеется наиб. легкоплавкий металл-Hg и наиб. тугоплавкий-W. Как правило, d-металлы отличаются высокой энтальпией возгонки, значит, электрич. проводимостью, уникальными магн. св-вами. Химия d-элементов во многом отличается от химии s- и p-элементов, что связано с большим числом степеней окисления d-элементов (напр., Ru проявляет все степени окисления от 0 до +8) и образованием координац. соединений. В отличие от s- и р-элементов, d-элементы имеют много общих черт.
Для каждой декады d-элементов наиб. устойчивы электронные конфигурации d 0 (Sc, Y, La), 5 >(Mn, Tc, Re) и d 10 (Zn, Cd, Hg). По этой причине являются стабильными, напр., Ti 4 + (d 0) , Fe 3+ (d 5 ) и Zn 2+ (d 10 ); напротив, Cr 2+ и Mn 3 + , имеющие конфигурацию d 4 , нестабильны. Особенности d-элементов большой набор их валентных состояний и, как правило, широкие пределы изменения окислит.-восстановит. и др. св-в. По многообразию валентных состояний d-элементы отличаются от всех других, в т. ч. и от f-элементов.
Большинство соед. d-элементов координационные, в частности карбонилы, "сэндвичевые". Для d-элементов характерно образование кластеров, а также нестехиометрич. соед. (оксиды, сульфиды и др.). Соед. d-элементов, как правило, окрашены. Окраска объясняется расщеплением уровней энергии d-электронов в поле лигандов; это делает возможным переход (при поглощении квантов света) d-электронов с низшего уровня на высший. Доля ковалентной связи в соед. d-элементов больше, чем в соед. s-металлов (но меньше, чем в соед. р-элементов), что сказывается на св-вах соединений П. э. они более легкоплавки, более летучи и более подвержены гидролизу, чем аналогичные соед. s-эле-ментов.
Mн. d-элементы в виде металлов имеют очень высокую каталитич. активность, особенно выделяются в этом отношении Pt и Pd; велика каталитич. активность и мн. соединений П. Э. С И. Дракин
Химическая энциклопедия. — М.: Советская энциклопедия . Под ред. И. Л. Кнунянца . 1988 .
Смотреть что такое "ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ" в других словарях:
ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ — ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ, химические элементы, расположенные в побочных подгруппах больших периодов периодической системы; металлы. Из 109 элементов 65 переходные. Переходные элементы, кроме железа, мало распространены в природе … Современная энциклопедия
Переходные элементы — ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ, химические элементы, расположенные в побочных подгруппах больших периодов периодической системы; металлы. Из 109 элементов 65 переходные. Переходные элементы, кроме железа, мало распространены в природе. … Иллюстрированный энциклопедический словарь
ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ — ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ, металлические элементы, имеющие незаполненные внутренние электронные оболочки. Переходные элементы характеризуются переменной ВАЛЕНТНОСТЬЮ и образованием окрашенных ионов. Сюда входят элементы с атомным номером от 21 до 112.… … Научно-технический энциклопедический словарь
ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ — хим. элементыпобочных подгрупп (b подгрупп) периодической системы элементов. К ним относятся d и f элементы, т. е. элементы, у к рыхпроисходит заполнение 3d ,4d , 5d оболочки (переходныеметаллы) или 4f и 5f оболочки (лантаноиды и актиноиды… … Физическая энциклопедия
переходные элементы — (переходные металлы), химические элементы подгрупп «б» периодической системы. Атомы переходных элементов имеют незавершённые внутренние электронные оболочки. Различают d элементы, у которых происходит заполнение внутренних 3d , 4d , 5d и 6d… … Энциклопедический словарь
ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ — В соответствии с периодической классификацией элементов существует 44 элемента, образующих подгруппы А. В каждой из этих подгрупп (или семейств) на внешней (валентной) электронной оболочке число электронов равно номеру группы. При переходе от… … Энциклопедия Кольера
переходные элементы — pereinamieji elementai statusas T sritis chemija apibrėžtis d ir f elementai. atitikmenys: angl. transition elements rus. переходные элементы … Chemijos terminų aiškinamasis žodynas
ПЕРЕХОДНЫЕ ЭЛЕМЕНТЫ — (переходные металлы), хим. элементы подгрупп б периодич. системы. Атомы П. э. имеют незавершённые внутр. электронные оболочки. Различают rf элементы, у к рых происходит заполнение внутр. 3d , 4d , 5d и 6d подоболочек, и f элементы, у к рых… … Естествознание. Энциклопедический словарь
Читайте также:
