К какому виду металлов относится платина
- Платина.
- Палладий.
- Родий.
- Рутений.
- Иридий.
- Осмий.
Главными особенностями металлов платиновой группы, являются:
- серебристо-серый оттенок, кроме осмия (бело-голубой);
- кристаллические свойства, способствующие ускорению химических процессов;
- катализаторы, контролирующие скорость окисления, реакции гидрирования;
- химически стойкие металлы по отношению к действию многих реагентов;
- обладают высокой электропроводностью;
- выдерживают высокие температуры;
- тугоплавкость.
Основными источниками платиновых металлов являются минералы редких элементов. Сегодня драгоценные платиновые металлы используют в ювелирном производстве, но в разной степени, а биологически активные соединения платиновых металлов в медицине.
Платина
Платина известна издревле, а название произошло с испанского языка: «маленькое серебро». Конкистадоры, это первые европейцы, которые познакомились с платиной в середине 16 века в Южной Америке. А в 1735 году король Испании издал указ, по которому следовало топить платину в реке и не ввозить в страну. Позже речку назвали Платино-дель-Пинто. Указ был отменен только через сорок лет, для фальсифицирования золотых и серебряных монет мадридскими властями. Позже с платиной познакомились алхимики, но посчитали ее непригодной. Но во Франции она все же нашла свое применение в виде эталона метра, а затем килограмма. В России металл назвали белым золотом, найдя его в россыпном золоте.
Платина, это один из редчайших металлов, ведь в земной коре ее содержания невелико. Главными месторождениями платины являются: Россия, США (2 крупных рудника: Stillwater, East Bouder), Китай, Зимбабве (9 тонн), ЮАР (Бушвельский комплекс).
В России данный металл МПГ обладает уникальной базой, с огромным количеством месторождений, основной из которых расположен в Зареченске (Мурманской области).
Добыча платины это трудоемкий процесс, двух видов:
- Открытый способ добычи: на вторичных россыпных месторождениях. Там платина концентрируется в результате разрушений первичной породы.
- Закрытый способ добычи: на первичных месторождениях, с постройкой шахт, просверливанием отверстий в породах, закладке взрывчатки и самого взрыва.
Платина это драгоценный металл, который используют в ювелирном деле и промышленности. Свойства платины широки:
- тяжелее, чем золото и серебро;
- не окисляется;
- не вступает в реакции с другими элементами при нагреве;
- пластичный металл;
- обладает хорошей электропроводностью;
- не растворяется под воздействием кислот;
- высокая температура плавления;
- хорошая ковкость.
Область применения платины достаточно широкое и не ограничивается ювелирным производством, ведь она обладает уникальной красотой и благородством. В настоящее время рост на металл растет, так как используют ее и в промышленности. Итак, применения платины:
- ювелирное производство, для изготовления разного вида украшений;
- медицина;
- химическая индустрия;
- судостроение;
- авиастроение;
- космическая сфера;
- стекольная отрасль;
- банковское дело.
Палладий
На сегодня, палладий самый дорогой металл платиновой группы, который используется в промышленности.
В конце 17 века бразильские горнодобывающие рабочие нашли сплав, похожий на содержание золота или платины. Химик У. Волластон проработал взаимодействие неочищенной платиной с соляной и азотной кислотами, и добавкой цианида ртути. После выпал желтый осадок, который он нагрел с серой и бурой. Получив шарики из металла и, назвав металл - палладий.
Название металл получил в честь астероида. Этот металл платиновой группы встречается в природе очень редко в чистом в виде. А чаще в комплексе с другими металлами (золото, серебро, платина).
Добывают металл также двумя способами:
- на коренных (первичных) месторождениях;
- на россыпи, в виде самородка и составляют всего 2% от всей добычи металла.
Главные месторождения палладия:
В России также происходит добыча палладия, сконцентрированная на Урале. Главными свойствами палладия являются:
- низкая плотность;
- химическая инертность;
- внешне напоминает серебро;
- высокая ковкость;
- эластичность, что позволяет использовать в изготовлении украшений;
- температура плавления 1555 градусов;
- поддается обработке;
- непрочный металл при механическом воздействии;
- растворяется при воздействии смеси серной и азотной кислот;
- может образовывать соединения с иными химическими элементами ( бор, хлор, сера, кремний);
- не вступает в реакции;
- не окисляется в природе.
Области применения палладия
- Ювелирная сфера, добавляя металл в сплавы;
- производство катализаторов для автомобилей, для дожигания выхлопных газов по нормам ЕС;
- медицина: изготовление элементов для кардиостимуляторов, инструментов, посуды;
- химическая отрасль: изготавливают колбы и емкости, а также для очищения водорода;
- электронная сфера: военно-аэрокосмическая техника;
- инвестиционная деятельность: покупка слитков.
Родий
Следом за открытием палладия, Волластон открыл еще один металл платиновой группы - родий, путем растворения неочищенной платины в царской водке (смесь соляной и азотной кислот) и нейтрализации избытка кислоты едким натром. Осадив платину хлористым аммонием, палладий - цианистой ртутью. Полученный фильтрат был обработан соляной кислотой (чтобы удалить избыток цианистой ртути) и выпарен до сухого состояния. А осадок, обработанный алкоголем, выглядел как темно-красный порошок двойной натриевородиевой соли соляной кислоты. А уже в свою очередь при прокаливании порошка в токе водорода, получил металл.
Родий получил свое название с греческого языка: роза. Добыча родия производится вместе с платиной/золотом. Основными источниками родия являются золотые месторождения Мексики, залежи родиевого Невьянскита.
Родий представляет собой металл серебристо-белого оттенка и относится к благородным металлам платиновой группы.
Свойства родия
- Растворяется в перекиси водорода, серной кислоте;
- растворяется при кипячении в смеси соляной и азотной кислот;
- высокая химическая устойчивость;
- взаимодействует с неметаллами лишь при температуре красного каления;
- окисление происходит при высокой температуре;
- стойкий металл к коррозийным средам.
Так как родий, это драгоценный и уникальный металл, то и область его применения различна:
- в качестве катализатора (каталитических фильтрах для нейтрализации выхлопных газов);
- является конструкционным материалом, для изготовления зеркал, стекол;
- при сплаве родия с платиной, получается эффективный катализатор при производстве азотной кислоты по средствам окисления аммиака воздухом;
- производство термопаров (при сплаве с иридием или платиной);
- придают износостойкость и устойчивость к коррозии ювелирным изделиям.
Рутений
Рутений был открыт в Казани в 1844 году К. Клаусом. Он анализировал заводские платиновые осадки из Петербургского монетного двора. Он извлек из руды платину и некоторые платиновые металлы, после чего сплавил остатки с селитрой, извлекая растворимую в воде часть. А нерастворимый в воде осадок, взаимодействовал с царской водкой и высушил. К. Клаус обработал сухой остаток после дистилляции кипящей водой, добавил избыток поташа. Отделив осадок гидроокиси железа, он обнаружил элемент неизвестного происхождения темно-пурпурного оттенка раствора осадка в соляной кислоте. Рутений был назван в честь России (Ruthenia - Россия).
Добыча рутения всегда сопровождает добычу платины на россыпных и коренных месторождениях. Присутствует в качестве примесей в составе никелевой руды, медной руды. Также существуют искусственные источники добычи рутения, т.е. отходы ядерной промышленности. Основное месторождение данного металла платиновой группы, это ЮАР, Канада, Россия, Зимбабве.
Основные характеристики рутения:
- серебристо-белый блестящий или матовый цвет;
- обладает твердостью;
- тугоплавок;
- при сильном прокаливании на воздухе переходит в газовую фазу;
- растворяется медленно соляной кислотой при обычной температуре, при высокой температуре - быстро;
- газопоглотительная способность.
Область применения металла
- Производство катализаторов;
- защитные покрытия;
- декоративные покрытия;
- в виде добавок к украшениям;
- добавка в элитные эмали и другое.
Иридий
В начале 19 века химики были заинтересованы неочищенной платиной и всеми возможными элементами содержащиеся в ней. Тогда Дескотиль, Фуркруа и Вокелен стали изучать сырой металл, сплавив его с едким кали, получив частично растворимые в воде соединения неизвестных металлов. Теннант пошел этим же способом, и смог выделит два новых металла: иридий и осмий.
Иридий получил свое название с греческого: радуга, благодаря тому, что соединения данного металла были окрашены в разные цвета. Осмий же в связи с растворение щелочного сплава осмиридия в кислоте (или в воде) сопровождался сильным запахом. С греческого языка, получив название: запах.
Иридий очень редкий металл платиновой группы, который добыть практически невозможно. Добыча его сопровождается попутчиками: платиной или осмием и рутением или палладием. Он встречается в медных и никелевых рудах. Место добывания иридия: Канада (Британская Колумбия), США (Калифорния), ЮАР (Трансвааль), Остров Тасмания, Новая Гвинея, остров Калимантан.
- красивый металл бело-серебристого оттенка;
- твердый и долговечный металл;
- высокая плотность и прочность;
- воздействия осуществляются за счет нагревания металла;
- укрепляет любой состав, делая его износоустойчивым;
- химическая стойкость;
- стойкий к коррозиям;
- стойкость к окислению и всяческому разрушению, даже под воздействием температуры.
- химическая промышленность;
- ювелирное дело;
- вместе с иными металлами является компонентом для автомобильных свечей;
- сплавы с иридием используют в медицине, для производства инструментов;
- в научной деятельности, металл не очень востребован.
Осмий
Чистого осмия в природе нет, он находится в комплексе с родием. Месторождения осмия сконцентрированы в: Африке (юг), Тасмании, Австралии, США, Канаде, Россие, Колумбия, ЮАР (самые большие запасы).
- серебристо-голубые кристаллы;
- резкий запах, при взаимодействии с веществами;
- не растворяется в щелочах и кислотах, смеси соляной и азотной кислот;
- химическая инертность;
- порошковый осмий - сырье для продукции, медленно подвержен к растворению;
- твердый и хрупкий;
- тугоплавкий;
- высокая плотность: самый тяжелый металл.
Область применения
- Медицина: кардиостимуляторы, импланты;
- промышленность: для измерительной техники, часовые механизмы;
- тетра оксид осмия используют в электронной микроскопии.
Металлы платиновой группы, редкие и уникальные металлы, которые не так часто встречаются в природе, но широко и активно применяются в разных сферах жизни, тем самым помогая человечеству.
ПЛАТИНА
Pt (platinum),
металлический химический элемент VIIIВ группы периодической системы элементов, наиболее распространенный член семейства платиновых металлов: Ru, Rh, Pd, Os, Ir, Pt. Хотя известны древние предметы искусства, сделанные из Pt, сам металл был обнаружен европейцами лишь в 1557 в Мексике поэтом и путешественником эпохи Возрождения Ю.Скалигером. В 1748 А.де Уллоа описал металл, о котором впервые письменно упомянул Ю.Скалигер. В чистом виде получена в 1803 У.Волластоном, который нашел способ приготовления тонкой платиновой проволоки и ковкой платины для изготовления посуды. Платина встречается в природе в самородном состоянии и в виде соединений. В природных отложениях она бывает в виде песчаноподобных частиц, смешанных с похожими частицами других металлов этой группы или с рудами Cu, Co, Ni и Au. В природе обнаружены и большие самородки платины. Наиболее важными рудами Pt являются сперрилит PtAs2 и куперит PtS. Мировым производителем платины считается Южно-Африканская республика, затем идут Канада и Россия. СВОЙСТВА ПЛАТИНЫ
Атомный номер 78 Атомная масса 195,08 Изотопы
Температура плавления, ° С 1769 Температура кипения, ° С 3827 Плотность, г/см3 21,45 Твердость (по Моосу) 4,3 Содержание в земной коре, % (масс.) 0,0000005 Степени окисления 0, +2, +4; реже +1, +3, +5, +6
Свойства. Платина - серебристый, сравнительно мягкий, плотный и ковкий металл с высокой прочностью на разрыв. Платина обладает относительно низкой электрической проводимостью и самым низким коэффициентом расширения из всех промышленных металлов. Она не тускнеет на воздухе, заметно испаряется при температуре красного каления. Галогены (и в том числе фтор) не взаимодействуют с Pt при обычной температуре, и это единственный металл, нерастворимый в любой из минеральных кислот. Но смесь концентрированных соляной и азотной кислот ("царская водка") и смесь соляной и хлорной кислот растворяют платину. При высокой температуре платина реагирует с расплавленными нитратами, с кислыми сульфатами, гидроксидами, пероксидами, сульфидами, I2, P, As, C, Si, Se и Te.
Основные соединения. При нагревании с царской водкой платина образует тетрахлороплатинат водорода H2PtCl4, а в избытке HCl - соответственно H2PtCl6 - гексахлороплатинат водорода. Гексахлороплатинат натрия Na2PtCl6 хорошо растворим в воде и даже в 75%-ном растворе спирта, чем отличается от соответствующих солей калия и аммония, и поэтому может быть отделен от них по обычной методике качественного анализа. При добавлении аммиака к солям платины получают комплексные соединения - аммины Pt(NH3)4Cl2 и Pt(NH3)6Cl4. Известны также флуоресцирующие двойные соли типа Pt(CN)2ЧBa(CN)2Ч4H2O. При нагревании H2PtCl4 с хлором образуется PtCl4, который при 370° С диссоциирует на PtCl2 + Cl2. Дихлорид PtCl2 в свою очередь разлагается при 200° С до губчатой платины. Такая платина при температуре красного каления способна адсорбировать большие объемы водорода, сохраняя адсорбционные свойства и при комнатной температуре. Платиновая чернь представляет собой более дисперсную форму платины.
См. также ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ.
Применение. Важнейшее применение платина находит как катализатор нейтрализации выхлопных газов и для увеличения октанового числа бензинов. Благодаря относительной инертности платина в свободном состоянии и в сплавах с Rh почти незаменима в компьютерной и электронной технике, магнитных контактах, свечах зажигания. Платина и ее сплавы играют важную роль в химической технологии, например в каталитическом производстве азотной кислоты из аммиака, в фильерах при изготовлении стекловолокна, в качестве электродов анодного окисления (перхлораты, пероксиды) или электроосаждения (Ni, Rh), для изготовления устойчивых к коррозии и термостойких деталей измерительной и регистрирующей аппаратуры. Платина широко используется в производстве ювелирных изделий, стоматологических сплавов, медицинского и хирургического инструмента.
ЛИТЕРАТУРА
Ливингстон С. Химия рутения, родия, палладия, осмия, иридия, платины. М., 1978 Платина, ее сплавы и композиционные материалы. М., 1980
Энциклопедия Кольера. — Открытое общество . 2000 .
Полезное
Смотреть что такое "ПЛАТИНА" в других словарях:
Платина — – химический элемент, драгоценный металл, являющийся биржевым товаром. Как правило, обозначается символом Pt, который происходит от испанского слова plata – «cеребро»; platina – уменьшительная форма, буквально «маленькое серебро» или «серебришко» … Банковская энциклопедия
ПЛАТИНА — (исп., от plata серебро). Самый тяжелый из благородных металлов; с виду похож на серебро, встречается в перуанских, бразильских и уральских россыпях. Словарь иностранных слов, вошедших в состав русского языка. Чудинов А.Н., 1910. ПЛАТИНА исп.… … Словарь иностранных слов русского языка
ПЛАТИНА — ПЛАТИНА, платины, мн. нет, жен. (исп. platina, уменьш. к plata серебро). Драгоценный нержавеющий металл белого цвета, ценимый дороже золота. Самородная платина. Чистая платина. Губчатая платина (см. губчатый). Толковый словарь Ушакова. Д.Н.… … Толковый словарь Ушакова
ПЛАТИНА — (Platinum), Pt, химический элемент VIII группы периодической системы, атомный номер 78, атомная масса 195,08; относится к платиновым металлам, tпл 1769 шC. Сплав платины и палладия катализатор дожигания выхлопных газов автомобилей, платина и ее… … Современная энциклопедия
ПЛАТИНА — (символ Pt), блестящий серебристо белый ПЕРЕХОДНЫЙ ЭЛЕМЕНТ, металл, открытый в 1735 г. Встречается, главным образом, в некоторых никелевых рудах. Будучи ковким и легко поддающимся обработке металлом, платина используется в ювелирном деле, в… … Научно-технический энциклопедический словарь
ПЛАТИНА — ПЛАТИНА, платина жен. белое золото, самородный (не рудный), ценный металл, тяжелее золота, весьма твердый и огнестойкий. Платинный и платиновый, из нее сделанный, к ней относящийся. Платинистый осмий, иридий, содержащий в себе платину. Платинка… … Толковый словарь Даля
ПЛАТИНА — (лат. Platinum) Pt, химический элемент VIII группы периодической системы, атомный номер 78, атомная масса 195,08, относится к платиновым металлам. Название от исп. platina (уменьшительное от plata серебро). Плотность 21,45 г/см³, tпл 1769 .С … Большой Энциклопедический словарь
Платина — Pt (исп. platina, уменьшит. от plata серебро * а. platinum; н. Platin; ф. platine; и. platino), хим. элемент VIII группы периодич. системы Mенделеева, ат. н. 78, ат. м. 195,09. П. первый в группе платиновых металлов. B природе 5… … Геологическая энциклопедия
Платина — металл имеет бело серую окраску, схожую по цвету со сталью, практически не растворим в воде, в кислотах, за исключением горячей царской водки, при взаимодействии с которой образуется платинохлористоводородная кислота. Плотность платины 21.45;… … Официальная терминология
ПЛАТИНА — ПЛАТИНА, ы, жен. Драгоценный тугоплавкий блестящий металл серовато белого цвета. | прил. платиновый, ая, ое. Платиновая брошь. Платиновая руда. Металлы платиновой группы. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
ПЛАТИНА — (Platinum), Pt, хим. элементVIII группы периодич. системы элементов Менделеева, ат. номер 78, ат. масса195,08, входит в платиновую группу благородных металлов. ПрироднаяП. смесь 6 изотопов: 190Pt, 192Pt,194Pt 196Pt и 198Pt, преобладают 195Pt… … Физическая энциклопедия
ПЛА́ТИНА -ы; ж. [исп. platina] Химический элемент (Pt), благородный металл серебристо-белого цвета, обладающий красивым внешним видом, химической стойкостью и тугоплавкостью (применяется в электро- и радиотехнике, ювелирном деле, как химический катализатор). Самородная п. Кольцо из платины. Сплавы с платиной. П. подорожала.
(лат. Platinum), химический элемент VIII группы периодической системы, относится к платиновым металлам. Название от испанского platina (уменьшит. от plata — серебро). Плотность 21,45 г/см 3 , tпл 1769°C. Идёт на изготовление катализаторов (около 50%; частично в виде сплавов с Rh, Pd, Ir), химической аппаратуры; используется в электро- и радиотехнике, ювелирном деле и т. д.Энциклопедический словарь . 2009 .

Тяжёлый, мягкий серебристо-белый металл
Платина / Platinum (Pt), 78
[Xe] 4f 14 5d 9 6s 1
2,28 (шкала Полинга)
Пла́тина (исп. Platina ) — элемент 10 группы (по устаревшей классификации — побочной подгруппы восьмой группы), 6 периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 78; благородный металл серо-стального цвета.
Содержание
История
В Старом Свете платина не была известна до XVIII века, однако цивилизации Анд (инки и чибча) добывали и использовали её с незапамятных времён. Первыми европейцами, познакомившимися с платиной, были конкистадоры в середине XVI века.
В 1735 году испанский король издаёт указ, повелевающий платину впредь в Испанию не ввозить. При разработке россыпей в Колумбии повелевалось тщательно отделять её от золота и топить под надзором королевских чиновников в глубоких местах речки Рио-дель-Пинто (приток Рио-Сан-Хуан (англ.) русск. ), которую стали именовать Платино-дель-Пинто. А ту платину, которая уже привезена в Испанию, повелевалось всенародно и торжественно утопить в море. Дело в том, что платина легко сплавляется с золотом и по плотности от него почти не отличается, чем не преминули воспользоваться фальшивомонетчики.
В 1748 году испанский математик и мореплаватель А. де Ульоа первым привез на европейский континент образцы самородной платины, найденной в Перу. Впервые в чистом виде из руд платина была получена английским химиком У. Волластоном в 1803 году. Итальянский химик Джилиус Скалигер в 1835 году открыл неразложимость платины и таким образом доказал, что она является независимым химическим элементом.
В России ещё в 1819 году в россыпном золоте, добытом на Урале, был обнаружен «новый сибирский металл», который сначала называли белым золотом. Платина встречалась на Верх-Исетских, а затем и на Невьянских и Билимбаевских приисках. Богатые россыпи платины были открыты во второй половине 1824 года, а на следующий год в России началась её добыча [2] .
Происхождение названия
Название платине было дано испанскими конкистадорами, которые в середине XVI в. впервые познакомились в Южной Америке (на территории современной Колумбии) с новым металлом, внешне похожим на серебро (исп. plata ). Слово буквально означает «маленькое серебро», «серебришко». Объясняется такое пренебрежительное название исключительной тугоплавкостью платины, которая не поддавалась переплавке, долгое время не находила применения и ценилась вдвое ниже, чем серебро.
Нахождение в природе
Месторождения
Основная часть месторождений платины (более 90 %) заключена в недрах пяти стран. К этим странам относится ЮАР, США, Россия, Зимбабве, Китай [3] .
В России основными месторождениями металлов платиновой группы являются: Октябрьское, Талнахское и Норильск-1 сульфидно-медно-никелевые в Красноярском крае в районе Норильска (более 99 % разведанных и более 94 % оцененных российских запасов), Фёдорова Тундра (участок Большой Ихтегипахк) сульфидно-медно-никелевое в Мурманская области, а также россыпные Кондёр в Хабаровском крае, Левтыринываям в Камчатском крае, реки Лобва и Выйско-Исовское в Свердловской области [4] .
Получение
Самородную платину добывают на приисках (см. подробнее в статье Благородные металлы), менее богаты рассыпные месторождения платины, которые разведываются, в основном, способом шлихового опробования.
Производство платины в виде порошка началось в 1805 английским ученым У. Х. Волластоном из южноамериканской руды. Сегодня платину получают из концентрата платиновых металлов. Концентрат растворяют в царской водке, после чего добавляют этанол и сахарный сироп для удаления избытка HNO3. При этом иридий и палладий восстанавливаются до Ir 3+ и Pd 2+ . Последующим добавлением хлорида аммония выделяют (NH4)2PtCl6. Высушенный осадок прокаливают при 800—1000 °C: 3(NH4)2[PtCl6] = 2N2 + 2NH3 + 18HCl + 3Pt. Получаемую таким образом губчатую платину подвергают дальнейшей очистке повторным растворением в царской водке, осаждением (NH4)2PtCl6 и прокаливанием остатка. Затем очищенную губчатую платину переплавляют в слитки. При восстановлении платиновых растворов химическим или электрохимическим способом получают мелкодисперсную платину — платиновую чернь.
Физические свойства
Серовато-белый пластичный металл, температуры плавления и кипения — 1769 °C и 3800 °C , удельное электрическое сопротивление — 0,098 мкОм·м (при 0°С). Платина — один из самых тяжелых (плотность 21,5 г/см³ ; атомная плотность 6,62·10 22 ат/см³ ) и самых редких металлов: среднее содержание в земной коре (кларк) 5·10 −7 % по массе. Твёрдость по Бринеллю 50 кгс/мм (по Моосу 3,5 [5] ).
Химические свойства

По химическим свойствам платина похожа на палладий, но проявляет большую химическую устойчивость. Реагирует только с горячей царской водкой:
Платина медленно растворяется в горячей серной кислоте и жидком броме. Она не взаимодействует с другими минеральными и органическими кислотами. При нагревании реагирует со щелочами и пероксидом натрия, галогенами (особенно в присутствии галогенидов щелочных металлов):
При нагревании платина реагирует с серой, селеном, теллуром, углеродом и кремнием. Как и палладий, платина может растворять молекулярный водород, но объём поглощаемого водорода меньше и способность его отдавать при нагревании у платины меньше.
При нагревании платина реагирует с кислородом с образованием летучих оксидов. Выделены следующие оксиды платины: чёрный PtO, коричневый PtO2, красновато-коричневый PtO3, а также Pt2O3 и Pt3O4.
Для платины известны гидроксиды Pt(OH)2 и Pt(OH)4. Получают их при щелочном гидролизе соответствующих хлорплатинатов, например:
Эти гидроксиды проявляют амфотерные свойства:
Гексафторид платины PtF6 является одним из сильнейших окислителей среди всех известных химических соединений, способный окислить молекулы кислорода, ксенона или NO:
С помощью него, в частности, канадский химик Нейл Бартлетт в 1962 году получил первое настоящее химическое соединение ксенона XePtF6.
C обнаруженного Н. Бартлеттом взаимодействия между Хе и PtF6, приводящего к образованию XePtF6, началась химия инертных газов. PtF6 получают фторированием платины при 1000 °C под давлением.
Фторирование платины при нормальным давлении и температуре 350—400 °C даёт фторид Pt(IV):
Фториды платины гигроскопичны и разлагаются водой.
Тетрахлорид платины (IV) с водой образует гидраты PtCl4·nH2O, где n = 1, 4, 5 и 7. Растворением PtCl4 в соляной кислоте получают платинохлористоводородные кислоты H[PtCl5] и H2[PtCl6]. Синтезированы такие галогениды платины как PtBr4, PtCl2, PtCl2·2PtCl3, PtBr2 и PtI2.
Для платины характерно образование комплексных соединений состава [PtX4] 2- и [PtX6] 2- . Изучая комплексы платины, А. Вернер сформулировал теорию комплексных соединений и объяснил природу возникновения изомеров в комплексных соединениях.
Реакционная способность
Платина является одним из самых инертных металлов. Она нерастворима в кислотах и щелочах, за исключением царской водки. Платина также непосредственно реагирует с бромом, растворяясь в нём.
При нагревании платина становится более реакционноспособной. Она реагирует с пероксидами, а при контакте с кислородом воздуха — с щелочами. Тонкая платиновая проволока горит во фторе с выделением большого количества тепла. Реакции с другими неметаллами (хлором, серой, фосфором) происходят менее охотно. При более сильном нагревании платина реагирует с углеродом и кремнием, образуя твёрдые растворы, аналогично металлам группы железа.
В своих соединениях платина проявляет почти все степени окисления от 0 до +6, из которых наиболее устойчивы +2 и +4. Для платины характерно образование многочисленных комплексных соединений, которых известно много сотен. Многие из них носят имена изучавших их химиков (соли Косса, Магнуса, Пейроне, Цейзе, Чугаева и т. д.). Большой вклад в изучение таких соединений внес русский химик Л. А. Чугаев (1873−1922), первый директор созданного в 1918 году Института по изучению платины.
Катализатор
Платина, особенно в мелкодисперсном состоянии, является очень активным катализатором многих химических реакций, в том числе используемых в промышленных масштабах. Например, платина катализирует реакцию присоединения водорода к ароматическим соединениям даже при комнатной температуре и атмосферном давлении водорода. Ещё в 1821 немецкий химик И. В. Дёберейнер обнаружил, что платиновая чернь способствует протеканию ряда химических реакций; при этом сама платина не претерпевала изменений. Так, платиновая чернь окисляла пары винного спирта до уксусной кислоты уже при обычной температуре. Через два года Дёберейнер открыл способность губчатой платины при комнатной температуре воспламенять водород. Если смесь водорода и кислорода (гремучий газ) ввести в соприкосновение с платиновой чернью или с губчатой платиной, то сначала идет сравнительно спокойная реакция горения. Но так как эта реакция сопровождается выделением большого количества теплоты, платиновая губка раскаляется, и гремучий газ взрывается. На основании своего открытия Дёберейнер сконструировал «водородное огниво» — прибор, широко применявшийся для получения огня до изобретения спичек.
Добыча и производство
До 1748 г. платина добывалась и производилась только на территории Америки, а в Старом Свете не была известна.
Когда платину стали завозить в Европу, её цена была вдвое ниже серебра. Ювелиры очень быстро обнаружили, что платина хорошо сплавляется с золотом, а так как плотность платины выше чем у золота, то незначительные добавки серебра позволили изготавливать подделки, которые невозможно было отличить от золотых изделий. Такого рода подделки получили столь широкое распространение, что испанский король приказал прекратить ввоз платины, а оставшиеся запасы утопить в море. Этот закон просуществовал до 1778 года. После отмены закона потребность в платине была небольшой, её использовали в основном для создания химического оборудования, приспособлений и в качестве катализаторов. Добываемой в Америке платины для этих целей было достаточно. Ни о каком значимом промышленном производстве говорить не приходилось.
В 1819 году платину впервые обнаружили на Урале близ Екатеринбурга, а в 1824 г. были открыты платиновые россыпи в Нижнетагильском округе. Разведанные запасы платины были столь велики, что Россия почти сразу заняла первое место в мире по добыче этого металла. Только в 1828 году в России было добыто 1,5 т платины — больше, чем за 100 лет в Южной Америке. На Урале появились целые платинодобывающие районы, из которых наиболее важными в промышленном отношении стали Исовской и Тагильский [6] .
К концу XIX века в Российской империи добывалось платины в 40 раз больше чем во всех остальных странах мира. Причём представлена она была и весьма увесистыми самородками. Например, у одного из найденных на Урале самородков масса составляла 9,639 кг, впоследствии он был переплавлен [7] .
К середине XIX в. в Англии и Франции были проведены обширные исследования по аффинажу платины. В 1859 году французский химик Анри Этьен Сент-Клер Девиль впервые разработал промышленный способ получения слитков чистой платины. С этого времени почти вся добываемая на Урале платина скупалась английскими и французскими фирмами, в частности, «Джонсон, Маттей и К°». Позже к закупкам платины у Российской империи подключились американские и немецкие компании.
Даже после значительных зарубежных закупок, большая часть добываемой Россией платины не находила достойного применения. Поэтому, начиная с 1828 года, по предложению министра финансов Егора Канкрина, в Российской империи начали выпускать платиновые монеты номиналом 3, 6 и 12 рублей [8] . При этом, 12-рублёвая платиновая монета имела массу 41,41 г, а в рублёвой серебряной монете было 18 г чистого серебра. То есть по стоимости металла платиновые монеты были дороже серебряных в 5,2 раза. С 1828 по 1845 гг. было выпущено 1 372 000 трёхрублёвых монет, 17 582 шестирублёвых и 3 303 двенадцатирублёвых общей массой 14,7 т. Основную выгоду от добычи получали владельцы рудников — Демидовы. Только в 1840 было добыто 3,4 т платины. В 1845 году, по настоянию министра финансов Фёдора Вронченко выпуск платиновых монет был прекращён, и все они были срочно изъяты из обращения. Основной версией столь поспешного шага считается повышение европейских цен на платину, в результате которого монеты стали стоить дороже номинала. После прекращения чеканки монет производство платины в Российской империи упало в 20 раз, и к 1915 году на долю России приходилось 95 % от мирового производства платины. Оставшиеся 5 % производила Колумбия. Причём почти вся российская платина поступала на экспорт. Например, в 1867 году Англия скупила весь запас российской платины — более 16 т.
К концу XIX в. Российская империя производила 4,5 тонны платины в год.
До Первой мировой войны второй после Российской империи страной по объёмам добычи платины была Колумбия; с 1930-х гг. стала Канада, а после Второй мировой войны — Южная Африка.
В 1952 году Колумбия добыла 0,75 т платины, США — 0,88 т, в Канада — 3,75 т, а Южно-Африканский Союз — 7,2 т. В СССР данные по добыче платины были засекречены.
В 2007 году в мире было добыто 213 т платины, а в 2008 году — 200 т. Лидерами добычи были:
Лидером добычи платины в России является ГМК «Норильский никель».
Кроме того, на территории Хабаровского края располагается прииск Кондёр, который является крупнейшим в мире россыпным месторождением платины [10] ; его разработку ведёт Артель старателей «Амур» (входит в Группу компаний «Русская платина»), по итогам 2011 года на прииске добыто около 3,7 тонны платины [11] .
Разведанные мировые запасы металлов платиновой группы составляют около 80 000 т и распределены, в основном, между ЮАР (87,5 %), Россией (8,3 %) и США (2,5 %).
Применение
В технике
- С первой четверти XIX века применялась в России в качестве легирующей добавки для производства высокопрочных сталей [12]
- Платина применяется как катализатор (чаще всего в сплаве с родием, а также в виде платиновой черни — тонкого порошка платины, получаемой восстановлением её соединений).
- Платина применяется в ювелирном и зубоврачебном деле, а также в медицине.
- Изготовление стойкой химически и к нагреванию лабораторной посуды.
- Изготовление миниатюрных магнитов огромной силы (сплав платина-кобальт, ПлК-78).
- Специальные зеркала для лазерной техники.
- Чрезвычайно долговечные и стабильные электроконтакты и сплавы для радиотехники (ПлИ-10, ПлИ-20, ПлИ-30 (платина-иридий).
- Гальванические покрытия.
- Перегонные реторты для производства плавиковой кислоты.
- Электроды для получения перхлоратов, перборатов, перкарбонатов, пероксодвусерной кислоты (фактически на платине держится все мировое производство перекиси водорода: электролиз серной кислоты — пероксодвусерная кислота — гидролиз — отгонка перекиси водорода).
- Нерастворимые аноды в гальванотехнике.
- Анодные штанги для защиты от коррозии корпусов подводных лодок.
- Нагревательные элементы печей сопротивления.
- Изготовление термометров сопротивления.
- Покрытия для элементов СВЧ-техники (волноводы, аттенюаторы, элементы резонаторов).
В медицине
Соединения платины (преимущественно, тетрахлорплатинаты) применяются, как цитостатики («цис-платина»). Однако в настоящее время имеются более эффективные противораковые лекарственные средства.
В ювелирном деле
Платина и её сплавы широко используются для производства ювелирных изделий.
Ежегодно мировая ювелирная промышленность потребляет около 50 тонн платины. До 2001 года большая часть ювелирных изделий из платины потреблялась в Японии. С 2001 года на долю Китая приходится примерно 50 % мировых продаж. В 1980 г. Китай потреблял около 1 % ювелирных изделий из платины. В настоящее время в Китае ежегодно продаётся около 10 млн изделий из платины общей массой около 25 тонн.
Российский спрос на ювелирную платину составляет 0,1 % от мирового уровня.
Монетарная функция

Платина, золото и серебро — основные металлы, выполняющие монетарную функцию. Однако платину стали использовать для изготовления монет на несколько тысячелетий позже золота и серебра.
Первые в мире платиновые монеты были выпущены и находились в обращении в Российской империи с 1828 по 1845 год. Чеканка началась с трехрублевиков. В 1829 г. «были учреждены платиновые дуплоны» (шестирублевики), а в 1830 г.— «квадрупли» (двенадцатирублевики). Были отчеканены следующие номиналы монет: достоинством 3, 6 и 12 рублей. Трехрублевиков было отчеканено 1 371 691 шт., шестирублевиков — 14 847 шт. и двенадцатирублевиков — 3474 шт [2] .
В 1846 г. чеканка платиновой монеты была прекращена, хотя к этому году добыча уральской платины составила около 2000 пудов или 32 000 кг, из которых в монету было перечеканено 14 669 кг. Громадное количество платины, скопившееся на Петербургском монетном дворе частью в виде монеты, а частью в необработанном виде (по разным данным от 720 до 2000 пудов), было продано английской фирме Джонсон, Маттэ и Ко. В результате Англия, которая не добывала ни одного грамма платины, долго была в этой отрасли монополистом [13] .
После 1846 года ни одна страна не позволяла себе «роскоши» вводить в обращение платиновые монеты. Выпускаемые разными странами в настоящее время платиновые монеты являются инвестиционными монетами. В период с 1992 по 1995 год инвестиционные платиновые монеты номиналами 25, 50 и 150 рублей выпускал Банк России.
Биологическая роль
Согласно замыслу одного из участников Википедии, на этом месте должен располагаться специальный раздел.
Вы можете помочь проекту, написав этот раздел.

Платина — минерал, природная Pt из группы платины класса самородых элементов, Обычно содержит Pd, Ir, Fe, Ni. Чистая платина встречается весьма редко, большинство образцов представлены железистой разновидностью (поликсеном), а нередко и интерметаллидами: изоферроплатиной (Pt,Fe)3Fe и тетраферроплатиной (Pt,Fe)Fе. Платина, представленная поликсеном, является наиболее распространённым в земной коре из минералов платиновой подгруппы.
Смотрите так же:
СТРУКТУРА
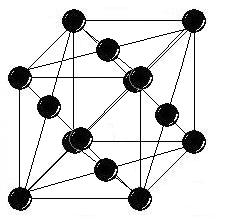
Кристаллическая решетка платины принадлежит к кубической системе. Молекула циклогексена имеет форму правильного шестиугольника. В рассматриваемой реакционной системе атомная структура катализатора и реагирующие молекулы обладают одним общим качеством – элементами симметрии третьего порядка. В кристалле платины такой порядок расположения атомов присущ только октаэдрической грани. В узлах расположены атомы платины. а = 0,392 нм, Z = 4, пространственная группа Fm3m
СВОЙСТВА

Цвет поликсена от серебряно-белого до стально-черного. Черта металлическая стально-серая. Блеск типичный металлический. Отражательная способность в полированных шлифах высокая – 65-70.
Твердость 4-4,5, у богатых иридием разностей – до 6-7. Обладает ковкостью. Излом крючковатый. Спайность обычно отсутствует. Уд. вес-15-19. Подмечена связь пониженного удельного веса с наличием пустот, занятых природными газами, а также включениями посторонних минералов. Обладает магнитностью, парамагнетик. Хорошо проводит электричество. Платина является одним из самых инертных металлов. Она нерастворима в кислотах и щелочах, за исключением царской водки. Платина также непосредственно реагирует с бромом, растворяясь в нём.
При нагревании платина становится более реакционноспособной. Она реагирует с пероксидами, а при контакте с кислородом воздуха — с щелочами. Тонкая платиновая проволока горит во фторе с выделением большого количества тепла. Реакции с другими неметаллами (хлором, серой, фосфором) происходят менее активно. При более сильном нагревании платина реагирует с углеродом и кремнием, образуя твёрдые растворы, аналогично металлам группы железа.
ЗАПАСЫ И ДОБЫЧА

Платина является одним из самых редких металлов: её среднее содержание в земной коре (кларк) составляет 5·10 −7 % по массе. Даже так называемая самородная платина является сплавом, содержащим от 75 до 92 процентов платины, до 20 процентов железа, а также иридий, палладий, родий, осмий, реже медь и никель.
Разведанные мировые запасы металлов платиновой группы составляют около 80 000 т и распределены, в основном, между ЮАР (87,5%), Россией (8,3%) и США (2,5%).
В России основными месторождениями металлов платиновой группы являются: Октябрьское, Талнахское и Норильск-1 сульфидно-медно-никелевые в Красноярском крае в районе Норильска (более 99% разведанных и более 94% оцененных российских запасов), Фёдорова Тундра (участок Большой Ихтегипахк) сульфидно-медно-никелевое в Мурманской области, а также россыпные Кондёр в Хабаровском крае, Левтыринываям в Камчатском крае, реки Лобва и Выйско-Исовское в Свердловской области. Крупнейшим платиновым самородком, найденным в России, является «Уральский гигант» массой 7860,5г, обнаруженный в 1904г. на Исовском прииске.
Самородную платину добывают на приисках, менее богаты рассыпные месторождения платины, которые разведываются, в основном, способом шлихового опробования.
Производство платины в виде порошка началось в 1805 году английским ученым У. Х. Волластоном из южноамериканской руды.
Сегодня платину получают из концентрата платиновых металлов. Концентрат растворяют в царской водке, после чего добавляют этанол и сахарный сироп для удаления избытка HNO3. При этом иридий и палладий восстанавливаются до Ir 3+ и Pd 2+ . Последующим добавлением хлорида аммония выделяют гексахлороплатинат(IV) аммония (NH4)2PtCl6. Высушенный осадок прокаливают при 800—1000 °C
Получаемую таким образом губчатую платину подвергают дальнейшей очистке повторным растворением в царской водке, осаждением (NH4)2PtCl6 и прокаливанием остатка. Затем очищенную губчатую платину переплавляют в слитки. При восстановлении растворов солей платины химическим или электрохимическим способом получают мелкодисперсную платину — платиновую чернь.
ПРОИСХОЖДЕНИЕ

Минералы платиновой группы в большинстве случаев встречаются в типичных магматических месторождениях, генетически связаннных с ультраосновными изверженными породами. Эти минералы в рудных телах выделяются в числе последних (после силикатов и окислов) в моменты, отвечающие гидротермальной стадии магматического процесса. Минералы платины, бедные палладием (поликсен, иридистая платина и др.), встречаются в месторождениях среди дунитов – оливиновых бесполевошпатовых пород, богатых магнезией и бедных кремнезёмом. При этом парагенетически они чрезвычайно тесно связаны с хромшпинелидами. Палладистая в никеле-палладистая платина преимущественно распространена в основных изверженных горных породах (норитах, габбро-норитах) и ассоциирует обычно с сульфидами: пирротином, халькопиритом и пентландитом.
В экзогенных условиях в процессе разрушения коренных месторождений и пород образуются платиноносные россыпи. Большинство минералов подгруппы платины в этих условиях химически устойчивы. Платина в россыпях встречается в виде самородков, чешуек, пластин, лепёшек, конкреций, а также скелетных форм и губчатых выделений размером от 0,05 до 5 мм., иногда до 12 мм. Уплощенные и пластинчатые зёрна платины указывают на значительное удаление от коренных источников и переотложение. Дальность переноса платины в россыпях обычно не превышает 8 км., в косовых россыпях она больше. Палладистая и медистая разновидности платины в зоне гипергенеза могут “облагораживаться”, теряя Pd, Cu, Ni. Содержание Cu и Ni, по А.Г. Бетехтину, в платине из россыпей может сокращаться более чем в 2 раза по сравнению с платиной коренного источника. В россыпях многих районов мира описаны новообразованная химически чистая платина и паладистая платина в виде натёчных форм радиально-лучистого строения.

Соединения платины (преимущественно, амминоплатинаты) применяются как цитостатики при терапии различных форм рака. Первым в клиническую практику был введен цисплатин (цис-дихлородиамминплатина(II)), однако в настоящее время применяются более эффективные карбоксилатные комплексы диамминплатины — карбоплатин и оксалиплатин.
Первые в мире платиновые монеты были выпущены и находились в обращении в Российской империи с 1828 по 1845 год. Чеканка началась с трехрублевиков. В 1829 г. «были учреждены платиновые дуплоны» (шестирублевики), а в 1830 г.— «квадрупли» (двенадцатирублевики). Были отчеканены следующие номиналы монет: достоинством 3, 6 и 12 рублей. Трехрублевиков было отчеканено 1 371 691 шт., шестирублевиков — 14 847 шт. и двенадцатирублевиков — 3474 шт.
Платина применялась при изготовлении знаков отличия за выдающиеся заслуги: из платины сделано изображение В. И. Ленина на советском ордене Ленина; из неё изготавливались советские орден «Победа», орден Суворова 1-й степени и орден Ушакова 1-й степени.
Читайте также:


