Ионы металлов могут иметь заряд
До появления знания об электроне, в науке главенствовала теория о валентности как о скрепляющей атомы внутри вещества силе.
Ее предвестником стала научная работа Уильяма Хиггинса, ирландского химика конца XVIII века, который описал существование неких связей между частицами веществ.
В начале прошлого века, когда появилась модель атомного ядра и выяснилось, что оно состоит из частиц трех видов: электронов, протонов и нейтронов — теория о валентности сменилась теорией о химических связях.
Феномен химических связей объясняется стремлением всего к упорядочиванию. Частицы веществ стремятся к наиболее стабильным и устойчивым формам с минимальным расходом энергии, благодаря чему появляется множество соединений.
Современная химия различает до шести видов связей, но чаще всего рассматривает только первые четыре из них:
- металлическая;
- ковалентная;
- ионная;
- водородная;
- ван-дер-ваальсова;
- двухэлектронная трехцентровая химическая.
От типа химической связи зависят ее свойства, а также строение химических решеток, структура и способы взаимодействия атомов и частиц.
Самой распространенной химической связью является ковалентная полярная, а остальные чаще всего являются либо крайними ее формами, либо вариациями с металлическими и нехарактерными неметаллическими химическими элементами в соединениях.
Ионная химическая связь
Ионная связь получила свое название от «иона» — частицы, вступающей в связь в соединении.
Ионная химическая связь — особый вид химической связи между частицами, основное действие которого направленно на заряженные частицы — ионы.
Ионная связь является крайней формой ковалентной полярной связи. При образовании, происходит поляризация атомов, в следствии чего образуются ионы.
Ионы — одноатомные или многоатомные частицы, имеющие ярко выраженный электрический заряд. Делятся на катионы — положительно заряженные атомы, и анионы — отрицательно заряженные.
Ионы могут иметь разный заряд и классифицируются по значению заряда на:
- однозарядную ( K + );
- двузарядную ( O 2 + );
- трехзарядную ( A l 3 + ) группы.
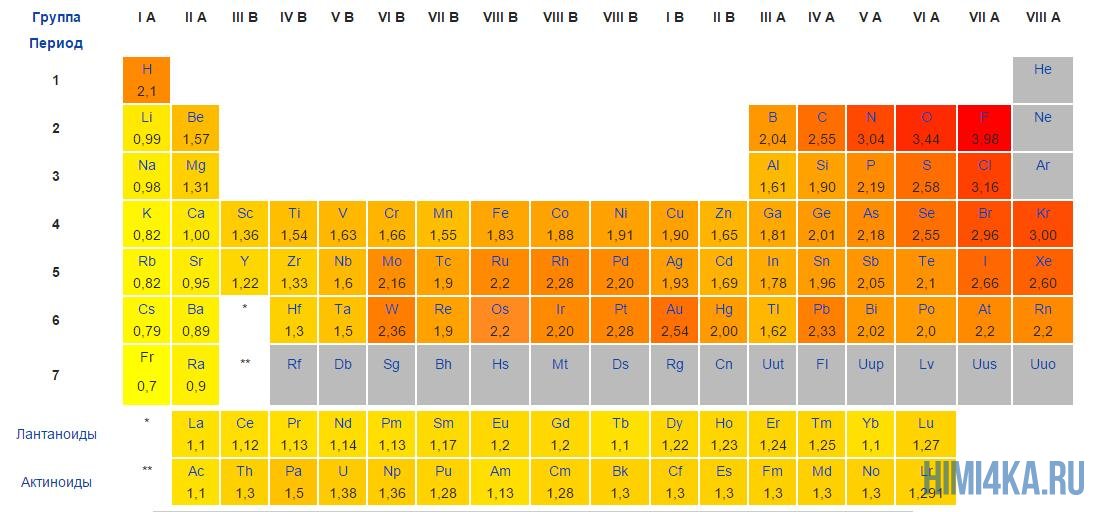
Частицы, вступающие в ионную связь, должны иметь большую разницу в 2 определение — электроотрицательности — способности притягивать электронные пары к себе. По Полингу для образования ионной связи необходима разница в 1,7 и более.
При таком виде химической связи происходит почти полный переход одного электрона к другому атому. Частицы с меньшей ЭО практически полностью переходят во владения частицы с большей ЭО, однако полного перехода никогда не случается.
Отчуждение электронов называется окислением, а присоединение — восстановлением.
Полного разделения на + и – заряженные частицы нет, так как частицы пересекаются своим электронными орбиталями и связываются очень прочной связью, а также имеют сильное электростатическое взаимодействие между частицами.
Ионная связь характерна для соединений металлов и неметаллов, реже для соединений неметаллов с неметаллами, присутствует в оксидах, гидроксидах, гидридах щелочных и щелочноземельных металлов, в солях, соединениях металлов с галогенами.
Ионная связь характеризуется двумя главными чертами:
Вещества с ионной химической связью имеют ряд особенностей:
- низкая летучесть;
- высокая температура плавления;
- низкая электростатическая проводимость из-за специфического строения кристаллической решетки;
- твердость, но при этом хрупкость веществ;
- заметная растворимость соединений в полярных растворителях.
Металлическая связь
Атомы металлов имеют возможность соединяться не только с неметаллами, но и между собой. В таком случае происходит формирование металлической связи.
Металлическая химическая связь — особый вид химической связи, образующийся между атомами металлов за счет обобществления их крайних электронных оболочек и валентных электронов.
В металлическую связь вступают частицы двух видов:
- ионизированных атомов металлов, которые в процессе формирования отдают электроны, а значит получают положительный заряд;
- свободных электронов, называемых «электронным газом», имеющих отрицательный заряд по своей природе происхождения.
Металлическая связь образуется только в веществах, а не между отдельными атомами. При этом связи внутри вещества связи не перманенты и не отличаются постоянством.
Кристаллическая решетка в веществах с металлической связью образуется в виде некого каркаса, в узлах которого находятся ионы металлов, а между ними в свободной форме путешествует «электронный газ», состоящий из свободных электронов.
Форма кристаллической решетки отличается в зависимости от группы, к которой относится металл:
- щелочные металлы (литий Li, калий K, рубидий Rb и другие) имеют объемно-центрированную кубическую кристаллическую решетку;
- переходные элементы (алюминий Al, медь Cu, цинк Zn и другие) имеют гранецентрированную кубическую форму решетки;
- щелоноземельные металлы (бериллий Be, кальций Ca, радий Ra, кроме бария) имеют гексагональную решетку;
- индий In имеет тетрагональную решетку;
- ртуть Hg имеет ромбоэдричсекую решетку.
Соединения, обладающие металлической связью, представляют собой либо чистые соединения металлов, либо их сплавы, которые образуют новые вещества, например, бронзу, сталь, чугун, латунь и другие.
Все металлы и их сплавы имеют сходные физические свойства:
- металлический блеск;
- теплопроводность материала;
- высокая ковкость, пластичность материала;
- хорошая электропроводность;
- твердое агрегатное состояние в нормальных условиях среды;
- высокая плотность материала.
Чем отличаются друг от друга и от ковалентной, что общего
Основные виды химической связи имеют довольно сходный принцип строения по природе происхождения. Они переплетаются между собой и имеют общие признаки. Более того, внутри одной молекулы нередко бывают сразу несколько видов химических связей.
Металлическая и ионная связь сходны между собой, а также сходны с ковалентной связью.
Металлическая и ковалентная связи сходны тем, что электроны, вступающие в связь обоих видах, становятся общими и принадлежат всем атомам либо в виде электронных пар, либо в виде электронного газа.
Ионная и ковалентная связи имеют сходство принципом строения. По сути происхождения, ионная связь является крайней формой ковалентной полярной связи. Полностью ионной связи в природе не существует — на какой-то процент она всегда остается ковалентной.
Металлическая связь сходна с ионной тем, что атомы металлов в соединениях легко отдают свои валентные электроны, которые слабо связаны со своими атомными ядрами. Отрыв электронов от ядра приводит к формированию ионизированных катионов металлов.
Однако отличия между связями все же есть. Именно по ним можно определить тип химической связи в соединении.
Металлическая от ковалентной связи отличается, в первую очередь, тем, что происходит между двумя атомами металлов, а не неметаллов. Благодаря этому она имеет высокую концентрацию электронов проводимости в своих атомах. Она менее прочна, чем ковалентная, а ее энергия связей меньше в 3-4 раза.
В отличие от ковалентной связи металлическая:
- ненасыщаема — объединяет большое количество атомов;
- ненаправлена — из-за сферической формы орбиталей;
- делокализирована — электроны в связи обобществляются всеми атомами соединения.
Ионная связь в отличие от ковалентной происходит между атомами металлов и неметаллов, реже между неметаллами. Она образуется между катионами и отрицательно заряженными электронами, которые не привязаны к одному ядру, а свободно движутся по кристаллической решетке.
Металлическая от ионной связи отличается:
- типом связываемых частиц — у металлической связи нет как такового аниона, вместо него катионы притягивают электронный газ;
- прочностью связи при ударе — взаимное смещение катионов не приводит к разрыву, но если в связи находятся катион и анион, то связь может быть разорвана.
Как образуется ионная и металлическая связь, примеры
Ионная связь образуется между металлом и неметаллом (иногда неметаллом и неметаллом) с разным уровнем электроотрицательности. Ионы могут быть простыми и иметь только один атом, как, например, C l - , N a + , так и сложными и иметь несколько атомов и общий уровень заряда при них, как, например, N H 4 - .
Графически образование ионной связи можно проследить на схеме образования соединения натрия и хлора:
По принципу ионной связи образуются также хлороводород HCl, оксид кальция CaO, фторид натрия NaF, бромид серебра AgBr и другие.
Металлическая связь образуется между двумя неметаллами. В связь вступают ионы металла и свободные электроны. Основой для образования металлической химической связи является наличие свободных атомных орбиталей, а также свободных электронов.
Схему образования металлической связи одной формулой можно записать следующим образом:
Число n будет зависеть от места химического элемента в Периодической системе химических элементов Д. И. Менделеева. Число внешних электронов равно номеру группы, в которой находится металл.
1. Дискретность электрического заряда. Электрон. Строение атома
Возьмём два одинаковых электрометра и один из них зарядим (рис. а). Его заряд соответствует \(6\) делениям шкалы.

Если соединить эти электрометры стеклянной палочкой, то никаких изменений не произойдёт. Это подтверждает тот факт, что стекло является диэлектриком. Если же для соединения электрометров использовать металлический стержень А (рис. б), держа его за не проводящую электричество ручку В, то можно заметить, что первоначальный заряд разделится на две равные части: половина заряда перейдёт с первого шара на второй. Теперь заряд каждого электрометра соответствует \(3\) делениям шкалы. Продолжим опыт. Разъединим электрометры и коснёмся второго шара рукой. От этого он потеряет заряд — разрядится. Соединим его снова с первым шаром, на котором осталась половина первоначального заряда. Оставшийся заряд снова разделится на две равные части, и на первом шаре останется четвёртая часть первоначального заряда. Таким же образом можно получить одну восьмую часть, одну шестнадцатую часть первоначального заряда и т.д.
Возникает вопрос, до каких пор можно уменьшать заряд? Существует ли предел деления электрического заряда? Чтобы выяснить это, понадобилось выполнить более сложные и точные опыты, чем описанный выше, так как очень скоро оставшийся на шаре заряд оказывается столь малым, что обнаружить его при помощи школьного электрометра не удаётся. Более точные опыты показали, что электрический заряд нельзя уменьшать бесконечно: он имеет предел делимости.
За единицу электрического заряда принят кулон (Кл). Частицу, имеющую самый маленький заряд, назвали электроном. Этот заряд нельзя «снять» с электрона. Заряд электрона обозначают буквой е. Заряд электрона является отрицательным. \(e = -0,00000000000000000016\) Кл = \(-\) 1,6 · 10 − 19 \(\)Кл. Этот заряд в миллиарды раз меньше того, что обычно получают в опытах по электризации тел трением.
Чтобы узнать заряд тела, необходимо заряд электрона умножить на количество зарядов n:
q = e · n .
Электрон — очень маленькая частица. Его масса \(m =\) 9,1 · 10 − 31 кг. Крылышко мухи имеет массу примерно в \(5·10²²\) большую, чем масса электрона.
Если тело не заряжено и при электризации оно приобрело электроны, то оно зарядится отрицательно. Его заряд будет равен сумме зарядов полученных электронов.
Если тело заряжено отрицательно и при электризации оно ещё приобретает электроны, то отрицательный заряд тела возрастает.
Например, до электризации тело с зарядом \(2е\) в ходе электризации приобретает ещё \(4\) заряда электрона. Тогда после электризации заряд тела равен \(2е + 4е = 6е\) .
Если тело заряжено отрицательно и при электризации оно теряет электроны, то отрицательный заряд тела уменьшается.
Например, до электризации тело с зарядом \(8е\) в ходе электризации теряет \(3\) заряда электрона. Тогда после электризации заряд тела равен \(8е - 3е = 5е\).
Ионная и металлическая связь
Урок 6. Простые ионы
В уроке 6 «Простые ионы» из курса «Химия для чайников» познакомимся с простыми ионами и выясним, чему равен его заряд; также рассмотрим как образуется ионная химическая связь; научимся определять степень окисления и валентность элементов. Данный урок очень важный, и чтобы его лучше понять, обязательно просмотрите прошлые уроки, особое внимание уделяя уроку 1 «Схема строения атомов», а также уроку 3 «Схема образования молекул».
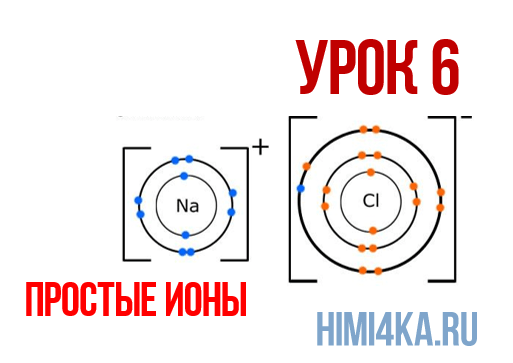
Ионная химическая связь
Мы уже кратко рассматривали ковалентную полярную химическую связь, в которой из-за незначительного различия в электроотрицательности атомов (0.4-2.0) электронная пара распределяется между ними не равномерно. Для тех, кто забыл, напоминаю, что электроотрицательность — это способность атомов притягивать к себе электроны.
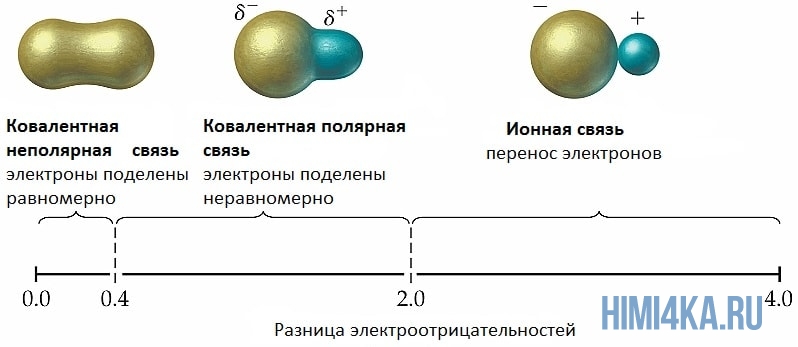
Однако, если электроотрицательность атомов различается больше чем на 2 по таблице электроотрицательности, то электронная пара полностью переходит к более электроотрицательному атому, и в результате образуется ионная химическая связь. Ионная химическая связь образуется только между атомами типичных металлов (т.к. они легко теряют внешние электроны) и неметаллов (т.к. они обладают большой электроотрицательностью).
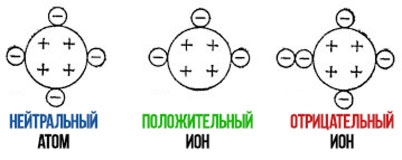
Положительные и отрицательные ионы
Наглядным примером ионной химической связи может служить обычная поваренная соль NaCl, которая присутствует на каждой кухне. Атомы натрия (и вообще всех металлов) слабо удерживают внешние электроны, тогда как атомы хлора напротив, обладают очень большой способностью притягивать к себе электроны, т.е обладают большой электроотрицательностью.
Поэтому при образовании молекулы NaCl каждый атом Na теряет один электрон (e — ), образуя положительный ион натрия Na + , а каждый атом Cl, наоборот, приобретает этот потерянный электрон натрия, образуя отрицательный ион хлора Cl — . Это записывается в виде двух реакций:
Записать ½Cl2 пришлось потому, что газообразный хлор в природе состоит из двухатомных молекул, а не из свободных одиночных атомов хлора.
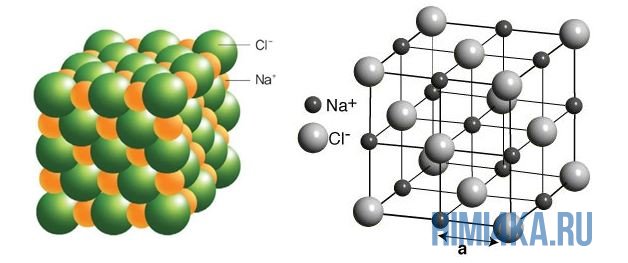
На рисунке выше, изображена кристаллическая решетка NaCl, где каждый хлорид-ион Cl — окружен со всех сторон соседними положительными ионами натрия Na + ; ионы натрия Na + точно также окружены ближайшими хлорид-ионами Cl — . Подобное расположение ионов обладает высокой устойчивостью.
Положительно заряженные ионы называются катионами. К ним в основном относятся металлы, так как они легко отдают от одного до трех электронов. Ниже приведены примеры катионов:

Анионами являются неметаллы, поскольку с радостью присоединяют к себе электроны, превращаясь в отрицательно заряженные ионы. Примеры анионов:

Степень окисления веществ
Заряд простого, одноатомного иона, например Mg 2+ или F 2- , называется его степенью окисления. Степень окисления — это такое число электронов, которое необходимо прибавить (восстановить) к иону или отнять (окислить) у него, чтобы он превратился обратно в нейтральный атом.
- Реакция восстановления: Mg 2+ + 2e — → Mg
- Реакция окисления: F 2- → F + 2e —
Процесс присоединения электронов к атому или просто их смещение в сторону данного атома называется реакцией восстановления, а оттягивание электронов от атома или их полное удаление называется реакцией окисления. Вот вам отличная шпаргалка со степенями окисления простых ионов:

Пример 12. Окисляется или восстанавливается хлор при образовании хлорид-иона? Какова степень окисления этого иона?
Решение: Хлор восстанавливается, поскольку к каждому атому хлора необходимо присоединить один электрон, чтобы образовался хлорид-ион. Хлорид-ион, Сl — , имеет степень окисления -1.
Пример 13. Окисляются или восстанавливаются металлы при образовании ими ионов? Какова степень окисления иона алюминия?
Решение: При образовании ионов металлов последние окисляются, поскольку при этом происходит удаление электронов от атомов металла. Ион алюминия, Аl 3+ , имеет степень окисления +3.
Валентность химических элементов
Валентностью называют число химических связей, которые данный атом образует с другими атомами в молекуле. Однако, если говорить простыми словами, то под валентностью понимается все та же степень окисления, но в отличии от нее валентность не имеет знака и не равна нулю.
| Молекулярная формула | Валентность | Степень окисления |
| H2O | H(I), O(II) | H +1 , O -2 |
| CS2 | C(IV), S(II) | C +4 , S -2 |
| CH4 | C(IV), H(I) | C -4 , H +1 |
Название ионов
Ионы металлов, которые имеют различные (переменные) степени окисления, записываются следующим образом:
- Fe 2+ железо(II) или ион двухвалентного железа
- Fe 3+ железо(III) или ион трехвалентного железа
- Сu + медь(I) или ион одновалентной меди
- Cu 2+ медь (II) или ион двухвалентной меди
- Sn 2+ олово(II) или двухвалентного олова
- Sn 4+ олово(IV) или ион четырехвалентного олова
Пример 2: Окисление или восстановление происходит при превращении иона трехвалентного железа в ион двухвалентного? Запишите уравнение этого процесса.
Решение: Уравнение реакции имеет следующий вид: Fe 3+ + e — → Fe 2+ . Она представляет собой процесс восстановления, поскольку к исходному иону присоединяется электрон.
Надеюсь урок 6 «Простые ионы» оказался для вас понятным и полезным. Если у вас возникли вопросы, пишите их в комментарии.
Читайте также:
