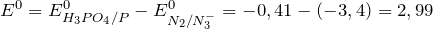Химические свойства фосфорной кислоты с металлами
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH - | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | - | - | Н | Н | Н | |
| F - | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | - | Н | Р | Р |
| Cl - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | - | - | - | Н | - | - | Н | - | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | - | Н | ? | Н | Н | ? | М | М | - | Н | ? | ? |
| HSO3 - | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | - | Н | Р | Р |
| HSO4 - | Р | Р | Р | Р | Р | Р | Р | Р | - | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р |
| NO2 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | - | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO - | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р | Р | - | Р | Р | Р | Р | Р | Р | Р | - | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые (
Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую:
Скопируйте эту ссылку, чтобы разместить результат запроса " " на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Внимание, если вы не нашли в базе сайта нужную реакцию, вы можете добавить ее самостоятельно. На данный момент доступна упрощенная авторизация через VK. Здесь вы можете выбрать параметры отображения органических соединений. Эти параметры действуют только для верхнего изображения вещества и не применяются в реакциях.
Корректная работа сайта обеспечена на всех браузерах, кроме Internet Explorer. Если вы пользуетесь Internet Explorer, смените браузер. На сайте есть сноски двух типов: Подсказки - помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация - такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Фосфор. Химия фосфора и его соединений
Фосфор расположен в главной подгруппе V группы (или в 15 группе в современной форме ПСХЭ) и в третьем периоде периодической системы химических элементов Д.И. Менделеева. Электронное строение фосфораЭлектронная конфигурация фосфора в основном состоянии :
Атом фосфора содержит на внешнем энергетическом уровне 3 неспаренных электрона и одну неподеленную электронную пару в основном энергетическом состоянии. Следовательно, атом фосфора может образовывать 3 связи по обменному механизму. Однако, в отличие от азота, за счет вакантной 3d орбитали атом фосфора может переходить в возбужденное энергетическое состояние. Электронная конфигурация фосфора в возбужденном состоянии:
При этом один электрон из неподеленной электронной пары на 3s-орбитали переходит на переходит на 3d-орбиталь. Для атома фосфора в возбужденном энергетическом состоянии характерна валентность V. Таким образом, максимальная валентность фосфора в соединениях равна V (в отличие от азота). Также характерная валентность фосфора в соединениях — III. Степени окисления атома фосфора – от -3 до +5. Характерные степени окисления -3, 0, +1, +3, +5. Физические свойства и нахождение в природеФосфор образует различные простые вещества (аллотропные модификации). Белый фосфор — это вещество состава P4. Мягкий, бесцветный, ядовитый, имеет характерный чесночный запах. Молекулярная кристаллическая решетка, а следовательно, невысокая температура плавления (44°С), высокая летучесть. Очень реакционно способен, самовоспламеняется на воздухе.
Покрытие бумаги раствором белого фосфора в сероуглероде. Спустя некоторое время, когда сероуглерод испаряется, фосфор воспламеняет бумагу (процесс лег в основу различных фокусов с самовозгоранием или получением огня из ничего): Белый фосфор можно расплавить в ёмкости с тёплой водой, поскольку он имеет температуру плавления в 44,15 °C. Красный фосфор – это модификация с атомной кристаллической решеткой . Формула красного фосфора Pn, это полимер со сложной структурой. Твердое вещество без запаха, красно-бурого цвета, не ядовитое. Это гораздо более устойчивая модификация, чем белый фосфор. В темноте не светится. Образуется из белого фосфора при t=250-300 о С без доступа воздуха.
Черный фосфор – то наиболее стабильная термодинамически и химически наименее активная форма элементарного фосфора. Чёрный фосфор — это чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, полностью нерастворимое в воде или органических растворителях.
Известны также такие модификации, как желтый фосфор и металлический фосфор. Желтый фосфор – это неочищенный белый фосфор. При очень высоком давлении фосфор переходит в новую модификацию – металлический фосфор , который очень хорошо проводит электрический ток.
В природе фосфор встречается только в виде соединений. В основном это апатиты (например, Ca3(PO4)2), фосфориты и др. Фосфор входит в состав важнейших биологических соединений —фосфолипидов. Кислоты. Химические свойства и способы получения
Перед изучением этого раздела рекомендую прочитать следующую статью: Кислоты – сложные вещества, которые при взаимодействии с водой образуют в качестве катионов только ионы Н + (или Н3О + ). По растворимости в воде кислоты можно поделить на растворимые и нерастворимые . Некоторые кислоты самопроизвольно разлагаются и в водном растворе практически не существуют (неустойчивые) . Подробно про классификацию кислот можно прочитать здесь.
Получение кислот1. Взаимодействие кислотных оксидов с водой. При этом с водой реагируют при обычных условиях только те оксиды, которым соответствует кислородсодержащая растворимая кислота. кислотный оксид + вода = кислота Например , оксид серы (VI) реагирует с водой с образованием серной кислоты: При этом оксид кремния (IV) с водой не реагирует: 2. Взаимодействие неметаллов с водородом. Таким образом получают только бескислородные кислоты. Неметалл + водород = бескислородная кислота Например , хлор реагирует с водородом: H2 0 + Cl2 0 → 2 H + Cl — 3. Электролиз растворов солей. Как правило, для получения кислот электролизу подвергают растворы солей, образованных кислотным остатком кислородсодержащих кислот. Более подробно этот вопрос рассмотрен в статье Электролиз. Например , электролиз раствора сульфата меди (II): 4. Кислоты образуются при взаимодействии других кислот с солями. При этом более сильная кислота вытесняет менее сильную. Например: карбонат кальция CaCO3 (нерастворимая соль угольной кислоты) может реагировать с более сильной серной кислотой. 5. Кислоты можно получить окислением оксидов, других кислот и неметаллов в водном растворе кислородом или другими окислителями. Например , концентрированная азотная кислота окисляет фосфор до фосфорной кислоты: Химические свойства кислот1. В водных растворах кислоты диссоциируют на катионы водорода Н + и анионы кислотных остатков. При этом сильные кислоты диссоциируют почти полностью, а слабые кислоты диссоциируют частично. Например , соляная кислота диссоциирует почти полностью: HCl → H + + Cl – Если говорить точнее, происходит протолиз воды, и в растворе образуются ионы гидроксония: HCl + H2O → H3O + + Cl – Многоосновные кислоты диссоциируют cтупенчато. Например , сернистая кислота диссоциирует в две ступени: HSO3 – ↔ H + + SO3 2– 2. Кислоты изменяют окраску индикатора. Водный раствор кислот окрашивает лакмус в красный цвет, метилоранж в красный цвет. Фенолфталеин не изменяет окраску в присутствии кислот. 3. Кислоты реагируют с основаниями и основными оксидами . С нерастворимыми основаниями и соответствующими им оксидами взаимодействуют только растворимые кислоты. нерастворимое основание + растворимая кислота = соль + вода основный оксид + растворимая кислота = соль + вода Например , гидроксид меди (II) взаимодействует с растворимой бромоводородной кислотой: При этом гидроксид меди (II) не взаимодействует с нерастворимой кремниевой кислотой. С сильными основаниями (щелочами) и соответствующими им оксидами реагируют любые кислотами.
Щёлочи взаимодействуют с любыми кислотами — и сильными, и слабыми . При этом образуются средняя соль и вода. Эти реакции называются реакциями нейтрализации . Возможно и образование кислой соли, если кислота многоосновная, при определенном соотношении реагентов, либо в избытке кислоты. В избытке щёлочи образуется средняя соль и вода: щёлочь(избыток)+ кислота = средняя соль + вода щёлочь + многоосновная кислота(избыток) = кислая соль + вода Например , гидроксид натрия при взаимодействии с трёхосновной фосфорной кислотой может образовывать 3 типа солей: дигидрофосфаты, фосфаты или гидрофосфаты. При этом дигидрофосфаты образуются в избытке кислоты, либо при мольном соотношении (соотношении количеств веществ) реагентов 1:1. При мольном соотношении количества щелочи и кислоты 1:2 образуются гидрофосфаты: В избытке щелочи, либо при мольном соотношении количества щелочи и кислоты 3:1 образуется фосфат щелочного металла.
4. Растворимые кислоты взаимодействуют с амфотерными оксидами и гидроксидами. Растворимая кислота + амфотерный оксид = соль + вода Растворимая кислота + амфотерный гидроксид = соль + вода Например , уксусная кислота взаимодействует с гидроксидом алюминия:
5. Некоторые кислоты являются сильными восстановителями. Восстановителями являются кислоты, образованные неметаллами в минимальной или промежуточной степени окисления, которые могут повысить свою степень окисления (йодоводород HI, сернистая кислота H2SO3 и др.). Например , йодоводород можно окислить хлоридом меди (II): 4H I — + 2 Cu +2 Cl2 → 4HCl + 2 Cu + I + I2 0 6. Кислоты взаимодействуют с солями. Кислоты реагируют с растворимыми солями только при условии, что в продуктах реакции присутствует газ, вода, осадок или другой слабый электролит . Такие реакции протекают по механизму ионного обмена. Кислота1 + растворимая соль1 = соль2 + кислота2/оксид + вода
Например , соляная кислота взаимодействует с нитратом серебра в растворе: Ag + NO3 — + H + Cl — → Ag + Cl — ↓ + H + NO3 — Кислоты реагируют и с нерастворимыми солями. При этом более сильные кислоты вытесняют менее сильные кислоты из солей . Например , карбонат кальция (соль угольной кислоты), реагирует с соляной кислотой (более сильной, чем угольная): 7. Кислоты взаимодействуют с кислыми и основными солями. При этом более сильные кислоты вытесняют менее сильные из кислых солей. Либо кислые соли реагируют с кислотами с образованием более кислых солей. кислая соль1 + кислота1 = средняя соль2 + кислота2/оксид + вода Например , гидрокарбонат калия реагирует с соляной кислотой с образованием хлорида калия, углекислого газа и воды: KHCO3 + HCl → KCl + CO2 + H2O Ещё пример : гидрофосфат калия взаимодействует с фосфорной кислотой с образованием дигидрофосфата калия: При взаимодействии основных солей с кислотами образуются средние соли. Более сильные кислоты также вытесняют менее сильные из солей. Например , гидроксокарбонат меди (II) растворяется в серной кислоте: Основные соли могут взаимодействовать с собственными кислотами. При этом вытеснения кислоты из соли не происходит, а просто образуются более средние соли. Например , гидроксохлорид алюминия взаимодействует с соляной кислотой: Al (OH) Cl2 + HCl → AlCl3 + H2O 8. Кислоты взаимодействуют с металлами. При этом протекает окислительно-восстановительная реакция. Однако минеральные кислоты и кислоты-окислители взаимодействуют по-разному. К минеральным кислотам относятся соляная кислота HCl, разбавленная серная кислота H2SO4, фосфорная кислота H3PO4, плавиковая кислота HF, бромоводородная HBr и йодоводородная кислоты HI и др. Такие кислоты взаимодействуют только с металлами, расположенными в ряду активности до водорода:
При взаимодействии минеральных кислот с металлами образуются соль и водород: минеральная кислота + металл = соль + H2↑ Например , железо взаимодействует с соляной кислотой с образованием хлорида железа (II): Fe + 2 H + Cl → Fe +2 Cl2 + H2 0 Кислоты-окислители (азотная кислота HNO3 любой концентрации и серная концентрированная кислота H2SO4(конц)) при взаимодействии с металлами водород не образуют, т.к. окислителем выступает не водород, а азот или сера. Продукты восстановления азотной или серной кислот бывают различными. Определять их лучше по специальным правилам. Эти правила подробно разобраны в статье Окислительно-восстановительные реакции . Я настоятельно рекомендую выучить их наизусть. 9. Некоторые кислоты разлагаются при нагревании. Угольная H2CO3, сернистая H2SO3 и азотистая HNO2 кислоты разлагаются самопроизвольно, без нагревания: Кремниевая H2SiO3, йодоводородная HI кислоты разлагаются при нагревании: Формула фосфорной кислотыФосфорная кислота – это неорганическая кислота, которая является производным фосфорного ангидрида .
Химическая формула – Молярная масса равна г/моль. Физические свойства – при комнатной температуре это бесцветные гигроскопичные кристаллы с температурой плавления , температурой кипения , растворимость в воде составляет 5,48 г/мл. Химические свойства фосфорной кислоты
Получение фосфорной кислоты
ПрименениеОртофосфорная кислота используется для очищения от ржавчины металлических поверхностей, как пищевая добавка E338 (регулятор кислотности), применяется в производстве удобрений, в текстильной промышленности для крашения тканей, в органическом синтезе в качестве катализатор, в стоматологии для получения зубного цемента. Качественная реакцияКачественной реакцией на фосфорную кислоту является образование ярко-жёлтого осадка молибденофосфата аммония:
и жёлтого осадка с нитратом серебра
Примеры решения задач
или и — массовые доли первого и второго растворов. и — масса первого и второго раствора.
Уравняем химическую реакцию:
5e коэффициент 2 наименьшее общее кратное 10 2e коэффициент 5
Определим значение стандартной ЭДС . В
В Читайте также:
|



















![\[ 3Mg + 2H_3PO_4 = Mg_3(PO_4)_2 \downarrow + 3H_2 \uparrow \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-765b126cb0e17a9f6ba9a4c44dd542b7_l3.png)
![\[ Fe_2O_3 + 2H_3PO_4 = 2FePO_4 \downarrow + 3H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-020c9dbe310f819d7ef20b6e2498efbb_l3.png)
![\[ H_3PO_4 + 3NaOH = Na_3PO_4 + 3H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-0a741a4048fc666b31df0503807fff0a_l3.png)
![\[ 2H_3PO_4 + 3CaCl_3 = Ca_3(PO_4)_2 \downarrow + 6HCl \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-62dadc7bcfe051666bdff3209075c2ec_l3.png)
![\[ H_3PO_4 + HClO_4 = [P(OH)_4]ClO_4 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-611678ccc6d864c845171d9c77228a51_l3.png)
![\[ 2H_3PO_4 = H_4P_2O_7 + H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-3fc2b4a2c6c516cbc603479767cbc8b1_l3.png)
![\[ H_3PO_4 = HPO_3 + H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-6a179351e7c30f28120bd30e798bdeff_l3.png)
![\[ Ca_3(PO_4)_2 + 3H_2SO_4 = 3CaSO_4 + 2H_3PO_4 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-d2ac0a5cfd83f3f61101c675001d349a_l3.png)
![\[ PCl_5 + 4H_2O = H_3PO_4 + 5HCl \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-98c703027457e3609039b1c795e6315a_l3.png)
![\[ P_2O_5 + 3H_2O = 2H_3PO_4 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-6c7a40679971c07f5f0b176c9ea31e0f_l3.png)
![\[ 3P + 5HNO_3 + 2H_2O = 3H_3PO_4 + 5NO \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-92dd853c92580cbe6ccba661d19a12ed_l3.png)
![\[ H_3PO_4 + 12[NH_4]2MoO_4 + 21HNO_3 = [NH_4]_3PMo_{12}O_{40} \cdot 6H_2O \downarrow + 21NH_4NO_3 + 6H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-c8f8c8a04ba2b6e8dd17e5ef395643c8_l3.png)
![\[ H_3PO_4 + 3AgNO_3 = Ag_3PO_4 \downarrow + 3HNO_3 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-7b0f58eafa026c4cb656c1dcfcb56b7d_l3.png)
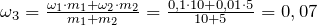
![\[ H_3PO_4 + NaN_3 + H_2SO_4 \rightarrow P + N_2 \uparrow + Na_2SO_4 + H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-e92fe42088291b7c0ef24be21226ef1f_l3.png)
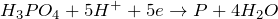
![\[ 2H_3PO_4 + 10H^+ + 10N_3^- \rightarrow 2P + 15N_2 + 8H_2O \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-9a8c0894b776fa6c3d6553d45fdc4055_l3.png)
![\[ 2H_3PO_4 + 10NaN_3 + 5H_2SO_4 \rightarrow 2P + 15N_2 + 8H_2O + 5Na_2SO_4 \]](http://ru.solverbook.com/wp-content/ql-cache/quicklatex.com-41a9da4a63fd2f522f717070f2204b5a_l3.png)