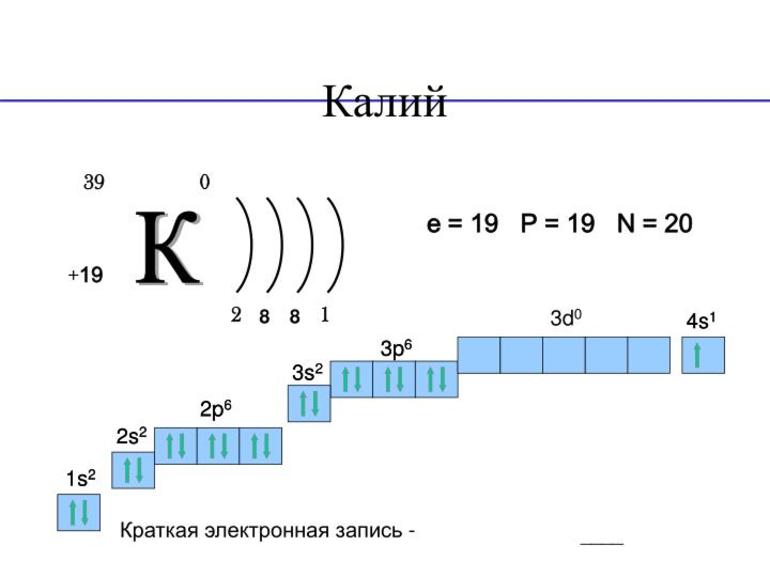
Характеристика элемента металла калия
(от араб. аль-кали - поташ; лат. Kalium) К, хим. элемент I гр. периодич. системы; относится к щелочным металлам, ат. н. 19, ат. м. 39,0983. Состоит из двух стабильных изотопов 39 К (93,259%) и 41 К (6,729%), а также радиоактивного изотопа 40 К (Т 1/2 1,32.10 9 лет). Поперечное сечение захвата тепловых нейтронов для прир. смеси изотопов 1,97.10 - 28 м 2 . Конфигурация внеш. электронной оболочки 4s 1 ; степень окисления +1; энергия ионизации К 0 : К + : К 2+ соотв. 4,34070 эВ и 31,8196 эВ; сродство к электрону 0,47 эВ; электроотрицательность по Полингу 0,8; атомный радиус 0,2313 нм, ионный радиус (в скобках указано координац. число) К + 0,151 нм (4), 0,152 нм (6), 0,160 нм (7), 0,165 нм (8), 0,178 нм (12). Содержание в земной коре 2,41% по массе. Осн. минералы: сильвин КСl, карналлит KCl.MgCl 2 .6H 2 O, калиевый полевой шпат (ортоклаз) K[AlSi 3 O 8 ], мусковит калиевая слюда) KAl 2 [AlSi 3 O 10 ](OH, F) 2 , каинит КСl.MgSO 4 .3H 2 O, полигалит K 2 SO 4 .MgSO 4 .2CaSO 4 .2Н 2 О, алунит KAl 3 (SO 4 ) 2 (OH) 6 .
Свойства. К. - мягкий серебристо-белый металл с кубич. решеткой, а =0,5344 нм, z =2, пространств. группа Im3m. Т. пл. 63,51 °С, т. кип. 761 °С; плотн. 0,8629 г/см 3 ; С 0 p 29,60 Дж/(моль. К); DH 0 пл 2,33 кДж/моль, DH 0 возг 89,0 кДж/моль; S 0 298 64,68 Дж/(моль. К); ур-ние температурной зависимости давления пара (в мм рт. ст.): lgp =7,34 - 4507/T(373-474 К); r 6,23.10 -8 Ом. м (0°С), 8,71.10 - 8 Ом. м (25°C) и 13,38.10 -8 Ом. м (77°С); g 0,114 Н/м (334 К), h 5,096.10 - 4 Н. с/м 2 (350 К); теплопроводность 99,3 Вт/(м. К) при 273 К и 44,9 Вт/(м. К) при 473 К; при 273-323 К температурные коэф. линейного и объемного расширения составляют соотв. 8,33.10 - 5 К - 1 и 2,498.10 - 4 К - 1 . К. может обрабатываться прессованием и прокаткой. К. химически очень активен. Легко взаимод. с О 2 воздуха, образуя калия оксид К 2 О, пероксид К 2 О 2 и надпероксид КО 2 ; при нагр. на воздухе загорается. С водой и разб. к-тами взаимод. со взрывом и воспламенением, причем H 2 SO 4 восстанавливается до S 2 - , S 0 и SO 2 , а НNО 3 - до NO, N 2 O и N 2 . При нагр. до 200-350 °С реагирует с Н 2 с образованием гидрида КН. Воспламеняется в атмосфере F 2 , слабо взаимод. с жидким Сl 2 , но взрывается при соприкосновении с Вr 2 и растирании с I 2 ; при контакте с межгалогенными соед. воспламеняется или взрывается. С S, Se и Те при слабом нагревании образует соотв. K 2 S, K 2 Se и К 2 Те, при нагр. с Р в атмосфере азота - К 3 Р и К 2 Р 5 , с графитом при 250-500 °С - слоистые соед. состава С 8 К-С 60 К. С СО 2 не реагирует заметно при 10-30°С; стекло и платину разрушает выше 350-400 °С. К. раств. в жидком NH 3 (35,9 г в 100 мл при - 70 °С), анилине, этилендиамине, ТГФ и диглиме с образованием р-ров с металлич. проводимостью. Р-р в NH 3 имеет темно-синий цвет, в присут. Pt и следов воды разлагается, давая KNH 2 и Н 2 . С азотом К. не взаимод. даже под давлением при высоких т-рах. При взаимод. с NH 4 N 3 в жидком NH 3 образуется азид KN 3 . К. не раств. в жидких Li, Mg, Cd, Zn, Al и Ga и не реагирует с ними. С натрием образует интерметаллид KNa 2 (плавится инконгруэнтно при 7°С), с рубидием и цезием -твердые р-ры, для к-рых миним. т-ры плавления составляют соотв. 32,8 °С (81,4% по массе Rb) и - 37,5 °С (77,3% Cs). С ртутью дает амальгаму, содержащую два меркурида -KHg 2 и KHg (т. пл. соотв. 270 °С и 180°С). С таллием образует КТl (т. пл. 335 °С), с оловом - K 2 Sn, KSn, KSn 2 и KSn 4 , со свинцом - КРb (т. пл. 568 °С) и фазы состава К 2 Рb 3 , КРb 2 и КРb 4 , с сурьмой - К 3 Sb и KSb (т. пл. соотв. 812 и 605 °С), с висмутом - K 3 Bi, K 3 Bi 2 и KBi 2 (т. пл. соотв. 671, 420 и 553 °C). К. энергично взаимод. с оксидами азота, а при высоких т-рах - с СО и СО 2 . Восстанавливает В 2 О 3 и SiO 2 соотв. до В и Si, оксиды Al, Hg, Ag, Ni и др. - до своб. металлов, сульфаты, сульфиты, нитраты, нитриты, карбонаты и фосфаты металлов - до оксидов или своб. металлов. Со спиртами К. образует алкоголяты, с галогеналкилами и галогенарилами - соотв. калийалкилы и калийарилы. Важнейшим соед. К. посвящены отд. статьи (см., напр., Калия гидроксид, Калия иодид, Калия карбонат, Калия хлорид). Ниже приводятся сведения о др. важных соединениях. Пероксид К 2 О 2 - бесцв. кристаллы с ромбич. решеткой ( а =0,6736 нм, b= 0,7001 нм, с =0,6479 нм, z = 4, пространств. группа Рппп); т. пл. 545 °С; плотн. 2,40 г/см 3 ; C 0 p 90,8 Дж/(моль. К); DH 0 пл 20,5 кДж/моль, DH 0 обр -443,0 кДж/моль; S 0 298 117 Дж/(моль. К). На воздухе К 2 О 2 мгновенно окисляется до КО 2 ; энергично взаимод. с водой с образованием КОН и О 2 , с СО 2 дает К 2 СО 3 и О 2 . Получают пероксид пропусканием дозированного кол-ва О 2 через р-р К. в жидком NH 3 , разложением КО 2 в вакууме при 340-350 °С. Надпероксид КО 2 - желтые кристаллы с тетрагон. решеткой ( а Ч0,5704 нм, с Ч0,6699 нм, z = 4, пространств. группа I4/mmm; плотн. 2,158 г/см 3 ); выше 149°С переходит в кубич. модификацию (а= 0,609 нм); т. пл. 535 °С; С 0 p 77,5 Дж/(моль. К);
DH 0 обр - 283,2 кДж/моль, DH 0 пл 20,6 кДж/моль; S 0 298 125,4 Дж/(моль. К); парамагнетик. Сильный окислитель. Взаимод. с водой с образованием КОН и О 2 . Диссоциирует, напр., в бензоле, давая анион-радикал О 2 - . Сера при нагр. с КО 2 воспламеняется и дает K 2 SO 4 . С влажными СО 2 и СО надпероксид образует К 2 СО 3 и О 2 , с NO 2 - KNO 3 и О 2 , с SO 2 - K 2 SO 4 и О 2 . При действии конц. H 2 SO 4 выделяется О 3 , при р-ции с NH 3 образуются N 2 , H 2 O и КОН. Смесь КО 2 с графитом взрывает. Получают надпероксид сжиганием К. в воздухе, обогащенном влажным О 2 и нагретом до 75-80 °С. Озонид КО 3 - красные кристаллы с тетрагон. решеткой ( а =0,8597 нм, с= 0,7080 нм, пространств. группа I4/mcm); плотн. 1,99 г/см 3 ; устойчив только при хранении в герметически закрытых сосудах ниже 0°С, при более высокой т-ре распадается на КО 2 и О 2 ; С 0 p >75 Дж/(моль. К); S 0 298 105 Дж/(моль. К); парамагнетик. Р-римость в жидком NH 3 (г в 100 г); 14,82 (-35°С), 12,00 (-63,5°С), эвтектика NH 3 - KO 3 (5 г в 100 г NH 3 ) имеет т. пл. - 80 °С; при длит. хранении аммиачные р-ры разлагаются на NH 4 O 3 и KNH 2 . Раств. в фреонах. КО 3 - сильный окислитель; мгновенно реагирует с водой уже при 0 °С, давая КОН и О 2 ; с влажным СО 2 образует К 2 СО 3 и КНСО 3 . Получают: взаимод. смеси О 3 и О 2 с КОН или КО 2 при т-ре ниже 0°С с послед. экстракцией жидким NH 3 ; озонированием суспензии КО 2 или КОН во фреоне 12. Надпероксид, пероксид и озонид К. - компоненты составов для регенерации воздуха в замкнутых системах (шахты, подводные лодки, космич. корабли). Гидрид КН - бесцв. кристаллы с кубич. решеткой ( а =0,570 нм, z = 4, пространств. группа Fm3m); т. пл. 619 °С при давлении водорода 6,86 МПа; плотн. 1,52 г/см 3 ; С 0 p 38,1 Дж/(моль. К); DH 0 обр -57,8 кДж/моль, DH 0 пл 21,3 кДж/моль; S 0 298 50,2 Дж/(моль. К). Разлагается при нагр. на К. и Н 2 . Сильный восстановитель. Воспламеняется во влажном воздухе, в среде F 2 и Сl 2 . Энергично взаимод. с водой, давая КОН и Н 2 . При нагр. с N 2 или NH 3 образует KNH 2 , с H 2 S - K 2 S и Н 2 , с расплавл. серой - K 2 S и H 2 S, с влажным СO 2 - НСООК, с СО - НСООК и С. Получают КН взаимод. К. с избытком Н 2 при 300-400 °С. Гидрид восстановитель в неорг. и орг. синтезах. Азид КN 3 - бесцв. кристаллы с тетрагон. решеткой (а= 0,6094 нм, с= 0,7056 нм, z = 4, пространств. группа I4/mcm); С 0 р >76,9 Дж/(моль. К); DH 0 обр -1,7 кДж/моль; S 0 298 104,0 Дж/(моль. К); т. пл. 354 °С, выше разлагается на К. и азот; плотн. 2,056 г/см 3 . Р-римость (г в 100 г р-рителя): вода -41,4 (0°С), 105,7 (100°С), этанол - 0,137 (16°С). В эфире и бензоле раств. плохо. Водой гидролизуется; эвтектика Н 2 О -KN 3 (35,5 г в 100 г) имеет т. пл. - 12°С. Получают: взаимод. N 2 O с расплавл. KNH 2 при 280 °С; действием КОН на р-р HN 3 .
Получение. К. производят взаимод. Na с КОН при 380-450 °С или КСl при 760-890 °С. Р-ции проводят в атмосфере N 2 . Взаимод. КОН с жидким Na осуществляют противотоком в тарельчатой колонне из Ni. При р-ции с КСl пары Na пропускают через расплав КСl. Продукт р-ций -сплав К - Na. Его подвергают ректификации и получают К. с содержанием примесей (в % по массе): 1.10 - 3 Na и 1.10 - 4 С1. Кроме того, К. получают: вакуум-термич. восстановлением КСl карбидом СаС 2 , сплавами Si-Fe или Si-Al при 850-950 °С и остаточном давлении 1,33 13,3 Па; нагреванием К 2 Сr 2 О 7 с Zr при 400 °С; электролизом КОН с железным катодом; электролизом КСl (или его смеси К 2 СО 3 ) с жидким свинцовым катодом при 680-720 °С с послед. разделением К и Рb вакуумной дистилляцией; электролизом 50%-ного р-ра KNH 2 в жидком NH 3 при 25 °С и давлении 0,75 МПа с амальгамой К. в качестве анода и катодом из нержавеющей стали, при этом образуется 30%-ный р-р К. в жидком NH 3 , к-рый выводится из аппарата для отделения К.
Определение. Качественно К. обнаруживают по розово-фиолетовому окрашиванию пламени и по характерным лииниям спектра: 404,41, 404,72, 766,49, 769,90 нм. Наиб. распространенные количеств. методы, особенно в присут. др. щелочных металлов, - эмиссионная пламенная фотометрия (чувствительность 1.10 - 4 мкг/мл) и атомно-абсорбц. спектрометрия (чувствительность 0,01 мкг/мл). В меньшей степени используются химико-спектральный и спектрофотометрич. методы с применением дипикриламина (чувствительность 0,2-1,0 мкг/мл). При большом содержании К. в пробе применяют гравиметрич. метод с осаждением К. в виде тетрафенилбората, K 2 [PtCl 6 ] или КСlO 4 в среде бутанола.
Применение. К. - материал электродов в хим. источниках тока; компонент катодов-эмиттеров фотоэлементов и термоэмиссионных преобразователей, а также фотоэлектронных умножителей; геттер в вакуумных радиолампах; активатор катодов газоразрядных устройств. Сплав К. с Na -теплоноситель в ядерных реакторах. Радиоактивный изотоп 40 К служит для определения возраста горных пород (калийаргоновый метод). Искусств. изотоп 42 К (T 1/2 12,52 года) -радиоактивный индикатор в медицине и биологии. К. - важнейший элемент (в виде соед.) для питания растений (см. Калийные удобрения). К. вызывает сильные ожоги кожи, при попадании мельчайших его крошек в глаза тяжело их поражает, возможна потеря зрения. Загоревшийся К. заливают минер. маслом или засыпают смесью талька и NaCl. Хранят К. в герметически закрытых железных коробках под слоем обезвоженного керосина или минер. масла. Отходы К. утилизируют обработкой их сухим этанолом или пропанолом с послед. разложением образовавшихся алкоголятов водой. К. открыл Г. Дэви в 1807. Лит.: Натрий и калий, Л., 1959; Коренман И. М., Аналитическая химия калия, М., 1964; Теплофизическиe свойства щелочных металлов, М., 1970, (Тр. МЭИ, в. 75); Вольнов И. И., Перекисные соединения щелочных металлов, М., 1980. Б. Д. Степин.
Химическая энциклопедия. — М.: Советская энциклопедия . Под ред. И. Л. Кнунянца . 1988 .
Полезное
Смотреть что такое "КАЛИЙ" в других словарях:
Калий-40 — Калий 40 … Википедия
КАЛИЙ — новолатинск. kalium, от араб. kali, щелочь. Мягкий и легкий металл, составляющий основание кали. Открыт Деви в 1807 году. Объяснение 25000 иностранных слов, вошедших в употребление в русский язык, с означением их корней. Михельсон А.Д., 1865.… … Словарь иностранных слов русского языка
КАЛИЙ — (Kalium), K, химический элемент I группы периодической системы, атомный номер 19, атомная масса 39,0983; относится к щелочным металлам; tпл 63,51шC. В живых организмах калий основной внутриклеточный катион, участвует в генерации биоэлектрических… … Современная энциклопедия
КАЛИЙ — (Kalium, s. Potassium), хим. элемент, симв. К, порядковый номер 19, серебристо белый, блестящий металл, имеющий при обыкновенной ta плотность воска; открыт Деви в 1807 г. Уд. в. при 20° 0,8621, атомный вес 39,1, одновалентен; t° плавления … Большая медицинская энциклопедия
Калий — (Kalium), K, химический элемент I группы периодической системы, атомный номер 19, атомная масса 39,0983; относится к щелочным металлам; tпл 63,51°C. В живых организмах калий основной внутриклеточный катион, участвует в генерации биоэлектрических… … Иллюстрированный энциклопедический словарь
КАЛИЙ — (символ К), распространенный химический элемент, относящийся к ЩЕЛОЧНЫМ МЕТАЛЛАМ. Впервые был выделен сэром Хэмфри Дэви в 1807 г. Его основными рудами являются сильвин (хлорид калия), карналлит и полигалит. Калий является теплоносителем в АТОМНЫХ … Научно-технический энциклопедический словарь
КАЛИЙ — муж. потасий, металл, составляющий основанье кали, весьма сходный с натрием (содием). Кали ср., нескл., растительная щелочь или щелочная соль; углекислый калий, чистый поташ. Калиевый, к калию относящийся. Калистый, содержащий кали. Толковый… … Толковый словарь Даля
калий — потассий, поташ Словарь русских синонимов. калий сущ., кол во синонимов: 4 • металл (86) • потассий … Словарь синонимов
КАЛИЙ — (лат. Kalium) К, химический элемент I группы периодической системы, атомный номер 19, атомная масса 39,0983, относится к щелочным металлам. Название от араб. аль кали поташ (давно известное соединение калия, добывающееся из древесной золы).… … Большой Энциклопедический словарь
Калий — K (от араб, аль кали поташ * a. Potassium, potash; н. Kalium; ф. potassium; и. potasio), хим. элемент I группы периодич. системы Mенделеева, ат.н. 19, ат. м. 39,102. Природный K. состоит из двух стабильных изотопов 39K (93,08%), 41K… … Геологическая энциклопедия
КАЛИЙ — КАЛИЙ, калия, мн. нет, муж., и кали, нескл., ср. (араб. поташ) (хим.). Химический элемент щелочный металл серебристо белого цвета, добываемый из углекалиевой соли. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
Калий – полезные свойства и особенности металла
Это вещество известно всем, особенно фанатам гигиены и чувствительным людям. Достоинства калия сделали его обязательным компонентом в науке, промышленном производстве, сельском хозяйстве.

Что представляет собой калий
Калий – это химический элемент, номер 19 таблицы Менделеева:
- Это мягкое вещество серебристо-белого цвета.
- Относится к щелочным металлам.
- Структура решетки кубическая.
- Международное обозначение – K (Kalium).
Химические свойства схожи с натрием, отличия выявлены на биологическом уровне.
Калий включает в себя три изотопа. Изотоп K40 – источник энергии, извлекаемой из геотермальных источников планеты.
Естественные либо синтезированные заменители металла не выявлены.
История
Калий упоминается, начиная со времени первых цивилизаций. Соединения вещества использовали еще древние египтяне. Речь о поташе, которым стирали одежду, мыли посуду.
Процесс был простым. Сжигали ветви, солому, оставшуюся золу заливали водой. Полученную щелочную массу отфильтровывали, выпаривали.
История получения металла европейскими учеными начинается с 19 века:
- В 1807 году английский химик Гемфри Дэви выбрал исходником едкий кали. Применив электролиз, получил калий.
- Через два года его французские коллеги прокалили едкий кали с углем и также получили металл.
С названием металла определились не сразу:
- Первооткрыватель окрестил вещество «потассием» (лат. Potassium).
- Немец Людвиг Гильберт предложил термин «калий».
Латинское kalium восходит к арабскому аль-кали. Так арабы именовали поташ.
Термин «калий» понравился немцам. Его переняли ученые Европы (в том числе российские).
Калий в природе
В природе свободный калий не обнаружен (этому препятствует высокая химическая активность), только как компонент соединений с другими химическими элементами в составе. Такая форма существует в почве, растительной золе, минералах, морской воде.

Калий под слоем ТГФ
Самые известные минералы – каинит, сильвин, сильвинит, карналлит.
Калий – элемент клеток живых организмов.
Тонна земной коры содержит 24 кг калия, литр морской воды – 380 мг.
По распространенности калий – пятый среди металлов, седьмой среди всех элементов.
Сырье извлекают из шахт либо подземных соленых вод.
Крупнейшими залежами располагают Канада, Россия, Белоруссия.
Технология получения
Подобно другим щелочным металлам, калий извлекают электролизом расплава хлоридов либо щелочей.
При таком способе получения используют – как менее тугоплавкие – щелочи плюс сода либо поташ:
- На катоде и аноде появляются, соответственно, расплавленный калий и кислород.
- Вода из расплава испаряется.
- Чтобы исключить взаимодействие с кислородом, используют медный катод.
- Над катодом укрепляют медный цилиндр. В нем оседает расплавленный калий.
Анод изготовляют из никеля (для щелочей) либо графита (хлоридов).
Физико-химические характеристики
Калий как металл проявляет типично «щелочные» характеристики:
- Химически суперактивен: без проблем взаимодействует с неметаллами, сложными веществами. В результате образуются галогениды, фосфиды, оксиды, амальгамы, соли.
- Взаимодействие с металлами возможно только при нагревании. Образуются сплавы-интерметаллиды.
- Почти мгновенно окисляется на воздухе.
- С кислородом реагирует так бурно, что получается супероксид – K2O4.
- Легкий (кубик с ребром в 1 см весит меньше грамма), легкоплавок.
- Это мягкий металл – легко режется ножом, раскатывается до фольги.
- Не тонет в воде.
Взаимодействие металла с водой взрывоопасно, на воздухе он разрушается. Для нейтрализации этих недостатков калий хранят в бензине, керосине либо плотно закрываемых сосудах.

Калий активно взаимодействует с водой. Выделяющийся водород воспламеняется, а ионы калия придают пламени фиолетовый цвет. Раствор фенолфталеина в воде становится малиновым, демонстрируя щелочную реакцию образующегося KOH.
| Свойства атома | |
|---|---|
| Название, символ, номер | Калий / Kalium (K), 19 |
| Атомная масса (молярная масса) | 39,0983(1) а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 4s1 |
| Радиус атома | 235 пм |
| Химические свойства | |
| Ковалентный радиус | 203 пм |
| Радиус иона | 133 пм |
| Электроотрицательность | 0,82 (шкала Полинга) |
| Электродный потенциал | −2,92 В |
| Степени окисления | 0; +1 |
| Энергия ионизации (первый электрон) | 418,5 (4,34) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 0,856 г/см³ |
| Температура плавления | 336,8 К; +63,65 °C |
| Температура кипения | 1047 К; 773,85 °C |
| Уд. теплота плавления | 2,33 кДж/моль |
| Уд. теплота испарения | 76,9 кДж/моль |
| Молярная теплоёмкость | 29,6 Дж/(K·моль) |
| Молярный объём | 45,3 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая объёмно-центрированная |
| Параметры решётки | 5,332 Å |
| Температура Дебая | 100 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 79,0 Вт/(м·К) |
| Номер CAS | 7440-09-7 |
Калий, его соединения придают пламени горелки розовато-фиолетовый оттенок. По этому признаку его легко отличить от других щелочных металлов.
Где используется калий
Калиево-натриевый сплав используется как теплоноситель в атомных реакторах.
Минералы, содержащие калий, аккумулируют изотопы аргона. Благодаря этому возможно определение возраста геологических формаций.
Калийные соединения используются в промышленности:
- Флюс для пайки цветных металлов, сталей.
- Монокристаллы в лазерах, пьезоэлектрики.
- Серебрение, золочение, другие гальванические операции. Используется цианид калия – один из сильнейших ядов.
- Очистка ацетилена от примесей.
- Регенерация воздуха на субмаринах и в противогазах.
Перманганат калия задействуют для получения кислорода. Это оказалось жизненно важным в период пандемии коронавируса.
Без перманганата – марганцовки – и бромида (успокоительного) не обходится домашняя аптечка.

Кристаллы перманганата калия
Химическое вещество с формулой KMnO4 – это обычная марганцовка.
Достоинства металла оценили аграрии. 90% продукции – это калийные удобрения: поташ, селитра, сильвин («калийная соль»).
Биологическая роль металла
Растения, высаженные в бедную калием почву, чахнут, плохо плодоносят. Не меньшее значение имеет микроэлемент для человека.
Жизненные процессы
В организме человека действует связка калий-натрий.
Она контролирует следующие процессы:
- Нормализация кислотно-щелочного, водного баланса, сердечного ритма.
- Содействие появлению мембранного потенциала, работе мышц.
- Поддержание кондиций крови.
Плюс активация ферментов.
Суточная потребность
Суточная норма микроэлемента (г):
Потребность в калии увеличивается при обезвоживании организма (расстройство ЖКТ, рвота, прием мочегонных препаратов, потение).
Питание
Калий поступает в организм с пищей.
Основные поставщики микроэлемента:
- Печень, рыба.
- Бобовые.
- Картофель.
- Молоко.
- Брокколи.
- Цитрусовые, виноград, курага, финики, дыня.
Калием насыщены экзотичные фрукты – помело, киви, авокадо, бананы. Он есть в ореховом масле.
Усвоению калия содействует витамин В6, тормозит алкоголь.
Симптомы недостатка/избытка
Недостаток металла влечет сбои в работе сердечной и скелетной мышц. В тяжелых случаях – невралгию.
Переизбыток опознается по язве тонкого кишечника. Случается остановка сердца.
На рынке представлена промышленная, аптечная продукция, удобрения с калием.
Цены доступны (руб. / кг):
- Калийные соединения – 50 – 350 (вольфрамат – 2,9 тыс.).
- Минеральные удобрения – 50 – 75.
Стоимость аптечных препаратов определяется брендом либо страной-производителем.
Калий

Калий — элемент первой группы (по старой классификации — главной подгруппы первой группы), четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 19. Обозначается символом K (лат. Kalium ). Простое вещество калий — мягкий щелочной металл серебристо-белого цвета.
В природе калий встречается только в соединениях с другими элементами, например, в морской воде, а также во многих минералах.
Очень быстро окисляется на воздухе и очень легко вступает в химические реакции, особенно с водой, образуя щёлочь.
Во многих свойствах калий очень близок натрию, но с точки зрения биологической функции и использования клетками живых организмов они антагонистичны.
Содержание
- 1 История и происхождение названия
- 2 Нахождение в природе
- 2.1 Месторождения
- 5.1 Взаимодействие с простыми веществами
- 5.2 Взаимодействие со сложными веществами
- 5.3 Соединения с кислородом
- 5.4 Гидроксид
- 6.1 Важные соединения
- 7.1 Калий в организме человека
История и происхождение названия
Соединения калия используются с древнейших времён. Так, производство поташа (который применялся как моющее средство) существовало уже в XI веке. Золу, образующуюся при сжигании соломы или древесины, обрабатывали водой, а полученный раствор (щёлок) после фильтрования выпаривали. Сухой остаток, помимо карбоната калия K2CO3, содержал сульфат калия K2SO4, соду и хлорид калия KCl.
19 ноября 1807 года в Бейкеровской лекции английский химик Дэви сообщил о выделении калия электролизом расплава едкого кали (KOH)(в рукописи лекции Дэви указал, что он открыл калий 6 октября 1807 года). Дэви назвал его «потасий» (лат. potasium ; это название (правда, в некоторых языках с двумя буквами s) до сих пор употребительно в английском, французском, испанском, португальском и польском языках. При электролизе влажного едкого кали KOH на ртутном катоде он получил амальгаму калия, а после отгонки ртути - чистый металл. Дэви определил его плотность, изучил химические свойства, в том числе разложение воды и поглощение водорода.
В 1808 году французские химики Гей-Люссак и Л. Тенар выделили калий химическим путём - прокаливанием KOH с углём.
В 1809 году немецкий физик Л. В. Гильберт предложил название «калий» (лат. kalium , от араб. аль-кали — поташ). Это название вошло в немецкий язык, оттуда в большинство языков Северной и Восточной Европы (в том числе русский) и «победило» при выборе символа для этого элемента — K.
Нахождение в природе
Ввиду высокой химической активности калий в свободном состоянии в природе не встречается. Породообразующий элемент, входит в состав слюд, полевых шпатов и т. д. Также калий входит в состав минералов сильвина KCl, сильвинита KCl·NaCl, карналлита KCl·MgCl2·6H2O, каинита KCl·MgSO4·6H2O, а также присутствует в золе некоторых растений в виде карбоната K2CO3 (поташ). Калий входит в состав всех клеток (см. ниже раздел Биологическая роль). Кларк калия в земной коре составляет 2,4 % (5-й по распространённости металл, 7-й по содержанию в коре элемент). Средняя концентрация в морской воде — 380 мг/л .
Месторождения
Крупнейшие месторождения калия находятся на территории Канады (производитель PotashCorp), России (ПАО «Уралкалий», г. Березники, г. Соликамск, Пермский край, Верхнекамское месторождение калийных руд), Белоруссии (ПО «Беларуськалий», г. Солигорск, Старобинское месторождение калийных руд).
Получение
Калий, как и другие щелочные металлы, получают электролизом расплавленных хлоридов или щелочей. Так как хлориды имеют более высокую температуру плавления (600—650 °C), то чаще проводят электролиз расплавленных щелочей с добавкой к ним соды или поташа (до 12 %). При электролизе расплавленных хлоридов на катоде выделяется расплавленный калий, а на аноде — хлор:
K + + e − → K 2Cl − → Cl2
При электролизе гидроксида калия на катоде также выделяется расплавленный калий, а на аноде — кислород:
Вода из расплава быстро испаряется. Чтобы калий не взаимодействовал с хлором или кислородом, катод изготовляют из меди и над ним помещают медный цилиндр. Образовавшийся калий в расплавленном виде собирается в цилиндре. Анод изготовляют также в виде цилиндра из никеля (при электролизе щелочей) либо из графита (при электролизе хлоридов).
Важное промышленное значение имеют и методы термохимического восстановления:
Na + KOH → N2,380−450oC NaOH + K
и восстановление из расплава хлорида калия карбидом кальция, алюминием или кремнием.
Физические свойства
![Калий]()
Калий — серебристый металл с характерным блеском на свежеобразованной поверхности. Очень лёгок и легкоплавок. Относительно хорошо растворяется в ртути, образуя амальгамы. Будучи внесённым в пламя горелки, калий (а также его соединения) окрашивает пламя в характерный розово-фиолетовый цвет.
![Калий]()
Калий активно взаимодействует с водой. Выделяющийся водород воспламеняется, а ионы калия придают пламени фиолетовый цвет. Раствор фенолфталеина в воде становится малиновым, демонстрируя щелочную реакцию образующегося KOH
Калий образует кристаллы кубической сингонии, пространственная группа I m3m, параметры ячейки a = 0,5247 нм , Z = 2 .
Химические свойства
Элементарный калий, как и другие щелочные металлы, проявляет типичные металлические свойства и очень химически активен, является сильным восстановителем. На воздухе свежий срез быстро тускнеет из-за образования плёнок соединений (оксиды и карбонат). При длительном контакте с атмосферой способен полностью разрушиться. С водой реагирует со взрывом. Хранить его необходимо под слоем бензина, керосина или силикона, дабы исключить контакт воздуха и воды с его поверхностью. С Na, Tl, Sn, Pb, Bi калий образует интерметаллиды.
Взаимодействие с простыми веществами
Калий при комнатной температуре реагирует с кислородом воздуха, галогенами; практически не реагирует с азотом (в отличие от лития и натрия). При умеренном нагревании реагирует с водородом с образованием гидрида (200—350 °C):
с халькогенами (100—200 °C, E = S, Se, Te):
При сгорании калия на воздухе образуется надпероксид калия KO2 (с примесью K2O2):
В реакции с фосфором в инертной атмосфере образуется фосфид калия зелёного цвета (200 °C):
Взаимодействие со сложными веществами
Калий при комнатной температуре (+20 °C) активно реагирует с водой, кислотами, растворяется в жидком аммиаке (−50 °C) с образованием тёмно-синего раствора аммиаката калия.
Калий глубоко восстанавливает разбавленные серную и азотную кислоты:
При сплавлении металлического калия со щелочами он восстанавливает водород гидроксогруппы:
При умеренном нагревании реагирует с газообразным аммиаком с образованием амида (+65…+105 °C):
Металлический калий реагирует со спиртами с образованием алкоголятов:
Алкоголяты щелочных металлов (в данном случае — этилат калия) широко используются в органическом синтезе.
Соединения с кислородом
При взаимодействии калия с кислородом воздуха образуется не оксид, а пероксид и супероксид:
Оксид калия может быть получен при нагревании металла до температуры не выше 180 °C в среде, содержащей очень мало кислорода, или при нагревании смеси супероксида калия с металлическим калием:
Оксиды калия обладают ярко выраженными осно́вными свойствами, бурно реагируют с водой, кислотами и кислотными оксидами. Практического значения они не имеют. Пероксиды представляют собой желтовато-белые порошки, которые, хорошо растворяясь в воде, образуют щёлочи и пероксид водорода:
![Калий]()
Свойство обменивать углекислый газ на кислород используется в изолирующих противогазах и на подводных лодках. В качестве поглотителя используют эквимолярную смесь супероксида калия и пероксида натрия. Если смесь не эквимолярна, то в случае избытка пероксида натрия поглотится больше газа, чем выделится (при поглощении двух объёмов CO2 выделяется один объём O2), и давление в замкнутом пространстве упадёт, а в случае избытка супероксида калия (при поглощении двух объёмов CO2 выделяется три объёма O2) выделяется больше газа, чем поглотится, и давление повысится.
В случае эквимолярной смеси (Na2O2:K2O4 = 1:1) объёмы поглощаемого и выделяемого газов будут равны (при поглощении четырёх объёмов CO2 выделяется четыре объёма O2).
Пероксиды являются сильными окислителями, поэтому их применяют для отбеливания тканей в текстильной промышленности.
Получают пероксиды прокаливанием металлов на воздухе, освобождённом от углекислого газа.
Также известен озонид калия KO3, оранжево-красного цвета. Получить его можно взаимодействием гидроксида калия с озоном при температуре не выше +20 °C:
Озонид калия является очень сильным окислителем, например, окисляет элементарную серу до сульфата и дисульфата уже при +50 °C:
Гидроксид
Гидроксид калия (или едкое кали) представляет собой твёрдые белые непрозрачные, очень гигроскопичные кристаллы, плавящиеся при температуре 360 °C. Гидроксид калия относится к щелочам. Он хорошо растворяется в воде с выделением большого количества тепла. Растворимость едкого кали при +20 °C в 100 г воды составляет 112 г .
Применение
- Жидкий при комнатной температуре сплав калия и натрия используется в качестве теплоносителя в замкнутых системах, например, в атомных силовых установках на быстрых нейтронах. Кроме того, широко применяются его жидкие сплавы с рубидием и цезием. Сплав с составом 12 % натрия, 47 % калия, 41 % цезия обладает рекордно низкой температурой плавления −78 °C.
- Соединения калия — важнейший биогенный элемент и потому применяются в качестве удобрений. Калий является одним из трёх базовых элементов, которые необходимы для роста растений наряду с азотом и фосфором. В отличие от азота и фосфора, калий является основным клеточным катионом. При его недостатке у растения прежде всего нарушается структура мембран хлоропластов — клеточных органелл, в которых проходит фотосинтез. Внешне это проявляется в пожелтении и последующем отмирании листьев. При внесении калийных удобрений у растений увеличивается вегетативная масса, урожайность и устойчивость к вредителям.
- Соли калия широко используются в гальванотехнике, так как, несмотря на относительно высокую стоимость, они часто более растворимы, чем соответствующие соли натрия, и потому обеспечивают интенсивную работу электролитов при повышенной плотности тока.
Важные соединения
- Бромид калия применяется в медицине и как успокаивающее средство для нервной системы.
- Гидроксид калия (едкое кали) применяется в щелочных аккумуляторах и при сушке газов.
- Карбонат калия (поташ) используется как удобрение, при варке стекла, как кормовая добавка для птицы.
- Хлорид калия (сильвин, «калийная соль») используется как удобрение.
- Нитрат калия (калийная селитра) — удобрение, компонент чёрного пороха.
- Перхлорат и хлорат калия (бертолетова соль) используются в производстве спичек, ракетных порохов, осветительных зарядов, взрывчатых веществ, в гальванотехнике.
- Дихромат калия (хромпик) — сильный окислитель, используется для приготовления «хромовой смеси» для мытья химической посуды и при обработке кожи (дубление). Также используется для очистки ацетилена на ацетиленовых заводах от аммиака, сероводорода и фосфина.
![Калий]()
- Перманганат калия — сильный окислитель, используется как антисептическое средство в медицине и для лабораторного получения кислорода.
- Тартрат натрия-калия (сегнетова соль) в качестве пьезоэлектрика.
- Дигидрофосфат и дидейтерофосфат калия в виде монокристаллов в лазерной технике.
- Пероксид калия и супероксид калия используются для регенерации воздуха на подводных лодках и в изолирующих противогазах (поглощает углекислый газ с выделением кислорода).
- Фтороборат калия — важный флюс для пайки сталей и цветных металлов.
- Цианид калия применяется в гальванотехнике (серебрение, золочение), при добыче золота и при нитроцементации стали. Чрезвычайно ядовит, один из сильнейших ядов.
- Калий совместно с перекисью калия применяется при термохимическом разложении воды на водород и кислород (калиевый цикл «Газ де Франс», Франция).
- Сульфат калия применяется как удобрение.
Биологическая роль
Калий — важнейший биогенный элемент, особенно в растительном мире. При недостатке калия в почве растения развиваются очень плохо, уменьшается урожай, поэтому около 90 % добываемых солей калия используют в качестве удобрений.
Калий в качестве катиона наряду с катионами натрия является базовым элементом так называемого калиево-натриевого насоса клеточной мембраны, который играет важную роль в проведении нервных импульсов.
![Калий]()
Калий в организме человека
Калий содержится большей частью в клетках, до 40 раз больше, чем в межклеточном пространстве. В процессе функционирования клеток избыточный калий покидает цитоплазму, поэтому для сохранения концентрации он должен нагнетаться обратно при помощи натрий-калиевого насоса. Калий и натрий между собой функционально связаны и выполняют следующие функции:
- Создание условий для возникновения мембранного потенциала и мышечных сокращений.
- Поддержание осмотической концентрации крови.
- Поддержание кислотно-щелочного баланса.
- Нормализация водного баланса.
Рекомендуемая суточная доля калия составляет для детей от 600 до 1700 миллиграммов, для взрослых — от 1800 до 5000 миллиграммов. Потребность в калии зависит от массы тела, физической активности, физиологического состояния и климата места проживания. Рвота, продолжительные поносы, обильное потение, использование мочегонных повышают потребность организма в калии.
Основными пищевыми источниками являются бобы (в первую очередь белая фасоль), шпинат и капуста кормовая, финики, картофель, батат, сушёные абрикосы, дыня, киви, авокадо, помело, бананы, брокколи, печень, молоко, ореховое масло, цитрусовые, виноград. Калия достаточно много в рыбе и молочных продуктах.
Практически все сорта рыбы содержат более 200 мг калия на 100 г . Количество калия в разных видах рыбы различается.
Овощи, грибы и травы также содержат много калия, однако в консервированных продуктах его уровень может быть гораздо меньше. Много калия содержится в шоколаде.
Всасывание происходит в тонком кишечнике. Усвоение калия облегчает витамин B6, затрудняет — алкоголь.
При недостатке калия развивается гипокалиемия. Возникают нарушения работы сердечной и скелетной мускулатуры. Продолжительный дефицит калия может быть причиной острой невралгии.
При избытке калия развивается гиперкалиемия, для которой основным симптомом является язва тонкого кишечника. Настоящая гиперкалиемия может вызвать остановку сердца.
Изотопы
Природный калий состоит из трёх изотопов. Два из них стабильны: 39 K (изотопная распространённость 93,258 %) и 41 K (6,730 %). Третий изотоп 40 K (0,0117 %) является бета-активным с периодом полураспада 1,251 миллиарда лет. Сравнительно малый период полураспада и большая распространённость калия по сравнению с ураном и торием означает, что на Земле ещё 2 млрд лет назад и ранее калий-40 вносил главный вклад в естественный радиационный фон. В каждом грамме природного калия в секунду распадается в среднем 31,0±0,3 ядра 40 K, благодаря чему, например, в организме человека массой 70 кг ежесекундно происходит около 4000 радиоактивных распадов. Поэтому легкодоступные в быту соединения калия (поташ, хлорид калия, калийная селитра и т. д.) можно использовать как пробные радиоактивные источники для проверки бытовых дозиметров. 40 K наряду с ураном и торием считается одним из основных источников геотермальной энергии, выделяемой в недрах Земли (полная скорость энерговыделения оценивается в 40—44 ТВт ). В минералах, содержащих калий, постепенно накапливается 40 Ar, один из продуктов распада калия-40, что позволяет измерять возраст горных пород; калий-аргоновый метод является одним из основных методов ядерной геохронологии.
Один из искусственных изотопов — 37 K, — с временем полураспада 1,23651 секунды, применяется в экспериментах по изучению Стандартной модели слабого взаимодействия.
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu,
Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, H2,
W, Sb, Bi, Ge, Re, Cu, Tc, Te, Rh, Po, Hg, Ag, Pd, Os, Ir, Pt, AuЛитий
Li
Атомный номер: 3
Атомная масса: 6,941
Темп. плавления: 453,85 К
Темп. кипения: 1615 К
Плотность: 0,534 г/см³
Электроотрицательность: 0,98Натрий
Na
Атомный номер: 11
Атомная масса: 22,98976928
Темп. плавления: 371,15 К
Темп. кипения: 1156 К
Плотность: 0,97 г/см³
Электроотрицательность: 0,96Калий
K
Атомный номер: 19
Атомная масса: 39,0983
Темп. плавления: 336,58 К
Темп. кипения: 1032 К
Плотность: 0,86 г/см³
Электроотрицательность: 0,82Рубидий
Rb
Атомный номер: 37
Атомная масса: 85,4678
Темп. плавления: 312,79 К
Темп. кипения: 961 К
Плотность: 1,53 г/см³
Электроотрицательность: 0,82Цезий
Cs
Атомный номер: 55
Атомная масса: 132,9054519
Темп. плавления: 301,59 К
Темп. кипения: 944 К
Плотность: 1,93 г/см³
Электроотрицательность: 0,79Франций
Fr
Атомный номер: 87
Атомная масса: (223)
Темп. плавления: ~300 К
Темп. кипения: ~950 К
Плотность: 1,87 г/см³
Электроотрицательность: 0,7Калий — элемент главной подгруппы первой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 19. Обозначается символом K (лат. Kalium). Простое вещество калий (CAS-номер: 7440-09-7) — мягкий щелочной металл серебристо-белого цвета. В природе калий встречается только в соединениях с другими элементами, например, в морской воде, а также во многих минералах. Он очень быстро окисляется на воздухе и очень легко вступает в химические реакции, особенно с водой, образуя щёлочь. Во многих отношениях химические свойства калия очень близки к натрию, но с точки зрения биологической функции и использования их клетками живых организмов они все же отличаются. История и происхождение названия калий
Калий (точнее, его соединения) использовался с давних времён. Так, производство поташа (который применялся как моющее средство) существовало уже в XI веке. Золу, образующуюся при сжигании соломы или древесины, обрабатывали водой, а полученный раствор (щёлок) после фильтрования выпаривали. Сухой остаток, помимо карбоната калия, содержал сульфат калия K2SO4, соду и хлорид калия KCl.
В 1807 году английский химик Дэви электролизом твёрдого едкого кали (KOH) выделил калий и назвал его «потассий» (лат. potassium ; это название до сих пор употребительно в английском, французском, испанском, португальском и польском языках). В 1809 году Л. В. Гильберт предложил название «калий» (лат. kalium , от араб. аль-кали — поташ). Это название вошло в немецкий язык, оттуда в большинство языков Северной и Восточной Европы (в том числе русский) и «победило» при выборе символа для этого элемента — K.
Присутствие в природе калия
В свободном состоянии не встречается. Калий входит в состав сильвинита KCl·NaCl, карналлита KCl·MgCl2·6H2O, каинита KCl·MgSO4·6H2O, а также присутствует в золе некоторых растений в виде карбоната K2CO3 (поташ). Калий входит в состав всех клеток (см. ниже раздел Биологическая роль).
Калий — получение калия
Калий, как и другие щелочные металлы, получают электролизом расплавленных хлоридов или щелочей. Так как хлориды имеют более высокую температуру плавления (600—650 °C), то чаще проводят электролиз расправленных щелочей с добавкой к ним соды или поташа (до 12 %). При электролизе расплавленных хлоридов на катоде выделяется расплавленный калий, а на аноде — хлор:
K + + e − → K
2Cl − − 2e − → Cl2При электролизе щелочей на катоде также выделяется расплавленный калий, а на аноде — кислород:
4OH − − 4e − → 2H2O + O2Физические свойства калия
Калий — серебристое вещество с характерным блеском на свежеобразованной поверхности. Очень лёгок и легкоплавок. Относительно хорошо растворяется в ртути, образуя амальгамы. Будучи внесённым в пламя горелки калий (а также его соединения) окрашивает пламя в характерный розово-фиолетовый цвет.
Химические свойства калия
Калий, как и другие щелочные металлы, проявляет типичные металлические свойства и очень химически активен, легко отдаёт электроны.
Является сильным восстановителем. Он настолько активно соединяется с кислородом, что образуется не оксид, а супероксид калия KO2 (или K2O4). При нагревании в атмосфере водорода образуется гидрид калия KH. Хорошо взаимодействует со всеми неметаллами, образуя галогениды, сульфиды, нитриды, фосфиды и т. д., а также со сложными веществами, такими как вода (реакция проходит со взрывом), различные оксиды и соли. В этом случае они восстанавливают другие металлы до свободного состояния.
Калий хранят под слоем керосина.
Оксиды калия и пероксиды калия
Оксиды калия обладают ярко выраженными основными свойствами, бурно реагируют с водой, кислотами и кислотными оксидами. Практического значения они не имеют. Пероксиды представляют собой желтовато-белые порошки, которые, хорошо растворяясь в воде, образуют щёлочи и пероксид водорода:
Гидроксиды калия
Гидроксид калия (или едкое кали) представляет собой твёрдые белые непрозрачные, очень гигроскопичные кристаллы, плавящиеся при температуре 360 °C. Гидроксид калия относится к щелочам. Он хорошо растворяется в воде с выделением большого количества тепла. Растворимость едкого калия при 20 °C в 100 г воды составляет 112 г.
Применение калия
- Жидкий при комнатной температуре сплав калия и натрия используется в качестве теплоносителя в замкнутых системах, например, в атомных силовых установках на быстрых нейтронах. Кроме того, широко применяются его жидкие сплавы с рубидием и цезием. Сплав состава натрий 12 %, калий 47 %, цезий 41 % обладает рекордно низкой температурой плавления −78 °C.
- Соединения калия — важнейший биогенный элемент и потому применяются в качестве удобрений.
- Соли калия широко используются в гальванотехнике, так как, несмотря на относительно высокую стоимость, они часто более растворимы, чем соответствующие соли натрия, и потому обеспечивают интенсивную работу электролитов при повышенной плотности тока.
![]()
- Бромид калия — применяется в медицине и как успокаивающее средство для нервной системы.
- Гидроксид калия (едкое кали) — применяется в щелочных аккумуляторах и при сушке газов.
- Карбонат калия (поташ) — используется как удобрение, при варке стекла.
- Хлорид калия (сильвин, «калийная соль») — используется как удобрение.
- Нитрат калия (калийная селитра) — удобрение, компонент чёрного пороха.
- Перхлорат и хлорат калия (бертолетова соль) используются в производстве спичек, ракетных порохов, осветительных зарядов, взрывчатых веществ, в гальванотехнике.
- Дихромат калия (хромпик) — сильный окислитель, используется для приготовления «хромовой смеси» для мытья химической посуды и при обработке кожи (дубление). Также используется для очистки ацетилена на ацетиленовых заводах от аммиака, сероводорода и фосфина.
- Перманганат калия — сильный окислитель, используется как антисептическое средство в медицине и для лабораторного получения кислорода.
- Тартрат натрия-калия (сегнетова соль) в качестве пьезоэлектрика.
- Дигидрофосфат и дидейтерофосфат калия в виде монокристаллов в лазерной технике.
- Пероксид калия и супероксид калия используются для регенерации воздуха на подводных лодках и в изолирующих противогазах (поглощает углекислый газ с выделением кислорода).
- Фтороборат калия — важный флюс для пайки сталей и цветных металлов.
- Цианид калия применяется в гальванотехнике (серебрение, золочение), при добыче золота и при нитроцементации стали.
- Калий совместно с перекисью калия применяется при термохимическом разложении воды на водород и кислород (калиевый цикл «Газ де Франс», Франция).
Биологическая роль
Калий содержится большей частью в клетках, до 40 раз больше чем в межклеточном пространстве. В процессе функционирования клеток избыточный калий покидает цитоплазму, поэтому для сохранения концентрации он должен нагнетаться обратно при помощи натрий-калиевого насоса.
- Создание условий для возникновения мембранного потенциала и мышечных сокращений.
- Поддержание осмотической концентрации крови.
- Поддержание кислотно-щелочного баланса.
- Нормализация водного баланса.
- Обеспечение мембранного транспорта.
- Активация различных ферментов.
- Нормализация ритма сердца.
Рекомендуемая суточная доля калия составляет для детей от 600 до 1700 миллиграмм, для взрослых от 1800 до 5000 миллиграмм. Потребность в калии зависит от общего веса тела, физической активности, физиологического состояния, и климата места проживания. Рвота, продолжительные поносы, обильное потение, использование мочегонных повышают потребность организма в калии.
Основными пищевыми источниками являются сушёные абрикосы, дыня, бобы, киви, картофель, авокадо, бананы, брокколи, печень, молоко, ореховое масло, цитрусовые, виноград. Калия достаточно много в рыбе и молочных продуктах.
Всасывание происходит в тонком кишечнике. Усвоение калия облегчает витамин В6, затрудняет — алкоголь.
При переизбытке калия развивается гиперкалиемия, для которой основным симптомом является язва тонкого кишечника. Настоящая гиперкалиемия может вызвать остановку сердца.
Изотопы
Природный калий состоит из трёх изотопов. Два из них стабильны: 39 K (изотопная распространённость 93,258 %) и 41 K (6,730 %). Третий изотоп 40 K (0,0117 %) является бета-активным с периодом полураспада 1,251×10 9 лет. В каждом грамме природного калия в секунду распадается в среднем 32 ядра 40 K, благодаря чему, например, в организме человека весом 70 кг ежесекундно происходит около 4000 радиоактивных распадов. 40 K считается одним из основных источников геотермальной энергии, выделяемой в недрах Земли (мощность оценивается в 44 ТВт). В минералах, содержащих калий, постепенно накапливается 40 Ar, один из продуктов распада калия-40, что позволяет измерять возраст горных пород; калий-аргоновый метод является одним из основных методов ядерной геохронологии.
Калий - характеристика химического элемента и основные свойства
Человеческий мозг непрерывно обучается. Нет разницы, чем мы занимаемся и какие конкретно действия повторяем день изо дня. Для прочного закрепления привычки требуется постоянное повторение и мозг обязательно обучится новому, даже претерпит изменения в своём физическом теле. Когда-то учёные начали узнавать наш мир. Они составляли причинно-следственные связи и удивлялись, открывая новые законы природы. Так, одной из задач для учёных стала тайна элемента калий — химический элемент, который важен для живых существ.
- История открытия
- Калий в природе
- Способы получения
- Физические свойства
- Химические характеристики
- Сфера применения
![Химический элемент калий]()
История открытия
Атомный номер калия 19, что указывает на его расположение в химической таблице Менделеева.
Примерная молярная масса 39,1 г/моль.
Электронная конфигурация калия 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1
![Атомный номер калия 19]()
Единственная возможная степень окисления +1 (плюс один).
На внешнем энергетическом уровне имеется всего 1 электрон. Это значит, что максимальная валентность элемента 1.
Кристаллическая решётка простого вещества кубическая объёмно-центрированная.
В 1807 году английский химик Х. Дэви опытным путём получил потассий (латинское название — потассиум). Именно так изначально был назван калий. Проводя электролиз каустической воды и расплавов поташа, учёный заметил образование мягкого легкоплавкого металла. Такое достижение подтолкнуло его к новым открытиям и он стал изучать химические и физические свойства нового вещества.
Такая сенсация потрясла весь научный мир и зарубежные коллеги решили не оставаться в стороне. Уже через 2 года британский эксперт Л. В. Гилберт предложил название «Аль-кали», что в переводе с арабского означает «зола растений». И это не удивительно, ведь золу, которая оставалась после сжигания растений, обрабатывали водой, а полученную смесь выпаривали до сухого остатка. В далёкие времена это использовали как моющее средство. В 1831 году немецкий физик Г. И. Гесс, изучавший свойства нового вещества, предложил своё название для элемента, который также называли «Аль-калий».
![Калий в природе]()
После многолетних поисков выяснилось, что в природе калий не находится в чистом виде. Он один из десяти элементов, которые составляют большую часть окружающего мира.
Калий — неотъемлемый элемент в составе клеток живых организмов. Также большое количество содержится в минералах и морской воде. Минералы, формулы которых могут «похвастаться» большим содержанием этого элемента:
- Сильвинита KCl·NaCl.
- Карналлита KCl·MgCl 2 ·6H 2 O.
- Каинита KCl·MgSO 4 ·6H 2 O.
- Зола растений как поташ K 2 CO 3.
Способы получения
Современные условия позволяют учёным получать калий несколькими способами.
Уравнение взаимодействия с жидким натрием расплавленного основания при 380−450°C или хлорида при 760- 890 °C: Na + KOH = NaOH + K
Электролиз расплава хлорида в смеси с карбонатом калия при температуре около 700 °C:
Легкоплавкий металл серебристого цвета. При надрезе быстро образует оксидную плёнку после нескольких секунд контакта с кислородом, что объясняет требования особых условий содержания в помещениях. Хранится только в посуде с керосином, силиконами или бензином. Обладает хорошей растворимостью при соединении со ртутью. Образует амальгамы.
На соединение с водой реагирует взрывом. При поднесении горелки окрашивает пламя в розово-фиолетовый цвет.
Химические характеристики
![Свойства калия]()
Калий имеет много общего с натрием. Это обусловлено их расположением в периодической таблице химических элементов Д. И. Менделеева. Оба элемента — щелочные металлы, которые ярко выражают свои свойства. Однако у потассия металлические свойства проявляются сильнее, чем у натрия и кальция, но слабее, чем у рубидия.
Калию свойственно проявлять такие характеристики, которые делают его незаменимым для химической промышленности:
- Химически активен.
- Легко отдаёт электроны.
- Сильный восстановитель.
Оксиды или пероксиды
![Сфера применения калия]()
При взаимодействии с кислородом образует не оксид, а пероксид или супероксид, что заметно невооружённым глазом (очень быстро образует оксидную плёнку на поверхности).
Может образовать оксид только лишь при медленном нагревании до температуры меньше 180 °C при низком содержании кислорода в окружающей среде.
Оксиды ярко проявляют основные свойства. Как и сам металл, бурно реагируют с водой, кислотными оксидами и самими кислотами. Практического применения в промышленности они не нашли, используются для обучения в университетах.
Пероксиды — белые порошки с жёлтым тоном. Хорошо растворяются в воде, образуя щёлочи и пероксид водорода.
Сильные окислители, поэтому обрели популярность в текстильной промышленности как отбеливающее средство.
Гидроксиды калия и натрия имеют особые названия: едкий кали и едкий натри. Белые, твёрдые, непрозрачные вещества. Очень гигроскопичны, это значит, что быстро впитывают влагу и требуют особого внимания при работе с ними. Лаборанту необходимо надевать перчатки и защитные очки, иначе получит сильный ожог и раздражение слизистых оболочек. Кристаллы плавятся при температуре 360 °C. Гидроксиды относят к щелочам, они быстро растворяются в воде, выделяя большое количество тепла.
Сфера применения
![Как используется калий]()
Соединения калия используют в качестве удобрений, что свидетельствует о его ценных биологических характеристиках. Один из важнейших компонентов биосистемы вместе с азотом и фосфором. Помимо этого, необходим обмен элемента в натриево-калиевом насосе клетки любого живого организма.
Большую популярность приобрел в гальванотехнике. Соли металла быстро растворяются, по сравнению с солями натрия. Это свойство позволяет устанавливать высокие цены компаниям, которые занимаются обработкой калия.
Жидкий сплав калия и натрия используется в качестве теплоносителей в атомных установках. Необходимое условие: комнатная температура.
Особые соединения калия
![Соединение калия]()
Бромид используется в фармацевтике для изготовления успокоительных лекарств.
Карбонат, хлорид и нитрат пользуются популярностью у садоводов, так как представляют собой удобрения, обогащённые большим количеством полезных микроэлементов.
Перманганат применяется в химических лабораториях для получения кислорода, а также ранее широко применялся в быту благодаря своим антисептическим свойствам.
Пероксид и супероксид обеспечивают регенерацию воздуха на подводных лодках и противогазах, благодаря своей способности поглощать углекислый газ и выделять кислород.
![Калий в организме]()
Из описания характеристик калия с другими элементами становится понятно, что это крайне важная составляющая организма, которая должны взаимодействовать с другими металлами и неметаллами, чтобы обеспечить гармоничный рост и развитие организма. Норма потребления этого элемента для человека — 2040 мг в сутки.
Роль этого металла и реакций организма, в которых он принимает участие, имеют большое значение для строения клеток, из которых состоит любой живой организм. Благодаря образованию различных химических связей, калий помог человечеству добиться новых вершин в кораблестроении, садоводстве, фармацевтической промышленности.
Повсеместное нахождение в природе позволяет добывать металл и его соединения беспрерывно, а благодаря успехам учёных в области химии возможно регулировать плотность содержания калия в препаратах. При соблюдении правильных пропорций и составлении схем алгоритмов можно предугадать пользу или вред.
Калий может быть полезным, но также он способен обрекать людей на тяжкие мучения, такие как: ожоги рук, раздражение слизистых оболочек. Об этом следует помнить всем, кто стремится узнать больше о свойствах этого металла. Прежде чем начинать работу с опасными веществами, лучше узнать всё о многолетнем опыте предшественников, чтобы избежать печальных и необратимых последствий.
Читайте также: