Графит кристаллическая решетка металлическая
Углерод — химический элемент № \(6\). Он расположен в IVА группе втором периоде Периодической системы.
На внешнем слое атома углерода содержатся четыре валентных электрона, и до его завершения не хватает четырёх электронов. Поэтому в соединениях с металлами углероду характерна степень окисления \(–4\), а при взаимодействии с более электроотрицательными неметаллами он проявляет положительные степени окисления: \( +2\) или \(+4\).
В природе углерод встречается как в виде простых веществ, так и в виде соединений. В воздухе содержится углекислый газ . В земной коре распространены карбонаты (например, Ca CO 3 образует мел, мрамор, известняк). Горючие ископаемые (уголь, торф, нефть, природный газ) состоят из органических соединений , главным элементом которых является углерод.
Углерод относится к жизненно важным элементам, так как входит в состав молекул всех органических веществ.
Существует несколько аллотропных видоизменений, образованных атомами углерода. Наиболее распространены алмаз и графит .
Алмаз имеет атомную кристаллическую решётку. Каждый атом углерода в алмазе связан четырьмя прочными ковалентными связями с соседними атомами, расположенными в вершинах тетраэдра.

Благодаря такому строению алмаз — самое твёрдое из известных природных веществ. Все четыре валентных электрона каждого атома углерода участвуют в образовании связей, поэтому алмаз не проводит электрический ток. Это бесцветное прозрачное кристаллическое вещество, хорошо преломляющее свет.
Графит тоже имеет атомную кристаллическую решётку, но устроена она иначе. Решётка графита слоистая. Каждый атом углерода соединён прочными ковалентными связями с тремя соседними атомами. Образуются плоские слои из шестиугольников, которые между собой связаны слабо. Один валентный электрон у атома углерода остаётся свободным.

Графит представляет собой тёмно-серое вещество с металлическим блеском, жирное на ощупь. В отличие от алмаза графит непрозрачный, проводит электрический ток и оставляет серый след на бумаге. У графита очень высокая температура плавления (\(3700\) °С).

Алмаз и графит взаимопревращаемы. При сильном нагревании без доступа воздуха алмаз чернеет и превращается в графит. Графит можно превратить в алмаз при высокой температуре и большом давлении.
Из мельчайших частиц графита состоят сажа , древесный уголь и кокс . Сажа образуется при неполном сгорании топлива. Древесный уголь получают при нагревании древесины без доступа воздуха, а кокс — переработкой каменного угля.
Древесный уголь имеет пористое строение и обладает способностью поглощать газы и растворённые вещества. Такое свойство называется адсорбцией .

Аллотропные модификации углерода в химических реакциях могут проявлять и окислительные , и восстановительные свойства. Окислительные свойства углерода выражены слабее, чем у других неметаллов второго периода (азота, кислорода и фтора).
Углерод горит в кислороде с образованием углекислого газа и проявляет в этой реакции восстановительные свойства:
Графит

Графит — минерал из класса самородных элементов, одна из аллотропных модификаций углерода. Распространенный в природе минерал. Встречается обычно в виде отдельных чешуек, пластинок и скоплений, разных по величине и содержанию графита. Различают месторождения кристаллического графита, связанного с магматическими горными породами или кристаллическими сланцами, и скрытокристаллического графита, образовавшегося при метаморфизме углей.

СТРУКТУРА

Гексагональная кристаллическая полиморфная (аллотропная) модификация чистого углерода, наиболее устойчивая в условиях земной коры. Слои кристаллической решетки могут по-разному располагаться относительно друг друга, образуя целый ряд политипов, с симметрией от гексагональной сингонии (дигексагонально-дипирамидальный вид симметрии), до тригональной (дитригонально-скаленоэдрический в.с.). Кристаллическая решетка графита – слоистого типа. В слоях атомы С расположены в узлах гексагональных ячеек слоя. Каждый атом С окружен тремя соседними с расстоянием 1,42Α
Различают две модификации графита: α-графит (гексагональный P63/mmc) и β-графит (ромбоэдрический R(-3)m). Различаются упаковкой слоёв. У α-графита половина атомов каждого слоя располагается над и под центрами шестиугольника (укладка …АВАВАВА…), а у β-графита каждый четвёртый слой повторяет первый. Ромбоэдрический графит удобно представлять в гексагональных осях, чтобы показать его слоистую структуру.
β-графит в чистом виде не наблюдается, так как является метастабильной фазой. Однако, в природных графитах содержание ромбоэдрической фазы может достигать 30 %. При температуре 2500-3300 К ромбоэдрический графит полностью переходит в гексагональный.
СВОЙСТВА

Хорошо проводит электрический ток. В отличие от алмаза обладает низкой твёрдостью (1 по шкале Мооса). Относительно мягкий. После воздействия высоких температур становится немного твёрже, и становится очень хрупким. Плотность 2,08—2,23 г/см³. Цвет тёмно-серый, блеск металлический. Неплавкий, устойчив при нагревании в отсутствие воздуха. Жирный (скользкий) на ощупь. Природный графит содержит 10—12 % примесей глин и окислов железа. При трении расслаивается на отдельные чешуйки (это свойство используется в карандашах).
Теплопроводность графита от 278,4 до 2435 Вт/(м*К), зависит от марки графита, от направления относительно базисных плоскостей и от температуры.
Электрическая проводимость монокристаллов графита анизотропна, в направлении, параллельном базисной плоскости, близка к металлической, в перпендикулярном — в сотни раз меньше. Минимальное значение проводимости наблюдается в интервале 300—1300 К, причём положение минимума смещается в область низких температур для совершенных кристаллических структур. Наивысшую электрическую проводимость имеет рекристаллизованный графит.
Коэффициент теплового расширения графита до 700 К отрицателен в направлении базисных плоскостей (графит сжимается при нагревании), его абсолютное значение с повышением температуры уменьшается. Выше 700 К коэффициент теплового расширения становится положительным. В направлении, перпендикулярном базисным плоскостям, коэффициент теплового расширения положителен, практически не зависит от температуры и более чем в 20 раз выше среднего абсолютного значения для базисных плоскостей.
Монокристаллы графита диамагнитны, магнитная восприимчивость незначительна в базисной плоскости и велика в ортогональных базисным плоскостях. Коэффициента Холла меняется с положительного на отрицательный при 2400 К.
МОРФОЛОГИЯ

Хорошо образованные кристаллы редки. Кристаллы пластинчатые, чешуйчатые, кривогранные, обычно имеют пластинчатую несовершенную форму. Чаще бывает представлен листочками без кристаллографических очертаний и их агрегатами. Образует сплошные скрытокристаллические, листоватые или округлые радиально-лучистые агрегаты, реже – сферолитовые агрегаты концентрически-зонального строения. У крупнокристаллических выделений часто наблюдается треугольная штриховка на плоскостях (0001).
ПРОИСХОЖДЕНИЕ

Образуется при высокой температуре в вулканических и магматических горных породах, в пегматитах и скарнах. Встречается в кварцевых жилах с вольфрамитом и др. минералами в среднетемпературных гидротермальных полиметаллических месторождениях. Широко распространён в метаморфических породах – кристаллических сланцах, гнейсах, мраморах. Крупные залежи образуются в результате пиролиза каменного угля под воздействием траппов на каменноугольные отложения (Тунгусский бассейн). Акцессорный минерал метеоритов.
Сопутствующие минералы: кварц, пирит, гранаты, шпинель.
ПРИМЕНЕНИЕ

Для изготовления плавильных тиглей, футеровочных плит — применение основано на высокой температурной стойкости графита (в отсутствие кислорода), на его химической стойкости к целому ряду расплавленных металлов.
Применяется в электродах, нагревательных элементах — благодаря высокой электропроводности и химической стойкости к практически любым агрессивным водным растворам (намного выше, чем у благородных металлов).
Для получения химически активных металлов методом электролиза расплавленных соединений, твёрдых смазочных материалов, в комбинированных жидких и пастообразных смазках, наполнитель пластмасс.
Является замедлителем нейтронов в ядерных реакторах, компонентом состава для изготовления стержней для чёрных графитовых карандашей (в смеси с каолином).
Используется для получения синтетических алмазов, в качестве эталона длины нанометрового диапазона для калибровки сканеров сканирующего туннельного микроскопа и атомно-силового микроскопа, для изготовления контактных щёток и токосъёмников для разнообразных электрических машин, электротранспорта и мостовых подъёмных кранов с троллейным питанием, мощных реостатов, а также прочих устройств, где требуется надёжный подвижный электрический контакт, для изготовления тепловой защиты носовой части боеголовок баллистических ракет и возвращаемых космических аппаратов.
Кристаллическая решетка и структура графита
Графит (от др.-греч. γράφω — пишу) – это природный материал, относящийся к классу самородных элементов, аллотропная модификация углерода. Он имеет слоистую структуру. Каждый слой кристаллической решетки графита может по-разному располагаться по отношению друг к другу, образуя политипы.

Графит находит свое применение в производственной и промышленной деятельности. Графитовые изделия отличаются повышенными эксплуатационными характеристиками. Графит устойчив к химическим и природным воздействиям, он достаточно прочный, хорошо проводит электрический ток, отличается низкой твердостью, относительной мягкостью, после воздействия высоких температур затвердевает.
Плотность составляет 2.23 г/см 3 . Графит имеет металлический блеск и темно-серый цвет. Теплопроводность этого минерала достаточно большая, поэтому его используют для изготовления комплектующих деталей электрооборудования.
Различают месторождения кристаллического графита, связанного с магматическими горными породами или кристаллическими сланцами, и скрытокристаллического графита, образовавшегося при метаморфизме углей.
Структура графита

Гексагональная кристаллическая полиморфная (аллотропная) модификация чистого углерода, наиболее устойчивая в условиях земной коры.
Слои кристаллической решетки могут по-разному располагаться относительно друг друга, образуя целый ряд политипов, с симметрией от гексагональной сингонии (дигексагонально-дипирамидальный вид симметрии), до тригональной (дитригонально-скаленоэдрический в.с.). Кристаллическая решетка графита — слоистого типа.
В слоях атомы С расположены в узлах гексагональных ячеек слоя. Каждый атом С окружен тремя соседними с расстоянием 1,42Α

Хорошо проводит электрический ток. В отличие от алмаза обладает низкой твёрдостью (1 по шкале Мооса). Относительно мягкий. После воздействия высоких температур становится немного твёрже, и становится очень хрупким. Плотность 2,08—2,23 г/см³.
Цвет тёмно-серый, блеск металлический. Неплавкий, устойчив при нагревании в отсутствие воздуха. Жирный (скользкий) на ощупь. Природный графит содержит 10—12 % примесей глин и окислов железа. При трении расслаивается на отдельные чешуйки (это свойство используется в карандашах).
Электрическая проводимость монокристаллов графита анизотропна, в направлении, параллельном базисной плоскости, близка к металлической, в перпендикулярном — в сотни раз меньше.
Минимальное значение проводимости наблюдается в интервале 300—1300 К, причём положение минимума смещается в область низких температур для совершенных кристаллических структур. Наивысшую электрическую проводимость имеет рекристаллизованный графит.
Коэффициент теплового расширения графита до 700 К отрицателен в направлении базисных плоскостей (графит сжимается при нагревании), его абсолютное значение с повышением температуры уменьшается. Выше 700 К коэффициент теплового расширения становится положительным.
В направлении, перпендикулярном базисным плоскостям, коэффициент теплового расширения положителен, практически не зависит от температуры и более чем в 20 раз выше среднего абсолютного значения для базисных плоскостей.
Монокристаллы графита диамагнитны, магнитная восприимчивость незначительна в базисной плоскости и велика в ортогональных базисным плоскостях. Коэффициента Холла меняется с положительного на отрицательный при 2400 К.

Хорошо образованные кристаллы редки. Кристаллы пластинчатые, чешуйчатые, кривогранные, обычно имеют пластинчатую несовершенную форму. Чаще бывает представлен листочками без кристаллографических очертаний и их агрегатами.
Образует сплошные скрытокристаллические, листоватые или округлые радиально-лучистые агрегаты, реже — сферолитовые агрегаты концентрически-зонального строения. У крупнокристаллических выделений часто наблюдается треугольная штриховка на плоскостях (0001).

Образуется при высокой температуре в вулканических и магматических горных породах, в пегматитах и скарнах. Встречается в кварцевых жилах с вольфрамитом и др. минералами в среднетемпературных гидротермальных полиметаллических месторождениях.
Широко распространён в метаморфических породах — кристаллических сланцах, гнейсах, мраморах. Крупные залежи образуются в результате пиролиза каменного угля под воздействием траппов на каменноугольные отложения (Тунгусский бассейн). Акцессорный минерал метеоритов. Сопутствующие минералы: кварц, пирит, гранаты, шпинель.

Для изготовления плавильных тиглей, футеровочных плит — применение основано на высокой температурной стойкости графита (в отсутствие кислорода), на его химической стойкости к целому ряду расплавленных металлов.
Применяется в электродах, нагревательных элементах — благодаря высокой электропроводности и химической стойкости к практически любым агрессивным водным растворам (намного выше, чем у благородных металлов).
Для получения химически активных металлов методом электролиза расплавленных соединений, твёрдых смазочных материалов, в комбинированных жидких и пастообразных смазках, наполнитель пластмасс.
Является замедлителем нейтронов в ядерных реакторах, компонентом состава для изготовления стержней для чёрных графитовых карандашей (в смеси с каолином).
Используется для получения синтетических алмазов, в качестве эталона длины нанометрового диапазона для калибровки сканеров сканирующего туннельного микроскопа и атомно-силового микроскопа, для изготовления контактных щёток и токосъёмников для разнообразных электрических машин, электротранспорта и мостовых подъёмных кранов с троллейным питанием, мощных реостатов.
А также прочих устройств, где требуется надёжный подвижный электрический контакт, для изготовления тепловой защиты носовой части боеголовок баллистических ракет и возвращаемых космических аппаратов.
Таблица типов кристаллических решёток: йода, алмаза, графита, натрия

Графит — минерал из класса самородных элементов, одна из аллотропных модификаций углерода. Минерал широко распространен в природе. Обычно встречается в виде единичных чешуек, пластинок и кластеров, различающихся по размеру и содержанию графита. Есть месторождения кристаллического графита, связанные с магматическими породами или кристаллическими сланцами, а также скрытокристаллический графит, образовавшийся во время метаморфизма углей.
- Структура
- Имущество
- Морфология
- Источник
- Заявка
- Классификация
- Физические свойства
- Оптические свойства
- Кристаллографические свойства
Агат — цена и лечебно-магические свойства
Физические свойства и структура алмаза

Полиморфная (аллотропная) гексагональная кристаллическая модификация чистого углерода, наиболее устойчивая в условиях земной коры. Слои кристаллической решетки могут быть расположены по-разному, образуя множество политипов, с симметрией от гексагональной системы (гексагонально-дипирамидальная симметрия) до тригональной (wc ди-тригонально-скаленоэдрической). Кристаллическая решетка графита стратифицированного типа. В слоях атомы C находятся в узлах гексагональных ячеек слоя. Каждый атом C окружен тремя соседями на расстоянии 1,42Α
Существует две модификации графита: α-графит (гексагональный P63 / mmc) и β-графит (ромбоэдрический R (-3) m). Отличаются они упаковкой слоев. В α-графите половина атомов каждого слоя находится выше и ниже центров шестиугольника (набор… ABABAB…), а в β-графите каждый четвертый слой повторяет первый. Ромбоэдрический графит удобно изобразить в гексагональных осях, чтобы показать его слоистую структуру.
β-графит в чистом виде не наблюдается, так как это метастабильная фаза. Однако в природных графитах содержание ромбоэдрической фазы может достигать 30%. При температуре 2500-3300 К ромбоэдрический графит полностью переходит в гексагональный.
Химия — удивительная наука. Столько невероятного можно обнаружить в, казалось бы, обычных вещах.
Всё материальное, что окружают нас повсюду, существует в нескольких агрегатных состояниях: газы, жидкости и твёрдые тела. Учёные выделили ещё и 4-е — плазму. При определённой температуре какое-либо вещество может переходить из одного состояние в другое. Например, вода: при нагревании свыше 100, из жидкой формы, превращается в пар. При температуре ниже 0 переходит в следующее агрегатную структуру — лёд.
Весь материальный мир имеет в своём составе массу одинаковых частиц, которые между собой связаны. Эти мельчайшие элементы строго выстраиваются в пространстве и образуют так называемый пространственный каркас.
Это интересно: анионы и катионы в химии, таблица растворимости.

Коэффициент теплопроводности графита от 278,4 до 2435 Вт / (м * К) зависит от марки графита, от направления относительно базисных плоскостей и от температуры.
Электропроводность монокристаллов графита анизотропна, в направлении, параллельном базисной плоскости, близка к металлической, в перпендикулярной — в сотни раз ниже. Минимальное значение проводимости наблюдается в диапазоне 300-1300 К, а положение минимума смещено в низкотемпературную область для идеальных кристаллических структур. Рекристаллизованный графит имеет самую высокую электропроводность.
Коэффициент теплового расширения графита до 700 К отрицателен в направлении базисных плоскостей (графит сжимается при нагревании), его абсолютное значение уменьшается с повышением температуры. Выше 700 К коэффициент теплового расширения становится положительным. В направлении, перпендикулярном базисным плоскостям, коэффициент теплового расширения положительный, практически не зависит от температуры и более чем в 20 раз превышает абсолютное среднее значение для базальных плоскостей.
Монокристаллы графита диамагнитны, магнитная восприимчивость незначительна в базисной плоскости и высока в ортогональных базисных плоскостях. Коэффициент Холла изменяется с положительного на отрицательный при 2400 К.
Графит атомная кристаллическая решетка какая
В приведённой ниже таблице перечислены характерные свойства веществ с атомной и ионной кристаллическими решётками.
Характерные свойства веществ
— твёрдые при обычных условиях;
— в расплавах и растворах проводят электрический ток
| С атомной кристаллической решёткой | С ионной кристаллической решёткой |
Используя данную информацию, определите, какую кристаллическую решётку имеет:
1) хлорид кальция
Запишите ответ в отведённом месте:
1) Хлорид кальция имеет
Хлорид кальция — вещество с ионной химической связью, тугоплавкое (Т пл = 772 °C), проводит электрический ток — имеет ионную кристаллическую решётку.
Графит — вещество с ковалентной неполярной химической связью, нелетучее, твёрдое — имеет атомную кристаллическую решётку.
Ответ: Хлорид кальция — ионная кристаллическая решётка, графит — атомная кристаллическая решётка.

Хорошо сформированные кристаллы встречаются редко. Кристаллы пластинчатые, чешуйчатые, изогнутые, обычно несовершенной пластинчатой формы. Чаще всего это листья без кристаллографических очертаний и их агрегаты. Образует сплошные радиально-радиальные агрегаты скрытокристаллические, листовые или округлые, реже — сферулитовые агрегаты концентрически-зонального строения. В крупнокристаллических осадках часто наблюдается треугольная штриховка на плоскостях (0001).
Металлический тип
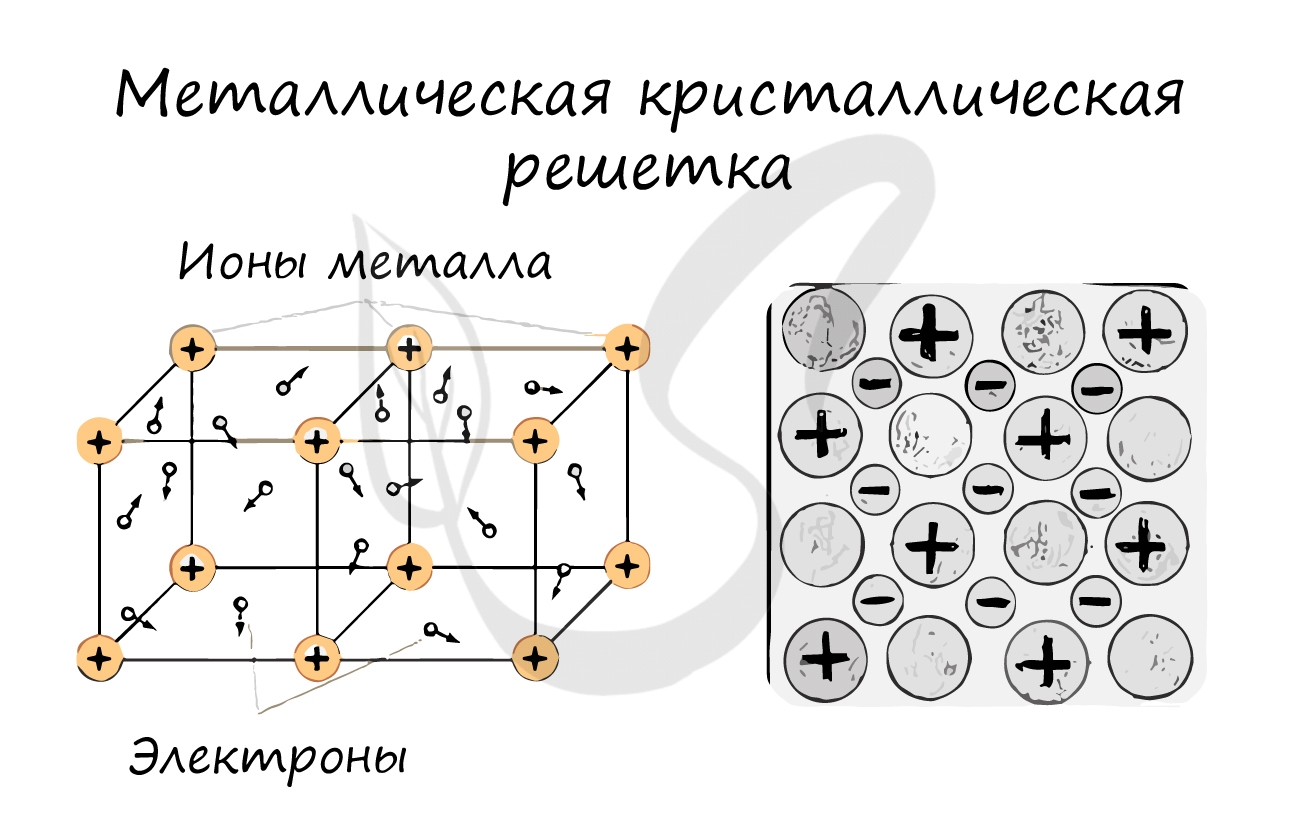
В своём строении напоминает молекулярную, но имеет всё же более прочные связи. Отличие данного типа в том, что на её узлах находятся положительно заряженные катионы. Электроны, которые находятся в межузловом пространстве, участвуют в образовании электрического поля. Они ещё носят название электрического газа.
Простые металлы и сплавы, характеризуются металлическим типом решётки. Для них характерно наличие металлического блеска, пластичность, тепло- и электропроводность. Они могут плавиться при различных температурах.

Он образуется при высоких температурах в вулканических и магматических породах, пегматитах и скарнах. Он встречается в кварцевых жилах с вольфрамитом и другими минералами в среднетемпературных гидротермальных полиметаллических месторождениях. Распространен в метаморфических породах — кристаллических сланцах, гнейсах, мраморах. Крупные месторождения образуются в результате пиролиза угля под воздействием ловушек на угольных месторождениях (Тунгусский бассейн). Акцессорный минерал метеоритов. Попутные минералы: кварц, пирит, гранаты, шпинель.
Определение
Кристаллическая решётка — особая структура твёрдого вещества, при которой частицы стоят в геометрически строгом порядке в пространстве. В ней можно обнаружить узлы — места, где расположены элементы: атомы, ионы и молекулы и межузловое пространство.
Твёрдые вещества, в зависимости от диапазона высоких и низких температур, являются кристаллическими или аморфными — они характеризуются отсутствием определённой температуры плавления. При воздействии повышенных температур они размягчаются и постепенно переходят в жидкую форму. К такого рода веществам относятся: смола, пластилин.
В связи с этим можно поделить на несколько видов:
Но при различных температурах одно вещество может иметь различные формы и проявлять многообразные свойства. Это явление называется аллотропной модификацией.
Это интересно: металлы и неметаллы в периодической таблице Менделеева.

Для изготовления плавильных тиглей, футеровочных плит — применение основано на высокой термостойкости графита (в отсутствие кислорода), его химической стойкости к ряду расплавленных металлов. Он используется в электродах, в нагревательных элементах, благодаря своей высокой электропроводности и химической стойкости практически ко всем агрессивным водным растворам (намного выше, чем у драгоценных металлов). Для производства химически активных металлов электролизом расплавов, твердых смазок, комбинированных жидких и пастообразных смазок, пластиковых наполнителей.
это замедлитель нейтронов в ядерных реакторах, компонент композиции для изготовления стержней с черным графитом (в смеси с каолином). Он используется для получения синтетических алмазов в качестве эталона длины нанометрового диапазона для калибровки сканеров микроскопа с туннельным эффектом и атомно-силового микроскопа, для изготовления контактных щеток и токосъемников для различных электрических машин электромобили и мостовые краны с тележкой, мощные реостаты и другие устройства, где требуется надежный мобильный электрический контакт для изготовления тепловой защиты носовой части боеголовок баллистических ракет и возвращаемых космических кораблей.
| Молекулярная масса | 12,01 г / моль |
| Происхождение названия | от древнегреческого. — пиши, пиши |
| Статус IMA | действителен, впервые описан до 1959 г. (до IMA) |
Описание графита:
Графит широко распространен в природе как минерал. Он встречается обычно в виде отдельных чешуек, пластинок и скоплений, разных по величине и содержанию.
Природный графит по своему химическому составу не отличается чистотой. В большом количестве (до 10-25%) в нем присутствует зола, состоящая из разных составляющих (Fe2O3, SiO2, Аl2O3, MgO, Р2О5, CuO, СаО и др.), газы (до 2%) и битумы, иногда вода.
Также графит получается искусственным путем различными способами. Например, нагреванием смеси кокса и пека до 2 800 °C.
ФИЗИЧЕСКИЕ СВОЙСТВА
| Минеральный цвет | железо черное превращается в стальную серую |
| Цвет линии | черный становится стальным серым |
| Прозрачность | непрозрачный |
| Светить | полуметаллический |
| Декольте | очень хорошо на |
| Твердость (шкала Мооса) | 1-2 |
| Расставаться | как слюда |
| Власть | гибкий |
| Плотность (измеренная) | 2,09 — 2,23 г / см3 |
| Радиоактивность (GRApi) | 0 |
Типы и марки графита:
В соответствии с ГОСТ 17022-81 «Графит. Типы, марки и общие технические требования» выделяют следующие минералогические типы графита:
Этим же ГОСТом предусмотрены следующие марки графита: ГСМ-1, ГСМ-2, ГАК-1, ГАК-2, ГАК-3, ГК-1, ГК-2, ГК-3, ГС-1, ГС-2, ГС-3, ГС-4, П, ЭУЗ-М, ЭУЗ-II, ЭУЗ-III, ЭУТ-I, ЭУТ-II, ЭУТ-III, ГТ-1, ГТ-2, ГТ-3, ГЭ-1, ГЭ-2, ГЭ-3, ГЭ-4, ГЛ-1, ГЛ-2, ГЛ-3, ЭУН, ГЛС-1, ГЛС-2, ГЛС-3, ГЛС-4.
Им соответствуют следующие виды использования (потребления) графита:
– графит специальный малозольный,
– графит кристаллический электроугольный,
– графит кристаллический литейный,
– графит скрытокристаллический электроугольный,
– графит скрытокристаллический литейный.
Лечебное влияние
Первыми оценили графит гомеопаты. Они установили, что минерал подходит для лечения кожных патологий (экземы, псориаз, лишай, другие).
Сегодня список расширен:
- Нарушение обмена веществ.
- Сбой в работе щитовидной железы.
- Заболевания дыхательных путей (ринит, бронхиальная астма).
- Проблемы ЖКТ (гастрит, язва желудка, 12-перстной кишки, колиты).
- Женские недуги (аменорея, хроническое воспаление яичников, мастопатия).
- Конъюнктивит, катаракта, ячмень.
Минерал «курирует» также эмоциональное здоровье. Его прописывают при утренней головной боли, неврастении, апатии, депрессии.
Кристаллические решетки
Кристаллической решеткой называют пространственное расположение атомов или ионов в кристалле. Точки кристаллической решетки, в которых расположены атомы или ионы, называют узлами кристаллической решетки.
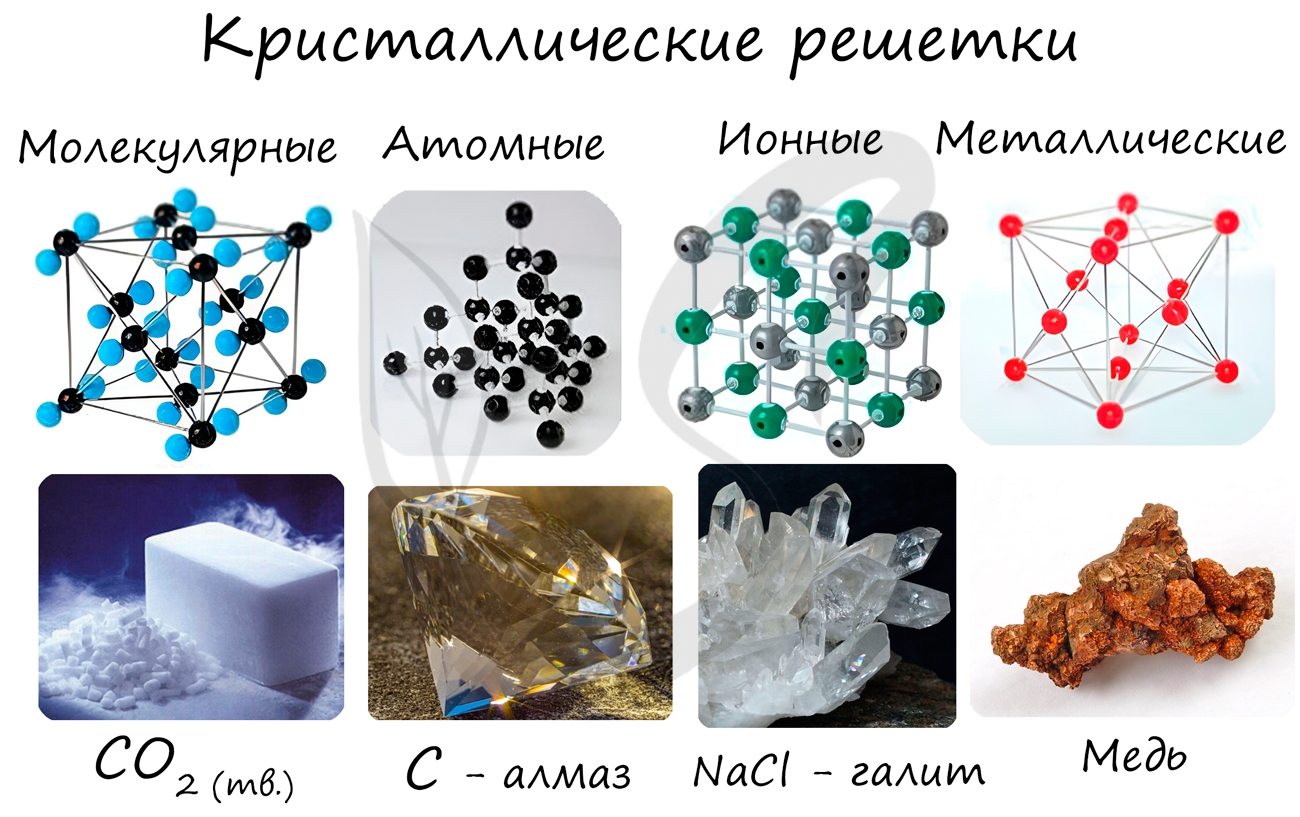
Кристаллические решетки подразделяют на молекулярные, атомные, ионные и металлические.
Очень важно не перепутать вид химической связи и кристаллической решетки. Помните, что кристаллические решетки отражают пространственное расположение атомов.
Молекулярная кристаллическая решетка
В узлах молекулярной решетки расположены молекулы. При обычных условиях молекулярную решетку имеют большинство газов и жидкостей. Связи чаще всего ковалентные полярные или неполярные.
Классическим примером вещества с молекулярной решеткой является вода, так что ассоциируйте свойства этих веществ с водой. Вещества с молекулярной решеткой непрочные, имеют небольшую твердость, летучие, легкоплавкие, способны к возгонке, для них характерны небольшие температуры кипения.
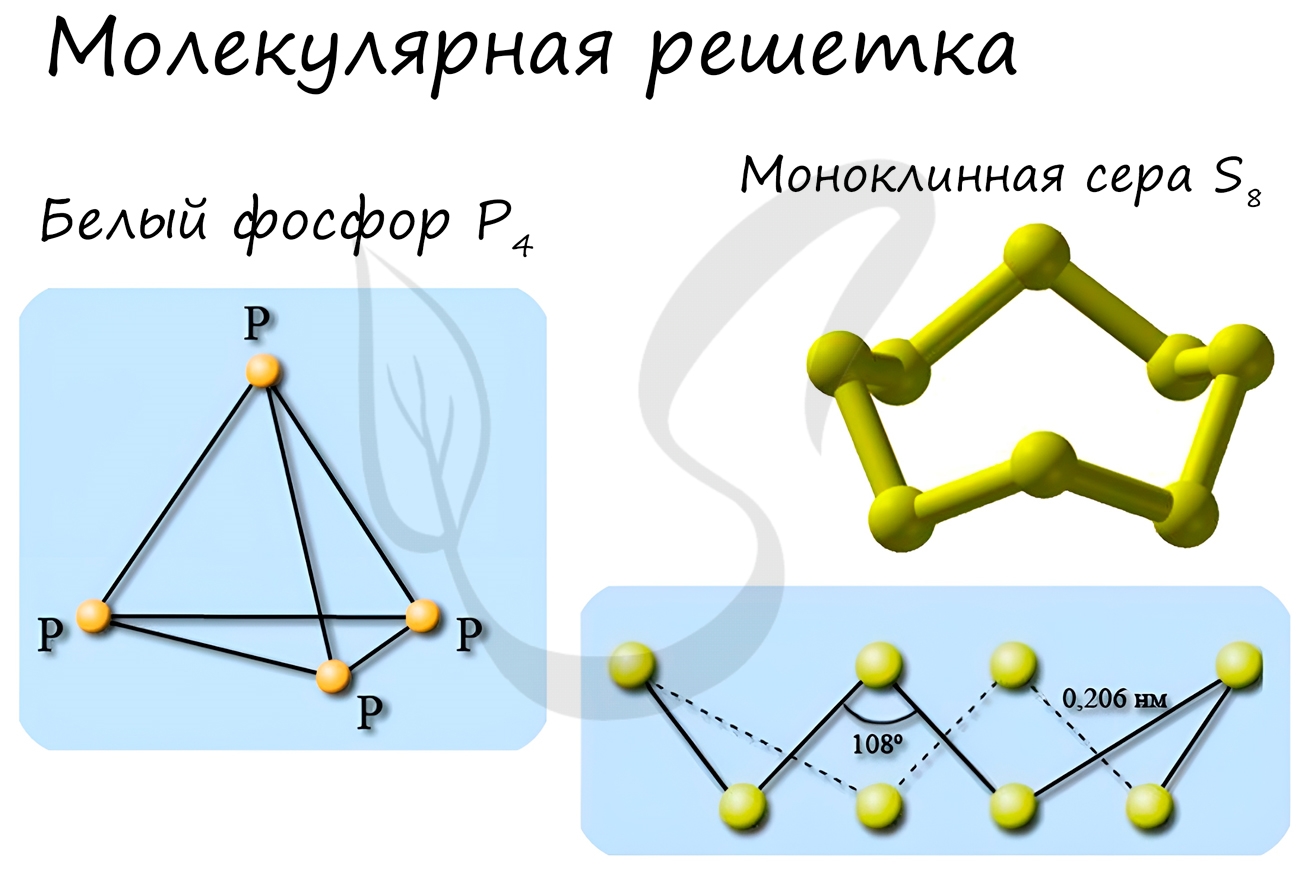
Примеры: NH3, H2O, Cl2, CO2, N2, Br2, H2, I2. Особо хочется отметить белый фосфор, ромбическую, пластическую и моноклинную серу, фуллерен. Эти аллотропные модификации мы подробно изучили в статье, посвященной классификации веществ.
Ионная кристаллическая решетка
В узлах ионной решетки находятся атомы, связанные ионной связью. Этот тип решетки характерен для веществ, обладающих ионной связь: соли, оксиды и гидроксиды металлов.
Ассоциируйте этот ряд веществ с поваренной солью - NaCl. Веществе с ионной решеткой имеют высокие температуры плавления и кипения, легко растворимы в воде, хрупкие, твердые, их растворы и расплавы проводят электрический ток.

Металлическая кристаллическая решетка
В узлах металлической решетки находятся атомы металла. Этот тип решетки характерен для веществ, образованных металлической связью.
Ассоциируйте свойства этих веществ с медью. Они обладают характерным металлическим блеском, ковкие и пластичные, хорошо проводят электрический ток и тепло, имеют высокие температуры плавления и кипения.
Примеры: Cu, Fe, Zn, Al, Cr, Mn.
Атомная кристаллическая решетка
В узлах атомной решетки находятся атомы, связанные ковалентной полярной или неполярной связью.
Ассоциируйте эти вещества с песком. Они очень твердые, очень тугоплавкие (высокая температура плавления), нелетучие, прочные, нерастворимы в воде.
Примеры: SiO2, B, Ge, SiC, Al2O3. Особенно хочется выделить: алмаз и графит (C), красный и черный фосфор (P).

Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Читайте также:
