Где применяются щелочноземельные металлы
К понятию щелочноземельных металлов относится часть элементов II группы системы Менделеева: бериллий, магний, кальций, стронций, барий, радий. Четыре последних металла имеют наиболее ярко выраженные признаки щелочноземельной классификации, поэтому в некоторых источниках бериллий и магний не включают в список, ограничиваясь четырьмя элементами.
Свое название металла получили благодаря тому, что при взаимодействии их оксидов с водой образуется щелочная среда. Физические свойства щелочноземельных металлов: все элементы имеют серый металлический цвет, при нормальных условиях имеют твердую структуру, с ростом порядкового номера увеличивается их плотность, имеют очень высокую температуру плавления. В отличие от щелочных металлов, элементы данной группы не режутся ножом (за исключением стронция). Химические свойства щелочноземельных металлов: имеют два валентных электрона, активность растет с повышением порядкового номера, в реакциях выступают в качестве восстановителя.

Характеристика щелочноземельных металлов свидетельствует об их высокой активности. В особенности это относится к элементам с большим порядковым номером. Например, бериллий в нормальных условиях не ступает во взаимодействие с кислородом и галогенами. Для запуска механизма реагирования его необходимо нагреть до температуры свыше 600 градусов по Цельсию. Магний в нормальных условиях имеет на поверхности оксидную пленку и также не реагирует с кислородом. Кальций окисляется, но достаточно медленно. А вот стронций, барий и радий окисляются практически мгновенно, поэтому их хранят в безкислородной среде под керосиновым слоем.
Все оксиды усиливают основные свойства с ростом порядкового номера металла. Гидроксид бериллия представляет собой амфотерное соединение, которое не реагирует с водой, но хорошо растворяется в кислотах. Гидроксид магния является слабой щелочью, нерастворимой в воде, но реагирующей с сильными кислотами. Гидроксид кальция - сильное, малорастворимое в воде основание, реагирующее с кислотами. Гидроксиды бария и стронция относятся к сильным основаниям, хорошо растворимым в воде. А гидроксид радия - это одна из сильнейших щелочей, которая хорошо реагирует с водой и практически всеми видами кислот.
Способы получения
Получают гидроксиды щелочноземельных металлов путем воздействия воды на чистый элемент. Реакция протекает при комнатных условиях (кроме бериллия, для которого требуется повышение температуры) с выделением водорода. При нагревании все щелочноземельные металлы реагируют с галогенами. Полученные соединения используются в производстве большого ассортимента продукции от химических удобрений до сверхточных деталей микропроцессора. Соединения щелочноземельных металлов проявляют такую же высокую активность, как и чистые элементы, поэтому их используют во многих химических реакциях.

Чаще всего это происходит при реакциях обмена, когда необходимо вытеснить из вещества менее активный металл. В окислительно-восстановительных реакциях принимают участие в качестве сильного восстановителя. Двухвалентные катионы кальция и магния придает воде так называемую жесткость. Преодоление этого явления происходит путем осаждения ионов при помощи физического воздействия или добавления в воду специальных смягчающих веществ. Соли щелочноземельных металлов образуются путем растворения элементов в кислоте либо в результате реакций обмена. Полученные соединения имеют прочную ковалентную связь, поэтому обладают невысокой электропроводностью.
В природе щелочноземельные металлы не могут находиться в чистом виде, так как быстро вступают во взаимодействие с окружающей средой, образую химические соединения. Они входят в состав минералов и горных пород, содержащихся в толще земной коры. Наиболее распространен кальций, немного уступает ему магний, довольно часто встречаются барий и стронций. Бериллий относится к редким металлам, а радий - к очень редким. За все время, которое прошло с момента открытия радия, во всем мире было добыто всего полтора килограмма чистого металла. Как и большинство радиоактивных элементов, радий имеет изотопы, коих у него насчитывается четыре штуки.

Получают щелочноземельные металлы путем разложения сложных веществ и выделения из них чистого вещества. Бериллий добывают путем восстановления его из фторида при воздействии высокой температуры. Барий восстанавливает из его оксида. Кальций, магний и стронций получают путем электролиза их хлоридного расплава. Сложнее всего синтезировать чистый радий. Его добывают путем воздействия на урановую руду. По подсчетам ученых в среднем на одну тонну руды приходится 3 грамма чистого радия, хотя встречаются и богатые месторождения, в которых содержится целых 25 грамм на тонну. Для выделения металла используются методы осаждения, дробной кристаллизации и ионного обмена.
Применение щелочноземельных металлов
Спектр применения щелочноземельных металлов очень обширен и охватывает многие отрасли. Бериллий в большинстве случаев используется в качестве легирующей добавки в различные сплавы. Он повышает твердость и прочность материалов, хорошо защищает поверхность от воздействия коррозии. Также благодаря слабому поглощению радиоактивного излучения бериллий используется при изготовлении рентгеновских аппаратов и в ядерной энергетике.
Магний используют как один из восстановителей при получении титана. Его сплавы отличаются высокой прочностью и легкостью, поэтому используются при производстве самолетов, автомобилей, ракет. Оксид магния горит ярким ослепительным пламенем, что нашло отражение в военном деле, где он используется для изготовления зажигательных и трассирующих снарядов, сигнальных ракет и светошумовых гранат. Является одним из важнейших элементов для регуляции нормального процесса жизнедеятельности организма, поэтому входит в состав некоторых лекарств.

Кальций в чистом виде практически не применяют. Он нужен для восстановления других металлов из их соединений, а также в производстве препаратов для укрепления костной ткани. Стронций используют для восстановления других металлов и в качестве основного компонента для производства сверхпроводящих материалов. Барий добавляют во многие сплавы, которые предназначены для работы в агрессивной среде, так как он обладает отличными защитными свойствами. Радий используется в медицине для кратковременного облучения кожи при лечении злокачественных образований.
Щелочноземельные металлы – перечень, свойства и польза элементов
Этой группе металлов отдан весь второй столбец таблицы Менделеева. И атомщики, и ювелиры используют щелочноземельные металлы. С ними интересно экспериментировать, но требуется осторожность.

Что представляют собой
Щелочноземельные металлы – это вся вторая группа таблицы Менделеева.
К щёлочноземельным металлам относятся:
То есть «щелочноземельный» список насчитывает шесть позиций, которые обычно располагаются по возрастанию атомного номера – от бериллия к радию.
История
Двойное название группы – отражение природы и характеристик входящих в нее элементов:
- Они способны образовывать щелочи.
- Ряд свойств их оксидов близки окислам алюминия и железа. Такие вещества еще средневековые алхимики именовали «землями».
Сегодняшний состав щелочноземельной группы сформировался не сразу: бериллий и магний отсутствовали.
Это объяснялось отличием свойств данных элементов от остальных:
- По большинству характеристик они ближе к алюминию, чем к другим элементам группы.
- Их гидроксиды – не щелочи.
- Магний взаимодействует с водой в замедленном режиме, у бериллия реакция в таком растворе нулевая. Та же картина при контакте с неметаллами.
Однако специалисты Международного союза теоретической и прикладной химии (IUPAC) решили все-таки причислить бериллий и магний к щелочноземельной группе.
Формы нахождения в природе
Щёлочноземельным металлам присуща чрезмерная активность, поэтому в природе они как самостоятельный элемент отсутствуют.
Почти всегда это составляющая минералов либо руд:
- Самый распространенный элемент щелочноземельной группы – кальций (2,9-12,9% по массе). Его получают из известняков, им насыщены мрамор, гранит.
- Почти три процента забирает магний.
- В сто раз реже в литосфере представлены барий со стронцием.
- Содержание остальных элементов измеряется тысячными долями процента.
Самым редким на планете щёлочноземельным металлом является радий. Но найти его легче других: это обязательный компонент урановых рудников.
Физико-химические характеристики
Элементы группы наделены общими физическими свойствами:
- Серебристый с сероватостью цвет.
- Твердость в стандартных условиях, ножом режется только стронций.
- Металлический блеск.
- Тускнение на воздухе с разной скоростью вследствие образования оксидной пленки.
- Хорошая пропускная способность для тепла и электричества.
- Два электрона на внешнем слое атома у каждого элемента, степень окисления – всегда +2. Это отражают формулы соединений, образованных металлами группы.
Самая тяжелая «щелочная земля» – радий. Кубик вещества с ребром в 1 см весит 5,5 грамма.
Более интересны химические свойства «земель».
Есть общие и оригинальные:
- Покрытый пленкой-оксидом бериллий способен на реакцию только при 600+°С (кроме фтора).
- Окисленный магний при средней температуре не реагирует ни с чем. Получение соединений металла возможно при температуре от 645°C.
- Кальций окисляется неспешно и только если воздух влажный. При незначительном нагреве горит, растворяется водой.
- Осмотрительности требуют барий, стронций, радий. На открытом пространстве взаимодействие этих металлов с кислородом и азотом чревато взрывом. Их держат в герметичных контейнерах, залив керосином. Эта особенность объединяет щелочные и щелочноземельные металлы.
Общие свойства щёлочноземельных металлов – растворение в кислотах, образование солей, щелочей при взаимодействии с водой.
Химическая активность щелочноземельных металлов усиливается с увеличением габаритов атома – от бериллия к радию.
Где используются
Свойства металлов щелочноземельной группы обусловили применение каждого во всех сегментах – от авиастроения до медицины и ювелирного дела:
- Бериллий. Исходник при выплавке сплавов, включая «атомные», получения ракетного топлива. Компонент ювелирных минералов первого ряда – аквамарина, гелиодора, изумруда.
- Кальций. Базис большинства огнеупоров, строительных материалов. Металл задействован при производстве топлива, аптечных препаратов.
- Магний. Самый легкий щелочноземельный металл. Как восстановитель нашел применение в металлургии. Без проблем куется, раскатывается. Чаще используется как «ингредиент» сплавов, снижающий их массивность, – материал корпусов и деталей ракет, самолетов, автомобилей, электроники. А также приборов для нужд оборонного комплекса и предприятий приборостроения.
Сегодня на первое место по использованию магниевых сплавов выходят смартфоны, планшеты, другие гаджеты.
- Стронций. Металлургами используется как лигатура сплавов, очиститель сталей, чугуна, меди от серы, других вредных примесей. Сырье закупают производители радиоэлектроники, химических источников тока, атомщики, пиротехники. Продукция «высокого сегмента» из металла – чистый уран, керамика-сверхпроводник, вакуумный инструментарий.
Стронций создает насыщенно-красные оттенки огней салюта. Изотопом вещества лечат онкологию.
- Барий. Используются соединения металла. Главный потребитель – атомщики. Ассортимент: вакуумные, пьезоэлектрические приборы, жидкий теплоноситель, линзы, стекло для урановых стержней, керамика-сверхпроводник. Нетоксичный сульфат используется рентгенологами как контрастное вещество.
На особом счету радий. Это самый редкий щелочноземельный металл: на планете его получено всего полтора килограмма.
Даже микродозы радиоактивного вещества смертельно опасны для человека. Однако это свойство используется исследователями ядерных процессов и для лечения онкологии.
Шкалы, стрелки компасов, бортовых приборов, изготовленных до 1970-х годов, покрыты краской, содержащей радий. Она светится в темноте, но с тех пор не используется как опасная для человека.
Биологическое значение
Значение щелочноземельных элементов разнообразно:
- Без кальция не формируется скелет, зубы, не сокращаются мышцы. Элемент «курирует» параметры крови.
- Магний – компонент биологических структур (к примеру, хлорофилла у растений). В организме человека содействует синтезу нуклеиновых кислот, работе ферментов, нервной системы.
- Микродозы стронция присутствуют в организме как аналог кальция. Особо важен щелочноземельный элемент для детей младше четырех лет.
Барий, радий, бериллий, их соединения ядовиты. Поэтому для биологических структур опасны.
Щелочные металлы – список и особенности взрывоопасных элементов
Продукты на основе этих металлов стали неотъемлемой частью жизни человека. Это и поваренная соль, и пищевая сода, и марганцовка.
Щелочные металлы ценят преподаватели химии: опыты с такими субстанциями способны увлечь химией любого.

Щелочные металлы – это элементы, занимающие почти весь первый столбец таблицы Менделеева. Кроме них, там расположился только водород.
К щелочным металлам относятся:
Названы щелочными вследствие растворимости соединений водой.
Результат воздействия воды – гидроксиды. Они также растворимы, потому называются щелочами.
Древние славяне под выщелачиванием подразумевали растворение вещества водой.
Особенности структуры
У атома щелочного металла на внешнем слое один электрон. Степень окисления у металлов группы одна – +1.
Этим обусловлена сходность характеристик элементов щелочного сегмента.
Как представлены в природе
Щелочная группа представлена на планете по-разному:
- Самые распространенные элементы – натрий с калием.
- Литий, рубидий, цезий причислены к редким и рассеянным.
- Самым редкостным щелочным металлом является франций. По редкости этот радиогенный материал – второй на планете: суммарный объем в земной коре не превышает трети килограмма.
Из-за повышенной активности щелочные металлы в природе не встречаются. Лишь как соединения с прочими элементами.
Поставщики натрия с калием:
- Хлорид натрия – обычная каменная соль. Ее содержит вода морей и океанов.
- Глауберова соль.
- Соли калия находят в почвах.
Металлы входят в структуру ряда минералов. Это в основном алюмосиликаты: альбит – натриевый; ортоклаз (полевой шпат) – калийный.
Технология получения
Щелочные металлы получают несколькими способами:
- Электролиз. Материалом служат расплавы их хлоридов (или других галогенидов) либо гидроксиды. Растворы солей как исходник не годятся: конечным продуктом становятся водород и щелочи.
- Восстановление из бромида, хромата либо хлорида. Восстановителями выступают магний, цирконий, кальций, кремний. Процесс получения протекает в вакууме при температурах под 1000°С, образующийся металл периодически отгоняется.
Натрий восстанавливают из карбоната. Ингредиенты: уголь, известняк, температура 990°C. Для промышленных нужд синтезируют гидроксид из крепкого раствора поваренной соли.
Физико-химические свойства
Металлы щелочного сегмента наделены общими и оригинальными физическими и химическими свойствами.
Физические характеристики
- Мягкость. Любой (кроме лития) легко режется.
- Легкость. Плотность лития, натрия, калия меньше единицы. Они не тонут в воде.
- Серебристо-белый цвет. Только цезий наделен желтоватостью на серебристом фоне.
- Металлический отблеск.
Оксиды группы обладают типичными для этого вида соединений свойствами: реагируют с водой, кислотами, их оксидами. У каждого свой цвет. Устойчивость и цветность оксидов щелочных элементов увязана с габаритами атома.
Химические параметры
Главная особенность щелочной группы – чрезмерная химическая активность:
- Разогретые щелочные элементы реагируют с азотом, кремнием, галогенами, серой, фосфором, углеродом. Результат – соответствующие продукты (галогениды, сульфиды, карбиды, силициды, др.)
- При нагревании с прочими металлами образуются полуметаллы (интерметаллиды).
- На воздухе сгорают.
При взаимодействии металлов с водой выделяется водород, возможен взрыв.
Окраска пламени щелочными металлами и их соединениями:
| Щелочной металл | Цвет пламени |
|---|---|
| Li | Карминно-красный |
| Na | Жёлтый |
| K | Фиолетовый |
| Rb | Буро-красный |
| Cs | Фиолетово-красный |
Элементы, не тонущие в воде, горят и взрываются в ней:
- Калий создает пламя фиалковой гаммы, взрыв самый сильный.
- У натрия пламя желтое, взрыв послабее.
- Литий просто горит.
Взрывом заканчивается реакция с кислотами.
Все щелочные металлы бурно реагируют на воду. Процесс сопровождается водородным фонтаном, затем пламенем, взрывом.
Мирно протекают реакции со спиртами, карбоновыми кислотами, другими органическими субстанциями.
| Формула кислородного соединения | Цвет |
|---|---|
| Li2O | Белый |
| Na2O | Белый |
| K2O | Желтоватый |
| Rb2O | Жёлтый |
| Cs2O | Оранжевый |
| Na2O2 | Светло- жёлтый |
| KO2 | Оранжевый |
| RbO2 | Тёмно- коричневый |
| CsO2 | Жёлтый |
Как опознать щелочной металл
Вид щелочного металла «выдает» окрас пламени:
Натрий либо его соединения делают пламя охристо-желтым.
Промышленники оценили утилитарные свойства щелочных металлов. Они легкоплавки, пластичны (раскатываются до фольги), хорошо куются, пропускают тепло и электричество.
Самый известный продукт – поваренная соль (формула NaCl). Ее дополняют кальцинированная сода с едким натром (карбонат, гидроксид натрия), марганцовка (перманганат калия).
Их производят миллионами тонн:
- Каустическая сода (в просторечии едкий натр) – ингредиент при варке мыла, производстве алюминия, искусственных волокон.
- Кальцинированная сода – сырье для получения мыла, стекла, заменитель хозяйственного мыла.
Каустическая и кальцинированная сода, глауберова соль несъедобны. Только столовая сода и поваренная соль.
- Пищевая сода нашла применение как домашнее средство для устранения ангины, обязательный ингредиент выпечки, натуральный консервант.
Альбит и ортоклаз классифицируются как коллекционный и декоративно-поделочный материал.
Техника безопасности
Химически активные элементы требуют осторожности.
При самостоятельной работе соблюдают следующие правила:
- Перед началом работы надеть защитные перчатки и очки (маску).
- Кусочек отрезают скальпелем от массива, не вытаскивая из керосина.
- В емкости, заполненной аргоном, счищают с поверхности остатки оксидов.
- Очищенный образец помещают в сосуд, где будет проводиться опыт.
- Остатки, не затронутые реакцией, засыпают сухим спиртом.
Аналогичный порядок работы со щелочноземельными элементами. Они так же химически активны.
Щелочные и щелочноземельные металлы хранят притопленными в керосине: контакт с водой, воздухом заканчивается взрывом.
Щёлочноземельные металлы - основные свойства, характеристика и строение элементов
Название «щелочноземельные металлы» происходит из времен, когда химия только начинала развиваться, и связано со старинным названием оксидов — их называли «земли». Гидроксиды металлов этого семейства являются щелочами. Отсюда и такое комбинированное название — щелочноземельные, то есть металлы, способные образовывать гидроксиды (щёлочи) и оксиды (земли).

Описание группы веществ
Все элементы этой группы твердые, за исключением разве что стронция (его можно разрезать ножом). Цвет щелочноземельные металлы имеют серый с серебристым оттенком. Все они обладают электропроводностью и теплопроводностью, которые являются классическими свойствами металлов. Согласно современной классификации, к этому классу веществ относятся соединения из следующего списка:

- бериллий;
- барий;
- кальций;
- магний;
- стронций;
- радий;
- унбинилий.
Ранее магний и бериллий, несмотря на то что они располагаются в том же столбце таблицы Менделеева, к этой группе не относили, так как щелочами их гидроксиды не являются. Кроме того, с водой магний реагирует очень медленно, а бериллий не реагирует вообще.
Взаимодействие с другими соединениями

Щелочные и щелочноземельные металлы характеризуются выраженными восстановительными свойствами (выражены они у щелочных металлов в большей степени, чем у щелочноземельных. Запомнить легко: какой столбец левее в таблице Менделеева, там вещества активнее. Хотя по сравнению с щелочными металлами они несколько слабее.
Во избежание окисления на воздухе, хранить вещества этой группы в лабораторных условиях и кабинетах химии предписывается под слоем жира, почему в обычных, «комнатных», условиях их хранить нельзя. Они должны находиться в нейтральной среде. Щелочноземельные металлы способны взаимодействовать со следующими веществами:
- неметаллами;
- кислородом (с образованием оксидов);
- водой (при взаимодействии образуется щелочный раствор и происходит выделение водорода);
- кислотами.
Получение щелочноземельных металлов
Получают вещества этого класса, чтобы использовать их в дальнейшем в промышленных целях. Образование веществ этого класса можно рассмотреть на следующих примерах:
- Результатом электролиза расплава солей соответствующих металлов и является выделение чистых кальция и стронция. Наиболее часто для этой цели используют хлориды.
- Чтобы получить чистый барий, используется реакция, где при взаимодействии оксида бария с алюминием и нагревании образуется оксид алюминия и барий высокой чистоты. Этот способ называется алюмотермическим.
Нахождение в природе
Лидером по распространённости в окружающем мире является кальций. Напротив, наименьшую распространение в природе имеет радиоактивный элемент радий.

Следует отметить, что в природе щелочноземельные металлы встречаются в виде составных частей минералов. Отсутствие в природе этих элементов в чистом виде связано с их высокой химической активностью. В частности, кальциевыми солями насыщены граниты, мраморы и известняки.
Бериллий обнаруживается в составе аквамарина, изумруда и гелиодора.
Соли магния определяют жесткость воды. В большом количестве этот элемент содержится в морской воде (в виде солей).
А обнаружение солей радия является сигналом о близости урановых руд.
Эти соединения встречаются не только в так называемый неживой природе. В частности, кальций и магний — биогенные элементы; они необходимы для нормального функционирования живых организмов.
Кальций в виде солей в изобилии содержится в клетках животных, их зубах и других тканях. Необходим он и для работы мышц, а также свертываемости крови.
Магний — важнейший внутриклеточный элемент. Он регулирует целый ряд жизненно важных процессов:
- синтез нуклеиновых кислот;
- работу нервной системы;
- функционирование ферментативных систем.
Практическое применение
Применение щелочноземельным металлам нашла не только природа. Научились это делать и люди.

Бериллий нашел применение в производстве ракетного топлива, а также сплавов, в том числе для атомных станций. Кальций, хорошо зарекомендовавший себя в качестве основы скелетов живых существ, нашел свое применение и при производстве строительных материалов. Кроме того, этот элемент используется при получении топлива, а также в фармацевтической промышленности.
Магний, основные свойства которого —это легкость и пластичность, хорошо поддаётся прокату и ковке. Из сплавов, содержащих этот металл, изготавливают детали и предметы, для которых важен низкий вес:
- металлические листы и профили;
- корпуса электронной техники.
Такие сплавы востребованы во многих отраслях промышленности (военной, электронной, космической, авиационной, автомобильной, приборостроительной).
Основные сферы применения солей стронция:
- радиоэлектрическая;
- металлургическая;
- пиротехническая;
- энергетическая;
- производство урана;
- производство магнитных материалов;
- изготовление керамики;
- медицинская промышленность, где изотоп этого вещества используется в качестве противоопухолевого средства.
Барий нашёл место это в атомной энергетике, оптики, в производстве вакуумных приборов. Благодаря свойству не растворяется в воде, сульфат этого металла используется в медицине в качестве контрастного вещества при рентгенографии и рентгеноскопии.
Люди нашли применение и редкому элементу радию. Используется он как при исследованиях в ядерной сфере, так и в медицине для лечения опухолей. От изготовления светящейся краски на основе радия пришлось отказаться в связи с опасностью этого вещества для людей.
Щёлочноземельные металлы - основные свойства, характеристика и список элементов
Щёлочноземельные металлы получили свое название за счет своих оксидов, которые сообщают воде щелочные реакции. Изучая химию, очень часто приходится взаимодействовать со сложными и непонятными названиями. Но если разобраться и понять что к чему, то изучать предмет легко и интересно.
Однако при написании формул стоит быть внимательным, не забывая про коэффициенты и признаки реакций.
Положение в периодической системе Менделеева
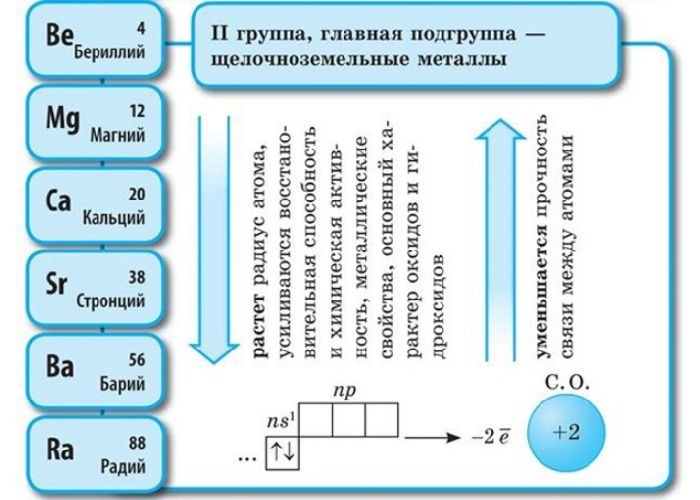
Щелочноземельные металлы – это химические элементы второй группы периодической системы химических элементов таблицы Менделеева:
Электронное строение и закономерности изменения свойств
Атомы данных металлов на внешнем энергетическом уровне имеют 2 s-электрона. Отсюда следует, что максимальная степень окисления +2.
Также могут иметь нулевую степень окисления, но не отрицательную, так как металлы не могут иметь данную степень.
Общая конфигурация внешнего энергетического уровня nS 2 :

В периоде от Be до Ra металлические свойства, восстановительные, электроотрицательные увеличиваются, а неметаллические, окислительные свойства и радиус атома уменьшается.
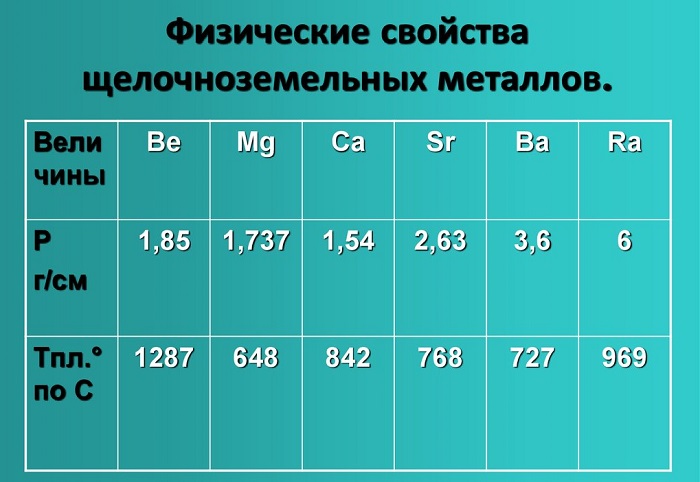
Физические свойства щелочноземельных металлов
Физические свойства данной группы имеют следующие характеристики: светло-серый — темно-серый цвет, твердые вещества, не растворимые и нелетучие, без запаха, тепло-электропроводимые, имеют характерный металлический блеск.
Показатели плотности и температуры плавления представлены в таблице:
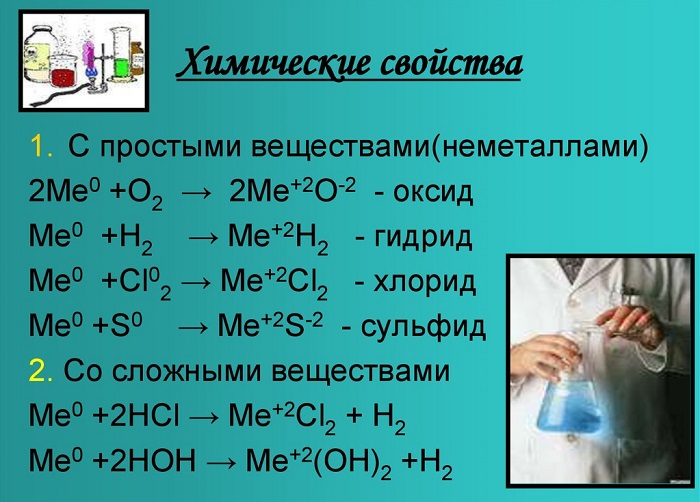
Химические свойства
Оксиды и гидроксиды щёлочноземельных металлов усиливают основные свойства при движении вниз по второй группе. Следовательно, бериллий имеет меньшие основные свойства, чем радий.
Эти вещества взаимодействуют с любыми растворами кислот от сильной до слабой, а также с образованием солей, образуя белый осадок.
С кислородом образуют реакцию горения и оксид:
Металлы, стоящие в главной подгруппе второй группы (кроме бериллия) реагируют с водой. При проведении данных реакций выделяется водород (H2):
Также реагируют с неметаллами:
Bа + Cl2 = BаCl2 — хлорид бериллия;
Ca + Br2 = CaBr2 — бромид кальция;
Sr + H2 = SrH2 — гидрид стронция.
Химические свойства щелочноземельных металлов показаны на картинке:
Все металлы данного типа встречаются на земле, но не в чистом виде. Часто они представлены в виде минеральных солей. Самый распространённый считается кальций, магний немного уступает, затем идет барий и стронций.
Бериллий и радий являются самыми редкими, однако последний металл в больших количествах находится в урановых рудах.

Способ получения
Магний, кальций и стронций получают электролизом расплавов солей.
Барий получают с помощью восстановления оксида.
При нагревании фторида бария получают сам металл.
Качественные реакции
Одна из качественных реакций-окрашивание пламени.
Список возможных цветов пламени при нагревании данных элементов:
Sr — насыщенный красный;
Ba - светло-зеленый или классический зеленый.

Металлы данного типа при взаимодействии с щелочами, оксидами или растворами солей выпадают в белый осадок.
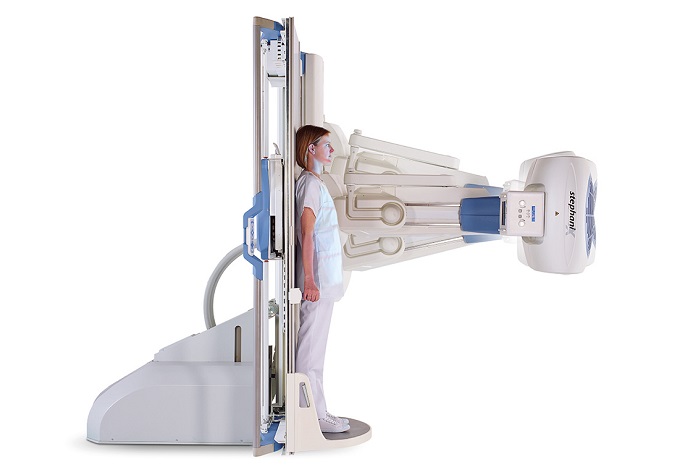
Бериллий из-за своей прочности добавляют в различные сплавы металлов, также препятствует коррозии. Используется в изготовлении рентгеновских аппаратов.
Магний и кальций активно использует для лекарственных средств, поскольку данные металлы играют большую роль в жизнедеятельности организма. Также в медицине используют радий, но для облучения кожи и злокачественных образований.
Стронций и барий добавляют в различный сплавы, которые работают в агрессивной среде и имеют сверхсильную проводимость.
Данные металлы играют огромную роль в жизни человека, выполняют различные функции и имеют ряд определенных свойств. Они содержатся в земной коре, поэтому довольно широко используются. Однако это не говорит о том, что их нужно расходовать безгранично.
Читайте также:
