Угольная батарейка своими руками
Стартуем НОВЫЙ КОНКУРС - "САМЫЙ АКТИВНЫЙ ПОДПИСЧИК"! На этот раз, разыграем комплект из 2х УКВ радиостанций, на которые я в скором времени сделаю обзор. Условия довольно просты: НЕ ПРОПУСКАЙ НОВЫЕ ВИДОСЫ, СТАВЬ ЛАЙКИ, ПИШИ КОММЕНТЫ! И уже по сложившейся традиции, в новогоднем видео объявим победителя!
Чтобы отметить человека, наведите на него курсор и нажмите левую кнопку мыши. Чтобы отметиться на фото, наведите на себя курсор и нажмите левую кнопку мыши.
"Батарейка" ёмкостью 200 Ампер-часов стоит около 40000руб, а её ресурс примерно 10 - 20 полных разрядов-зарядов, хотя по паспортным данным обещают тысячи полных разрядов. Это проверено.

Электричество окружает современного человека постоянно. Но даже на этом фоне удивительно, что напряжение присутствует в обычных вещах и продуктах (лимон, картофель и т.д.). С помощью них можно сделать простую батарейку в домашних условиях. Поскольку напряжение, ток и емкость изготовленной дома батарейки далеки от привычных нам источников питания, то использовать в реальной жизни такую батарейку смысла нет. Зато в качестве бытового физико-химического опыта для образовательных целей тема бесценна.
Немного теории

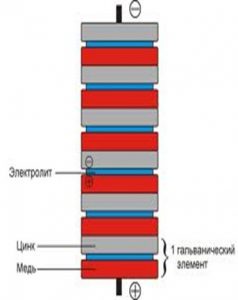
Схематичное устройство гальванического элемента
Предположим, что мы имеем емкость с кислотой с погруженными в нее цинковым и медным электродами (рис). Когда элемент выдает электрический ток через внешнюю цепь, цинк на поверхности цинкового электрода растворяется в растворе. Атомы цинка растворяются в электролите как электрически заряженные ионы (Zn 2+ ), оставляя в металле 2 отрицательно заряженных электрона (e — )
Эта реакция называется окислением.
Пока цинк попадает в электролит, два положительно заряженных иона водорода (H + ) из электролита объединяются с двумя электронами на поверхности медного электрода и образуют молекулу водорода (H2)
Эта реакция называется восстановлением.
Электроны, используемые на медном электроде для образования молекул водорода, передаются от цинкового электрода через внешний провод, соединяющий медный и цинковый электроды. Молекулы водорода, образующиеся на поверхности меди в результате реакции восстановления выделяются в виде газообразного водорода.
Об электролите
Напряжение на ячейке зависит от кислотности электролита, измеряемой по его pH. Уменьшение кислотности (увеличение pH) вызывает падение напряжения. Используемая кислота не влияет на напряжение, кроме как через значение pH. Это не так для сильнокислых электролитов (pH Две перечисленные выше окислительно-восстановительные реакции происходят только тогда, когда электрический заряд может переноситься через внешнюю цепь.
Об электродах
Из химии: ряд напряжений металлов используется на практике для относительной оценки химической активности металлов в реакциях с водными растворами солей и кислот и для оценки катодных и анодных процессов при электролизе. Восстановительная активность металлов (свойство отдавать электроны) уменьшается, а окислительная способность их катионов (свойство присоединять электроны) увеличивается в указанном ряду слева направо. Металлы, стоящие левее, являются более сильными восстановителями, чем металлы, расположенные правее: они вытесняют последние из растворов солей. Например, взаимодействие Zn + Cu 2+ → Zn 2+ + Cu возможно только в прямом направлении. Цинк вытесняет медь из водного раствора её соли. При этом цинковая пластинка растворяется, а металлическая медь выделяется из раствора.
Наиболее распространённые металлы расположены в ряду напряжений в следующей последовательности: Li, К, Ca, Na, Mg, Al, Mn, Zn, Fe, Co, Ni, Sn, Pb, (H2), Cu, Hg, Ag, Au.
Итого, чем дальше в этом ряду находятся металлы друг от друга, тем большее напряжение возникает между ними.
Теоретические выводы
- Получается, что э нергия исходит не от лимона или картофеля, а от химического изменения цинка, когда он растворяется в кислоте.
- Чем выше кислотность (меньше pH) электролита (но до pH
- Чем дальше в ряду напряжения металлов находятся друг от друга электроды, тем выше напряжение
- Между одинаковыми электродами напряжение должно быть 0
- О значимой силе тока в подобных экспериментах говорить не приходится. Она, конечно, прямо пропорциональна площади электродов, но площадь эта такова, что для получения аналога среднестатистического автомобильного аккумулятора потребовалось бы несколько миллионов ячеек из лимонов.
Можно приступать в проверке.
Батарейка из лимона или картофеля
Для того чтобы сделать батарейку из фрукта и подручных материалов, понадобятся следующие компоненты:
- лимон или картофель;
- стальной (цинковый, алюминиевый) предмет;
- медный предмет;
- два изолированных провода.
Прежде чем приступить к созданию простой батарейки, необходимо зачистить стальной и медный предметы. Это можно сделать наждачной бумагой.

Совет! В качестве стального предмета удобно использовать гвозди. В качестве медного — медную монетку или проволоку. Полоску цинка можно попытаться аккуратно добыть из корпуса старой батарейки, но надо соблюдать предельную осторожность
Далее необходимо воткнуть их в лимон на расстоянии 3-2 см друг от друга. А к импровизированным контактам присоединить провода. Также их можно аккуратно воткнуть вплотную к контактам. Медный элемент будет выступать в качестве плюса, а стальной минуса.

Интересно! Вместо лимона также можно использовать яблоко. Но необходимо выбирать кислые плоды, так как это необходимо для реакции.

Самодельная батарейка на основе одного лимона или яблока может выдавать примерно 0.5-0.7 Вольт. Этого недостаточно для заряда простого мобильного или приемника. Если нужно напряжение от 3 до 5 Вольт, то вполне возможно это сделать. Нарастание происходит за счет увеличения количества плодов.

Батарейка из монет
Конструкцию из монет в качестве простейшего гальванического элемента также называют Вольтов столб. Для его изготовления понадобится:
- медные монеты (например, по 10 или 50 копеек);
- фольга;
- бумага;
- уксус или очень соленная вода.

Для красоты конструкции необходимо выбирать монеты одного номинала. Также перед экспериментом их ненадолго окунуть в уксус. Это устранит налет и загрязнения. После чего необходимо вырезать из бумаги и фольги элементы по форме монеток. Их количество должно быть на 2 меньше, чем монет.
Вольтов столб собирается так:
- Бумага смачивается в растворе уксуса или соленной воды и прикрепляется к монетке.
- Сверху на бумагу кладется круг из фольги.
- Далее кладется следующая монетка.
- Этапы повторяются пока не кончатся монеты в выбранном количестве.
- Конструкция должна получиться такой, чтобы с одного конца была монета (+) последним элементом, а с другого фольга (-).
Чем больше монет будет задействовано в эксперименте, тем большее напряжение выдаст батарейка. Важно понимать, что после эксперимента монеты, возможно, не будут пригодны для использования. Элементы могут покрыться ржавчиной.
Батарейка в алюминиевой банке
Для создания батарейки своими руками в алюминиевой банке необходимо взять:
- алюминиевую банку (например, из под кока-колы);
- уголь от костра в виде крошки или пыли;
- свечка парафиновая;
- графитный стержень;
- соль и вода;
- пенопласт толщиной более 1 см.
Для начала необходимо отрезать у банки верхушку. После чего изготовить из пенопласта круг, подходящий ко дну банки. В круге необходимо проделать не сквозное отверстие для стержня. Пенопласт поместить на дно банки и воткнуть в него графит. Важно, чтобы стержень стоял ровно по центру банки. Пространство вокруг графитного стержня необходимо заполнить углем.
Важно! Стержень из графита не должен прикасаться к банке.
После чего остается сделать солевой раствор взяв 0.5 литра воды и 3 ст. ложки поваренной соли. Раствор размешивать до тех пор, пока кристаллы соли не растворятся, лучше это делать в теплой воде. Залить электролит в банку и запечатать ее воском. Важно чтобы стержень из графита выглядывал за банку.
Провода подключать к графитовому стержню (катод, плюс), и корпусу банки из алюминия (анод, минус). Для того, чтобы получить напряжение в 3 Вольт, необходимо последовательно подключить не менее 2 банок. Полученной батарейкой можно привезти в действие лампочку, калькулятор и часы. Также их можно заряжать.
Заключение
Все вышеописанные способы создания батареек не являются полноценными их заменителями. Но их вполне можно собирать ради интересного эксперимента для наглядной демонстрации работы и устройства гальванических элементов.

С приходом новых технологий, в каждом доме появились устройства, не имеющие постоянного источника питания.

Использование многих переносных электроприборов невозможно без соответствующих элементов питания. Разного рода батарейки, аккумуляторы и

Современный мир насыщен разнообразными гаджетами, игрушками и приборами, которые требуют для работы элементы питания

Практически в каждом доме есть устройства, работающие на батарейках, поэтому представить сегодня жизнь без
Всегда можно получить постоянное напряжение для питания небольших электронных устройств, если знать, как сделать аккумулятор своими руками. Аккумуляторы отличаются от батареек обратимостью своих химических реакций. Это значит, что они не только вырабатывают электрический ток и со временем разряжаются, а также обладают способностью восстанавливаться. Для этого нужно выполнить заряд, пропуская через аккумулятор ток от внешнего источника.

Как сделать аккумулятор своими руками
Химический источник тока (двухполюсник), способный после разряда восстанавливаться, можно выполнить своими руками. Любой химический источник тока, имеющий периодический режим работы (разряд – заряд), состоит из следующих основных элементов:
- электроды: анод и катод;
- электролит;
- разделительные пластины (сепараторы);
- корпус;
- контактные клеммы (выводы).
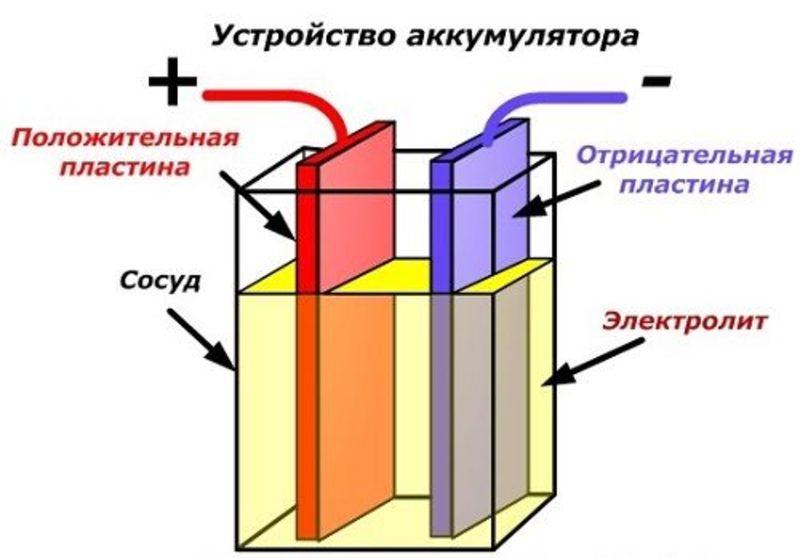
В качестве анода и катода используются различные пары химических элементов. Анод имеет отрицательный заряд – восстановитель, катод положительный заряд – окислитель.
Оба электрода погружены в электролит. Это водные растворы солей и кислот, проводящие электричество. Когда происходит разряд аккумулятора (двухполюсника) на нагрузку, анод окисляется и вырабатывает электроны, которые через электролит движутся к катоду. На катоде происходит процесс восстановления окислителя.
Важно! При работе на нагрузку ток через двухполюсник течёт от минуса к плюсу, при зарядке от постороннего источника тока (ИТ) – от плюса к минусу.
Для создания одной банки простейшего аккумулятора из меди и цинка понадобятся следующие детали:
- медная проволока длиной 100 мм;
- оцинкованная пластина размерами 25 * 50 мм;
- прокладка – вырезанная из москитной полиэтиленовой сетки полоска;
- электролит – соляной раствор;
- корпус из непрозрачного материала – герметичный стаканчик из-под кофе с крышкой.
Необходимо, чтобы ёмкость для аккумулятора была непрозрачной.
Сборка элемента производится в следующей последовательности:
- медная проволока скручивается спиралью, для увеличения площади рабочей поверхности к верхнему концу припаивается отвод;
- оцинкованная пластина также скручивается по окружности, к верхней части пластины припаивается отвод;
- в крышке баночки делается два отверстия для выводов: в центре – для медной проволоки и ближе к краю – для вывода цинкового электрода;
- медную спираль располагают по центру, вокруг неё размещают цинковую трубку, между ними вставляют изолирующую прокладку;
- заливают электролит: солёную воду (1л воды на 5 ст. л. соли) или уксус 15%;
- неплотно прикрывают крышку, предварительно продев в неё выводы.
К полученной банке подключают источник тока для зарядки самодельного аккумулятора. При этом нельзя плотно закрывать крышку. Или для выхода газов при заряде в ней проделывается множество мелких отверстий (кроме отверстий для выводов). У самодельного элемента плюс – на медном электроде, минус – на цинковом.
Внимание! Чем меньше расстояние между элементами меди и цинка, и чем больше площадь поверхности электродов, тем большее напряжение выдаст подобная аккумуляторная ячейка.
В идеале такой элемент вырабатывает 0,7 вольта. Недостаток такой АКБ заключается в высоком внутреннем сопротивлении и быстром саморазряде.
Как сделать мощный аккумулятор своими руками
Для того чтобы самодельный аккумулятор выдавал на выходе более 3,6 В постоянного тока, нужно собирать самодельные банки в последовательно соединённую батарею. Можно единичные элементы помещать в общий корпус.

Качественные системы зарядки Li-ion 18650
Литий-ионные источники электричества этого типа широко эксплуатируются с различными устройствами. Для их продолжительной работы необходима постоянная подзарядка. При заряде напряжение на элементе достигает значения 4,2 В, после чего снижается до 2-3 В. При глубоких разрядах (ниже 3 В) срок службы Li-ion 18650 значительно сокращается.

Существуют специальные зарядные устройства для подобных аккумуляторов, но их можно сделать самостоятельно, используя схему.
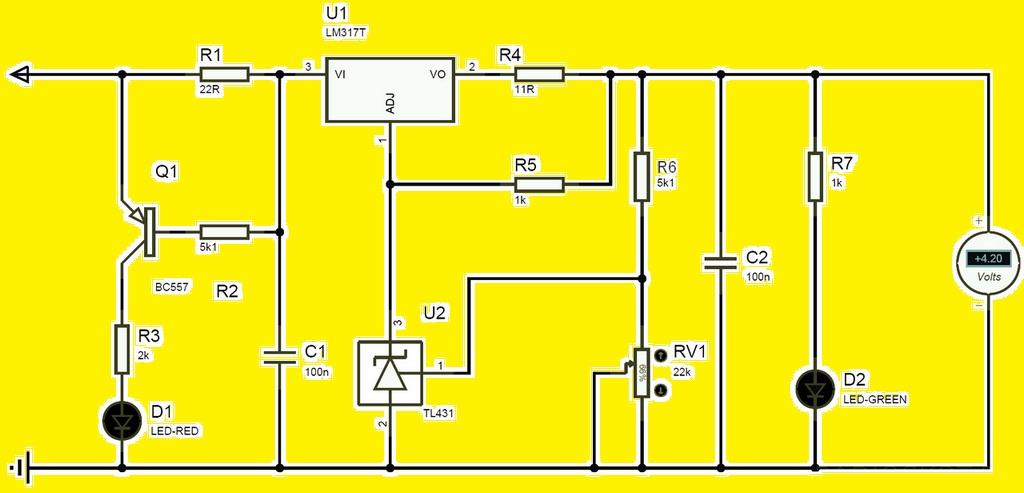
Регулировка тока осуществляется подбором резистора R4 на первоначальное значение тока зарядки. Он зависит от емкости аккумулятора. Например, если ёмкость батареи 3000 мА/ч, то ток зарядки равен 2-3 А.
Заводские системы контроля заряда самостоятельно делают регулировку этого параметра в рамках всего времени заряда.
Самодельная батарейка из подручных средств
Как можно сделать аккумуляторы, используя электролит и электроды, рассмотрено выше. Теперь о том, как быстро собрать источник тока однократного действия. Батарейка – это гальванический источник электричества, который не имеет способности восстанавливаться.
Способ первый: батарейка из лимона
Мякоть лимона содержит лимонную кислоту, она послужит электролитом. В качестве электрода выступают оцинкованный гвоздик и отрезок медной проволоки. Они втыкаются в лимон на расстоянии 50-100 мм друг от друга. Реакция окисления запускает движение электрического тока.

Способ второй: банка с электролитом
Литровую стеклянную банку используют в качестве ёмкости. В качестве электродов берутся цинковая и медная пластины. К пластинам прикрепляются провода, сами они опускаются в банку с электролитом. Им служит 20% раствор серной кислоты. Также можно использовать хлористый аммоний (нашатырь). На 100 мл воды берут 50 г. порошка. Уровень электролита не достигает края банки на 15-20 мм.
Осторожно! Работа с серной кислотой при приготовлении электролита подразумевает добавление воды в кислоту, а не наоборот. При приготовлении раствора необходимо использовать стеклянную посуду и стеклянную или деревянную палочку для перемешивания.
Способ третий: медные монеты
Принцип использования медного катода и алюминиевого анода рассмотрен в этом способе. Процесс изготовления источника тока следующий:
- по форме медных монет одного размера (медный пятак) вырезают кружочки из алюминиевой фольги и плотного картона (обложка старой книги);
- монеты очищаются путём погружения в уксус, им же пропитываются и кружочки картона;
- картон вставляется между монетой и кружком фольги, которые служат катодом и анодом.
Собранная таким образом батарея будет работать до тех пор, пока не высохнет электролит, пропитавший картонные кружки.

Способ четвертый: батарейка в пивной банке
Сам корпус пивной банки (алюминиевый) служит анодом (минус), в качестве катода используют графит. При изготовлении выполняются следующие шаги:
Способ пятый: батарейка из картошки
Это вариант использования химической реакции окисления между медными и оцинкованными полосками, в качестве электролита используется мякоть картофеля.
Внимание! Полученные напряжения таких источников настолько малы, что подобные конструкции могут служить лишь в качестве опытов для изучения происхождения электричества.

Способ шестой: графитовый стержень

Несмотря на всё разнообразие способов и видов самодельных источников тока, все они работают, благодаря электролитическим процессам и химическим реакциям окисления. Правильно подобранные пары элементов для анода и катода, а также использование подходящего электролитического раствора дают реальные результаты. Можно сделать аккумулятор своими руками для питания гаджетов и малогабаритных устройств.
Видео
Для того чтобы
ДОБАВИТЬ САЙТ В ЗАКЛАДКИ
Нажмите одновременно
(CTRL+D)
Здесь Вы обнаружите, практические советы, подсказки, идеи, схемы, чертежи, фото. Рассылка пишется для любителей мастерить, строить, самодельничать.
Узнайте первым о новых обзорах "Для умелых рук"
Чтобы прочитать новую цитату обновите страницу,или перейдите на любую другую
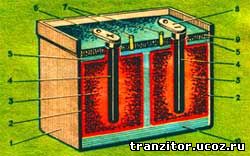
Существенным недостатком кислотных и щелочных аккумуляторов следует считать неудобство их транспортировки, так как при переноске электролит может выплескиваться из сосудов, попадать на одежду, разрушая ткань. Кроме того, эти аккумуляторы имеют большой вес и габариты. Они выгодны для юных электротехников, когда установлены на одном постоянном месте. Для различных игр и походов можно изготовить удобные сухие свинцово-поташные аккумуляторы. Они имеют небольшой вес и габариты. Электролит у них сгущен. Их легко переносить и хранить.
Сухой свинцово-поташный аккумулятор показан на рисунке. Он состоит из стеклянного или железного сосуда 5, в котором расположены два мешочных электрода. В одном мешочке помещен угольный электрод 1 с активной массой 3 отрицательного полюса, а в другом мешочке — угольный электрод с активной массой положительного полюса. Активная масса в обоих мешочках одинакова по составу — смесь свинцового глета или сурика с порошком графита. Электролитом служит раствор поташа в воде.
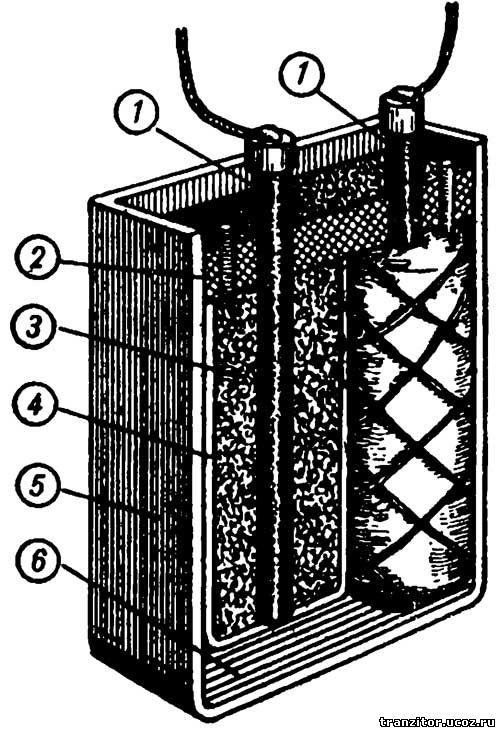
Сухой свинцово-поташный аккумулятор очень легко изготовить. Подберите какую-либо банку емкостью около пол-литра. Из сухого дерева сделайте круглую или прямоугольную болванку таких размеров, чтобы она заняла примерно половину банки. Сделайте два одинаковых мешочка 4 из фильтровальной или газетной бумаги. Для этого деревянную болванку неплотно оберните четырьмя-пятью слоями бумаги, не применяя клея. Нижний край бумаги загните на торце болванки подобно тому, как это делается при завертывании бумажки у конфет. Мешочки надо изготовить таких размеров, чтобы они, будучи вставленными в сосуд, плотно прилегали к его стенкам и друг к другу.
Теперь приготовьте активную массу. Для этого возьмите одну весовую часть свинцового глета или сурика в порошке, одну весовую часть графита в порошке и тщательно их перемешайте до получения однородной массы. Чтобы удобнее было обращаться со смесью, увлажните ее слегка электролитом (на 10 весовых частей смеси добавьте 1 весовую часть электролита), причем смесь не должна терять свойства сыпучести.
Подберите два угля от старых гальванических накальных элементов или дуговых фонарей и приступайте к сборке аккумулятора. Уложите на дно сосуда 20—30 прокладок 6 из газеты. В сосуд вставьте мешочки и заполните их активной массой почти до краев, наблюдая за тем, чтобы не запачкать верхних краев бумажных мешочков. К верхним концам углей прикрепите металлические колечки с отводами. В центры мешочков вставьте угли слегка закругленным концом вниз, при этом угли должны доходить до дна мешочков. При вставке углей не следует сильно нажимать на них, чтобы не прорвать дно мешочка. Массу нельзя подвергать прессовке.
Электролит приготовьте по следующему рецепту. Возьмите 10 весовых частей холодной прокипяченной воды и добавьте в нее 5 весовых частей поташа, все это тщательно перемешайте и наливайте электролит порциями в сосуд до тех пор, пока он не перестанет впитываться. Спустя 1—1,5 часа, когда активная масса 1 поглотит почти все количество залитого электролита, его снова доливают. Чтобы активная масса прочнее связалась с углями аккумулятора, сосуд встряхивают, слегка постукивая его дном по столу. Если в сосуде окажется избыток электролита, его нужно отсосать пипеткой.
Вставьте в активную массу по одной влажной спичке и залейте аккумулятор расплавленной смолой 2 или варом. Когда смола затвердеет, выньте спички. В образовавшиеся отверстия неплотно вставьте деревянные пробочки — и аккумулятор готов.
Теперь его надо зарядить. Средний зарядный ток для сухого аккумулятора 1 ампер на 1 кв. дециметр поверхности любого электрода, а разрядный ток в 5 раз меньше. Емкость достигает до 1,5 ампер-часа на 100 граммов веса аккумулятора. Внутреннее сопротивление — от 0,08 до 0,15 ома на 1 кв. дециметр любого электрода.
Перед тем как приступить к зарядке аккумулятора, надо включить его в зарядную цепь. Один полюс аккумулятора соедините с плюсом источника зарядного тока, а другой полюс — с минусом источника через реостат. Первый электрод аккумулятора обозначьте плюсом ( + ), а второй — минусом (—). Эта полярность должна строго сохраняться при эксплуатации и последующих зарядках аккумулятора. Зарядку следует прекратить, как только э. д. с. аккумулятора достигнет 2—2,4 вольта. Перед каждой зарядкой открывают пробочки и заливают по нескольку капель воды. Чтобы получить аккумуляторную батарею, необходимо изготовить несколько таких аккумуляторов и соединить их последовательно.
По материалам книги "Пионер-электротехник", Детгиз 1960
Автор П. Стрелков
Рисунки по эскизам автора выполнены М. Симаковым
Читайте также:


