Как сделать хлорат натрия в домашних условиях
,ОП ИСАНИ Е ИЗОБРЕТЕНИЯ К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ Своз СфветскикСоциалистическихРеспублик(5)М. Кл. С 01 В 11/14 ЙсуВфствеккм 1 квюитвт ССВР ае делам кзебретеивй и вткрмтий(53) УДК 661. .442 (088.8) Дата опубликования описания 23,02.83(54 СПОСОБ ПОПУЧЕНИ АТРИЯ РА Изобретение относится к химическоймышленности, а именно к области поения хлората натрия,ио Известен способ получения хлората натрия состоящий из последовательных стадий электролиза хлорна-хлоратных растворов с применением на стадии доочистки от хлора соединений трехвалент-. ного хрома 1 ),ми данногоергоза трать Недостася большие етода являют осе+ и загрязнени нениями трех И олучается рита натри Известен также каустический способ получения хлората натрия, заключающийся в получении слабых щелоков путем :электролиза раствора ЯаЦ,с последук- шим их хлорированием до хлората нат.рия. Растворы хлората натрия в дальнейшем используются для получения бертолетовой. соли. Недоста ются большоведен ика до хлвания про пера сына раствора токсичными свалентного хрома. Получение хлората натрия в процхлорирования гидроокиси натрия идследующим реакциям: се+н,о =нсСо+нсеЙООИНСВО=ЙаОС 6 +ИОМа ОСЕ+йисЕО=нас ЕО+-СИСА.НаОН+НСЕ =йасЕ+НОСуммарно хлорирование раствора ыражается уравнением 6 йаОН+ ЪСС 2= йаСЕО пий видно, что хлорат натрия путем окисления гинохлоя хлорноватистой кислотой 12,). ком известного способа явлт- ие энергозатраты и трудность процесса хлорирования каус-. ората натрия, конец хлорироекает с резким повышением ы, что часто приводит к выраствора из аппарата,3 9983Белью изобретения является удешевление продукта и обеспечение безопаснос,зи ведения процесса,Поставленная цель достигается тем,что согласно способу получения хлоратанатрия окислением раствора гипохлората натрия, окисление ведут углекислым газом до рН 7,5-8,5 с последующим облучением ультрафиолетовым светом, 10В качестве исходного сырья используются отходы растворов гипохлоританатрия с содержанием 120-140 г/лИЗО 10-40 г/л - МАССО, 100-140 г/лИОС, 10-40 г/л -11001, которые обра- дзуются при поглощении абгазов хлорагидроокисью натрия, Например, в,производстве фреонов и каустика диафрагмен. кым методом,.Если содержание щелочи в растворегипохлорита будет ниже 2 г/л, то может пойти самопроизвольное разложениегипохлорита натрия с образованием хлора, если будет более 3 г/л, то растворхлората натрия будет загрязнен карбонатом натрия, который образуется при взаимодействии гидроокиси натрия с углеюислым газом,Установлено, что при обработке раствора газам до рН 8,5-7,5 в растворе30 присутствует гипохлорит натрия и хлор новатистая кислота, хлора в абгазах не обнаружено, что указывает на отсутствие разложения активного хлора по хлорному методу, Если подачу углекислого газа 35 прекратить при рН среды выше 8,5, то хлорноватистой кислоты в растворе еще недостаточно и после облучения в растворе остается гипохлорит натрия, следовательно при этом снижается процент 40выхода хлората натрия. При рН среды ниже 7,8 наблюдается частичное раэло жение активного хлора с выделением хлораП р и м е р 1. Раствор гипохлорита 43 натрия, содержащий 121,0 г/л ЙООСЕП 41,2 г/л ЮСЕО,; 140 г/л сС8,3 г/л НОВ, в количестве 100 мл наливают в кварцевую колбочку, при температуре 15 оС и непрерывном перемешиванин раствора магнитной мешалкой подают углекислый газ до снижения рН среды а 11,2 до 7,5. После этого подачу угпекислого газа прекращают. и раствор облучают ультрафиолетовым светом, В ка 33 честве источника ультрафиолетового излучения используют лампу БУВ, ко-торая имеет следующие электрические 27 4характеристики: мощность 15 Вт, ток0,3 А, напряжение на лампе 57 В, световой поток 130 лм, диапазон длин войн577-254 нм, Лампу располагают нарасстоянии 100 мм от колбочки и облучают раствор в течение 40 мин,По истечении указанного времени гипохлорит натрия полностью превращаетсяв хлорат и в растворе содержится 94, 1 г,МС 00, 207,1 МОС 1, 0,7 г/л ЙО 2 СОВыход хлората натрия по сравнению соретическим составляет 99,3%. Выдешиеся при обработке абгазы поглоша-ют раствором гидроокиси натрия. Прианализе в растворе были обнаруженыследы МОСГ, что указывает на отсутствие побочных реакций в процессе окисле-.ния гипохлорита в хлорат.П р и м е р 2. Раствор гипохлоратанатрия, содержащий 119,3 г/дфООСР,36,2 г/л ЙОЯО 132,5 г/л МОСЕ и41,0 г/л ЙСОН, подвергают хлорирова:нию до достижения щелочности 5 г/лБООИ, После чего. раствор в количестве 100 мл наливают в кварцевую колбочку и подают углекислый газ при температуре 15 С до снижения рН средыс .11,2 до 8,5. После этого подачу углекислого газа прекращают и раствороблучают ультрафиолетовыми лучами, Вкачестве источника ультрафиолетовогоизлучения используют лампу БУВ,Электрическая характеристика лампыуказана в примере 1, Лампу располагаютна расстоянии 100 мм от колбочки исблучают раствор в течение 40 мин.По истечении указанного времени гипохлорит натрия полностью превращается вхлорат и в растворе содержится 107,2 г/лКОСОГО 237,1 г/лйаСС и 0,6 г/лМО СО, Выход хлората натрия по сравнению с теоретическим составляет 99,5%,В процессе подачи углекислого газа иоблучения раствор перемешивают на магнитной мешалке, В растворе гидроокисинатрия после поглощения абгазов обнару-жень следы йСЗОС 8Гр и м е р 3. (рН 5,9,МаОН 5,1 г/л)В кварцевую колбочку наливают 75 мл раствора гипохлорита натрияс содержанием 140,1 г/л ЙООСЕП, 31,4 г/лМОСЮ 170 г/л ЙОС, 51 г/л КООИи при температуре 15 оС и непрерывномперемешивании раствора магнитной мешалкой подают углекислый газ до снижения рН среды с 1.1;2 до 5,9. После этого подачу углекислого газа прекращаюти раствор облучают в течение 40 мин.9983 Источники информации,принятые во внимание при экспертизе 1. Авторское свидетельство СССР 2 Ме 431099, кл,С 25 В 1/26 1974. 2, Шрайбман С, С, Производство бертолетовой соли, ГОНТИ НКТП, 1936,с. 156-164, (прототип).7237,1 г/л Йбйи 0,6 г/л МЮСОр,Выход хлората натрия по сравнению с,теоретическим составляет 99,5%. Врастворе гидроокиси натрия после пог-,лощения абгаэов обнаружены следы ЙООИ 3П р и м е р 8. (рН 9, ЙЬОН -4,9 г/л).В кварцевую колбочку заливают 100 млраствора гипохлорита натрия с содержаелем 147,8 гlл ЙООЙ, 28,1 г/лКЬС 1 С181,0 г/л )49 Й и 4,9 г/л МООНи при 1 фтемпературе 15 С и непрерывном пере 0мешивании раствора магнитной .мешалкойподают углекислый газ до снижения рНсреды с 11,2 до 9. После этого подачууглекислого газа прекрашают и раствор 1 фобпучают в течение 40 мин ультрафио-летовыми лучами, В качестве источникаультрафиолетового излучения используютлампу БУВс электрической характеристикой, указанной в примере 1. После облучения в растворе содержится15,7 г/лЙООС, 252,8 г/л ИОСИФО0,6 г/л МО,рСОЗ, Выход хлората натрияпо сравнению с теоретическим составляет 89; 3%,В растворе гидроокиси натрия послепоглощения абгаэов определена только ЙС 10 Н. 27 8Предлагаемый способ позволяет болеерационально испольэовать отходы гипохлорита натрия с полученйем более дешевого и необходимого для народного хозяйства хлората натрия. Растворы хлората натрия могут использоваться для получения бертолетовой соли или анилиновых красителей. формула изобретения Способ получения хлората натрияокислением раствора гипохлорита натрияотличаюшийсятем, чтоспвлью удешевления продукта и обеспечения безопасности ведения процесса,окисление ведут углекислым газом дорН 7,5-8,5 с последуюшим облучениемультрафиолетовым светом, Составитель Н. ЯрмолюкРедактор Г. Волкова Техред МГергель КоРРектоР С, ШекмарЗаказ 1088/36 Тираж 469 Подписное ВНИИПИ Государственного комитета СССР по делам изобретений и открытий 113035, Москва, Ж, Раушская набд, 4/5 филиал ППП "Патент", г. Ужгород, ул. Проектная, 4
Заявка
ПРЕДПРИЯТИЕ ПЯ Р-6751
БРУСОВА НАДЕЖДА ПЛАТОНОВНА, ГНАТЮК МИХАИЛ ИВАНОВИЧ, ГОЛУБКОВА ТАТЬЯНА ЛЕОНТЬЕВНА, СОТНИК АЛЛА НАУМОВНА, ШМИДТ ЛЮДМИЛА ПАВЛОВНА
Производство кислородные соединения хлора

Хлорокислородные кислоты и их соли являются окислителями. Окислительную активность и кислотные свойства их можно изобразить в виде следующего ряда:
Увеличение кислотных свойств
Увеличение окислительной активности
Получение гипохлорита натрия
Гипохлорит натрия — энергичный окислитель и применяется при отбеливании высококачественных тканей из растительных волокон, а также в металлургии цветных металлов. Он хорошо растворим в воде и не дает, подобно хлорной извести, крупинок, которые могли бы повредить тонкий текстильный материал. Гипохлорит натрия не стоек и со временем разлагается. Его получают химическим способом взаимодействием хлора и щелочи по реакции:
Сl2 + 2NaOH → NaClO + NaCl + Н2O
Электролитический способ получения гипохлорита натрия был открыт около 1882 г., почти одновременно в России (А. П. Лидов и В. А. Тихомиров) и за границей . Этот способ основан на получении хлора и его взаимодействии со щелочью в одном и том же аппарате — электролизере. Если вести электролиз раствора NaCl в ванне без диафрагмы, то на катоде будет выделяться водород и образовываться щелочь, а на аноде идти разряд ионов хлора. Образующийся на аноде хлор растворяется в электролите и взаимодействуя со щелочью, дает гипохлорит натрия. Последний в значительной степени диссоциирует с образованием ионов СlO — , которые способны к дальнейшему анодному окислению. Поляризационная кривая окисления СlO — лежит при менее электроположительных потенциалах, чем кривая разряда ионов Сl — , вследствие чего по мере накопления СlO — будет происходить все более интенсивное их окисление:
6СlO — +3Н2O — 6 е → 2СlO3 — + 6Н + + 4Сl — +1,5O2
Этот процесс ведет к снижению выхода по току в расчете на гипохлорит натрия. Поэтому электролиз следует вести в условиях, обеспечивающих минимальное перенапряжение при выделении хлора, и при невысокой концентрации СlO — в прианодном слое электролита. Повышенная температура снижает перенапряжение при выделении хлора, но приводит к ускорению разложения гипохлорита натрия. Полученный гипохлорит на катоде восстанавливается:
Чтобы воспрепятствовать восстановлению гипохлорита, в элек« тролит добавляют небольшие количества (0,1%) Na2Cr2O7, СаСl2 или канифольного мыла. Эти добавки вызывают образование пленок на поверхности катода, препятствующих подходу к нему ионов СlO — .
Процесс электролиза проводят при температуре электролита 20—25° С. Исходный электролит содержит 150—160 г/л NaCl. Можно применять графитовые аноды и катоды. В одной из предложенных конструкций электролизеров графитовые электроды включаются биполярно. Плотность тока достигает 1400 а/м 2 . Напряжение между электродами 3,7—4,2 в. В начале процесса выход по току достигает 95%, при накоплении 10—12 г/л активного хлора выход по току падает до 50—55%. При этих условиях расход энергии на 1 кг активного хлора достигает 6,5 кет • ч, а расход NaCl 12— 14 кг.
Химический способ получения гипохлорита натрия оказывается более экономичным, требует меньше хлорида натрия, дает более концентрированный и чистый продукт. Поэтому электролитический способ получения гипохлорита натрия может конкурировать с ним только в том случае, когда получение хлора и его хранение затруднено.
Получение хлоратов
Хлораты — сильные окислители и поэтому их применяют для приготовления пиротехнических составов. КСlO3 используют в спичечном производстве. Смесь Са(СlO3)2 и СаСl2 в виде раствора применяют для уничтожения травы на железнодорожных путях. Хлораты также служат исходным сырьем для получения перхлоратов.
Промышленный способ электролитического получения хлоратов был разработан французскими учеными Галлем и Монтлором в 1886 г.
Электрохимически ионы ClO 3 образуют в нейтральной растворе, как указано выше, за счет разряда ионов СlO — .
На 2 г-ион ClO — 3 требуется затратить 6 F электричества и кроме того, 1 2 F нужно израсходовать на образование 6 г-ион СlO — .
Таким образом, на каждый электрохимически полученный г-ион нужно затратить 9 F. Из них 3 F идет на образование 1,5 г-ат кислорода. Следовательно, теоретически выход по току на хлорат не может превышать 66,7%. В кислой среде выходы по току могут превышать эту величину, так как наряду с разрядом СlO — идет образование хлората чисто химическим путем за счет окисления иона гипохлорита хлорноватистой кислотой:
2HClO + NaClO → NaClO3 + 2HCl
Для получения 1 г-мол NaClO3 по этой реакции необходимо всего 6F (по 2F на образование каждого г-мол НСlO и NaClO). Побочной реакцией на аноде является разряд ионов ОН — (или восстановление молекул воды). Следовательно, нужно выбрать условия, обеспечивающие высокое перенапряжение выделения кислорода. Поэтому в качестве материала анода применяют графит. Раньше применяли также платиновые и магнетитовые аноды. Низкие температуры способствуют повышению перенапряжения кислорода и, следовательно, высоким выходам по току, но при повышенных температурах ускоряется реакция химического образования хлората. Катодный процесс сводится к выделению водорода. Так как хлорноватистая кислота и гипохлорит натрия связываются в хлорат, то концентрация их остается невысокой, и при этих условиях выхода по току хлората могут превосходить 90%.
Образовавшийся хлорат подвергается восстановлению на катоде. Для предотвращения восстановления применяют защиту катода пленкой основных соединений хрома. С этой целью в электролит вводят 5—6 г/л Na2Cr2O7.
Для поддержания слабокислой реакции в электролит систематически вводят небольшие количества НСl (концентрация ее в электролите 0,5—0,6 г/л). Добавка в раствор Na2Cr2O7, кроме предотвращения катодного восстановления хлората, является, в известных пределах, регулятором и индикатором кислотности, за счет реакции:
При образовании щелочи равновесие сдвигается слева направо. Избыточная щелочь нейтрализуется ионами водорода, а цвет раствора меняется от оранжевого до желтого. Наоборот, при подкислении равновесие сдвигается влево, избыточная кислота связывается, а цвет раствора становится оранжевым за счет образования бихромата. Электролиз обычно ведут при рН = 6—7, и температуре 40—50° С, так как при более высоких температурах стой кость графитовых анодов резко уменьшается. Регулировка темпе ратуры производится при помощи железных змеевиков с охлаждающей водой, которые, во избежание коррозии, находятся под катодной защитой.
Если присутствие хромовых соединений в хлорате недопустимо, то электролиз можно вести без добавления Na2Cr2O7 с высокой катодной плотностью тока и охлаждаемыми катодами.
Существуют ванны разных конструкций на нагрузку от 1000 до 20 000 а.
Хлорат натрия NaClO3 имеет ограниченное применение, так как эта соль гигроскопична, однако непосредственное получение КСlO3 в электролизере затруднительно ввиду невысокой растворимости этой соли. Поэтому ведут электролиз смешанного электролита NaCl и КCl, который получается в виде оборотного продукта после выделения КСlO3 согласно обменной реак ции:
При получении КСlO3 электролизом смешанного электролита раствор, поступающий в ванны, содержит 70— 100 г/л КСlO3; 180 —220 г/л NaCl; 100—130 г/л КСl и 5—6 г/л Na2Cr2O7 при содержании НСl 0,6—0,7 г/л. Ванны располагаются каскадом. Из нижней ванны каскада получают раствор, содержащий: 150— 200 г/л КСlO3 80—120 г/л NaClO3; 60—70 г/л КCl; 140—160 г/л NaCl. Этот раствор подается в аппарат с мешалкой, где нагревается до 100° С и реагирует с КО, добавляемым в твердом виде. После этого в растворе содержится: 270— 300 г/л КСlO3; 180—200 г/л NaCl и 100—130 г/л КCl. Раствор охлаждают до ,35—40° С и выделяют кристаллы
В случае необходимости кристаллы КСlO3 подвергают перекристаллизации. Маточный раствор корректируют до первоначального состава и возвращают на электролиз,
Условия электролиза для смешанного электролита не изменяются. Расход энергии несколько ниже, чем для NaClO3и составляет около 6000 квт • ч на 1 т КСlO3.
На получение 1 т КСlO3 расходуют 0,61—0,65 т КCl; 15—20 кг НCl; 1,5—2,0 кг K2Cr2O7.
Получение перхлоратов и хлорной кислоты
В хлорной кислоте содержится 64% кислорода. В ряду кислородных кислот хлора это наиболее сильная и устойчивая кислота. Ее применяют в гальванотехнике, фотографии, в некоторых гальванических элементах и как окислитель. Хлорнокислые соли (перхлораты) используют в пиротехнике и в технологии взрывчатых веществ. Перхлорат магния применяют как осушающее вещество.
Перхлораты могут быть получены химическим и электрохимическим путями. Электрохимический способ получения перхлоратов и хлорной кислоты был открыт Стадионом. При электрохимическом способе электролизу подвергается раствор хлората натрия. Образующийся при этом перхлорат натрия перерабатывается путем конверсии в перхлорат калия или аммония, а также в хлорную кислоту. Самостоятельное использование перхлората натрия ограничено вследствие его высокой гигроскопичности.
При электролизе анодная реакция протекает по уравнению:
На катоде разряжаются ионы водорода:
Суммарная реакция в ванне может быть представлена уравнением:
Следовательно, в ванне не должно происходить, заметного изменения кислотности.
Потери тока происходят вследствие частичного разряда ОН — и при малой концентрации СlO — 3 в конце процесса, становятся значительными. Для нормального хода электролиза необходимо поддерживать кислотность в пределах 0,1—0,15 г/л НСl. При избытке кислоты происходит химическое разложение хлората, возможен также разряд ионов хлора на аноде.
Анодным материалом может служить только платина, применяемая в виде тонкой фольги, проволоки или сетки или платинированный титан. Лучшими катодными материалами являются никель, нержавеющая сталь и графит. При использовании железных катодов рекомендуется во избежание восстановления вводить в электролит 0,5% Na2Cr2O7.
В исходном электролите содержится 500—700 г/л NaClO3. К концу электролиза содержание NaClO4 доходит до 900—1000 г/л (за счет увеличения молекулярного веса и отчасти испарения воды). Электролиз ведут при 30—60°С с анодной плотностью тока 3000—7000 а/м 2 и с катодной 1000—2000 а/м 2 . Начальный выход по току около 95%, к концу процесса при концентрации NaClO3 ниже 50 г/л выход по току падает до 40%. Средний выход по току составляет 85%. Напряжение на ванне при межэлектродном расстоянии 10 мм, температуре 40° С и анодной плотности тока 4000 а/м 2 равно около 6,0 в. Расход энергии при этих условиях 3000—3-200 квт • ч на 1 т NaClO4. Для получения KCl O4 проводят конверсию с хлоридом калия, а для получения NH4ClO4 рекомендуется вести обменное разложение с (NH4)2SO4, так как при использовании хлорида аммония одновременно с перхлоратом аммония выделяется NaCl.
В качестве анода можно использовать электролитически осажденную РbО2. С этой целью проводят электролиз раствора Рb (NO3 )2 с никелевым, угольным или танталовым (предварительно никелированным или платинированным) анодом. Во избежание катодного осаждения свинца к электролиту добавляют Сu(NO3)2. На аноде осаждается слой РbО2 толщиной около 3 мм. При использовании РbО2 в качестве анода для получения перхлоратов к раствору NaClO3 добавляют 0,5 г/л NaF и не вводят N а2Сr2O7. Анодную плотность тока поддерживают равной 1500 а/м 2 , а катодную 700 а/м 2 . Процесс протекает при напряжении 4,7—5,7 в с выходом по току 90%.
Наличие в перхлорате более 0,2% хлората значительно повышает его взрывоопасность. Поэтому стремятся к полному окислению хлората в перхлорат. При этом однако к концу процесса резко падает выход по току и на аноде выделяются значительные количества кислорода. Небольшой остаток хлората в электролите можно разрушить добавкой соляной кислоты.
Получение перхлората натрия возможно и непосредственно из раствора NaCl, перетекающего через каскад электролизеров.
Хлорную кислоту можно получить действием концентрированной соляной кислоты на твердый NaClO4:
При проведении этой реакции необходимо пользоваться перхлоратом с содержанием хлората не свыше 0,5%, в противном случае возникает опасность взрыва.
Хлорид натрия в этих условиях почти количественно выпадает в осадок.
Хлорную кислому можно получать и непосредственно электролизом. Еще в 1898 г. Габер и Гринберг показали, что хлорная кислота может быть получена на гладком платиновом аноде непосредственно электролизом разбавленных растворов соляной кислоты. При этом на аноде протекают одновременно реакции окисления молекул воды и ионов хлора, образования хлорноватой кислоты и окисления
СlO — 3 до СlO — 4. Последний процесс в зависимости от условий электролиза и концентрации соляной кислоты может протекать с выходом по току от 0 до 45— 50%). Сильное влияние на выход по току хлорной кислоты оказывает плотность тока. Как показали опыты К. Г. Ильина и Д..|П. Семченко, при анодной плотности тока 500 а/м 2 выход по току едва достигает 15%. а на аноде в основном выделяется хлор. С возрастанием плотности тока выход по току в расчете на хлорную кислоту возрастает, а при 4000 а/м 2 достигает 40—45%. Диаграмма баланса анодных реакций при этой плотности тока и температуре 25° С.
Выход по току данного продукта определяется величиной отрезка между линиями, ограничивающими поле этого продукта на перпендикуляре, восстановленном из точки, отвечающей концентрации соляной кислоты. Из рис. 196 следует, что при концентрации НСl 0,1 моль/л на выделение хлора расходуется примерно 25% тока, на выделение кислород; 30%, на образование НСlO4 —40% и на катодное восстановлен анодных продуктов — 5%,. Образования НСlO3 в этих условиях почти не происходит. Концентрация соляной кислоты также оказывает очень сильное влияние на характер анодных процессов. С ростом концентрации соляной кислоты большое развитие получает процесс выделения хлора, а доля тока, идущая на выделение кислорода, падает.
При средних концентрациях значительная часть тока расходуется на образование хлорноватой кислоты. Максимальный выход по току хлорной кислоты соответствует 0,1 н. раствору НСl. При более высоких и более низких концентрациях соляной кислоты выход по току хлорной кислоты падает, и, например, при 0,4 моль/л НСl практически становится равным нулю.
Для образования на аноде хлор ной кислоты требуется высокое перенапряжение выделения хлора и кислорода, чему способствует низкая температура электролита. Так, если в условиях описанных выше опытов поднять температуру при электролизе с 25 до 50° С, то выход по току хлорной кислоты уменьшится примерно в 2 раза.
Анодный потенциал процесса образования НСlO4 очень высок и достигает при плотности тока 4000 а/м 2 и температуре 20° С 3 ,4 в.
При длительной работе и непрерывном добавлении соляной кислоты возможно получение растворов, содержащих значительные концентрации хлорной кислоты.
Статья на тему Кислородные соединения хлора
Похожие страницы:
Содержание статьи1 ЧТО ТАКОЕ ЖЕЛЕЗНЕНИЕ1.1 Растворы для железнения1.2 Какие применяют аноды ЧТО ТАКОЕ ЖЕЛЕЗНЕНИЕ Железнение — это нанесение слоя железа.
ХЛОРИД НАТРИЯ ( Натрий хлор , поваренная соль , каменная соль ) NaCl . Получают из природных источников , соляные.
Кислородные соединения галогенов Галогены не соединяются непосредственно с кислородом, поэтому их кислородные соединения получаются только косвенным путем и представляют собой.
ХЛОРОВОДОРОД И СОЛЯНАЯ КИСЛОТА В лаборатории хлороводород получают действием серной кислоты на хлорид натрия: NaCl + H2SO4 = HCI +.
ЧТО ТАКОЕ КАДМИРОВАНИЕ Это нанесение на поверхность металлических изделий слоя кадмия. Кадмиевые покрытия (толщиной 7—20 мкм) защищают изделия (преим. стальные).
Что такое сульфат натрия Na2SO4 Получение сульфата натрия Получают при получении соляной кислоты из хлорида натрия с серной кислотой (.
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH - | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | - | - | Н | Н | Н | |
| F - | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | - | Н | Р | Р |
| Cl - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | - | - | - | Н | - | - | Н | - | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | - | Н | ? | Н | Н | ? | М | М | - | Н | ? | ? |
| HSO3 - | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | - | Н | Р | Р |
| HSO4 - | Р | Р | Р | Р | Р | Р | Р | Р | - | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р |
| NO2 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | - | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO - | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р | Р | - | Р | Р | Р | Р | Р | Р | Р | - | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые (
Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую:
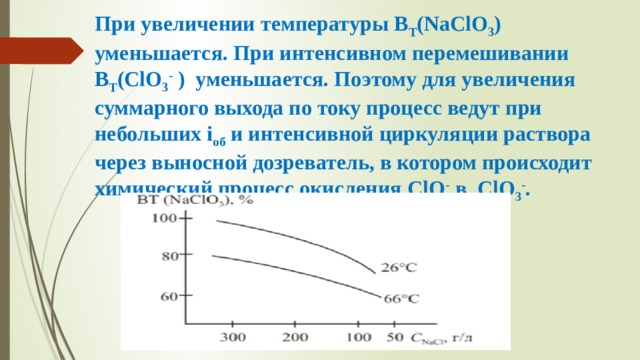
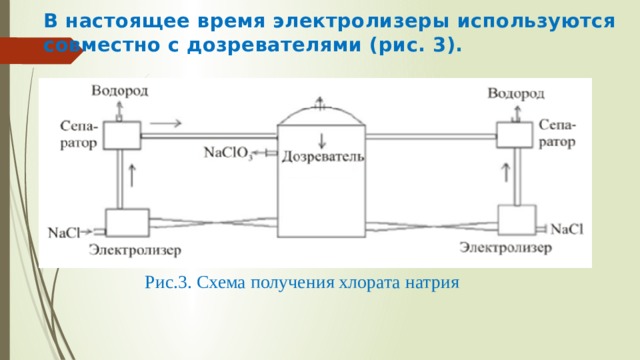
Скопируйте эту ссылку, чтобы разместить результат запроса " " на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки - помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация - такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Соли хлорной кислоты (хлораты) используются в органическом синтезе, пиротехнике, в производстве спичек, гербицидов, красящих веществ, перхлоратов (ClO 3 - ). Наиболее применимы NaClO 3 и KClO 3 (бертолетова соль). Хлораты можно получать электролизом раствора NaCl в бездиафрагменном электролизере. Процессы на электродах Катодный процесс Анодный процесс Хлорноватистая кислота взаимодействует со щелочью: НClO + ОН – ↔ ClO – + Н 2 О (4) Образующиеся анионы ClO – окисляются на аноде: 6ClO – + 3H 2 O – 6e→ 2ClO 3 – + 6H + + 4Cl – + 3/2О 2 (5) В растворе протекает химическая реакция: NaClO + 2HClО → NaClO 3 + 2HCl (6) Выделяющийся на катоде водород может восстанавливать ионы ClO - и ClO 3 - : ClO - + H 2 →Cl - + H 2 O (7) ClO 3 - + 3H 2 → Cl - + 3H 2 O Для предотвращения протекания побочных реакций вводят добавку K 2 Cr 2 O 7 . Получение хлоратов возможно в результате: 1) химического окисления NaClO хлорноватистой кислотой; 2) анодного окисления иона ClO - . Соотношение между скоростями реакций зависит от условий электролиза. Для получения хлоратов обычно используют концентрированные растворы (до 280 г/л) NaCl, т. к. при уменьшении концентрации исходного раствора B T (ClO 3 - ) уменьшается. Аноды – графитовые, металлооксидные (ОРТА, Fe 3 O 4 , Ti–PbO 2 , ПТА). Графитовые аноды разрушаются, особенно при i = 0,8– 1,0 кА/м 2 и увеличении температуры от 40 до 50ºС. Оптимальный износ графитовых анодов 6–8 кг/т ClO – . С повышением анодной плотности тока B T (ClO 3 - ) увеличивается . Рис.1 Влияние рН раствора на выход по току хлората При значении рН = 6,0–6,8 скорость химической реакции максимальна (рис.1). Значение рН поддерживают постоянным, вводя HCl и используя буферные свойства бихромата в этой области рН Cr 2 O 7 2- + H 2 O → 2CrO 4 2- + 2H + При увеличении температуры В Т (NaClO 3 ) уменьшается. При интенсивном перемешивании B T (ClO 3 - ) уменьшается. Поэтому для увеличения суммарного выхода по току процесс ведут при небольших i об и интенсивной циркуляции раствора через выносной дозреватель, в котором происходит химический процесс окисления ClO - в ClO 3 - . В настоящее время электролизеры используются совместно с дозревателями (рис. 3). Рис.3. Схема получения хлората натрия В электролизерах протекает электролиз водного раствора хлорида натрия с образованием NaClO и HClO 3 . Электролит за счет подъемной силы Н 2 поднимается по трубам и поступает в сепараторы, где отделяется от жидкости. Далее электролит поступает в дозреватель, где при повышении температуры идет химическая реакция. После накопления NaClO 3 до 550–600 г/л раствор отводят. NaClO 3 получают в твердом виде либо выпариванием, либо вымораживанием при охлаждении до –2– (–10)ºС. Определяющим фактором в выборе технологической схемы производства NaClO 3 является соотношение цен на пар и на электричество Читайте также:
|