Из чего состоит аккумулятор телефона
Узнать, из чего состоят аккумуляторы телефона можно, только разобрав его самостоятельно. И то, куча непонятных деталей для неспециалиста мало о чем скажет. Еще один нюанс – разбор батарейки опасная вещь, возможны даже взрывы. Проще – детально изучить устройство, основные элементы и принцип работы батареи из статьи.
Как устроен и работает аккумулятор телефона?
С виду батарея мобильной техники – небольшой блок и информацией о производителе на поверхности. Чтобы разобраться в особенностях этой детали, нужно детальнее осмотреть устройство аккумуляторов смартфонов.
Принципы и устройства аккумулятора
Батарея телефона, благодаря своим химическим и физическим свойствам является живительным элементом для процессора, дисплея и других частей.
Принцип, по которому работает аккумулятор:
- Ионы лития попадают в специальную решетку графита.
- Ионы при контакте с молекулами углерода создают химическую реакцию.
- Происходят разрывы.
- В результате реакции вырабатывается энергия.
- Энергия оседает на полюсах аккумулятора в форме электричества.
Долгое время производители питательных элементов трудились над одной проблемой. Дело в том, что литий внутри аккумулятора – жидкий. Это плохо сказывалось на стабильности его химических свойств. Когда появлялись трещины на корпусе – жидкий состав просто вытекал. Несмотря на такие недостатки, жидкий вариант обладал низким сопротивлением, поэтому лучше выполнял функции, чем сухой.
Современные батарейки сочетают в себе качественную работу Li-Ion и сухих частиц. Принцип работы аккумуляторов телефона основан на тех же ионах лития, но в устройстве установлен сухой сепаратор. Риск возникновения химических реакций сведен к минимуму. Механизм устроенный так, что при правильной эксплуатации батарейки она не взорвется.
Что внутри батарейки?
Самые сложные элементы аккумуляторов мобильников находятся внутри корпуса. Можно изучить их конструкцию и основные функции. Кроме банки с ионами лития и сепаратора, конструкция оснащена контроллером.
Контроллер – это «мозги» батареи сотового, состоит из таких элементов:
- Резисторы (в схеме питания, защиты).
- Терморезистор.
- MOSFET-транзисторы.
- Микросхема.
- Конденсатор накопления.
Контроллер выполняет следующие функции:
- Контроль заряда. Аккумуляторы телефонов заряжаются постепенно. Первых 10% с невысокой скоростью, потом ускорение до 80%, и конечный этап – замедление. С высокой скоростью заряжается лишь «средняя часть» батарейки, такая особенность работы для снижения нагрузки.
- Защита от перезаряда. Ток от сети поступает, но при достижении напряжения в 4,2 В питание автоматически останавливается.
- Защита от разряда. Установлено и минимальное напряжение, на уровне, примерно в 2,9 В. Даже если процент упал до 0, и мобильный телефон выключился, в аккумуляторе остается небольшой запас. Если его не будет – потеряется полезная емкость.
- Ограничение тока. Напряжение не всегда стабильно, великие скачки или короткое замыкание – однозначно повредят батарею. Это плохо скажется на длительности срока эксплуатации. Ограничитель препятствует этому.
- Балансировка батареи. Это конструкция, состоящая из последовательных электронных элементов. Такая схема обеспечивает равномерный заряд разных частей. От функции зависит долговечность батарейки.
- Контроль за температурой. В каждой батарейке установлен терморезистор. Он контролирует температуру и при надобности защищает устройство от перегрева или переохлаждения.

Корпус для батареек и из чего он сделан
После ознакомления с тем, как устроен аккумулятор телефона, остается ознакомиться с корпусом этой детали.
Он состоит их двух слоев:
- Верхний слой. Пластиковое покрытие. Изолирует банку батареи, защищает ее от воздействия внешних факторов. Еще на покрытии производитель печатает информационный блок.
- Внутренний слой. Это – металл. Материал твердый и прочный, защищает внутренности от повреждений.
Производители аккумуляторов для техники используют металл с определенным показателем эластичности. Это делается для того, чтобы корпус выдержал деформации в случае вздутия батареи.
Примерный химический состав аккумуляторов телефона
Современные производители батареек для смартфонов применяют три класса катодных соединений:
- Кобальт лития. LiCoO2.
- Литий-марганцевая шпинель LiMn2O2.
- Литий-феррофосфат LiFePO4.
Электрохимические цепочки батарей телефонов будут состоять из следующих элементов:
- Литий-кобальтовые: LiCoO2 + 6C → Li1xCoO2 + LiC6
- Литий феррофосфатные: LiFePO4 + 6C → Li1xFePO4 + LiC6
Чтобы понять, как работает и какие функции выполняет батарея смартфона – следует изучить его устройство. Тогда станет понятно, какой элемент за что отвечает, и какие материалы используются.

Тысячи мобильных гаджетов нуждаются в бесперебойных поставках энергии в свои маленькие тела. Энергоносителем для таких устройств выступают аккумуляторы, запасающие электричество в ячейках. В отличие от обычных батареек, они способны выдержать до 15 000 циклов заряда-разряда.
Устройство аккумулятора
Классическая батарея — банка с положительно заряженным графитовым анодом и отрицательно заряженным катодом, между которыми находится пористая прокладка, покрытая активным веществом — электролитом. Электрический заряд хранит в себе положительно заряженные ионы, выстраивающиеся в кристаллическую решетку токопроводящего электролита. При зарядке, ток гонит ионы к аноду, при разрядке они меняют свое направление, отправляясь обратно к катоду.
Сейчас выделяют три основных типа перезаряжаемых батарей: металл-гидроидные (Ni-MH), никель-кадмиевые (Ni-Cd) и литий-ионные (Li-ion).
В свою очередь литиевые подразделяются на кобальтовые, марганцевые и титанатные. Именно о них мы и поговорим в данном блоге, ведь только Li-ion оптимально зарекомендовали себя среди мобильных устройств.
Литиевое семейство
LiCoO2 — химическое соединение литий-кобальта, которое отличается высокой энергоемкостью с номинальным напряжением в 3,6 В и пиковым — 4,2 В. Легкие, емкие, быстро заряжаются и гарантированно обеспечивают стабильную работу шуруповерта, ноутбука, телефона на протяжении до 1000 перезарядок. Единственный минус — высокая цена кобальта, из которого делают катод.

LiMn2O4 — литий-марганцевые батареи имеют более высокое напряжение при сниженном жизненном цикле — 700 перезарядов. Применяются в энергоемких гаджетах.
LiNiMnCoO2— удачный результат симбиоза, получивший неоспоримое преимущество. Литий-никель-марганец-кобальтовые аккумуляторы могут перезаряжаться до 2000 раз, в каждой банке до 2800 мА·ч. Используются для создания источников питания для автомобилей, гироскутеров.
Li4Ti5O12 — литий-титанатный конкурент вышеописанного аккумулятора. Заряжается в 5 раз быстрее, но выдает низкий ток и не так энергоэффективен. Размер батареи на 200-300% больше LiNiMnCoO2 при равном объеме, из-за этого не может применяться в носимых устройствах. Литий- титанатные аноды испускают дух только после 15 000 циклов и эффективно противостоят холоду, поэтому их используют в Московских электробусах.
Li-pol — литий-полимерные аккумуляторы на 25% энергоэффективнее, но при этом быстрее деградируют, способны перезаряжаться около 1000 раз. Полимер позволяет делать батарею гибкой, благодаря этой технологии появилось большое количество сгибаемых портативных устройств.

Отрицательная черта всего семейства литий-ионных батарей — чувствительность к сильным токам и страх перед полной разрядкой. Под высокой нагрузкой они теряют часть «жизненных сил» и быстрее выходят из строя. Решают эту проблему контроллеры заряда, следящие за силой тока и нагревом батарейки. Чем полней коробочка, тем жарче внутри, именно поэтому быстрая зарядка работает только до 50%, затем интенсивность заполнения емкости снижается. Подробнее можно ознакомиться здесь.
Проблема недержания
Отработав несколько сотен циклов, батарея начинает деградировать, частично теряя способность удерживать заряд. Процесс заполнения батареи энергией похож на накачку водонапорной башни. Чтобы поднять жидкость вверх, потребуется энергия, назад вода бежит своим ходом. Тоже происходит и с ионами, чтобы оторвать их от катода, требуется ток, от анода они убегают самостоятельно.
Тепло и мороз
Высокие температуры, равно как и мороз, негативно влияют на поведение накопителя. Набившись стайкой в банку, ионы провоцируют повышение градуса по Цельсию. Каждый раз, когда аккумулятор «жарится» под нагрузкой или при зарядке, часть ионов слипается, лишаясь возможности двигаться и передавать энергию.
Холод тоже негативно влияет на способность батареи к удержанию энергии и способен нанести необратимый урон. Почему аккумуляторы теряют стойкость на морозе и как уберечь свой гаджет от быстрой потери заряда, вы можете прочитать в блоге на эту тему.
Кислая проблема
С точки зрения химии в батарее происходит окислительно-восстановительный процесс, его проявление иногда заметно на поверхности батарей, покрывшихся белым/зеленым порошком — окисью. Катод и анод предают энергию через коллектор тока, связанный с ними клейким материалом. Со временем «сцепка» осыпается из-за циклов нагрева и охлаждения, обнажая алюминиевую ножку коллектора. Анод передает эстафету коррозии коллектору, который по своей ножке поднимает окись вверх. Катод состоит из графита, который может покрыться налетом, но передать окись металлу не способен. Иногда к ним присоединяется электролит, выливающийся из-за повреждения банки, слишком разросшимся кристаллом — это процесс сопровождается вздутием. Батарея — должна быть герметична, если окись вышла посмотреть, что делается в большом мире, внутри полный аут, остается только выкинуть.

Что в итоге?
Идеальных аккумуляторов не существует, более чем за 100 лет производства инженеры разработали десятки видов накопителей энергии, но не смогли создать универсального. Подбирая аккумулятор, необходимо ориентироваться на конкретные задачи, выбирая между объемом и мощностью.

Практически все современные гаджеты объединяет одна деталь — в них есть аккумуляторная батарея. И её ёмкость остаётся одним из главных критериев при выборе устройства. Мы живем в эру мобильности, и требования к аккумуляторам растут с каждым годом.
Батареи для ноутбуков (и многие другие) состоят из энергетических элементов, скомпонованных в связанные друг с другом ячейки. Ноутбуки, как и большая часть других мобильных устройств, работают на литий-ионных или литий-полимерных аккумуляторах.
Мало кто задумывается о том, как сложно создать аккумуляторную батарею, отвечающую требованиям времени. Сегодня вы узнаете, как их производят в промышленных масштабах… начиная с химических элементов.
Li-ion — литий-ионные

Широко распространённый литий-ионный аккумулятор состоит из электродов (катода из алюминиевой фольги и анода из медной), разделенных пористым сепаратором, пропитанным жидким электролитом. Пакет электродов помещен в герметичный корпус, катоды и аноды подсоединены к клеммам-токосъемникам. Корпус иногда оснащают предохранительным клапаном, сбрасывающим внутреннее давление при аварийных ситуациях или нарушениях условий эксплуатации.

Типичная литий-ионная перезаряжаемая батарея состоит из положительного электрода (зеленый), отрицательного электрода (красный) и разделяющим их слоем сепаратора (желтый). Ионы лития (Li +, синий) перемещаются от отрицательного электрода (анода) к положительному (катод). Во время зарядки происходит обратный процесс, ионы лития переносятся к аноду. Источник
Литий-ионный аккумулятор обладает высокой энергоплотностью, но быстро разряжается при использовании на морозе и может быть взрывоопасен при перезаряде выше 4,2 В. Если вы проколете литий-ионную батарею и создадите короткое замыкание, она загорится и возникнет действительно сильный огонь, который нельзя легко потушить с помощью обычного огнетушителя. Именно поэтому многие такие аккумуляторы оснащают специальной защитой.
Li-po — литий-полимерные

Литий-полимерный аккумулятор (литий-ионный полимерный аккумулятор) представляет собой усовершенствованную конструкцию литий-ионного аккумулятора. В таком аккумуляторе в качестве электролита используется не жидкость, а сухой полимерный материал (синтетический пластик). В отличие от Li-ion, Li-po безопаснее, может отдавать сильные токи и, благодаря полимерному материалу, может быть какой угодно толщины и формы.
Li-po и технологии

Ноутбук, оснащенный литий-полимерным аккумулятором, поддерживает в 3 раза больше циклов зарядки (то есть служит в 3 раза дольше), чем ноутбук со стандартным литий-ионным аккумулятором.
Эффективность энергопотребления достигается не только за счет химических свойств батареи. Если ноутбук остается подключенным к зарядке, когда аккумулятор уже полностью заряжен, это может привести к ухудшению рабочих характеристик аккумулятора и, соответственно, к сокращению срока его службы. Это может также стать причиной набухания аккумулятора из-за внутреннего накопления газов, вызванного окислением, а значит и деформированию или повреждению ноутбука. Дополнительные программные технологии позволяют установить предельный уровень заряда 60%, 80% или 100%, чтобы продлить срок службы батареи и уменьшить вероятность ее набухания.
Ноутбуки также оснащаются механизмом быстрой зарядки, с помощью которого аккумулятор заряжается за несколько десятков минут чуть более чем наполовину.
Li-po vs Li-ion
Положительные и отрицательные электроды Li-po и Li-ion имеют сходный химический состав. Основное различия между двумя видами батарей заключается в способе их компоновки. С литий-ионной технологией для оболочки можно выбрать только жесткий металлический корпус, в то время как литий-полимерная технология позволяет использовать мягкую оболочку для корпуса (пластиковая или алюминиевая фольга). При толщине до 3 мм Li-po имеет преимущество в емкости. При толщине более 3 мм Li-ion дает существенную выгоду в цене.
Существуют и другие виды аккумуляторов на основе лития: LiFePO4 — литий-железо-фосфатные, LiFeYPO4 — литий-железо-иттрий-фосфатные, и другие. Отличаются они различными добавками, улучшающими характеристики батареи. Однако в основе большей части новых экспериментов лежит всё тот же металл, пришедший на смену некогда популярным никель-кадмиевым и никель-металлгидридным аккумуляторам.
Литий

Очень легкий, очень мягкий металл серебристо-белого цвета.
Первые работы в области создания перезаряжаемого аккумулятора на основе лития были начаты в 1912 году, но до 1970-х эксперименты не выходили за пределы лабораторий из-за нестабильности лития. В 1980-х на основе технологий, разработанных в Оксфордском университете, стали появляться первые промышленные литиевые аккумуляторные батареи, которые быстро перегревались и выходили из строя. Только в 1991 году был создан аккумулятор, в котором металлический литий был заменен более безопасной ионной формой.
Литий снискал заслуженную популярность за счет своих особых свойств. Это один из самых легких металлов в периодической таблице, который действительно помогает сохранять большие объемы энергии в небольшом объеме и при незначительном весе. Однако популярность лития сегодня может привести к исчерпанию этого металла в будущем.

Добыча лития — это трудоемкий процесс даже в тех регионах, где металла много. На протяжении десятилетий коммерческое производство лития основывалось на минеральных рудных источниках, таких как сподумен, петалит и лепидолит. Однако извлечение лития из руды вдвое превышает стоимость производства из соляных растворов.
Основные залежи лития, пригодные для активной разработки, находятся в Южной Америке и Китае. На территории России больше всего лития содержится в слюде, сопровождающей месторождения редкоземельных металлов. До недавнего времени добыча лития из слюды стоила слишком дорого, но в 2017 году ученые НИТУ «МИСиС» представили установку, сделавшую добычу соединений лития из бедной руды вдвое дешевле.
Большая часть лития сегодня добывается из естественных водяных линз соляных озер, в насыщенных соляных растворах которых концентрируется хлорид лития, калий и натрий. Раствор выкачивается и выпаривается на солнце, полученная смесь солей перерабатывается.
Извлечение лития

Солончак Уюни содержит около 100 миллионов тонн лития, или от 50 до 70% его мировых запасов.
Крупнейший источник лития находится в Боливии — это солончак Уюни, высохшее соленое озеро, расположенное на высоте около 3650 м над уровнем моря. Имеет площадь 10 588 км². Внутренняя часть покрыта слоем поваренной соли толщиной 2-8 м. Хлорид лития, находящийся здесь в огромных количествах, пригоден для добычи из него лития, а раньше использовался в качестве замены обычной соли. Употреблять в пищу его перестали после открытия токсических эффектов.

Литиевый соляной пруд в Аргентине.
Для извлечения лития соляные растворы сначала перекачивают на поверхность в специальные пруды, где под воздействием солнца в течение нескольких месяцев происходит медленное испарение. Когда хлорид лития в испарительных прудах достигает оптимальной концентрации, раствор перекачивают на восстановительную установку, где фильтрацией удаляют из смеси нежелательные примеси.
Преобразование лития в металл производится в электролитической ячейке. Хлорид лития смешивается с хлоридом калия в соотношении 55% к 45% для того, чтобы произвести расплавленный эвтектический электролит. Далее электролизом расплава при температуре 600 °C получают расплавленный литий, который поднимается на поверхность электролита.
Другие химические элементы

Составляющие стоимости Li-ion батареи.
Внутри литий-ионного аккумулятора может использоваться несколько материалов для катодов. Первоначально основным компонентом катода был кобальт, но он имеет ограниченную доступность в природе и токсичен, что является огромным недостатком для массового производства. Сегодня кобальт частично замещается никелем, а также смесью кобальта, никеля и марганца.
Безопасная и долговечная батарея нуждается в надежном электролите, который может выдерживать существующее напряжение и высокие температуры и имеет длительный срок хранения, обеспечивая высокую подвижность ионов лития. Растворы электролита состоят из органических растворителей, соли LiPF6 (гексафторфосфат лития) и различных добавок.
Электролит высокой чистоты играет ключевую роль в транспортировке положительных ионов лития между катодом и анодом. Электролитные добавки улучшают стабильность, предотвращая деградацию раствора. Состав электролитов варьируется в зависимости от используемых анодных и катодных материалов, однако выбор электролита часто подразумевает компромисс между воспламеняемостью и электрохимическими характеристиками.
Полимерные электролиты представляют собой ионно-проводящие полимеры. Они часто смешиваются в композитах с керамическими наночастицами, что приводит к более высокой проводимости и устойчивости к более высоким напряжениям.
В литий-ионных батареях в качестве токоприемников используется разнообразная металлическая фольга — медная, никелевая или фольга из каталитической меди. Как правило, медная фольга ставится в качестве отрицательного электрода для коллектора анодного тока, а алюминиевая фольга применяется в качестве положительного электрода для катодного токосъемника.

Строение Li-po батареи
Анод состоит из смеси графита и лития (возможно также использование интерметаллидов или кремния), в то время как катод объединяет литий и другие металлы (материалы катода требуют чрезвычайно высокой чистоты и должны быть почти полностью очищены от нежелательных металлических примесей — железа, ванадия и серы).
Отделяет катод от анода сепараторный материал из полипропилена, полиэтилена или другого схожего полимерного материала. Сепараторы большинства батарей состоят из очень простых пластиковых пленок, которые имеют правильный размер пор, чтобы позволить ионам перемещаться, блокируя при этом другие элементы. В случае жидкого электролита сепаратор представляет собой вспененный материал, который пропитывается электролитом и удерживает его на месте.
Процесс производства батареи

Основы для анода и катода поставляются на завод в виде черного порошка, и для неподготовленного глаза они почти неотличимы друг от друга. Порошок очень мелкой фракции, чтобы достичь максимальной эффективной площади поверхности электродов. Форма частиц также важна. Предпочтительны гладкие сферические крупицы с закругленными краями, поскольку острые кромки или шелушащиеся поверхности чувствительны к высоким электрическим нагрузкам.
Аноды и катоды в литиевых батареях имеют одинаковую форму и выполняются по аналогичным процессам на идентичном оборудовании. Но поскольку загрязнение между анодным и катодным материалами приведет к разрушению батареи, то для предотвращения контакта материалов их обычно обрабатываются в разных цехах.

Первая стадия производства заключается в смешивании материалов электродов и нанесении суспензии на поверхность фольги. Активные электродные материалы покрываются с обеих сторон металлической фольгой, которая действует как токоприемник, проводящий ток внутри и снаружи ячейки. Затем фольга с материалами сушится, разрезается на узкие полоски и сворачивается в несколько слоев. Это требует постоянного контроля, поскольку любые заусенцы на краях полосок фольги могут привести к внутренним коротким замыканиям в ячейках.

В процессе сборки батареи сепаратор зажимают между анодом и катодом. После помещения батареи в корпус ее заполняют электролитом и запечатывают. Это должно выполняться в «сухой комнате», так как электролит реагирует с водой. Влага приведет к разложению электролита с выбросом токсичных газов.

Электроды помещают в корпус, оставляя отверстие для добавления электролита/
Как только сборка ячейки будет завершена, она должна пройти хотя бы один контролируемый цикл зарядки/разрядки. Процесс зарядки начинается с низкого напряжения, которое постепенно нарастает. Только после прохождения теста батарея покинет завод и отправится дальше.
В будущем, несомненно, появятся новые виды аккумуляторов. Возможно, тогда литий останется в прошлом. Пока же есть еще множество возможностей для улучшения характеристик существующих аккумуляторных батарей.

В телефонах, а так же различных мобильных аксессуарах используются литий-ионные и литий-полимерные аккумуляторы. В статье описана конструкция обоих типов источников питания, а так же принцип работы.
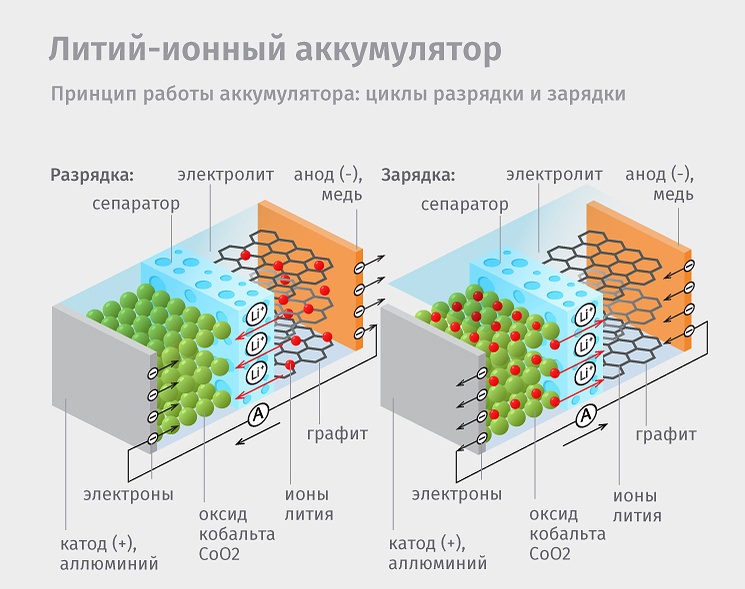
Конструкция литий-ионного аккумулятора
Аккумулятор литий-ионного типа выполнен в герметичном корпусе. Внутри располагаются два электрода – анод и катод, разделенные пористым сепаратором, пропитанным жидким электролитом. Оба электрода соединены с индивидуальными токосъемниками и выведены наружу. Отрицательный анод изготавливается из медной фольги, а положительный катод из алюминиевой. В качестве переносчика заряда выступает ион лития.
Анод и катод в виде ленты плотно свернуты в рулон прямоугольной формы с нанесенным на обратной стороне слоем тонкого графита. Наличие сепаратора обусловлено разделением положительного и отрицательного электрода, поскольку при соприкосновении двух электродов образуется короткое замыкание, что приводит к воспламенению или взрыву батареи. А пористая структура сепаратора позволяет ионам лития свободно перемещаться с анода на катод и обратно.

Принцип работы
При зарядке батареи, ионы лития через электролит перемещаются с положительного катода на отрицательный анод. При зарядке батареи происходит обратный процесс – ион лития покидает отрицательный анод и встраивается в катодный материал. Далее электроны выходят через внешнюю цепь и распределяются контроллером для питания необходимых узлов.
Так же большинство аккумуляторов снабжаются внешними платами защиты. Печатная плата содержит контроллер питания, что ограничивает прием и отдачу энергии при достижении определенного напряжения. Защитный механизм оставляет часть энергии при полной разрядке батареи, сохраняя внутреннюю целостность и возможность дальнейшей эксплуатации аккумулятора. При заполнении энергии питание отключается до наступления разрушения батареи. Если же защитная плата отсутствует, вышеописанные действия выполняет контроллер питания устройства, где располагается аккумулятор.
Конструкция литий-полимерного аккумулятора
Конструктивно литий-полимерные аккумуляторы не многим отличаются в сравнении с литий-ионными. Основное различие в электролите, где вместо жидкого наполнителя используется сухой либо гелеобразный материал на основе полимеров. Благодаря переходу с жидкого электролита на «твердый», получилось реализовать выпуск батарей разной формы, включая тонкие варианты толщиной в 2 мм.
Принцип работы остался прежним. Ионы лития при зарядке батареи перемещаются с катода на анод, а при разрядке с анода на катод. Для удержания заряженных ионов на аноде выступает графит. А для внедрения в катод оксиды кобальта, марганца или ванадия. Ввиду дороговизны кобальта, производители чаще используют различные сплавы на основе кобальта, с целью снижения себестоимости производства.
Вывод
В статье подробно описано, из чего сделаны аккумуляторы для сотовых телефонов. Так же описан принцип работы литий-ионных и литий-полимерных батарей.
Читайте также:


