Haemophilus somnus что это
Haemophilus somnus (H. somnus; histophilus somni) belongs to bacteria domain, proteobactereia Phylum, Class of gamma proteobacteria, Order of pasteurellales, family of pasteurellaceace, genus Histophilus, species of somnus
Current Research
1. J.F. Challacombe (et. Al) has sequenced the genome of H. somnus 129Pt, a nonpathogenic commensal preputial isolate, and compared it to the genomes of H. somnus, H. influenzae Rd, and H. ducreyi 35000HP. They found genes in H. somnus 129Pt that involved amino acid metabolism, cell surface adhesion, biosynthesis of cofactors, energy metabolism, and electron transport and also determined that there were differences in the numbers and composition of the genes that are involved in metabolism and host colonization among the species. This information was proposed to be potentially useful in determining host specificities, niche preferences, and development of vaccines and protective strategies against these organisms.
2. It was determined that the proteins, transferrin and lactoferrin, found in bovine plasma increased the virulence of H. somnus. The organism was pre-incubated in fetal calf serum for 5 minutes which lead to the increase in virulence. In another set of experiments, H. somnus was pre-incubated in either purified bovine serum or plasma proteins before innoculation in mice; it was found that transferrin led to increased virulence as did lactoferrin. Increased amounts of whole cells and culture supernatant bound to transferrin was detected when the organism was grown in media with restricted iron levels; this property was not observed with lactoferrin although binding was observed. It was thus concluded that the increase of virulence in H. somnus was due to the binding of transferrin receptors to the organisms iron-regulated outer-membrane proteins (IROMPs) by providing the organism with iron and that lactoferrin increased the virulence by some undetermined mechanism. (Geertsema RS et al.) [9]
3. A series of experiments conducted by Kelly E. Beheling, et al. determined that H. somnus adheres to bovine brain endothelial cells (BBECs) in vitro but is unable to invade the cells. The activation of BBEC with tumor necrosis factor alpha (TNF-alpha) significantly increased the number of adherent H. somnus while the addition of exogenious glycosaminoglycans, heparinase digestion of the cell’s glycocalyx, and sodium chlorate inhibition of endothelial sulfated glycan synthesis significantly reduced H. somnus adherence to BBEC. The experiment suggests that heparin-binding proteins on the pathogen could serve as the initial adhesions to sulfated proteoglycans on the BBECs, leading to the ability of H. somnus to infect the bovine CNS. [10]
Genome Structure
The genome of H. somnus consists of a circular chromosome (seq: RS: NC_008309) containing 2,007,700 base pairs and plasmids (an autonomously replicating piece of DNA separate from the chromosome) including plasmid pHS129, which is approximately 5178 bp in length. The organisms genome is made up of roughly 34% GC content and 66% AT and contains genes coding for approximately 1798 different proteins and 65 RNA genes. One of the plasmids isolated from nasal discharge of cattle with respiratory disease was found to be 1065 base pairs long and a 39.2 percent G-C content [11]. It is unable to code for any protein longer than 43 residues and it is currently unclear whether the plasmid codes for any H. somnus factors.
Pathology
Haemophilus somnus causes a wide variety of diseases ranging from pneumonia, abortion, arthritis, myocarditis, and septimia in cattle, sheep, and American bison. It is able to spread throughout cattle herds undetected until symptoms begin to occur. There are 3 primary forms that H. somnus is able to assume: reproductive tract, urinary tract, respiratory tract form.
1.Reproductive and urinary tract form[3]
In this form, H. somnus attacks the reproductive tract of pregnant cows, which may lead to the death of a fetus and subsequent abortion. The attack may also lead infection of the uterus and has been found in the urinary tract and prepuce of bulls which contracted the organism during mating. The excretion of uterine or vaginal discharge and urine of the infected animal also acts to transmit the disease to other unaffected cattle in close proximity, which become exposed to the organism by sniffing or by physically being contacted with the discharge. This can then lead to the respiratory form.
2. Respiratory form[3]
The respiratory form of this infection is able to attack both the upper and lower portions of the respiratory tract. Typically in calves, the upper respiratory tract is infected, leading to what is known as calf diptheria. The surface tissues of the larynx, also known as the voice box, become infected due to the interruption in blood supply, causing the tissue to die and become degraded, making it extremely difficult to breath. If the disease is allowed to spread, the windpipe may also become infected as well as the lungs. If the infection occurs in the lungs, pneumonia may be the result, which can cause rapid death. However, although this is typically the primary cause of pneumonia, it is often outgrown by other organisms such as Pasteurella multocida and Pasteurella haemolytica.
3. The septic form[3]
This form is developed from circulation of infected blood. Clinical signs depend on the location in the bovine body that the organism colonizes while the severity depends on the amount of tissue death as a result of blood clots. If the blockage occurs in the brain or spinal cord, the disease can become nervous disorders.
Гемофильный
Haemophilus является род палочковидных грамотрицательных - отрицательна бактерий изв Pasteurellaceae семьи . 16 типов этих бактерий представляют собой неподвижные палочки, которые иногда живут на слизистых оболочках людей и животных и могут вызывать заболевания. Почти всевиды Haemophilus способны выжить без кислорода (необязательно анаэробно ); однако они в основном более аэробные . Название группы происходит от их особой любви к питательным средам с добавлением крови или гемоглобина, на которых их можно хранить в культуре.
Показания для госпитализации
Хиб-инфекция в форме эпиглоттита, флегмоны, поражения жировой клетчатки на лице или менингита – показание для экстренной госпитализации, нередко в отделение интенсивной терапии. Стационарное лечение рекомендовано проводить, исходя из тяжести состояния. Так, пневмония без дыхательной недостаточности может купироваться амбулаторно. Существуют эпидемические показания для госпитального прохождения терапии.
До 5-7 дня нормальной температуры тела при менингитах и воспалении надгортанника назначается строгий постельный режим, проводится профилактика пролежней, гипостатической пневмонии. Рекомендуется высокобелковая, витаминизированная диета, увеличение водной нагрузки (в отсутствие противопоказаний).
Консервативная терапия
Пациенты с гемофильной инфекцией обязательно должны получать антибактериальные средства, которые необходимо вводить с первых часов подтверждения диагноза. Лечение лучше начинать с инфузионного введения лекарств. Важно проводить санацию контактных лиц, поскольку у 70% ухаживающих за больными выявляются патогенные гемофильные палочки. Лечебная тактика включает:
- Этиотропное лечение. Назначаются антибиотики широкого спектра действия с учетом растущей антибиотикорезистентности. Препараты выбора: защищенные пенициллины, цефалоспорины, можно использовать макролиды, карбапенемы и фторхинолоны.
- Патогенетические средства. Проводится массивная инфузионная дезинтоксикация гидроксиэтилкрахмалами, кристаллоидами, введение растворов альбумина, свежезамороженной плазмы. Возможно назначение НПВС, реже глюкокортикостероидов.
- Симптоматическая терапия. Включает жаропонижающие, обезболивающие, седативные и другие препараты – муколитики, противокашлевые. Используются диуретики, оксигенотерапия, противосудорожные средства. Проводится коррекция кислотно-щелочного баланса, компенсирование хронических патологий.
Хирургическое лечение
Осуществляется в случае возникновения флегмон и абсцессов, особенно на лице. У половины больных с гнойными артритами плечевых и тазобедренных суставов возникает необходимость в лечебной артроскопии. Местное лечение после широкого иссечения гнойного очага состоит в промывании, применении антисептиков для повязок в растворимых, реже мазевых формах. Нередко для улучшения проходимости респираторного тракта осуществляется трахеостомия.
References
[2] Yarnall M., Widders P.R. ,Corebeil L.B. “Isolation and Characterization of Fc Receptors from Haemophilus somnus” Scandinavian Journal of Immunology 28 (2), 129–137. doi:10.1111/j.1365-3083.1988.tb02424.x Volume 28 Issue 2 Page 129 - August 1988
[8] Andrew Ekins, Andrew (et al.), “Haemophilus somnus Possesses Two Systems for Acquisition of Transferrin-Bound Iron” Microbiology Unit, Department of Natural Resource Sciences, Macdonald Campus, McGill University, Sainte Anne de Bellevue, Quebec, Canada H9X 3V9, Received 31 October 2003/ Accepted 2 April 2004
[9] Geertsema RS, Kimball RA, Corbeil LB. “Bovine plasma proteins increase virulence of Haemophilus somnus in mice.” Department of Pathology, School of Medicine, University of California, San Diego, 200 West Arbor Drive, San Diego, CA 92103-8416, USA. Epub 2006 Nov 27.
Симптомы гемофильной инфекции
Хиб-инфекция обладает коротким инкубационным периодом ‒ 2-4 дня. Симптомы разнятся в зависимости от поражаемого органа, но в типичных случаях начинаются остро с повышения температуры тела более 38,5°C, озноба, слабости. При воспалении надгортанника страдает способность к речи, глотанию, возникает слюнотечение, нехватка воздуха на вдохе. Дыхание становится шумным, кожа приобретает синюшный оттенок. Пациенты сидят, вытянув подбородок и подавшись вперед.
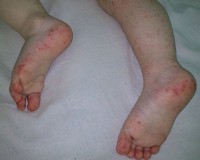
Для начала менингита характерны проявления, сходные с ОРВИ: кашель, насморк, лихорадка более 38°C. Затем возникают заторможенность, выраженные головные боли с рвотой на высоте болевого пика, ригидность затылочных мышц, светобоязнь. Появляются бред, галлюцинации, сонливость. Присоединение сепсиса манифестирует геморрагической сыпью на различных участках тела. На лице, шее возникают болезненные красные уплотнения (целлюлит, флегмона).
Симптомы пневмонии – насморк, сухой кашель, першение в горле. Через несколько суток возникает учащение кашлевых толчков, появление скудной мокроты, боли в грудной клетке при вдохе, лихорадка более 39°C. Пациенты отмечают нарастающую нехватку воздуха, бледность, а затем синюшность кожи, обильное потоотделение. Одышка поначалу заметна только при физической нагрузке, со временем появляется в покое. Нарастает слабость, требуется вынужденное положение.
У детей до первого года жизни симптомы менингита, вызванного гемофильной палочкой, могут проявляться как стойкая лихорадка свыше 39°C, не купируемая жаропонижающими средствами, срыгивания (эквивалент рвоты), постоянный пронзительный «мозговой крик». Нередко возникают судороги, подергивания мимических мышц, выбухание и пульсация большого родничка. Дети могут отказываться от еды, становиться вялыми, сонливыми либо, наоборот, пребывать в психомоторном возбуждении.
Осложнения
Гемофильная инфекция имеет ряд осложнений, основным из которых является острая дыхательная недостаточность. Она развивается вследствие асфиксии либо из-за отека респираторной ткани. До 70% случаев пневмоний, вызванных гемофильной бактерией, у детей осложняются плевритом. Часто возникают абсцессы надгортанника. Опасным осложнением менингита является отек головного мозга.
Сепсис вызывает симптомы полиорганной недостаточности у 20% больных. Отдаленные последствия перенесенной гемофильной инфекции: хронические патологии ЛОР-органов (отиты, синуситы, глухота), слепота после менингита и эндофтальмита, остеомиелит. До 50% детей, переболевших гемофильным менингитом, получают группу инвалидности. Редкими осложнениями являются хронические перикардиты, артриты.
Диагностика и терапия послеродовых эндометритов у коров, вызванных haemophilus somnus
Защита состоится «11» октября 2011 года в 1400 часов на заседании диссертационного совета Д 006.106.01 при Государственном научном учреждении Северо-Кавказский зональный научно-исследовательский ветеринарный институт Российской академии сельскохозяйственных наук.
346421, Ростовская область, г. Новочеркасск, Ростовское шоссе, 0
С диссертацией можно ознакомиться в библиотеке ГНУ Северо-Кавказский зональный научно-исследовательский ветеринарный институт Россельхозакадемии - 346421, Ростовская область, г. Новочеркасск, Ростовское шоссе, 0.
Автореферат разослан «____» сентября 2011 г.
д.б.н., профессор А.М. Ермаков
1. ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность темы. Диагностика и терапия послеродовых эндометритов у крупного рогатого скота остается нерешенным вопросом вот уже в течение многих лет. Различные подходы в диагностике и терапии связаны со многими факторами: различные породы крупного рогатого скота и уровни производительности, факторы риска развития эндометрита, а также микробные этиологические факторы. Наиболее часто послеродовый эндометрит развивается в первые 10-14 дней после рождения коров. Может протекать с различной тяжестью клинического течения – от субклинического до токсического с летальным исходом. Экономические потери от данного заболевания связаны со снижением удоев, затрат на лечение, уничтожением молока контаминированного лечебными препаратами, затрат на работу специалистов, и возможной гибели животного (Garcia M.E., 2003; Butler M., 2008; Антипов В.А. 1997; Гавриш В.Г., 2000; Макаров В.В.; 2000; Дегтярёв Д.В., 2002; Нежданов А.Г., 2003; Карташов С.Н., 2005; Рецкий М.И., 2005).
Послеродовыми эндометритами переболевает от 12 до 60% отелившихся коров. Ежегодно на молочных комплексах страны по причине эндометритов преждевременно выбраковывают до 27-30% коров, не пригодных для дальнейшего воспроизводства (Kim I.H., 2003; Feldmann M., 2005; Акулов А.В., 1987; Нежданов А.Г., 1995; Донник И.М., 1997; Эрнст Л.К., 2002; Карташов С.Н., 2008; Джамалутдинов Ш.А., 2009).
Главным этиологическим фактором в возникновении и развитии эндометритов считают условно-патогенную и патогенную микрофлору, которая попадает в половые пути самок гематогенным и лимфогенным путями, а также из внешней среды до отела, во время отела и сразу же после его завершения. Именно поэтому развитие традиционной терапии эндометритов осуществляется преимущественно на основе антимикробных средств. Однако применение химиотерапевтических средств сопряжено с целым рядом негативных сторон, и в частности, с недостаточной лечебной эффективностью, снижением качества и количества животноводческой продукции, ингибирующим влиянием на факторы локальной и общей резистентности макроорганизма, отрицательным влиянием на морфофункциональное состояние эндометрия. Вместе с тем в литературе имеются данные, что до 30% послеродовых эндометритов у коров вызываются специфическими возбудителями, существенную долю которых составляют эндометриты, вызванные Haemophilus somnus (Gilbert R.O., 2005; Corstvet R.E., 2009; Студенцов А.П., 1975; Гавриш В.Г., 1997; Сюрин В.Н., 1998; Субботин В.М., 2000; Шахов А.Г., 2006)
В этой связи имеется объективная необходимость в усовершенствовании методов диагностики послеродовых эндометритов у коров, и разработки новых терапевтических подходов, учитывающих этиологию данного заболевания, что и послужило целью нашего исследования.
Цель и задачи исследования. Цель настоящих исследований - выяснить эпизоотологические и клинико-морфологические аспекты эндометритов у крупного рогатого скота, вызванных Haemophilus somnus, разработать экспресс методы диагностики данной патологии, обосновать схемы терапии.
Для достижения этой цели были поставлены следующие задачи:
- Изучить эпизоотологические аспекты и этиологию эндометритов у крупного рогатого скота в хозяйствах Ростовской области, выяснить долю эндометритов, вызванных Haemophilus somnus.
- Установить качественный состав микрофлоры матки у коров при нормальном течении послеродового периода и при остром эндометрите.
- Разработать диагностический набор на обнаружение Haemophilus somnus.
- Выяснить эпизоотологические особенности эндометритов у крупного рогатого скота, вызванных Haemophilus somnus.
- Изучить клинические, морфологические и биохимические изменения крови при эндометритах,вызванных Haemophilus somnus.
- Разработать эффективные методы лечения коров, больных эндометритами, вызванными Haemophilus somnus.
Научная новизна. Впервые изучены эпизоотологические особенности эндометритов у крупного рогатого скота, вызванных Haemophilus somnus. Разработан диагностический набор для диагностики инфекций крупного рогатого скота, вызванных Haemophilus somnus. Установлены клинические аспекты, а также морфологические и биохимические изменения в картине крови при данной патологии. Выяснены формы клинического течения послеродовых эндометритов у коров вызванных H. somnus. Разработаны эффективные схемы лечения коров, больных послеродовым эндометритом, вызванным H. somnus с учетом тяжести течения заболевания
Практическая значимость. Изучены эпизоотологические особенности гемофилеза крупного рогатого скота в Ростовской области, установлена его инцидентность и сезонность. Разработан диагностический набор для диагностики инфекций крупного рогатого скота, вызванных H. somnus. Выявлены различные клинические формы послеродового эндометрита у коров, установлены несколько степеней тяжести данного заболевания, что позволяет дифференцированно подходить к терапии данного заболевания.
Апробация работы. Материалы диссертации доложены и обсуждены на Всероссийской научно практической конференции «Актуальные проблемы ветеринарного обеспечения Российского животноводства» ГНУ СКЗНИВИ, г. Новочеркасск 2010г., на Всероссийской научно практической конференции «Научное обеспечение инновационного развития отечественного животноводства» ГНУ СКЗНИВИ г. Новочеркасск 2011г., на III Международной научно–практической конференции «Инновационные процессы в АПК», посвященной 50-летию образования аграрного факультета РУДН Москва, 2011 г.
Реализация результатов исследований. Разработанные практические предложения реализуются в повседневной работе скотоводческих хозяйств Ростовской области, в учебном процессе - при чтении лекций и проведении лабораторно-практических занятий на кафедре внутренних незаразных болезней и патофизиологии ДонГАУ.
Публикации. Основные положения диссертации отражены в 8 научных работах, в том числе 1 в трудах Международных конференций и 3 в изданиях, рекомендованных ВАК Минобразования и науки РФ: «Ветеринария и кормление» и «Ветеринарная патология».
Структура и объем работы. Диссертация изложена на 127 страницах компьютерного исполнения, состоит из введения, обзора литературы, материалов и методов исследований, результатов собственных исследований, а также заключения, выводов, предложений для практики, списка литературы и приложения. В диссертации приведено 16 таблиц, она иллюстрирована 4 рисунками. Список литературы включает 196 источников, в том числе 113 иностранных.
Основные положения, выносимые на защиту:
Выделение H. Somnus методом ПЦР при послеродовых эндометритах является эффективным методом позволяющим ставить точный диагноз в кратчайшие сроки.
Клинико-гематологические показатели и морфофункциональные изменения у коров при послеродовых эндометритах позволяют оценить тяжесть течения заболевания без уточнения вида возбудителя.
Точное знание возбудителя заболевания позволяет проводить этиотропное лечение и улучшать курабельность заболевания.
Работу выполняли с 2008 по 2010 гг. в лаборатории функциональной диагностики болезней сельскохозяйственных животных ГНУ СКЗНИВИ Россельхозакадемии. Тема диссертационной работы является составной частью комплексной темы научных исследований Государственного научного учреждения Северо-Кавказский зональный научно-исследовательский ветеринарный институт и имеет № гос. регистрации №15070.3666026906.06.8.001.2.
Часть исследований была проведена в Ростовской областной ветеринарной лаборатории. Для изучения эпизоотической ситуации по гемофилезу были проанализированы результаты лабораторных исследований ГУРО «Ростовская областная ветеринарная лаборатория».
Клинико-гинекологическому исследованию по общепринятой методике подвергнуто 1248 отелившихся коров, из них у 457 животных проведены гематологические, биохимические, микробиологические исследования. Для микробиологических исследований использовано 1250 проб маточных выделений коров больных острым послеродовым эндометритом. Степень распространения острого послеродового эндометрита гемофилезной этиологии учитывали в зависимости от сезона года. Для своевременного выявления коров с острыми эндометритами в послеродовом периоде мы применяли методику гинекологической диспансеризации, предложенную Н.И. Полянцевым (1989).
Кровь для исследований от коров брали при начале опыта, затем 1 раз в неделю.
Для определения тяжести и особенности течения гемофилезного острого послеродового эндометрита всем животным проводили морфологический и биохимический анализ крови. Кровь для биохимического и морфологического исследования брали из яремной вены.
Морфологический анализ крови включал: определение числа эритроцитов и лейкоцитов в сетке камеры Горяева, определение концентрации гемоглобина – фотоэлектроколориметрическим методом, гематокрита по методике, предложенной И. И. Архангельским и Л. П. Сошенко (1993), определение скорости оседания эритроцитов (СОЭ) - в аппарате Т.Н.Панченкова, выведение лейкограммы выполняли путем подсчета лейкоцитов в мазках, окрашенных по Романовскому-Гимза по общепринятой методике.
Биохимический анализ крови включал определение следующих показателей: общий белок определяли рефрактометрически, а белковые фракции – электрофорезом в геле агара (П.Грабар, П.Буртен, 1963). Альбумин - по реакции с бромкрезоловым зеленым, С-реактивного белка - методом реакции преципитации в капилляре, сиаловых кислот, фибриногена, лактатдегидрогеназы и глобулина.
Для микробиологических исследований маточные выделения получали методом ректального массажа матки и вагинального отбора в одноразовые пробирки. С целью определения состава микрофлоры матки осуществляли посев полученного материала на МПА, МПБ, кровяной агар, МПА с 1% глюкозы, и др. Идентификацию изолированных микроорганизмов проводили с учетом их морфологических, культуральных свойств по общепринятым методикам. Для определения вида бактерий использовали пластины биохимические, дифференцирующие энтеробактерии и стафилококки, углеводные среды Гиса. Патогенность микроорганизмов изучали путем внутрибрюшного заражения белых мышей одномиллиардной взвесью смыва суточной агаровой культуры в дозах 0,2-0,5 мл (200-500 млн. микробных клеток).
Cell structure and metabolism
Lipooligosaccharides (LOS) are the major outer membrane component of H. somnus. It is composed of 3 main compartments: endotoxin lipid A, an inner core, and an outer core. Both lipid A and the inner core are generally conserved across species as opposed to the outer core, which is species specific. The outer core is made up of up to typically 10 non-repeating hexose resides, which are highly variable in their number of residues and linkage. The LOS is similar to enteric lipo polysaccharides (LPS) except that it does not consist of the O antigen, which confers hydrophilic properties of bacteria and allows for their survival in the gastrointestinal tract. LOS, on the other hand, is less hydrophilic, making it better suited to the mucosal environment[1]. In addition, LOS can also have attached phosphocholine (Pcho) and phosphoethanolamine along with phosphate groups. Pcho is also found across many other species and infections agents such as H. influenzae and other respiratory pathogens.
H. somnus also contains two bacterial transferrin receptors (105 and 73 kDa in size), which are structures that contributes to its virulence (typically in cattle). These function as iron repressible outer membrane proteins which typically bind bovine transferins and are likely to function as iron binding proteins in the host, allowing H. somnus to survive in iron limiting environments[8].
Four immunoglobulin binding proteins have been observed in H. somnus[2]. Three out of the four proteins, which are of molecular weights 350, 270, and 120 kDa are able to strongly bind the bovine IgG (immnuoglobulin G) subclasses, IgA and IgM. The receptor of molecular weight 41 kDa is only able to weakly bind the two subclasses. All four receptors are antigenic related and the 41 kDa receptor seems to be a subunit of the 350, 270, and 120 kDa proteins[2].
In laboratory environments, H. somnus growth requirements include enriched medias such as brain, heart infusion agar with a supplement of 5 to 10 percent bovine or sheep blood containing under 5 to 20 percent carbon dioxide; additional nutritional requirements for many strains of H. somnus include thiamine pyrophoshate. It is grown at 37 degress celcius and does not require hemin or NAD for growth. Colonies grown on blood agar grow to be around 1-2 mm in size in about 2 to 3 days of growth. They are moist, round, and convex with a butyraceous consistency and a slight gray-yellow color.
Общие сведения
Гемофильная инфекция (Хиб-инфекция) представляет собой патологический процесс, вызываемый условно-патогенными микроорганизмами. Возбудитель был открыт в 1892 г. немецким иммунологом Р. Пфейффером (палочка носит его фамилию). Инфекция распространена повсеместно, заболеваемость повышается в зимне-весенний период. До трети всех менингитов детского возраста вызывается гемофильной палочкой. Преимущественно страдают дети младше 5 лет, гендерных различий нет. По некоторым данным, до 40-70% детей, посещающих дошкольные учреждения, являются носителями бактерии.
Важные с медицинской точки зрения виды
Haemophilus influenzae
Бактерия, также известная как бактерия гриппа Пфайффера , ранее также бацилла гриппа или Bacillus influenzae , была впервые обнаружена в 1892 году бактериологом Пфайффером , считается возбудителем « гриппа » и является самым известным представителем вида Haemophilus . Это сделало особенно популярным тот факт, что это было первое живое существо, которое было полностью секвенировано в 1995 году, и, таким образом, представляет собой веху в исследованиях генома .
Cocoid бактерия стержня дифференцирована на восемь биотипов (типов I к VIII) на основе различных характеристик (например, различную ферментативную структура ). Есть Haemophilus influenzae - штаммы , образующие капсулы . В зависимости от состава капсулы (разные уровни полисахаридов ) эти штаммы делятся на серотипы от a до f. Инкапсулированный H. influenzae является облигатным патогеном ; тип b чаще всего приводит к инвазивным инфекциям. Капсула обеспечивает устойчивость к фагоцитозу , что делает ее наиболее важным фактором вирулентности. Помимо IgA - образуются протеазы, которые ослабляют местный иммунный ответ на H. influenzae .
Его следует отличать от неинкапсулированного бактериального варианта, который является частью нормальной флоры человека. На его долю приходится около 1,8% от общей флоры у детей и 0,15% у взрослых. Неинкапсулированный вариант доступен только при определенных обстоятельствах, например. Б. с преэпителиальным повреждением, вызванным токсинами, такими как никотин, патогенными. Хроническая инфекция слизистой оболочки бронхов может способствовать «кашлю курильщика». Поскольку H. influenzae может поглощать ДНК из окружающей среды ( компетентность ), инкапсулированные штаммы могут терять свою капсулу, и наоборот, неинкапсулированные штаммы могут образовывать капсулу («переключатель»).
H. influenzae обитает исключительно на слизистых оболочках человека как компонент флоры полости рта , особенно в верхних дыхательных путях ( нос , горло или ротоглотка , трахея ) и может вызывать воспалительные заболевания ( синусит , эпиглоттит , бронхит , пневмония). ) там и в нижних дыхательных путях , но также отит , эндокардит и остеомиелит ). Бактерия в основном передается воздушно-капельным путем от больных или здоровых микробов-носителей, за пределами слизистых оболочек она жизнеспособна только в течение короткого времени. Из-за его присутствия, особенно в случае гриппа, ранее считалось, что он является возбудителем гриппа, пока вирус гриппа не мог быть идентифицирован как фактическая причина. Таким образом, H. influenzae рассматривается как возбудитель вторичных симптомов гриппа , которому способствует ослабление людей вирусами . Эта бактерия, особенно у (невакцинированных) маленьких детей, также является возбудителем менингита ( менингита ) и других воспалительных заболеваний. В качестве профилактики , вакцинации против гемофильной инфекции б - в это - вакцинации МИпа рекомендуются. В 2000 году, до повсеместного внедрения вакцинации HIB в раннем детстве в государствах-членах ВОЗ , ежегодно от этой инфекции, которую можно предотвратить с помощью вакцин, умирали около 371 000 детей в возрасте до 5 лет. Число погибших в странах, где вакцинация HIB теперь проводится в стандартной комплектации (183 страны, включая Германию), снизилась на 90%.
Доказательства получены по мокроте , крови и жидкости путем культивирования. В идеале это нужно делать на приготовленном кровяном агаре . Бацитрацин также добавляется в питательную среду для предотвращения роста других бактерий. В качестве альтернативы, «кормилица», Staphylococcus aureus , который часто используется дополнительно, создает идеальные условия для роста (рост кормилицы ) за счет сильной продукции NAD + и гемина при использовании кровяного агара . Через 1-2 дня инкубации при 37 ° C можно увидеть гладкие, слегка прозрачные колонии. Затем специальная диагностика проводится биохимически или с помощью MALDI-TOF , типирования капсул с помощью агглютинации на предметных стеклах и с помощью ПЦР .
В Германии прямые или косвенные доказательства Haemophilus influenzae должны сообщаться по имени в соответствии с разделом 7 Закона о защите от инфекций, если доказательства указывают на острую инфекцию. В Швейцарии, положительные лабораторный результат анализа является гемофильной уведомлению и что после того , как Закон Эпидемии (ЭППЫ) , в связи с эпидемическим Положением и Приложение 3 в регулировании ЭОДА по отчетности наблюдений инфекционных заболеваний человека .
Haemophilus ducreyi

Haemophilus ducreyi известен как Streptobacillus мягкого шанкра (также Ulcus molle ) и является возбудителем этого заболевания, передающегося половым путем , которое не подлежит регистрации в Германии, в отличие от Австрии . Заболевание и, следовательно, его возбудитель встречаются в основном в тропических (и бедных) регионах Африки , Юго-Восточной Азии и Латинской Америки . Видимые симптомы округлая язва на половых губах и в вагинальных преддвериях женщин или на головку и пенис вал мужчин. Геном этой бактерии также известен с 2003 года .
Haemophilus aegyptius
Haemophilus aegyptius , также известный как Koch-Weeks-Bacillus , не может быть морфологически отличен от H. influenzae . Он в основном распространяется в Северной Африке и на других тропических и субтропических континентах и является возбудителем известного как гнойный конъюнктивит конъюнктивита .
Haemophilus parainfluenzae
Haemophilus parainfluenzae очень редко встречается как возбудитель одной из форм эндокардита (воспалительные изменения внутренней оболочки сердца).
Haemophilus vaginalis
Это старое название бактерий, ныне известных как Gardnerella vaginalis , которые довольно часто возникают при неспецифических воспалениях влагалища и матки . Однако бактерия, вероятно, не всегда является патогенной, поскольку она также часто встречается у здоровых женщин.
Haemophilus haemolyticus
В отличие от других представителей рода Haemophilus haemolyticus способен расщеплять и использовать гемоглобин крови. Однако, как известно, этот вид не играет роли патогена.
Haemophilus parasuis
Возбудитель болезни Глессера у свиней. В клинической картине преобладают лихорадочные полисерозиты и полиартрит. Однако возбудитель обнаруживается и на слизистых оболочках здоровых животных. Выраженные клинические картины обычно возникают под воздействием стресса. Выявление культуральных патогенов особенно хорошо удается из спинномозговой ликвора с учетом специфических для вида требований роста.
Haemophilus paragallinarum
Возбудитель инфекционного куриного гриппа ( Coryza contagiosa ). Наиболее заметным клиническим симптомом является «совиная голова», который можно проследить до скопления секрета в придаточных пазухах носа .
Бывшие представители
Haemophilus somnus таксономически сомнительна для разделения на род Haemophilus. Согласно руководству Берджи, он принадлежит к виду incertae sedis . Независимость факторов X и V противоречит классификации рода Haemophilus. Таким образом, бактерии, описанные как Haemophilus agni и Histophilus ovis, были объединены с H. somnus в новом виде Histophilus somni . Возбудитель ИСТМЭ ( инфекционного, сепсисного, тромбозирующего менингоэнцефалита ) у крупного рогатого скота. Симптомы - это общее лихорадочное заболевание с симптомами центральной нервной системы. Кроме того, возбудитель может быть причиной эндометридов, мастита, абортов и рождения слабых телят.
терапия
Терапией выбора являются антибиотики амоксициллин (возможно, вместе с ингибитором бета-лактамаз, например клавулановая кислота , например, в виде комбинированного препарата) или моксифлоксацин.
Другие антибиотики, которые можно использовать против Haemophilus (influenzae), включают ампициллин, цефуроксим (-аксетил), цефотиам, цефподоксим-проксетил, цефотаксим , доксициклин, цефтриаксон , меропенем (особенно при менингите), ципрофлоксацин и левофлоксацин . Цефтриаксон, цефотаксим, хинолоны , эртапенем , имипенем , левофлоксацин и меропенем особенно подходят для тяжелых инфекций . Hemophilus в первую очередь устойчив к цефалоспоринам 1-го поколения.
Application to Biotechnology
At Iowa State University (ISU), a protein from H. somnus that had been cloned into an E. coli vector was used to immunize mice. The recombinant protein, when injected into a mouse, resulted in the generation of antibodies against H. somnus that is now used as a vaccine in cattle to prevent infections by the bacteria.
Haemophilus somnus 129PT, which lacks the surface - binding protein for immunoglobulins, is also being used as a vaccine strain of H. somnus. The vaccine can be used to prevent spontaneous abortions and other systematic diseases that have lead to the widespread death of cattle, and has severely impacted the economic vitality of the agricultural sector worldwide.
Description and significance
Haemophilus somnus is a small, rod-shaped, gram-negative pleomorphic coccobacillus, (derived from the word cocci meaning “spherical shaped” and bacilli meaning “elongated”), with gram stain morphology similar to other species in this genus (as well as other genera of family Pasteurellaceae) [1] . It is an encapsulated, non acid-fast, and non-motile organism with no observable flagella or pili for motility. First discovered in 1960, H. somnus was described as a “haemophillus-like organism” that caused infectious meningo-encephalitis (IME) of feedlot cattle in California and was also believed to be the infectious agent that caused the reported bovine central nervous system disease in Colorado of 1956. Although the organism does not produce a capsule, which is associated with the pathogenic properties of many bacteria, under certain conditions it does form an exopolysaccharide (slime layer). H. somnus can be either opportunistic pathogens or commensal of bovine mucosal surfaces [4]. The bacteria commonly lives in the upper respiratory tract, prepuce and vagina of cattle [5] and can also be found circulating in the bloodstream. H. somnus typically colonize in the respiratory tract, reproductive tract, and circulatory system of many herd animals such as cattle, sheep, and American bison. Cattle infections caused by this bacteria have been reported in many parts of the world including North and South America, Europe, Russia, Japan, Australia, New Zealand, South Africa, and Zimbabwe. Having the bacteria’s genome sequenced is useful because it can be compared to virulent strains to aid in the development of protective strategies and vaccines for cattle against diseases caused by H. somnus [4] .
Гемофильная инфекция ( Хиб-инфекция )
Гемофильная инфекция – это группа бактериальных инфекций, вызываемых палочкой инфлюэнцы (Пфейффера). Наиболее часто поражаются органы дыхания, головной мозг, опорно-двигательная система; при генерализации возникает сепсис. Около трети переболевших остаются пожизненными инвалидами либо имеют стойкие нарушения работы ЦНС, суставов, ЛОР-органов. Диагностика гемофильной инфекции строится на обнаружении возбудителя (молекулярно-генетическое, бактериологическое исследование), растущего титра антител к патогену (ИФА). Лечение: этиотропная антибиотикотерапия, патогенетические меры, симптоматическая терапия.
Причины
Возбудитель инфекции – бактерия рода Haemophilus (вид Н. influenzae), наиболее часто поражения у человека вызывает палочка H. influenzae типа b. Микроорганизм является условно-патогенным представителем нормальной микрофлоры слизистых оболочек респираторного тракта человека. Источником инфекции могут быть здоровые носители, а также больные люди. Пути передачи – воздушно-капельный, у детей нередко сочетается с контактным (через общие игрушки, столовые приборы).
Факторы риска
Группу высокого риска составляют проживающие в домах престарелых, интернатах, лица после спленэктомии, новорожденные дети на искусственном вскармливании, ВИЧ-инфицированные, пациенты, длительно получающие системные глюкокортикостероиды, онкологические больные. Основные факторы риска:
- возраст: до 2-х лет и старше 60-ти;
- вредные зависимости: алкоголизм, наркомания;
- иммуносупрессия;
- недоношенность;
- пороки сердца;
- гипогаммаглобулинемия;
- неудовлетворительные санитарно-гигиенические условия.
Классификация
Гемофильная инфекция чаще представляет собой болезнь, связанную с переходом латентной патологии в манифестную после бессимптомной колонизации верхних дыхательных путей микроорганизмами. Хиб-инфекцию можно классифицировать по клиническим проявлениям:
- Инвазивная. Включает эпиглоттит, менингит, пневмонию, поражения костей, суставов, подкожно-жировой клетчатки. Более 85% случаев выявляется у детей младше 4-х лет.
- Неинвазивная. Часто вызывается нетипируемыми штаммами, протекает как рецидивирующий синусит, отит, конъюнктивит. Поражаются как дети, так и взрослые.
- Сепсис. Характерно бурное течение, высокая летальность, отсутствие вторичных очагов. Обычно заболевают младенцы в возрасте 6-12 месяцев, роженицы. Больные погибают от септического шока.
Оглавление
МКБ-10

Ecology
H. somnus is a parasitic organism that typically lives as a commensal organism in its host. It is commonly found in upper respiratory tract, prepuce and vagina of cattle [5] and can also be found circulating in the bloodstream. Like many haemophilus species, such as Haemophilus influenzae, H. somnus is a pathogen and is the cause of many fatal bovine diseases. They take over many of the host’s mechanisms in order to survive. For instance, H. somnus obtains its iron in iron low environments by attaching to bovine transferrin.
Прогноз и профилактика
Прогноз всегда серьезный и зависит от формы гемофильной инфекции. Летальность достигает 10-20%. Разработана специфическая профилактика. Вакцины разрешены к введению с 3-х месяцев жизни, по схеме 3-4,5-6 месяцев, ревакцинация проводится в 1,5 года. Применяются как в виде многокомпонентных (Пентаксим, Инфанрикс Гекса), так и монопрепаратов (АктХИБ, Хиберикс). После 5-ти лет вакцинация здоровым детям не проводится.
Неспецифическими мерами является санитарно-просветительская работа с населением, санация бактерионосителей в очагах, улучшение условий проживания. Важным звеном профилактики является изоляция больных и контактных лиц на дому или стационаре, карантинные мероприятия в детских учреждениях (до 10 дней). Экстренная антибиотикопрофилактика показана лицам из групп риска.
Диагностика
Диагностика гемофильной инфекции осуществляется врачами различных специальностей, чаще педиатрами, инфекционистами. Важен тщательный сбор эпидемиологического анамнеза, особенно вакцинальной истории ребенка либо взрослого. Основные лабораторно-инструментальные и клинические признаки болезни:
- Физикальные данные. Объективно выявляются симптомы ДН: одышка, изменение оттенка кожи, втягивание межреберных промежутков, вынужденное положение. На коже туловища и конечностей при сепсисе определяется геморрагическая сыпь. Неврологические проявления включают ригидность мышц затылка, положительный симптом Ласега, Кернига, Брудзинского. Гнойные поражения кожи выглядят гиперемированными, флюктуирующими, отекшими, резко болезненными.
- Ларингоскопия. Симптомы эпиглоттита требуют осмотра ЛОР-врача с проведением визуальной оценки состояния дыхательных путей. При непрямой ларингоскопии выявляется гиперемия зева, большое количество слюны, слизи. Надгортанник увеличен в размерах, багрово-синюшного оттенка, вход в гортань сужен из-за отека стенок.
- Лабораторные исследования. Определяется лейкоцитоз с резким сдвигом формулы влево, ускорение СОЭ. При сепсисе возникает анемия, тромбоцитопения, регистрируется рост активности печеночных трансаминаз, мочевины, креатинина, а также билирубина, Д-димера, гипоальбуминемия. В ОАМ – увеличение плотности, протеинурия, эритроцитурия. Ликворограмма характеризуется нейтрофильным плеоцитозом.
- Идентификация инфекционных агентов. Обнаружение бактерии производится путем микроскопии и посева на питательные среды смывов из носоглотки, зева, мокроты, ликвора, крови или гнойного отделяемого. Наиболее быстрым методом детекции инфекционной палочки является ПЦР. Серологическая диагностика (ИФА) проводится в парных сыворотках с интервалом не менее 14 дней, служит для ретроспективного подтверждения диагноза.
- Инструментальные методы. Необходимо проведение рентгена органов грудной клетки либо низкодозовой КТ легких. Рентгенография шеи в боковой проекции применяется при подозрении на эпиглоттит. В тяжелых случаях возможно выполнение оптиковолоконной ларингобронхоскопии. Рекомендуется УЗИ мягких тканей, брюшной полости. При симптомах менингита обязательна люмбальная пункция.
Дифференциальная диагностика
Дифференциальная диагностика проводится с гнойными менингитами и пневмониями иной этиологии (часто различия только лабораторные, определяются при выделении возбудителя). Эпиглоттит клинически сходен с паратонзиллярным, заглоточным абсцессами. Похожую клинику имеют инородные тела гортани, ожоги кислотами, щелочами, однако в этих случаях обычно известны подробности анамнеза. Может потребоваться исключение острого стенозирующего ларингита, истинного дифтерийного крупа.
Патогенез
Патогенез инфекции окончательно не изучен. При попадании внутрь организма человека бактерия длительно персистирует во входных воротах, находясь вне- и внутриклеточно. Колонизация может происходить типируемыми и нетипируемыми штаммами с динамической сменой микробного пейзажа. У серотипа b имеются протеазы, способные инактивировать секреторные иммуноглобулины слизистой. Белки оболочки-капсулы гемофильной палочки могут блокировать фагоцитоз.
При снижении резистентных свойств организма (сопутствующее вирусное поражение, стресс, переохлаждение) возникает активация размножения возбудителя и местное воспаление. Гемофильная палочка может пенентрировать слизистую, попадать в системный кровоток, распространяться по органам-мишеням (головной мозг, легкие, мягкие ткани). Бактерия способна размножаться в крови, формируя бактериемию с вторичными очагами, а затем септическое состояние.
Лечение гемофильной инфекции
Читайте также:


