Для электрохимической защиты стальных изделий от коррозии в качестве протектора
Электрохимическая защита – эффективный способ защиты готовых изделий от электрохимической коррозии. В некоторых случаях невозможно возобновить лакокрасочное покрытие или же защитный оберточный материал, тогда целесообразно использовать электрохимическую защиту. Покрытие подземного трубопровода или же днища морского суда очень трудоемко и дорого возобновлять, иногда просто невозможно. Электрохимическая защита надежно защищает изделие от коррозии, предупреждая разрушение подземных трубопроводов, днищ судов, различных резервуаров и т.п.
Применяется электрохимическая защита в тех случаях, когда потенциал свободной коррозии находится в области интенсивного растворения основного металла либо перепассивации. Т.е. когда идет интенсивное разрушение металлоконструкции.
Суть электрохимической защиты
К готовому металлическому изделию извне подключается постоянный ток (источник постоянного тока или протектор). Электрический ток на поверхности защищаемого изделия создает катодную поляризацию электродов микрогальванических пар. Результатом этого является то, что анодные участки на поверхности металла стают катодными. А вследствии воздействия коррозионной среды идет разрушение не металла конструкции, а анода.
В зависимости от того, в какую сторону (положительную или отрицательную) смещается потенциал металла, электрохимическую защиту подразделяют на анодную и катодную.
Катодная защита от коррозии
Катодная электрохимическая защита от коррозии применяется тогда, когда защищаемый металл не склонен к пассивации. Это один из основных видов защиты металлов от коррозии. Суть катодной защиты состоит в приложении к изделию внешнего тока от отрицательного полюса, который поляризует катодные участки коррозионных элементов, приближая значение потенциала к анодным. Положительный полюс источника тока присоединяется к аноду. При этом коррозия защищаемой конструкции почти сводится к нулю. Анод же постепенно разрушается и его необходимо периодически менять.
Существует несколько вариантов катодной защиты: поляризация от внешнего источника электрического тока; уменьшение скорости протекания катодного процесса (например, деаэрация электролита); контакт с металлом, у которого потенциал свободной коррозии в данной среде более электроотрицательный (так называемая, протекторная защита).
Поляризация от внешнего источника электрического тока используется очень часто для защиты сооружений, находящихся в почве, воде (днища судов и т.д.). Кроме того данный вид коррозионной защиты применяется для цинка, олова, алюминия и его сплавов, титана, меди и ее сплавов, свинца, а также высокохромистых, углеродистых, легированных (как низко так и высоколегированных) сталей.
Внешним источником тока служат станции катодной защиты, которые состоят из выпрямителя (преобразователь), токоподвода к защищаемому сооружению, анодных заземлителей, электрода сравнения и анодного кабеля.
Катодная защита применяется как самостоятельный, так и дополнительный вид коррозионной защиты.
Главным критерием, по которому можно судить о эффективности катодной защиты, является защитный потенциал. Защитным называется потенциал, при котором скорость коррозии металла в определенных условиях окружающей среды принимает самое низкое (на сколько это возможно) значение.
В использовании катодной защиты есть свои недостатки. Одним из них является опасность перезащиты. Перезащита наблюдается при большом смещении потенциала защищаемого объекта в отрицательную сторону. При этом выделяется. В результате – разрушение защитных покрытий, водородное охрупчивание металла, коррозионное растрескивание.
Протекторная защита (применение протектора)
Разновидностью катодной защиты является протекторная. При использовании протекторной защиты к защищаемому объекту подсоединяется металл с более электроотрицательным потенциалом. При этом идет разрушение не конструкции, а протектора. Со временем протектор корродирует и его необходимо заменять на новый.
Протекторная защита эффективна в случаях, когда между протектором и окружающей средой небольшое переходное сопротивление.
Каждый протектор имеет свой радиус защитного действия, который определяется максимально возможным расстоянием, на которое можно удалить протектор без потери защитного эффекта. Применяется протекторная защита чаще всего тогда, когда невозможно или трудно и дорого подвести к конструкции ток.
Протекторы используются для защиты сооружений в нейтральных средах (морская или речная вода, воздух, почва и др.).
Для изготовления протекторов используют такие металлы: магний, цинк, железо, алюминий. Чистые металлы не выполняют в полной мере своих защитных функций, поэтому при изготовлении протекторов их дополнительно легируют.
Железные протекторы изготавливаются из углеродистых сталей либо чистого железа.
Цинковые протекторы
Цинковые протекторы содержат около 0,001 – 0,005 % свинца, меди и железа, 0,1 – 0,5 % алюминия и 0,025 – 0,15 % кадмия. Цинковые проекторы применяют для защиты изделий от морской коррозии (в соленой воде). Если цинковый протектор эксплуатировать в слабосоленой, пресной воде либо почвах – он достаточно быстро покрывается толстым слоем оксидов и гидроксидов.
Протектор магниевый
Сплавы для изготовления магниевых протекторов легируют 2 – 5 % цинка и 5 – 7 % алюминия. Количество в сплаве меди, свинца, железа, кремния, никеля не должно превышать десятых и сотых долей процента.
Протектор магниевый используют в слабосоленых, пресных водах, почвах. Протектор применяется с средах, где цинковые и алюминиевые протекторы малоэффективны. Важным аспектом является то, что протекторы из магния должны эксплуатироваться в среде с рН 9,5 – 10,5. Это объясняется высокой скоростью растворения магния и образованием на его поверхности труднорастворимых соединений.
Магниевый протектор опасен, т.к. является причиной водородного охрупчивания и коррозионного растрескивания конструкций.
Алюминиевые протекторы
Алюминиевые протекторы содержат добавки, которые предотвращают образование окислов алюминия. В такие протекторы вводят до 8 % цинка, до 5 % магния и десятые-сотые доли кремния, кадмия, индия, таллия. Алюминиевые протекторы эксплуатируются в прибрежном шельфе и проточной морской воде.
Анодная защита от коррозии
Анодную электрохимическую защиту применяют для конструкций, изготовленных из титана, низколегированных нержавеющих, углеродистых сталей, железистых высоколегированных сплавов, разнородных пассивирующихся металлов. Анодная защита применяется в хорошо электропроводных коррозионных средах.
При анодной защите потенциал защищаемого металла смещается в более положительную сторону до достижения пассивного устойчивого состояния системы. Достоинствами анодной электрохимической защиты является не только очень значительное замедление скорости коррозии, но и тот факт, что в производимый продукт и среду не попадают продукты коррозии.
Анодную защиту можно реализовать несколькими способами: сместив потенциал в положительную сторону при помощи источника внешнего электрического тока или введением в коррозионную среду окислителей (или элементов в сплав), которые повышают эффективность катодного процесса на поверхности металла.
Анодная защита с применением окислителей по защитному механизму схожа с анодной поляризацией.
Если использовать пассивирующие ингибиторы с окисляющими свойствами, то защищаемая поверхность переходит в пассивное состояние под действием возникшего тока. К ним относятся бихроматы, нитраты и др. Но они достаточно сильно загрязняют окружающую технологическую среду.
При введении в сплав добавок (в основном легирование благородным металлом) реакция восстановления деполяризаторов, протекающая на катоде, проходит с меньшим перенапряжением, чем на защищаемом металле.
Если через защищаемую конструкцию пропустить электрический ток, происходит смещение потенциала в положительную сторону.
Установка для анодной электрохимической защиты от коррозии состоит из источника внешнего тока, электрода сравнения, катода и самого защищаемого объекта.
Для того, чтоб узнать, возможно ли для определенного объекта применить анодную электрохимическую защиту, снимают анодные поляризационные кривые, при помощи которых можно определить потенциал коррозии исследуемой конструкции в определенной коррозионной среде, область устойчивой пассивности и плотность тока в этой области.
Для изготовления катодов используются металлы малорастворимые, такие, как высоколегированные нержавеющие стали, тантал, никель, свинец, платина.
Чтобы анодная электрохимическая защита в определенной среде была эффективна, необходимо использовать легкопассивируемые металлы и сплавы, электрод сравнения и катод должны все время находится в растворе, качественно выполнены соединительные элементы.
Для каждого случая анодной защиты схема расположения катодов проектируется индивидуально.
Для того, чтоб анодная защита была эффективной для определенного объекта, необходимо, чтоб он отвечал некоторым требованием:
- все сварные швы должны быть выполнены качественно;
- в технологической среде материал, из которого изготовлен защищаемый объект, должен переходить в пассивное состояние;
- количество воздушных карманов и щелей должно быть минимальным;
- на конструкции не должно присутствовать заклепочных соединений;
- в защищаемом устройстве электрод сравнения и катод должны всегда находиться в растворе.
Для реализации анодной защиты в химической промышленности часто используют теплообменники и установки, имеющие цилиндрическую форму.
Электрохимическая анодная защита нержавеющих сталей применима для производственных хранилищ серной кислоты, растворов на основе аммиака, минеральных удобрений, а также всевозможных сборников, цистерн, мерников.
Анодная защита может также применяться для предотвращения коррозионного разрушения ванн химического никелирования, теплообменных установок в производстве искусственного волокна и серной кислоты.
Недорого и эффективно — протекторная защита от ржавчины
Несмотря на повсеместное применение пластика, металлические трубопроводы по-прежнему широко применяются для транспортировки кислот, щелочей, газов, нефтепродуктов и пр. Такие сооружения со временем начинают приходить в негодность из-за атмосферной, химической и других видов коррозии. Несмотря на то, что это естественный процесс, его, тем не менее, можно замедлить. Для этого и существует протекторная защита металла от коррозии.

Причины повреждения металлических конструкций
- Химические реакции. Разрушение происходит при взаимодействии металла с различными химическими соединениями (кислотами, щелочами и пр.). Возникающая как продукт химической реакции ржавчина последовательно разъедает трубопровод.
- Электрохимические процессы. Этот вид коррозии один из самых агрессивных. Появляется, если труба или судно находится в электролите, где образовываются катоды и аноды. Возникающая ржа быстро распространяется, повреждая самый толстый металл.
- Атмосферные явления. При взаимодействии металла с водой, паром, воздухом выделяется оксид железа, который и разрушает сооружение.
Перед планированием работ по защите от коррозии необходимо провести оценку факторов, влияющих на металлическую поверхность.
Защита металла от коррозии
- обработка химическими составами;
- покрытие стенок защитными материалами;
- предупреждение блуждающих токов;
- организация катода или анода.
- Пассивные действия. Во время монтажа трубопровода до прилежащей почвы оставляют некоторый зазор. Он предупреждает попадание грунтовых вод с примесями на металлическую поверхность. Трубопровод покрывают специальными составами, которые защищают металл от негативного воздействия грунта. Затем наносят специальные химические вещества, образующие защитную пленку на металлической поверхности.
- Активная защита. Создается электродренажная система, защищающая трубопровод от блуждающих токов. Металлическую поверхность от разрушения защищают созданием анода или катода.

Что такое протекторная защита?
Протекторная защита — вариант антикоррозийной обработки, которая предполагает контакт металлической предохраняемой поверхности с протектором – ингибитором, более активным металлом. Под воздействием воздуха ингибитор предохраняет основное изделие (трубопровод, систему водоснабжения или отопления, корпус корабля и пр.) от разрушения.
Протекторная защита металлов от коррозии является оптимальной при отсутствии возможности проведения специальных электрических линий для создания эффективной катодной защиты перед электрохимической ржавчиной либо при нецелесообразности такого метода. Применять протекторную защиту целесообразно на малогабаритных объектах либо в случаях, когда поверхность обрабатываемого сооружения покрыта изоляционным материалом.
Протектор может полностью предохранить от повреждения основной объект в случае, если показатель переходного сопротивления между объектом и окружающей средой незначительный.
Но протекторная защита от коррозии имеет положительный эффект только на каком-то расстоянии, то есть каждый из видов протекторов имеет свой радиус антикоррозийного действия. Это максимальное расстояние протектора от предохраняемого объекта.
Для антикоррозийной защиты применяют установки, которые состоят из одного или нескольких протекторов, соединительных кабелей и контрольно-измерительных участков. Если есть необходимость, то в схему включают шунты, регулирующие резисторы, поляризованные элементы. Монтируют установки ниже уровня промерзания грунта (не менее 1 метра). Располагают протектор на расстоянии 3 — 7 метров от защищаемого сооружения. Более близкое может спровоцировать повреждение изоляционного слоя солями растворяющегося ингибитора.
- Менее активный металл восстанавливается.
- Протектор окисляется, защищая основное сооружение от коррозии.
Так как во время активного взаимодействия с окружающей средой и трубопроводом протектор полностью «растворяется» или просто теряет контакт с предохраняемым сооружением, то защитный механизм периодически необходимо восстанавливать.

Особенности протекторной защиты
Учитывая физико-химические особенности такой защиты металлических сооружений, можно сделать вывод о нецелесообразности применения протектора в случае, если конструкция эксплуатируется в кислых средах. Протекторная защита рекомендована к применению, если сооружение находится в нейтральной среде (грунт, вода, воздух и пр.).
Чтобы защитить железный трубопровод, в качестве протектора имеет смысл использовать кадмий, хром, цинк, магний (более активные металлы). Но и при их использовании существует ряд нюансов.
Например, чистый магний имеет высокую скорость ржавления, чистый цинк из-за крупнозернистой структуры растворяется неравномерно, алюминий быстро покрывается оксидной пленкой. Чтобы предотвратить негативные явления, в чистое вещество, которое будет служить протектором, вводят легирующие составляющие. Фактически протектором выступает не чистый металл, а его сплав с другими веществами.
Магниевая защита
Чаще всего в качестве защиты применяют сплавы магния. Легирующими компонентами состава выступают алюминий (максимум 7 %), цинк (до 5 %), также вводят медь, свинец и никель, но их суммарная доля не превышает сотой части состава. В качестве протектора такие составы могут применяться в средах с показателем кислотности не выше 10,5.
Даже в составе сплава магний быстро растворяется, а потом на его верхнем слое появляются труднорастворимые соединения. Магниевые сплавы имеют существенный недостаток — после нанесения они могут спровоцировать растрескивание металлических изделий, способствовать возникновению повышенной водородной хрупкости.

Цинковая защита
Альтернативой магниевому сплаву для защиты конструкций, расположенных в соленой воде, выступают цинковые составы. Легирующими компонентами для цинка становятся кадмий (максимальный показатель 0,15 %), алюминий (менее 0,5 %) и незначительное количество железа, свинца и меди (суммарно до 0,005 %). От влияния морской воды такой протектор будет идеальным, но в нейтральных средах протекторы из цинкового сплава быстро покроются оксидами и гидроксидами, сведя на нет весь антикоррозийный комплекс.
Цинковые сплавы выступают как протекторы от коррозии, обеспечивая максимальную взрыво- и пожарную безопасность. Этими составами целесообразно обрабатывать трубопроводы для горючих и взрывоопасных веществ, например, газа. Еще один «балл» в свой актив такие составы получают за экологическую безопасность – при анодном растворении не образуется загрязняющих веществ. Поэтому цинковые композиции часто применяются для коррозийной защиты нефтепроводов, а также для транспортирующих нефть танкеров и судов.
От воздействия проточной соленой воды обычно применяют алюминиевые составы. В сплав также вводят цинк (до 8 %), магний (до 5 %) и индий с кремнием , таллием и кадмием с незначительной долей (до 0,02 %). Добавки предупреждают возникновение окислов на алюминии. Также алюминиевые сплавы пригодны в условиях, где используется магниевая защита.
Обработка агрессивных жидкостей
Повреждение металлических конструкций происходит как снаружи, так и внутри. Даже жидкость с нейтральным уровнем кислотности (вода) может быстро разрушить трубопровод, если в ее составе содержатся бикарбонаты, карбонаты, кислород, которые являются причиной возникновения ржавчины. Обычная очистка внутренних поверхностей в таких сооружениях невозможна. Оптимальным выходом будет предварительное введение в жидкость соды, карбоната натрия или кальция. Такой обработкой воды можно снизить агрессивность транспортируемой жидкости.
Подземные емкости, изготовленные из цинковых сплавов, защищают путем введения в транспортируемую или хранящуюся среду силикатов, фосфатов или поликарбонатов. В результате химической реакции на цинковой поверхности появляется тонкая пленка, предупреждающая развитие ржавчины.

Преимущества и недостатки протекторной защиты
- простота, автономность и экономичность благодаря отсутствию источника тока и использованию магниевых, алюминиевых или цинковых сплавов;
- возможность формирования одиночных или групповых установок;
- возможность применения протекторной защиты, как для проектируемых объектов, так и для уже эксплуатируемых конструкций;
- организация защиты практически в любых условиях, где невозможно или нецелесообразно сооружать источники тока;
- при правильном использовании система может работать достаточно долго без всякого обслуживания;
- безопасность и возможность применения на взрывоопасных объектах (ввиду малости напряжений).
- Ограниченность применения способа в плохо проводящих ток средах.
- Безвозвратные потери протектора.
- Возможность загрязнения прилегающих территорий.

Как увеличить эффективность протекторов?
Чаще всего протекторные композиции применяются совместно с лакокрасочными составами, имеющими антикоррозийные свойства. Лакокрасочная защита самостоятельно не дает нужного эффекта, но при сочетании с протектором:
- позволяет устранить изъяны покрытия металлического сооружения, которые возникают в процессе эксплуатации (вспучивание, отслоение, набухание металла, появление трещин и пр.);
- снижает расход протекторных составов, увеличивая срок службы (при довольно высокой стоимости защитных сплавов это значимый эффект);
- обеспечивает равномерное распределение защитного тока по поверхности металлического трубопровода.
Конечно, на эксплуатируемое судно или резервуар нанести лакокрасочный состав довольно сложно. В этом случае лучше отказаться от его применения, а использовать только протекторы.
Резюме
Практически все эффективные методы защиты от коррозии требуют расхода электрического тока. Протекторный способ позволяет предупредить ржавчину простым нанесением дополнительного слоя защитного сплава на трубу.
Особенности протекторной защиты металлов от коррозии
Протекторная защита — это один из возможных вариантов защиты конструкционных материалов трубопроводов от коррозии. Применяется, прежде всего, на газопроводах и других магистралях.

Сущность протекторной защиты
Протекторная защита представляет собой использование специального вещества — ингибитора, который является металлом с повышенными электроотрицательными качествами. Под воздействием воздуха протектор растворяется, в результате чего основной металл сохраняется, несмотря на воздействие коррозийных факторов. Протекторная защита — одна из разновидностей катодного электрохимического метода.
Данный вариант антикоррозийных покрытий особенно часто применяется, когда предприятие стеснено в своих возможностях по организации катодной защиты от коррозийных процессов электрохимического характера. Например, если финансовые или технологические возможности предприятия не позволяют построить линии электропередач.

Схема протекторной защиты трубопровода
Протектор-ингибитор эффективен, когда показатель переходного сопротивления между защищаемым объектом, и средой вокруг него, не является значительной. Высокая результативность протектора возможна лишь на определенной дистанции. Чтобы выявить это расстояние, применяется определение радиуса антикоррозийного действия применяемого протектора. Данное понятие показывает максимальное удаление защищающего металла от охраняемой поверхности.
Суть коррозийных процессов сводится к тому, что наименее активный метал в период взаимодействия, привлекает к собственным ионам электроны более активного металла. Таким образом, в одно и то же время осуществляется сразу два процесса:
- восстановительные процессы в металле с меньшей активностью (в катоде);
- окислительные процессы металла анода с минимальной активностью, за счет чего и обеспечивается защита трубопровода (или другой стальной конструкции) от коррозии.
Спустя некоторое время эффективность протектора падает (в связи с потерей контакта с защищаемым металлом или же из-за растворения защищающего компонента). По этой причине возникает потребность в замене протектора.
Особенности метода
Протекторы для защиты от коррозийных процессов в условиях кислых сред лишены смысла. В таких средах растворение протектора происходит опережающими темпами. Методика рекомендуется для применения только в нейтральных средах.

В сравнении со сталью, большей активностью обладают такие металлы, как хром, цинк, магний, кадмий, а также, некоторые иные. В теории именно перечисленные металлы нужно использовать для защиты трубопроводов и других металлоконструкций. Однако тут есть ряд особенностей, зная которые, можно обосновать технологическую бессмысленность применения чистых металлов в качестве защиты.
К примеру, для магния характерна высокая скорость развития коррозии, на алюминии стремительно образовывается толстая оксидная пленка, а цинк растворяется очень неравномерно из-за своей особой крупнозернистой структуры. Чтобы свести на нет подобные отрицательные свойства чистых металлов, в них добавляют легирующие элементы. Иначе выражаясь, защита газопроводов и других металлических конструкций осуществляется за счет использования всевозможных сплавов.

Нередко применяются магниевые сплавы. Помимо основного компонента — магния — в их составе имеется алюминий (5-7%) и цинк (2-5%). Кроме того, добавляются небольшие количества никеля, меди и свинца. Магниевые сплавы актуальны для защиты от коррозии в условиях сред, где показатель pH не превышает 10,5 единиц (традиционный грунт, пресные и слабосоленые водоемы). Данный ограничивающий показатель связан с быстрой растворяемостью магния на первом этапе и дальнейшим появлением труднорастворимых соединений.
Обратите внимание! Магниевые сплавы часто влекут трещины в металлических изделиях и повышают их водородную хрупкость.
Для конструкций из металлов расположенных в соленой воде (например, подводном морском трубопроводе), следует применять протекторы, в основе которых находится цинк. Такие сплавы также содержат:
- алюминий (до 0,5%);
- кадмий (до 0,15%);
- медь и свинец (суммарно до 0,005%).
В водной соленой среде защита металлов от коррозии с помощью сплавов на основе цинка будет оптимальным вариантом. Однако в пресных водоемах и на обычном грунте такие протекторы очень быстро обрастают оксидами и гидроксидами, в результате чего антикоррозионные мероприятия теряют смысл.

Протекторы на основе цинка чаще используются для защиты от коррозии тех металлических конструкций, где технологические условия требуют наивысшей степени противопожарной безопасности и взрывобезопасности. Примером востребованности таких сплавов являются газопроводы и трубопроводы для транспортировки горючих жидкостей.
Кроме того, цинковые составы, в результате анодного растворения, не образуют загрязняющих веществ. Поэтому такие сплавы практически безальтернативны, когда нужно защитить трубопровод для транспортировки нефти или металлоконструкции в танкерных судах.
В условиях соленой проточной воды на прибрежном шельфе часто применяются алюминиевые сплавы. Такие составы включают кадмий, таллий, индий, кремний (в сумме — до 0,02%), а также магний (до 5%) и цинк (до 8%). Протекторные свойства алюминиевых составов близки со свойствами магниевых сплавов.
Комбинация протекторов и красок
Часто возникает необходимость защитить газопровод от коррозии не только протектором, но лакокрасочным материалом. Краска считается пассивным способом защиты от коррозионных процессов и действительно эффективна лишь, когда сочетается с применением протектора.

Такая методика сочетания позволяет:
- Уменьшить отрицательное воздействие потенциальных изъянов покрытия металлоконструкций (отслаивание, набухание, растрескивание, вспучивание и тому подобное). Такие изъяны имеются не только в результате заводского брака, но и в связи с природными факторами.
- Уменьшить (порой на весьма значимую величину) расход дорогих протекторов, при этом увеличив их срок эксплуатации.
- Сделать распределение по металлу защитного слоя более равномерным.
Также стоит отметить, что лакокрасочные составы очень часто непросто наносить на определенные поверхности уже работающего газопровода, танкера или какой-то другой металлоконструкции. В таких случаях придется обойтись только защитным протектором.
Электрохимические методы защиты от коррозии - катодная защита
Суть этих методов заключается в том, чтобы при возможном возникновении гальванических элементов защищаемый металл был заведомо катодом, так как разрушается, окисляясь, всегда металл - анод. Для создания подобных гальванических элементов используют более активный металл либо внешний источник постоянного тока.
Использование более активных металлов
К одному из вариантов этой защиты можно отнести рассмотренные выше «анодные» металлические покрытия после их частичного нарушения.
Если более активный металл вводят в объём защищаемого металла, образуются устойчивые к коррозии сплавы. В частности, устойчивыми к коррозии сталями являются хромистые стали. При содержании хрома более 20% они обладают высокой стойкостью против всех видов коррозии, их часто называют нержавеющими. Хром имеет меньший потенциал, чем железо, поэтому железо в возможно образующихся на поверхности микрогальванических элементах будет катодом.
Активные металлы (имеющие меньшие значения потенциалов) или содержащие их сплавы используют в качестве протекторов. Металл-протектор присоединяют к поверхности защищаемой металлической конструкции. Обычно используют несколько протекторов, присоединяемых к одной конструкции. Образуются гальванические элементы, в которых защищаемый металл является катодом, а протектор - анодом. Для защиты стальных изделий в качестве протекторов используют цинк или сплавы на основе магния (рис. 17).
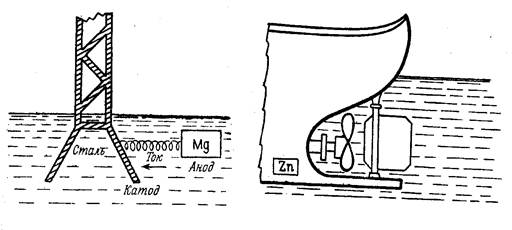
а) - опора ЛЭП; б) - корпус корабля
Рисунок 17 - Схема протекторной защиты
Рассмотрим защиту стальной конструкции с помощью магниевых протекторов в воде с рН = 7. Магний является анодом (Е° Mg/Mg 2+ = -2,38 В,
Е°Fe/ Fe2+ = -0,44В), и разрушается, а сталь является катодом, и на её поверхности происходит восстановление кислорода. Процесс восстановления не затрагивает и не изменяет металл катода, поэтому до тех пор, пока протекторы полностью не разрушатся, коррозия на поверхности стальной конструкции происходить не будет.
Анод: Mg│Fe° - 2 ё → Fe 2+
Катод: Fe│О2 +2Н2О + 4 ё → 4(ОН) -
Протекторную защиту обычно применяют как дополнительный способ защиты в сочетании с различными гидроизолирующими покрытиями.
Электрозащита от коррозии
Сущность электрозащиты (защита наложенным постоянным током) состоит в том, что защищаемая металлическая конструкция подключается к отрицательному полюсу внешнего источника постоянного тока (выпрямителя, генератора), поэтому она будет катодом, а анодом служит вспомогательный электрод, обычно сталь, чугун (или металл), который присоединяется к положительному полюсу источника тока (рис. 18).
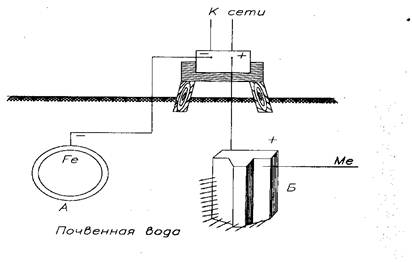
А) - защищаемый стальной трубопровод (катод);
Б) - вспомогательный электрод (анод)
Рисунок 18 - Схема электрозащиты
Электрозащиту чаще всего используют для массивных стальных конструкций, находящихся в воде или в почве, обычно в комбинации с изолирующими покрытиями. Преимущества электрозащиты заключаются в легкости регулирования подаваемого тока и поддержания необходимого за-
щитного потенциала, а также в возможности применения в качестве анодов дешёвых чёрных металлов или металлолома.
При катодной электрозащите на поверхности защищаемого металла (катод) в зависимости от значения рН и состава среды происходит восстановление ионов водорода или молекул кислорода, а вспомогательный металл (анод) разрушается.
Рассмотрим реакции при электрозащите стального трубопровода, находящегося в нейтральной среде (металл вспомогательного электрода обозначен символом Me).
Анод: Me│ Me 0 - 2 ё →Ме 2+
Металлические защитные покрытия (анодные, катодные).
Неметаллические защитные покрытия. Электрохимические методы защиты от коррозии.
Методы защиты от коррозии можно объединить в следующие группы:
1) нанесение защитных покрытий и пленок;
2) изменение электрохимического потенциала защищаемого материала по отношению к среде на границе фаз;
3) модификация коррозионной среды.
Борьба с коррозией с применением защитных покрытий является наиболее распространенным способом. В качестве защитных применяют металлические и неметаллические покрытия.
Металлические покрытия могут быть выполнены из металла более или менее благородного, чем подложка. В связи с этим они делятся на две группы: катодные и анодные покрытия.
К катодным покрытиям относятся те покрытия, электрохимический потенциал которых в данных условиях больший, чем у защищаемого металла. На алюминий почти всегда наносят катодные покрытия. Покрытия из благородных металлов на стали имеют такой же характер. Катодные покрытия защищают металл только благодаря его изоляции от атакующей среды. Поэтому свою роль они выполняют только при наличии полной сплошности. Если в катодном покрытии образуется щель, то в условиях коррозии она становится катодом, а открытая часть защищаемого металла – анодным элементом. Анодная поверхность при этом значительно меньше, чем катодная. Электрохимическое разрушение металла концентрируется на небольшой поверхности. Учитывая опасности, кроющиеся в возможных несплошностях катодных покрытий, их делают сравнительно большой толщины.
Анодные покрытия – это покрытия, выполненные из металла, у которого электродный потенциал меньше, чем у защищаемого металла. Для железа, работающего в малокислых или нейтральных растворах, анодными покрытиями являются цинк, алюминий. Защитные свойства анодных покрытий состоят не только в механической изоляции металла от коррозионной среды. Они заключаются еще и в электрохимическом воздействии. В случае нарушения покрытия и образования коррозионного элемента, защищаемый металл, являющийся катодом, не разрушается. Небольшие несплошности в анодных покрытиях не опасны.
Металлические покрытия наносят электроосаждением, погружением в расплавленные металлы, металлизацией напылением, химическим осаждением солей, диффузией и т. д. В последнее время все большее распространение получает нанесение покрытий в вакууме.
Неметаллические покрытия применяются в случае возникновения химической реакции металла в соответствующих средах. К ним, в частности, относят оксидные алюминиевые покрытия, полученные в ходе специального электролитического процесса. Фосфатные покрытия применяются в большинстве случаев с дополнительными защитными средами, как, например, краски, лаки и т. п. Фосфатирование стали состоит в погружении изделия в разбавленный раствор фосфорной кислоты и кислых фосфатов цинка или магния. В результате реакции образуется нерастворимый фосфат железа, который в ходе процесса плотно покрывает поверхность металла. К этой же группе относят керамические покрытия и стекловидные эмали. Эти покрытия достаточно стойки к воздействию минеральных и органических кислот. Их недостатком является повышенная хрупкость и низкая стойкость в условиях резких перепадов температуры.
Одним из самых популярных способов защиты металла от коррозии является нанесение неметаллических составов. Это может быть пластик, керамика, каучук, битум, полиуретан, лакокрасочные составы и многое другое. Причем последние представляют собой наиболее широкий ассортимент и могут применяться в зависимости от условий среды, в которых будет использоваться изделие. Так выделяют лакокрасочные покрытия, устойчивые к действиям воды, атмосферы, химическим растворам и т. д.
К органическим покрытиям относятся разнообразные лакокрасочные материалы.
Знание механизма коррозии позволило создать методы коррозионной защиты путем наложения на металл такого потенциала, при котором он становится термодинамически устойчивым. К таким методам относятся катодная защита и уменьшение агрессивности среды, окружающей металлоконструкцию.
Катодная защита состоит в присоединении к защищаемой конструкции анода-протектора с более отрицательным электрохимическим потенциалом. Протектор (лат. protector – покровитель, защитник) и служит таким анодом, препятствующим разрушению защищаемого сплава; сам протектор при коррозии постепенно разрушается.
Протектором может являться любой металл, имеющий по отношению к данному сплаву более отрицательный потенциал. Однако разница в потенциалах не должна быть слишком большой, чтобы при электрохимическом процессе не происходило быстрого разрушения протектора.
Протекторы представляют собой обычно небольшие пластинки, присоединяемые к защищаемой детали заклепками или болтами. Катодную или протекторную защиту широко применяют при защите от морской и подземной коррозии металлоконструкций, коммуникаций, трубопроводов, сосудов и т. д. В качестве анодов-протекторов для защиты стальных изделий обычно применяют сплавы магния или цинка. Защита может также осуществляться присоединением защищаемого металла к отрицательному полюсу постоянного тока.
Для уменьшения агрессивности окружающей среды в нее вводят добавки, называемые ингибиторами коррозии, которые или способствуют пассивации металла, или значительно снижают скорость его коррозии. Условием использования ингибиторов является эксплуатация изделия в замкнутой среде постоянного состава.
Различают анодные и катодные ингибиторы. В качестве анодных ингибиторов коррозии используют различные вещества, образующие нерастворимые соединения на анодных участках. Одним из таких пассиваторов является хромпик К2Сr207, вводимый в количестве 2 – 3 г/л в раствор охлаждающей жидкости.
Катодные ингибиторы тормозят катодный процесс. К их числу относятся различные травильные присадки, добавляемые в количестве 1 – 2 % в кислоты для снятия окалины без разрушения основного металла.
Летучие ингибиторы, такие как нитрат натрия NaNO2, применяют для пропитки бумаги, в которую заворачивают детали, подлежащие хранению или транспортировке. Испаряясь, они насыщают окружающее детали пространство, создавая защитную газовую среду. Летучие ингибиторы отличаются высокой эффективностью. Стальные изделия, завернутые в бумагу, обработанную NaNO2, в условиях относительной влажности 85 % не ржавеют в течение 5 лет. Преимуществом летучих ингибиторов является отказ от применения защитных покрытий, удобство расконсервации и постоянная готовность деталей к немедленному использованию без дополнительной обработки.
Суть электрохимической защиты
Читайте также:
