Pci это в медицине
Стадия онкологического заболевания дает информацию о том, насколько велика опухоль и распространилась ли она по организму. Это помогает врачам определять прогноз пациента и план лечения.
С помощью врача-онколога, резидента Высшей школы онкологии Сергея Югая разбираемся, как врачи устанавливают стадии рака и что каждая из них означает.
На что влияет стадия онкологического заболевания?
Стадирование нужно, чтобы спрогнозировать, какие у пациента шансы на выздоровление, а также чтобы определить, какой метод лечения будет наиболее эффективен в конкретном случае, — поясняет Сергей Югай.
Все начинается с медицинского осмотра и обследований — УЗИ, КТ, МРТ, ПЭТ-КТ и других методов в зависимости от вида рака. Затем врач берет кусочек опухоли — биопсию или удаляет опухоль целиком во время операции, а после отправляет материал на гистологический анализ, чтобы поставить диагноз.
Стадии рака по TNM-классификации
Стадии онкологического процесса описывают разными способами — это зависит от вида опухоли. Один из самых распространенных способов — стадирование с помощью TNM-классификации.
Т характеризует первичную опухоль, ее размеры и вовлечение окружающих структур в опухолевый рост, например, прорастание в стенку кишки или желудка. N говорит о наличии в лимфоузлах метастазов и количестве пораженных лимфоузлов, а М — о наличии отдаленных метастазов (во внутренних органах, костях, ЦНС или лимфоузлах, которые расположены далеко от первичной опухоли), — объясняет Сергей Югай.
Индекс Т принимает значения от 0 до 4. 0 означает, что первичная опухоль не обнаружена, 1 — опухоль маленькая, а 4 — опухоль проросла в прилегающие ткани. Таким образом, чем больше цифра рядом с Т, тем ситуация сложнее. При некоторых видах рака N принимает значение 0 или 1, при других — 0, 1 или 2, а иногда — 0, 1, 2 и 3. 0 означает, что опухоль не проникла в ближайшие лимфоузлы, а 3 — что поражено множество лимфоузлов. M0 показывает, что метастазов нет, а 1 — что метастазы есть.
Онкологи выставляют стадию по TNM клинически — до операции или когда операция не планируется и патоморфологически — при изучении удаленной во время операции опухоли, — объясняет Сергей.
Клиническая стадия обозначается буквой «c», например, cT2. Патоморфологическая — буквой «p», например, pN1.
От правильной стадии зависит тактика лечения. Например, пациент — мужчина с раком желудка и стадией cT1N0M0. Это значит, что опухоль прорастает в слизистую и подслизистый слой стенки желудка. В этом случае пациенту показана операция. Если же стадия выше (cT2N1M0, например), то есть опухоль пациента прорастает в мышечный слой, и есть метастазы в лимфоузлах, то может понадобиться химиотерапия перед операцией, которая позволит улучшить результаты лечения, — добавляет Сергей.
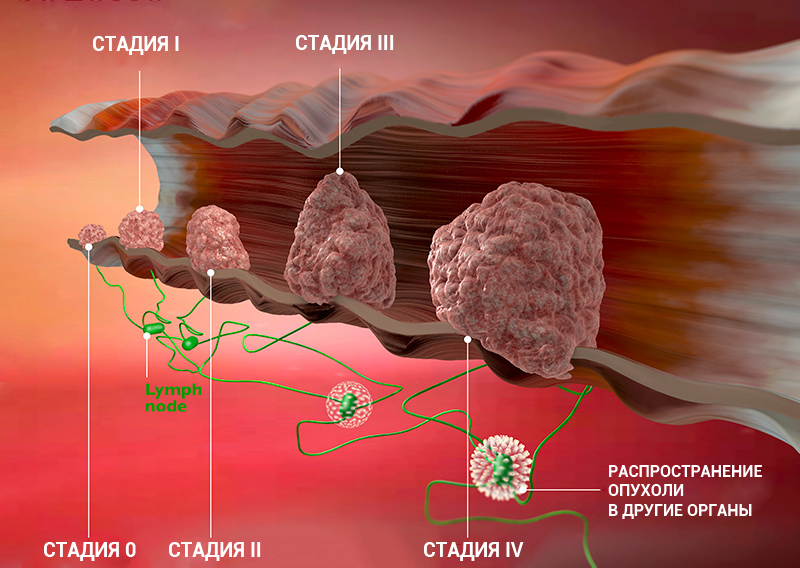
Стадию рака могут обозначать с помощью цифр — 0, I, II, III, IV. Что это значит?
- Стадия 0 — предраковое состояние. Предрак почти всегда успешно лечится, вовремя проведенное лечение позволяет избежать развития онкологического заболевания. Следующие стадии обозначают уже онкологический процесс.
- Стадии I, II — чем выше цифра, тем больше размер опухоли, но ее клетки, скорее всего, еще не проникли в ближайшие лимфоузлы.
- Стадия III — опухоль растет и распространилась на окружающие ткани и/или лимфоузлы.
- Стадия IV — есть отдаленные метастазы.
Клинические стадии (0, I, II, III, IV) тесно связаны с системой TNM. Как правило, одна клиническая стадия включает в себя несколько вариантов стадирования по TNM. Эти варианты характеризуются схожими прогнозом и подходом к лечению. Например, стадии T1N3M0, T2N3M0, T3N2M0 рака легкого объединяются в IIIВ стадию, так как при любой из этих ситуаций пациент будет иметь примерно одинаковый прогноз и тактику лечения. В этом конкретном примере необходима химиолучевая терапия, а не операция, — комментирует Сергей Югай.
Меняется ли стадия после лечения, при прогрессировании заболевания?
Нет, стадия выставляется один раз. Но есть нюансы:
Например, мы хотим посмотреть, как опухоль ответила на лечение, чтобы понять, можно ли делать операцию. После лечения опухоль уменьшилась, и мы добавляем к стадии новые данные. При прогрессировании опухолевого процесса первоначальная стадия также остается прежней, но, к сожалению, прогноз будет менее благоприятный. Например, у человека II стадия рака желудка. Он прооперирован, и прогноз у него хороший. Через 2 года врачи обнаруживают у пациента метастазы в легких. Стадия остается II, но рак у пациента уже метастатический, что очень усложняет положение, — говорит Сергей.
Бывает, что люди сравнивают свою ситуацию с историями других пациентов. Если речь идет о разных онкологических заболеваниях, то такие сравнения некорректны — это заболевания с разными прогнозами и схемами лечения:
Предлагаем Вашему вниманию краткий, но очень подробный обзор перитонеального канцероматоза.
Филиалы и отделения, где лечат перитонеальный канцероматоз
МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
Национальный центр лечения больных канцероматозом
МНИОИ имени П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России
Руководитель Центра к.м.н. Владимир Михайлович Хомяков – 8 495 150 11 22
Введение
Перитонеальный канцероматоз (опухоль брюшины) - одно из самых грозных вариантов прогрессирования целого ряда онкологических заболеваний. Канцероматоз является формой метастазирования, при которой опухолевые клетки распространяются по внутренней выстилке анатомической полости (брюшной или плевральной) и формируют на ней мелкие узелки, так называемые диссеминаты. Ее возникновение в большинстве случаев подразумевает IV стадию заболевания, и сопряжено с неблагоприятным прогнозом для пациента. Лечение пациентов с перитонеальным канцероматозом является одной из самых сложных задач в онкологии. Наиболее часто он развивается при злокачественных новообразованиях желудочно-кишечного тракта, дыхательной системы и женских репродуктивных органов. При каких опухолях может развиваться перитонеальный канцероматоз? При раке желудка, раке легкого, раке толстой и тонкой кишки, раке яичников, муцинозных опухолях червеобразного отростка. мезотелиоме брюшины или плевры, раке поджелудочной железы, саркоме брюшной полости (саркоматоз).
Согласно данным статистики, перитонеальный канцероматоз встречается у 20-35% пациентов с онкопатологией: в 40% случаев данное осложнение формируется при опухолях желудочно-кишечного тракта, в 30% - при раке яичников (причем на момент верификации диагноза рака яичников у подавляющего большинства пациенток уже имеет место поражение брюшины). Перитонеальный канцероматоз (опухоль брюшины) является неблагоприятным прогностическим фактором; данная форма прогрессирующего опухолевого поражения практически не поддается хирургическому лечению, а применение только системной химиотерапии улучшает состояние лишь на некоторое время.
Причины возникновения перитонеального канцероматоза
Перитонеальный канцероматоз является вторичным опухолевым поражением, результатом прогрессирования рака различной локализации. Наиболее часто поражение брюшины осложняется раком желудка, тонкого кишечника, поджелудочной железы, злокачественными опухолями яичников, матки, маточных труб, печеночноклеточным раком, реже - первичными опухолями брюшины (перитонеальная мезотелиома). В ряде случаев первичный очаг остается неустановленным.
Развитие перитонеального канцероматоза является поэтапным процессом. Первый этап – распространение опухолевых клеток из первичного очага поражения. Это связано с нарушением межклеточного взаимодействия и приобретением клетками опухоли подвижности. При этом эпителиальные клетки меняют фенотип на мезенхимальный, происходит деградация межклеточного матрикса. Распространение опухолевых клеток может происходить в ходе оперативного вмешательства. Их механическое отделение возможно при повреждении лимфатических или кровеносных сосудов. Попавшие в брюшную полость клетки опухоли мигрируют под действием силы тяжести, сокращений внутренних органов, имплантируются в местах повышенной резорбции: большом сальнике, в области слепой кишки, дугласовых карманах.
На втором этапе опухолевые клетки взаимодействуют с мезотелием брюшины. Механизмы адгезии определяются природой клеток, особенностями морфологии брюшины, а также наличием участков ее повреждения. Далее клетки закрепляются в мезотелии, происходит их горизонтальное распространение по поверхности перитонеума, а затем инвазивный рост – прорастание в базальную мембрану, соединительную ткань. Следующим этапом является стимуляция неоангиогенеза – обязательного фактора развития опухоли. Морфопатогенетические механизмы формирования канцероматоза брюшины еще недостаточно изучены, в связи с чем отсутствуют радикальные методы лечения.
Частота развития канцероматоза брюшины зависит не только от первичной локализации опухоли, но и от ее размеров, глубины инвазии, гистотипа, степени дифференцировки (недифференцированный рак желудка осложняется поражением брюшины в 60% случаев, ограниченный – в 15%).
Классификация перитонельного канцероматоза
Единая классификация данного заболевания отсутствует, поскольку характеристики первичных опухолей, приводящих к поражению брюшины, весьма разнообразны. Наиболее распространена классификация перитонеального канцероматоза брюшины в зависимости от числа, локализации метастазов, которая предусматривает три степени:
Р1 – локальное поражение брюшины
Р2 – несколько областей канцероматоза, разделенных здоровыми участками брюшины
Р3 – многочисленные очаги поражения
Также используется метод определения индекса канцероматоза брюшины: суммируются баллы измерения максимальных очагов поражения (0-3 балла) в каждой из 13 наиболее вероятных областей поражения брюшины.
Симптомы перитонеального канцероматоза
Перитонеальный канцероматоз брюшины является вторичным поражением, поэтому его клиническая картина во многом определяется проявлениями первичной опухоли. Характерным признаком является обильный выпот в брюшную полость – формирование асцита. Зачастую асцитический синдром, развивающийся вследствие обструкции лимфатического дренажа, является единственным признаком заболевания, и пациенты могут поступать в отделение гастроэнтерологии или терапии для диагностики причин асцита. Состояние больных тяжелое, характерна значительная потеря веса. Неспецифическими признаками являются тошнота, рвота, выраженная слабость, утомляемость. При наличии крупных метастазов возможно их прощупывание через брюшную стенку.
Диагностика перитонеального канцероматоза
Перитонельный канцероматоз имеет неспецифическую клиническую картину, однако консультация гастроэнтеролога или онколога позволяет предположить данное заболевание на основании симптомов и физикальных данных. Лабораторные анализы не выявляют специфических изменений: определяется лейкоцитоз, ускорение СОЭ. Диагностическая программа обязательно должна включать УЗИ органов брюшной полости и малого таза, позволяющее обнаружить распространенное поражение, а также МСКТ брюшной полости с контрастированием. Обязательно проводится цитологическое исследование асцитической жидкости, полученной при лапароцентезе, которое дает возможность впервые установить или подтвердить диагноз, а также определить гистогенез клеток опухоли.
Информативным методом диагностики перитонеального канцероматоза является лапароскопия с осмотром перитонеума, дугласова пространства, диафрагмы, сопровождающаяся биопсией. Высокой специфичностью обладает обратнотранскриптазная полимеразная цепная реакция (ОТ-ПЦР), которая позволяет определить источник диссеминации даже при малом количестве опухолевых клеток.
Сложности диагностики возникают при наличии перитонеального канцероматоза без выявленного первичного очага. Данная форма заболевания, встречающаяся в 3-5 % случаев, проявляется клинически только при уже сформировавшемся поражении брюшины. При этом первичный очаг может иметь настолько малые размеры, что его прижизненное обнаружение невозможно.
В качестве дополнительных методов может использоваться определение онкомаркеров (кислой фосфатазы, раково-эмбрионального антигена, альфа-фетопротеина, бета-субъединицы ХГЧ). Такая диагностика не обладает высокой специфичностью, но применяется для оценки прогноза, раннего выявления диссеминации, рецидивов, а также для контроля эффективности лечения.
Лечение перитонеального канцероматоза
Хирургическое лечение канцероматоза включает удаление первичной опухоли с регионарными метастазами и отсевами по брюшине. Циторедуктивная операция выполняется в объеме перитонэктомии, может сочетаться с удалением матки и придатков, сигмовидной кишки, желчного пузыря. После проведения операции оценивается индекс полноты циторедукции: СС-0: после проведения хирургического лечения очаги поражения визуально не определяются; СС-1: имеются неудаленные очаги диаметром до 2,5 мм; СС-2: очаги диаметром 2,5 мм – 2,5 см; СС-3: очаги поражения более 2,5 см в диаметре. Однако даже при определении индекса СС-0 нельзя полностью исключить возможность диссеминации, поэтому обязательно проводится химиотерапия.
Эффективные подходы к лечению, как правило, подразумевают проведение комбинированной терапии, например, сочетания хирургического вмешательства и системной химиотерапии. Одним из наиболее эффективных методов является локальная химиотерапия. Идея локальной химиотерапии состоит в том, чтобы обеспечить доставку лекарственного препарата непосредственно к опухолевым клеткам, находящимся на внутренней выстилке анатомической полости. Из-за крайне низкой проницаемости этой области для лекарственных препаратов, например, при внутривенном их введении или приеме в виде таблеток, доставка препаратов в виде аэрозоля под давлением углекислого газа даёт накопление препарата в опухоли в значительно больших концентрациях.
Методы лечения перитонеального канцероматоза
Длительное время канцероматоз брюшины и плевры считали терминальной стадией болезни, не подлежащей специальному лечению. Разработка методик непосредственного воздействия на брюшину и плевру позволила улучшить прогноз при этом состоянии. МНИОИ им. П.А. Герцена обладает уникальными возможностями лечения больных с канцероматозом, имея в арсенале весь комплекс новейших методов терапии.
Гипертермическая интраоперационная внутрибрюшная (внутриплевральная) химиотерапия (HITEC).
Это методика, при которой во время операции в брюшную или плевральную полость вводится подогретый до 42,5С, высококонцентрированный раствор химиотерапевтических препаратов, что обеспечивает их воздействие непосредственно на раковые клетки в брюшной (плевральной) полости при минимальном воздействии на другие органы. Сеанс проводится в течение часа, что позволяет разрушить опухолевые клетки, оставшиеся после так называемой циторедуктивной операции.
Внутрибрюшная (внутриплевральная) аэрозольная химиотерапия под давлением (PIРAC)
Это новейший инновационный метод лечения перитонеального канцероматоза, который обеспечивает доставку лекарственного препарата непосредственно к опухолевым клеткам, находящимся на внутренней выстилке анатомической полости. Метод совсем недавно появился в России. Процедуру проводят посредством лапароскопии (торакоскопии). В брюшной или плевральной полости под давлением углекислого газа распыляют аэрозоль химиопрепаратов и оставляют в течение 30 мин. При таком способе введения химиопрепаратов их воздействие на опухоль многократно возрастает при полном отсутствии системной токсичности. Ноу-хау МНИОИ имени П.А. Герцена в этом методе лечения стала разработка собственной специальной форсунки, которая формирует поток мелкодисперсного аэрозоля с размером капель от 1 до 40 мкм. Изделие выполнено из специализированных материалов и не уступает по качеству импортному аналогу, а по ряду технических характеристик его превосходит.
Преимущества лечения перитонеального канцероматоза в МНИОИ имени П.А. Герцена – филиале ФГБУ «НМИЦ радиологии» Минздрава России
Программа лечения перитонеального канцероматоза определяется междисциплинарным консилиумом врачей, в который входят специалисты экспертного класса ФГБУ «НМИЦ радиологии» Минздрава России. Метод применения аэрозольной химиотерапии под давлением (PIPAC) был впервые испытан в Германии, а Московский научно-исследовательский онкологический институт им. П.А. Герцена - филиал «НМИЦ радиологии» Минздрава России еще в 2013 году стал вторым в мире центром, приступившим к изучению и внедрению данной методики. Проведённая за истекшие 6 лет масштабная научно-практическая работа позволила институту занять лидирующие позиции в этой области и первым в мире доказать целесообразность применения аэрозольной химиотерапии в качестве одного из основных методов лечения у пациентов, страдающих перитонеальным канцероматозом.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Напоминаем вам, что самостоятельная интерпретация результатов недопустима, приведенная ниже информация носит исключительно справочный характерПСА общий (простатический специфический антиген общий): показания к назначению, правила подготовки к сдаче анализа, расшифровка результатов и показатели нормы.
Показания к назначению исследования
Простатический специфический антиген (ПСА) секретируется эпителиальными клетками канальцев предстательной железы. В сыворотке крови он содержится в двух формах – свободной (10%) и связанной с различными антипротеазами (90%). Свободная и связанная фракции составляют общий простатический специфический антиген. Известно, что с возрастом концентрация ПСА увеличивается.
У простатического специфического антигена есть несколько физиологических функций: он разжижает семенной сгусток после эякуляции, выделяет особую субстанцию, которая стимулирует сокращение гладкой мускулатуры семенных пузырьков, обладает ингибирующим (замедляющим) действием на рост клеток, проявляя антиканцерогенный и антиангиогенный эффекты.
Увеличение концентрации сывороточного ПСА при раке простаты происходит из-за роста опухолевых клеток, разрушения пораженного органа и попадания антигена в общий кровоток.Сывороточный уровень ПСА может повышаться не только при раке предстательной железы, но и при ее доброкачественной гиперплазии (ДГПЖ), и при хроническом простатите, поэтому простатический специфический антиген - это органоспецифический, но не опухолеспецифический маркёр.
Концентрацию ПСА выше 4 нг/мл обнаруживают примерно у 80-90% больных раком предстательной железы и у 10-20% больных аденомой простаты. Повышение уровня ПСА не всегда говорит о злокачественности процесса - значение имеет скорость нарастания концентрации ПСА (при раке это происходит быстрее).
Факторами риска развития рака предстательной железы считают генетическую предрасположенность, возраст мужчины и особенности питания.
Существует связь между уровнем простатического специфического антигена и степенью злокачественности процесса и метастазированием. Так, при значении ПСА выше 50 нг/мл у большинства пациентов может наблюдаться выход онкологического процесса за капсулу органа и поражение регионарных лимфатических узлов.
Мониторирование концентрации ПСА помогает специалистам обнаружить рецидив (возвращение проявлений заболевания по причине неполного выздоровления) или метастазирование (процесс образования вторичных очагов опухолевого роста (метастазов) в результате распространения клеток из первичного очага в другие ткани и/или органы). Например, после простатэктомии (удаления предстательной железы) ПСА должен определяться в крови не выше уровня остаточной концентрации от 0,05 до 0,1 нг/мл. Концентрация ПСА выше этого уровня может свидетельствовать об остаточной опухолевой ткани или метастазах. При этом рекомендовано определять ПСА через 60-90 дней после удаления простаты в связи с возможными ложноположительными результатами.
Таким образом, показаниями к проведению исследования уровня простатического специфического антигена являются:
- ранняя диагностика рака предстательной железы;
- решение о целесообразности проведения биопсии простаты;
- мониторинг течения заболевания;
- оценка эффективности проводимой терапии рака простаты;
- диагностика метастазирования.
Подготовка к процедуре
Предпочтительно выдержать 4 часа после последнего приема пищи.
Анализ следует проводить до или не ранее чем через 6-7 дней после массажа или пальцевого ректального обследования простаты, трансректального УЗИ, биопсии, лазерной терапии, эргометрии, цистоскопии, колоноскопии, после любых других механических воздействий на простату.
Срок исполнения
До 1 рабочего дня, указанный срок не включает день взятия биоматериала.
Что может повлиять на результат
В случае несоблюдения правил подготовки полученный результат может оказаться некорректным.
Повышенная концентрация ПСА может наблюдаться в течение 10 дней после пальцевого ректального исследования, цистоскопии, колоноскопии, трансуретральной биопсии, простатэктомии или массажа простаты, лазерной терапии, при задержке мочи, эякуляция накануне исследования.
На уровень общего ПСА могут влиять лекарственные препараты - антагонисты андрогенов, аллопуринол, финастерид, циклофосфамид, метотрексат.
ПСА общий (Простатический специфический антиген общий, Prostate-specific antigen total, PSA total)
ПСА общий – белок, специфичный для ткани предстательной железы, используемый в качестве опухолевого маркера. Физиологический экскреторный продукт предстательной железы. Синонимы: Анализ крови на ПСА общий; Простат-специфический антиген общий. Prostate-specific antigen total.
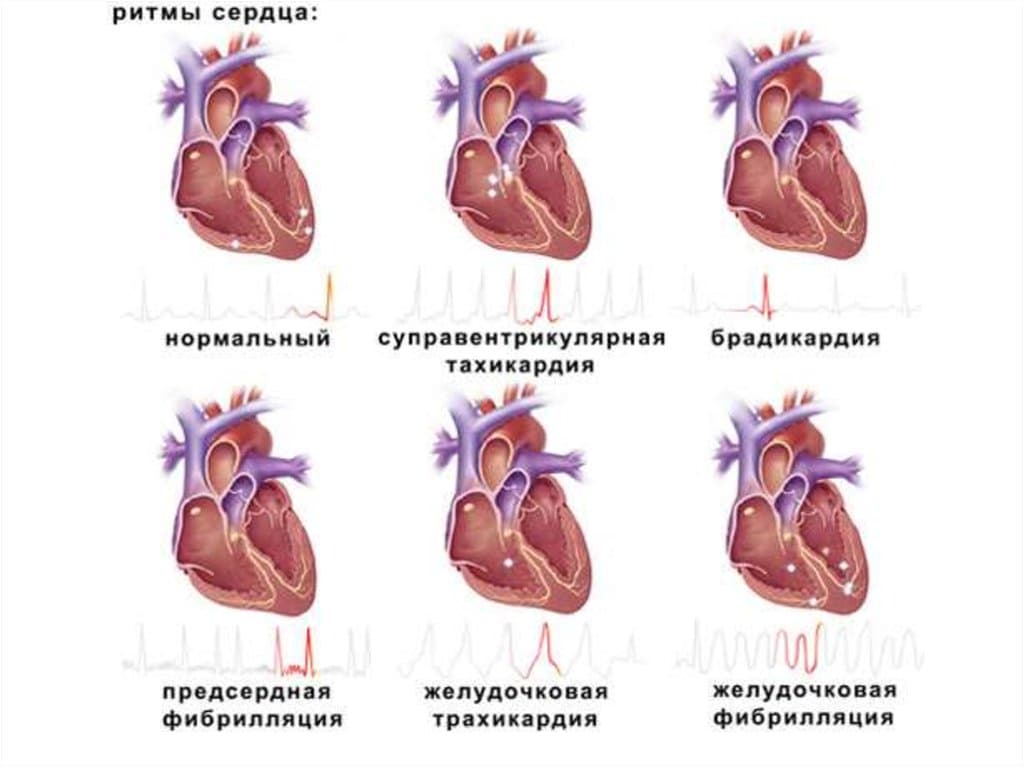
Сокращения сердечной мышцы вызываются электрическими импульсами, которые образуются и проводятся в специализированную и видоизмененную ткань сердца, названную проводящей системой сердца. В здоровом сердце импульсы возбуждения возникают в основном водителе ритма (синусовый узел), проходят через предсердия и достигают узла второго порядка (атриовентрикулярный узел), после чего по системе пучка Гиса и волокнам Пуркинье распространяются на желудочки сердца и вызывают сокращение мышечных клеток сердца. Любое отклонение от вышеописанного порядка необходимо относить к нарушениям ритма сердца (НРС) или аритмиям сердца. .
С учетом частоты сердечных сокращений их можно подразделить на две большие группы:
1. Брадиаритмии:
- СА (синаурикулярные) - блокады,
- СССУ (синдром слабости синусового узла),
- нарушение АВ (атриовентрикулярного) - проведения,
- АВ-блокады,
- АВ-диссоциация,
- синдром Фредерика и др.
2. Тахиаритмии:
- наджелудочковые и желудочковые тахикардии,
- синусовые,
- узловые,
- эктопические предсердные,
- экстрасистолия и др.
Важно отличать нарушения ритма сердца, вызванные органическим (необратимым) поражением миокарда, и функциональные нарушения. Как правило, функциональные нарушения встречаются при здоровом сердце и могут быть вызваны психогенными, рефлекторными и гуморальными расстройствами. Функциональные нарушения ритма сердца встречаются достаточно часто, важно выявить и исключить вызывающие их причины, что позволит избавить человека от аритмии.
Органические нарушения возникают при: коронарной ишемии, гемодинамических пороках сердца и крупных сосудов, сердечной недостаточности, гипертонии. Они могут появляться при токсическом воздействии (медикаментозных препаратов, алкоголя и др.) или инфекционно токсическом (ревматизм, вирусные инфекции, миокардиты различной этиологии и др.), гормональных сдвигах. Аритмии бывают врожденные (синдром WPW, врожденная АВ блокада и др.) и приобретенными, вызванные внешними воздействиями (миокардит,операции и травмы сердца и др.).
Основные симптомы (проявления аритмий)
Брадиаритмии:
- Перебои в работе сердца, неритмичность сердцебиения, редкий пульс (менее 50 ударов в минуту);
- Эпизодически возникающие головокружения, потемнения в глазах;
- Снижения памяти;
- Внезапные приступы потери сознания (обмороки) связанные с редким пульсом (приступы Морганьи-Эдемса-Стокса);
- Повышенная утомляемость, снижение толерантности к физической нагрузке, на фоне редкого пульса;
- Периоды падения артериального давления и его нестабильность, неэффективность медикаментозной терапии в лечение гипертонии;
- Проявление сердечной недостаточности (отеки на ногах, одышка) на фоне брадикардии;
- Боли в сердце.
Тахиаритмии:
- Внезапно возникающий приступ сердцебиения.
- Перебои в работе сердца.
- Пульсация в голове или горле.
- Одышка.
- Боли в сердце на фоне приступа.
- Общая слабость, снижение толерантности к физической нагрузке, повышенная утомляемость на фоне приступа.
- Развитие головокружения или потери сознания на фоне приступа.
- Снижение артериального давления (артериальная гипотензия или не стабильное АД).
Обычно диагностика аритмий осуществляется врачом поликлиники, кардиологом или врачом скорой помощи. Имеет значение сбор анамнеза, физикальное обследование, и различные инструментально-диагностические методы. Наиболее важным является регистрация НРС на ЭКГ (для предъявления аритмологу).
На сегодняшний день в специализированных или многопрофильных клиниках пациентов консультирует врач кардиохирург-аритмолог и определяет необходимость и возможность эндоваскулярного интервенционного (малотравматичного) лечения нарушения ритма сердца. В нашей Клинике есть все необходимые ресурсы для диагностики и лечения аритмий
К методам диагностики нарушения ритма сердца относят:
- ЭКГ (электрокардиограмма) позволяет на момент обращения выявить тахикардию, брадикардию, либо преходящие СА и АВ блокады.
- Электрофизиологическое исследование (ЭФИ) проводящей системы сердца – применяется для подтверждения диагноза в случаях, если при наличии клинических проявлений не удается выявить преходящие нарушения ритма обычными методами (ЭКГ, ХМ) В некоторых случаях этот метод позволяет верифицировать органическую или функциональную причину нарушений сердечного ритма.
- Суточное холтеровское мониторирование (ХМ - непрерывная запись ЭКГ) - наиболее достоверный метод диагностики преходящих нарушений ритма сердца за период наблюдения.
- ЭхоКГ(УЗИ сердца) – выявляет патологию миокарда.
- Рентгенологическое исследование грудной клетки позволяет оценить размеры тени сердца и выявить признаки венозного застоя в легких.
- Велоэргометрия (тредмил-тест) - позволяет выявить ишемическую болезнь сердца и оценить адекватный прирост сокращений сердечного ритма сердца на физическую нагрузку.
Тилт-тест – проба с пассивным ортостазом. Проводится на специальном поворотном столе. Позволят выявить или исключить связь между развитием обморочных состояний и нарушениями сердечного ритма.
В начале лечения аритмий необходимо учитывать и исключать такие состояния как: наличие тиреотоксикоза, злоупотребление алкоголем, курение, нарушение водно-электролитного состояния и др., а также заболевания сердца: сердечную недостаточность, ишемию миокарда, гипертрофию миокарда, воспалительные заболевания миокарда, нарушения вегетативной регуляции сердца и др. заболевания, которые могут вызывать и поддерживать тахикардии.
В нашей Клинике выбор способа лечения нарушения ритма сердца осуществляется специа-листом с учетом клинической картины заболевания, данных инструментально-диагностических исследований и рекомендаций Российского кардиологического обще-ства, Всероссийского научного общества аритмологов.
Самостоятельный прием препаратов, самолечение различными методами является крайне не желательным и не безопасным, если неизвестен и не учитывается характер, механизм и причина аритмии.
Существует несколько способов лечения нарушения ритма сердца:
- 1. Антиаритмическая терапия (при постоянном приеме фарм. препаратов).
- 2. Электрофизиологические методики:
- кардиоверсия/дефибрилляция,
- электрокардиостимуляция,
- катетерная аблация очага аритмии.
- имплантацию кардиостимулятора (искусственного водителя ритма),
- кардиовертера-дефибриллятора
- устройства для ресинхронизирующей терапии.
Операция выполняется под местной анестезией в условиях рентгеноперационной длительностью до 40-55 минут.
Эффективным и радикальным методом лечения тахиаритмий является катетерная аблация (деструкция) очага аритмии. Операция, в среднем, длится не более 1 часа, и через сутки пациент может быть выписан из стационара.
Читайте также:


