Как сделать фосфорную кислоту
Фо́сфорные кисло́ты — соединения фосфора в степени окисления +5 общей формулы P2O5·nH2O:
Из ортофосфорной кислоты легко испаряется вода и она становится концентрированной. При нагревании до 300°C ортофосфорная кислота отдает воду, разлагаясь сначала на пирофосфорную кислоту, затем различные полифосфорные кислоты. При этом образуется гигроскопичная стекловидная масса. Если затем эту массу разбавить водой, то она превратится обратно в ортофосфорную кислоту. Полифосфорные кислоты можно получить также растворением при повышенной температуре оксида фосфора(V) в ортофосфорной кислоте.
Наибольшее значение имеет ортофосфорная кислота (или просто фосфорная), которую для технических целей получают по реакции
Применение
Применяют ортофосфорную кислоту в настоящее время довольно широко.
- Основным ее потребителем служит производство фосфорных и комбинированных удобрений. Для этих целей ежегодно добывается во всем мире фосфоросодержащей руды около 100 млн. т. Фосфорные удобрения не столько способствуют повышению урожайности различных сельскохозяйственных культур, сколько придают растениям зимостойкость и устойчивость к другим неблагоприятным климатическим условиям, создают условия для более быстрого созревания урожая в районах с коротким вегетативным периодом. Они также благоприятно действуют на почву, способствуя ее структуированию, развитию почвенных бактерий, изменению растворимости других содержащихся в почве веществ и подавлению некоторых образующихся вредных органических веществ.
- Немало ортофосфорной кислоты потребляет пищевая промышленность. Дело в том, что на вкус разбавленная ортофосфорная кислота очень приятна и небольшие ее добавки в мармелады, лимонады и сиропы заметно улучшают их вкусовые качества. Этим же свойством обладают и некоторые соли фосфорной кислоты. Гидрофосфаты кальция, например, с давних пор входят в хлебопекарные порошки, улучшая вкус булочек и хлеба.
Интересны и другие применения ортофосфорной кислоты в промышленности:
- Например, было замечено, что пропитка древесины самой кислотой и ее солями делают дерево негорючим. На этой основе сейчас производят огнезащитные краски, негорючие фосфодревесные плиты, негорючий фосфатный пенопласт и другие строительные материалы.
- Различные соли фосфорной кислоты широко применяют во многих отраслях промышленности, в строительстве, разных областях техники, в коммунальном хозяйстве и быту, для защиты от радиации, для умягчения воды, борьбы с котельной накипью и изготовления различных моющих средств.
- Фосфорная кислота, конденсированные кислоты и дегидротированные фосфаты служат катализаторами в процессах дегидратирования, алкилирования и полимеризации углеводородов.
- Особое место занимают фосфорорганические соединения как экстрагенты, пластификаторы, смазочные вещества, присадки к пороху и абсорбенты в холодильных установках. Соли кислых алкилфосфатов используют как поверхностно-активные вещества, антифризы, специальные удобрения, антикоагулянты латекса и др. Кислые алкилфосфаты применяют для экстракционной переработки урановорудных щелоков.
Н3РО4 применяют для производства удобрений, в пищевой, текстильной промышленности, в медицине, как флюс при пайке. Фосфаты применяют как фосфорные удобрения, в производстве эмалей, стёкол.
См. также
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Фосфорная кислота" в других словарях:
Фосфорная кислота — (ортофосфорная кислота или обыкновенная фосфорная кислота) (H3PO4) получается при действии серной кислоты на природный фосфат трикальция. Полученная таким образом техническая кислота содержит в качестве примесей пентаоксид дифосфора,… … Официальная терминология
ФОСФОРНАЯ КИСЛОТА — Соединение фосфора с кислородом. Объяснение 25000 иностранных слов, вошедших в употребление в русский язык, с означением их корней. Михельсон А.Д., 1865. ФОСФОРНАЯ КИСЛОТА соединение фосфора к кислородом, кристаллы её бесцветны, призматичны,… … Словарь иностранных слов русского языка
ФОСФОРНАЯ КИСЛОТА — (ортофосфорная кислота), H3PO4, твердое вещество, tпл 42,35шC. Применяют фосфорную кислоту в производстве удобрений, различных фосфатов, для обработки кормов для скота, нанесения антикоррозионных покрытий на металлы, осветления сахара, как… … Современная энциклопедия
ФОСФОРНАЯ КИСЛОТА — (Acidum phosphori cum), этим наименованием охватывают к ты 5 валентного фосфора. Для удобства классификации их можно рассматривать как продукты взаимодействия фосфорного ангидрида (Р206) и воды; известны одноосновная метафосфор ная к та, НР03( =… … Большая медицинская энциклопедия
фосфорная кислота — (ортофосфорная кислота), Н3РО4, tпл 42,5°C, кислота средней силы. Соли и эфиры называются фосфатами. Фосфорная кислота полупродукт в производстве удобрений, фармацевтических препаратов, кормовых концентратов, катализатор в органическом синтезе,… … Энциклопедический словарь
фосфорная кислота — ortofosfato rūgštis statusas T sritis chemija formulė H₃PO₄ atitikmenys: angl. orthophosphoric acid; phosphoric acid rus. ортофосфорная кислота; фосфорная кислота ryšiai: sinonimas – vandenilio tetraoksofosfatas (3–) sinonimas – fosforo rūgštis … Chemijos terminų aiškinamasis žodynas
ФОСФОРНАЯ КИСЛОТА — (ортофосфорная кислота), Н3РО,), tnn 42,5 °С, кислота средней силы. Соли и эфиры наз. фосфатами. Ф. к. полупродукт в произ ве удобрений, фарм. препаратов, кормовых концентратов, катализатор в органич. синтезе, антипирен, компонент… … Естествознание. Энциклопедический словарь
Фосфорная кислота — Жарг. шк. Пренебр. То же, что серная кислота 2. (Запись 2004 г.) … Большой словарь русских поговорок
фосфорная кислота — ортофосфорная кислота … Cловарь химических синонимов I
Фосфорная кислота — см. Фосфор … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Производство ортофосфорной (фосфорной) кислоты

Ортофосфорная (фосфорная) кислота: определение и формула
Знакомство с химическим продуктом логично начинать с его формулы. Она выглядит так:
H3PO4 (P2O5·3H2O)
Физически ортофосфорная кислота — это гигроскопичные бесцветные кристаллы с температурой плавления 42,4ºС. При нагревании подвергается дегидратации (выпаривание воды) с повышением содержания P2O5 от 73% до 85%.
Применение ортофосфорной (фосфорной) кислоты
Фосфорную кислоту с содержанием P2O5 73%-85% называют полифосфатной (суперфосфатной) кислотой: вещество, ценное для производства высококонцентрированных жидких и твердых фосфатных удобрений. На эти цели расходуется около 90% добываемой продукции. К примеру, это могут быть: фосфаты кальция, калия, аммония, смешанные удобрения в различном виде и кормовые фосфаты.
Помимо этого, ортофосфорная кислота находит применение в процессе производства огнезащитных материалов. В качестве катализатора она применяется при производстве различных химических соединений. Слабый раствор фосфорной кислоты (пищевая ОФК) применяют в пищевой промышленности для улучшения вкуса (добавка Е338). Применяют её и для фосфатирования поверхности металлоизделий, при покраске текстильных волокон, в производстве стекла, медикаментов.
Сфера применения фосфорной кислоты велика и многогранна!
Универсальный солдат фосфат!
- Производство фосфатных и сложных удобрений;
- Пищевая промышленность, как добавка Е 338
- Деревообрабатывающая промышленность;
- Производство строительных материалов:
- Фармацевтическая промышленность;
- Авиационная отрасль и бытовая химия;
- Металлопрокатная промышленность;
- Медицина – стоматологическое дело;
- Нефтяная промышленность;
- Производство противопожарных изделий.
Производство ортофосфорной (фосфорной) кислоты
Принципиально существуют два способа промышленного получения ОФК.

Эта технология содержит 4 этапа при получения ортофосфорной (фосфорной) кислоты:
1. Высокотемпературное восстановление (отделение) фосфора в электрических печах в присутствии углерода и кремнезема:Са3(РО4)2 + 5С + 2SiO2 = P2 + 5CO + Ca3Si2O7, где Р2 — выделенный фосфор.
2. Окисление фосфора в печи (сжигание с подачей сжатого воздуха) до фосфорного ангидрида:
2Р2 + 5О2 = 2Р2О5.
3. Гидратация ангидрида водой (в башне гидратации) с получением ОФК в виде газовой фазы (туман):
Р2О5 + 3Н2О = 2Н3РО4.
4. Конденсация охлаждением (в теплообменнике) Н3РО4 в жидкую фазу ОФК. В качестве хладагента применяют воду или оборотную (возвратную, не расходуемую) фосфорную кислоту. Практикуют комбинированные системы конденсации: теплообменные, циркуляционные и испарительные.
Полученную ортофосфорную кислоту перекачивают погружными насосами.
Термический способ позволяет перерабатывать даже бедное сырьё с низким содержанием фосфатов и получить на выходе ОФК высокой чистоты. Но способ энергозатратный, поэтому сейчас применяется редко.

Этот способ основан на вытеснении ортофосфорной кислоты из фосфатов сильными кислотами и не требует предварительного выделения фосфора из сырья. В качестве сильной кислоты чаще всего применяется серная кислота H2SO4. Процесс производства экстракционной ортофосфорной кислоты (ЭОФК) происходит в баковом экстракторе по следующей упрощенной формуле:Ca5F(PO4)3 + 5H2SO4 = 5CaSO4 + 3Н3РО4 + HF, где:
Ca5F(PO4) — загружаемое подготовленное сырье.
Н3РО4 — ЭОФК (основной продукт).
CaSO4 — сульфат кальция, фосфогипс (сопутствующий продукт).
HF — фтористый водород.Фтористый водород взаимодействует с H2SiO3 (присутствует в растворе как примесь сырья):4HF + H2SiO3 = SiF4 + 3H2OЧасть SiF4 улетучивается в газовую среду, а часть остается в растворе ЭОФК в более сложном виде H2SiF6.Основной процесс происходит в баках экстракции, куда подаются дозированные сырье, серная кислота и оборотная часть ЭОФК для разбавления концентрата-пульпы (в смешанном растворе серной и фосфорной кислот процесс идет активнее, повышается % выхода ЭОФК). Дозирование имеет важное значение для активности химических процессов, повышения выхода ЭОФК. Для измельченного сырья применяют весовые дозаторы, для серной кислоты — щелевые.В первом баке достигается однородность пульпы и изотермичность процесса, а во втором — дозревание пульпы до свойств, перспективных для последующей фильтрации ЭОФК и отделения примесей на лотках карусельной фильтрации.Для оводнения сульфата кальция, поддержания необходимой текучести пульпы и вывода остаточного ЭОФК из нерастворимого осадка в систему подается вода.
Полученная ЭОФК имеет низкую концентрацию и небольшое количество примесей сырья, её необходимо упаривать. Из-за более низкой себестоимости экстракционный способ рентабельнее термического. Недостаток способа — наличие небольшого количества примесей гипса, соединений фтора, окислов железа и алюминия.
Минеральных ресурсов меньше — новых технологий больше!
В связи с уменьшением ресурсов качественных фосфатных залежей разрабатываются новые технологии производства ОФК, направленные на увеличение выхода полезного продукта. Представляем одну из них:

Суть её в работе двух разделительных реакторов, соединенных последовательно. Основная часть примесей отделяется в первом реакторе, и полученная ЭОФК концентрацией 21% P2O5 поступает во второй реактор, обогащая находящийся там раствор. На выходе — ЭОФК с содержанием P2O5 30%. Т.е. эта технология позволяет повысить выход полезного продукта на 9%.
Где купить ортофосфорную (фосфорной) кислоту
Конечно же у нас, в БСК-СОЛЬ!
Мы производим и реализуем ортофосфорную кислоту высочайшего качества. Продукция изготавливается на новейшем, современном оборудовании. Точные сроки производства и высокое качество продукции – главное преимущество нашей компании. В штате предприятия задействованы профессиональные и квалифицированные специалисты с многолетним стажем. Компания уделяет пристальное внимание контролю качества продукции по системе ISO, TP,TC.
Мы лидируем в своем секторе и имеем большой потенциал и опыт работы как на местном, так и на зарубежном рынках, с малыми и крупными компаниями.
Для достижения качественного результата и высокой скорости работ, предприятие задействует сеть долгосрочных партнеров, качество работы которых проверено годами. Вся продукция, произведенная в компании, соответствует требованиям мировых стандартов качества.
Получить индивидуальное предложение на поставку ортофосфорной (фосфорной) кислоты от производителя с максимальной скидкой и быстрой доставкой

В этом крутом опыте будет много дыма, таинственное исчезновение и изменение цвета раствора!
Реагенты и оборудование:
- красный фосфор;
- колба (2 л);
- спиртовка;
- раствор лакмуса;
- дистиллированная вода;
- ложка для сжигания;
- пробка.
Пошаговая инструкция
В двухлитровую колбу наливаем дистиллированную воду и добавляем раствор лакмуса. Затем в ложку для сжигания набираем немного красного фосфора и поджигаем его в пламени спиртовки. Опускаем горящий фосфор в колбу и закрываем ее пробкой. Образуется облако из оксида фосфора(V). Цвет лакмуса меняется на красный, а белый дым постепенно исчезает.
Пояснение процессов
При горении фосфор окисляется до оксида (V):
Поскольку Р₂О₅ является кислотным оксидом, он взаимодействует с водой, образуя фосфорную кислоту:
Лакмус является кислотно-основным индикатором, его цвет зависит от рН среды:
- красный (кислая среда);
- фиолетовый (нейтральная);
- синий (щелочная).
Под действием фосфорной кислоты окраска лакмусового индикатора меняется с фиолетовой на красную.
Меры предосторожности
Работайте в защитных перчатках и очках. Проводите эксперимент в хорошо проветриваемом помещении. Соблюдайте технику безопасности при работе с горючими веществами.
Внимание! В эксперименте использованы токсичные и опасные для здоровья вещества. Не пытайтесь повторить этот опыт самостоятельно.

Фосфорная кислота - это коррозионно-активная неорганическая кислота с химической формулой H3PO4. Это слабая кислота, доступная в различных количествах, чистоте и различных классах реагентов.
В чистом виде фосфорная кислота представляет собой бесцветное твердое вещество. В менее концентрированном виде это вязкая жидкость без запаха с плотностью 1,885 г/мл. Обычно она нелетучая и нетоксична, но 85-процентный раствор по-прежнему может повредить глаза и вызвать сильное раздражение кожи.
Давайте копнем глубже и выясним, как образуется фосфорная кислота, как она выглядит на молекулярном уровне, каковы ее физические и химические свойства и где она используется.
Профиль фосфорной кислоты
Молярная масса: 97,994 г/моль
Внешний вид: густая бесцветная жидкость.
Точка кипения: 212 °C
Точка плавления: 42,35 °C (кристаллического твердого вещества)
Динамическая вязкость: от 2,4 до 9,4 сантипуаз (85% водный раствор).
Плотность: 1,83 г / см 3 (твердое вещество); 1,68 г / см 3 (85% водный раствор при 25 °C)
Структура
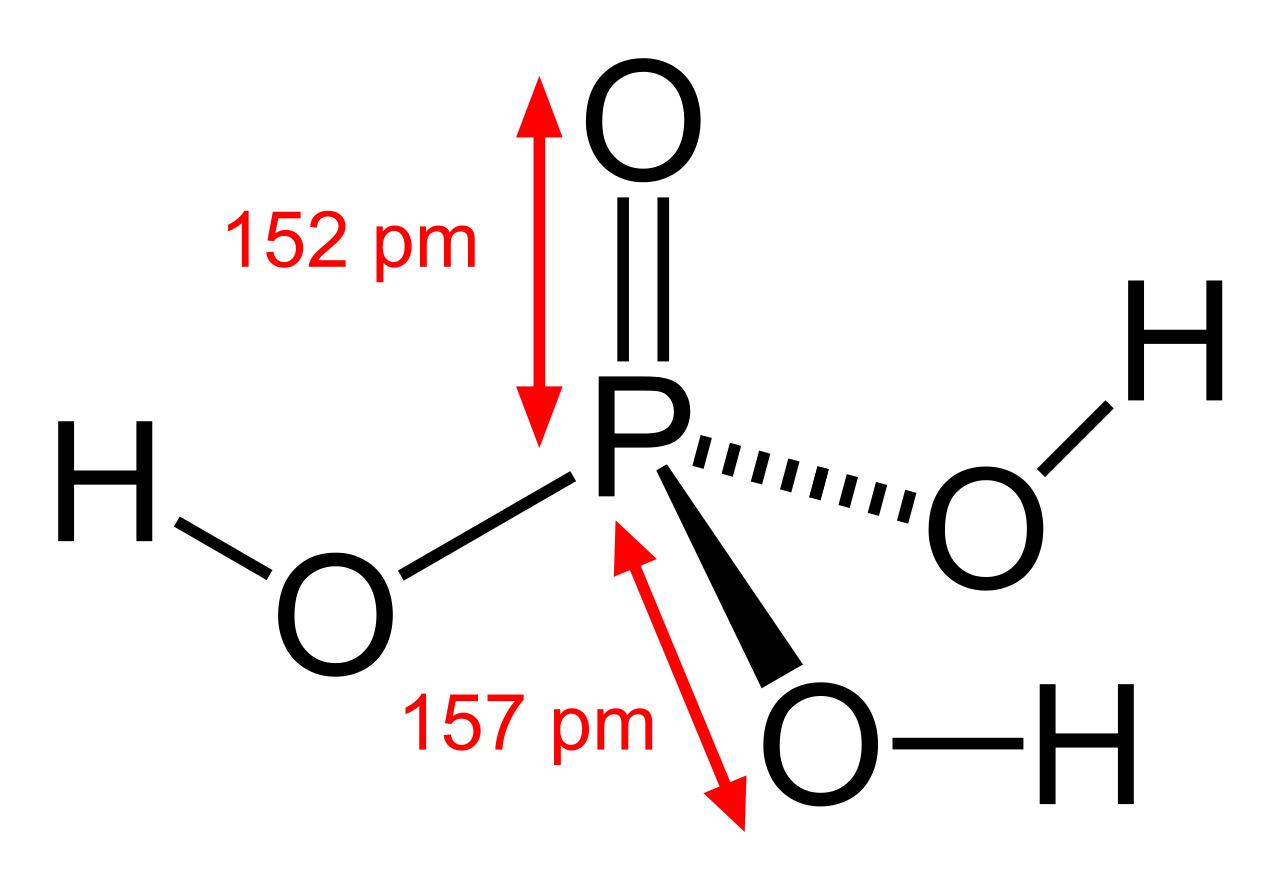
Соединение H3PO4 имеет в общей сложности 32 валентных электрона. Поскольку фосфор является наименее электроотрицательным, он помещается в центре. Атомы водорода присоединяются к внешней стороне атомов кислорода, образуя он-Группы.
В этой структуре каждый атом имеет полную внешнюю оболочку: атомы фосфора и кислорода имеют восемь валентных электронов, а атомы водорода имеют вокруг себя два валентных электрона.
Фосфор может иметь расширенный октет (более восьми валентных электронов), поэтому он получает формальный заряд +1, в то время как кислород (тот, который не присоединен к атому водорода) получает формальный заряд -1. Образуя двойную связь, фосфор и кислород теряют свои заряды.
В структуре все еще есть 32 валентных электрона, и каждый атом имеет формальный заряд, равный нулю. Таким образом, это наиболее вероятная или вероятная структура Льюиса для H3PO4.
Соединение содержит 3 одинарные связи ОН, 3 одинарные связи PO и 1 двойную связь P = O. Каждая одинарная связь является сигма-связью, а двойная связь состоит из сигма-связи и пи-связи.
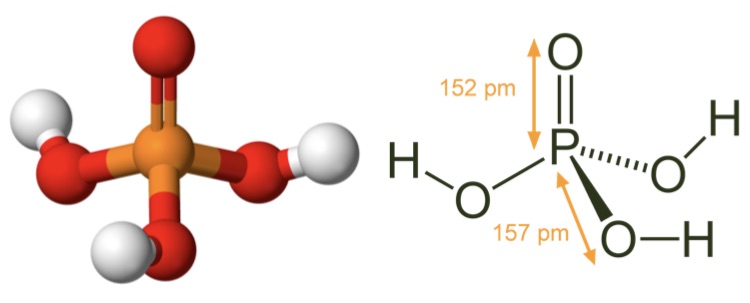
Фосфорная кислота: шарообразная модель и размеры структурной формулы
Молекулярная геометрия PO (OH)3 является тетраэдрической, а кристаллическая структура-моноклинной. А поскольку распределение зарядов на центральных атомах асимметрично, то молекула считается полярной.
Последние достижения в области нанотехнологий, включая методы поглощения рентгеновских лучей вблизи краев и методы рассеяния рентгеновских лучей под большим углом, позволили ученым точно определить структуру фосфорной кислоты. Расстояние связи P=O в структуре близко к 152 пикометрам, и расстояния P=O-O были уточнены до 309 пикометров, с углом связи близким к тетраэдрическому.
Как она производится?
Фосфорная кислота может быть синтезирована либо мокрым способом, либо термическим способом.
В последнем в качестве сырья используются воздух, вода и элементарный фосфор. Он включает в себя три важных этапа: сгорание, увлажнение и запотевание. Вот как это происходит:
Во-первых, жидкий элементарный фосфор сжигается в камере сгорания при высоких температурах в диапазоне от 1650 до 2760 °C. Эта реакция окисления происходит в окружающем воздухе и производит пятиокись фосфора.
Затем продукт гидратируют водой с образованием сильной фосфорной кислоты (в жидком состоянии).
На последнем этапе для удаления фосфорно-кислотного тумана из потока дымовых газов используются высоконапорные каплеуловители.
Концентрация фосфорной кислоты, синтезированной в этом процессе, обычно составляет от 75 до 85 процентов. Такие уровни концентрации необходимы для производства высококачественной химической продукции. Несколько эффективных установок извлекают чрезвычайно концентрированную фосфорную кислоту (до 99,9%), используя тот же тепловой процесс.
Однако почти 80% фосфорной кислоты производится мокрым способом. В этом методе серная кислота обрабатывается природным фосфатсодержащим минералом, таким как гидроксиапатит.
Минерал высушивают, крошат, а затем подают в реактор вместе с серной кислотой. В результате реакции сульфат сливается с кальцием (из минерала), образуя сульфат кальция (гипс).
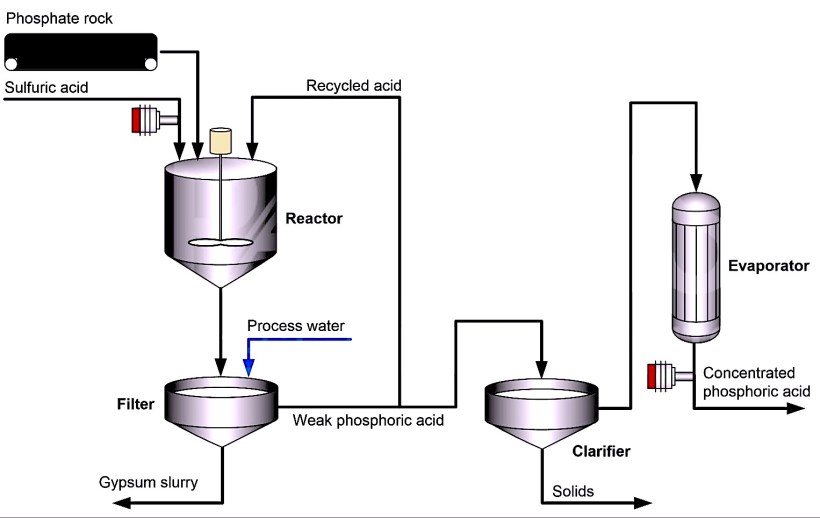
Затем добавляется обработанная вода, и гипс вместе с другими нерастворимыми примесями удаляется через фильтр. Фосфорная кислота, полученная этим мокрым способом, содержит 25-30% пятиокиси фосфора.
Обычно эта кислота дополнительно концентрируется, чтобы соответствовать требованиям, предъявляемым к производству удобрений. В большинстве случаев фосфорная кислота концентрируется до 40-55% пятиокиси фосфора с помощью двух / трех вакуумных испарителей.
Свойства
Чистая фосфорная кислота в лаборатории выглядит как плотное, бесцветное, бесформенное кристаллическое твердое вещество, которое плавится при температуре 42,35 °C. Ее физические свойства зависят от чистоты, концентрации кислоты, а также от температуры, при которой вы ее видите.
Фосфорная кислота менее агрессивна и менее опасна по сравнению с азотной и серной кислотами. Это негорючее вещество как в жидкой, так и в твердой форме.
Когда кислота подвергается воздействию тепла, а затем охлаждается до комнатной температуры, она образует прозрачное, хрупкое стекло. После такого воздействия тепла состав кислоты остается прежним.
Обычно фосфорная кислота выпускается в виде бесцветного сиропа с концентрацией в воде 85 процентов и плотностью 1,885 граммов на миллилитр.

В водном растворе фосфорная кислота действует как трипротовая кислота, имеющая три ионизируемых атома водорода. Соединение может потерять эти атомы в виде протонов (ионов H + ).
- Когда один протон удаляется, в результате образуется дигидрофосфат-Ион H 2 PO 4 −
- Когда два протона удаляются, в результате образуется Ион фосфата водорода HPO 4 2−
- Удаление всех трех протонов дает ортофосфат-Ион PO 4 3− .
Кислота растворима как в воде, так и в этаноле. Однако большинство ее солей не растворимы в воде, если нет сильной минеральной кислоты.
Области применения
Фосфорная кислота имеет несколько важных применений. Ее соли, такие как фосфаты аммония и кальция, широко используются в качестве удобрений. Кислота используется для производства электролитов, средств для удаления ржавчины, модификаторов рН, травителей, бытовых чистящих средств и дезинфицирующих средств.
Поскольку это вещество нетоксично и имеет умеренно кислую природу, оно также используется в напитках, пищевых ароматизаторах, косметике, средствах для ухода за зубами и кожей. Давайте подробнее рассмотрим, чем полезна фосфорная кислота.
В менее концентрированной форме она используется для производства различных видов безопасных фосфорных удобрений, которые помогают растениям расти. Фактически, почти 90% синтезированной фосфорной кислоты используется в качестве удобрений.
Многие безалкогольные напитки, в том числе Coca-Cola, содержат фосфорную кислоту. Это придает напитку слегка кисловатый вкус. Несмотря на то, что его концентрация достаточно низкая, экстремальный прием таких напитков может вызвать эрозию зубов и даже привести к образованию почечных камней.
Фосфорная кислота в качестве электролита имеет полезные характеристики, такие как хорошая ионная проводимость, низкая летучесть, стабильность при относительно высоких температурах и устойчивость к диоксиду углерода и монооксиду углерода.
Поскольку чистая фосфорная кислота обладает высокой протонной проводимостью и превосходной термостабильностью, полибензимидазол (PBI), допированный фосфорной кислотой, является наиболее многообещающим среди мембран на основе PBI, которые могут обеспечить хорошую производительность топливных элементов даже при низком уровне увлажнения и температуре 200 °С.
Специфическое применение фосфорной кислоты:
- Трифосфат натрия используется в мыле и моющих средствах.
- Дикальцийфосфат используется в зубной пасте как полирующее средство.
- Фосфатное покрытие наносится на стальные детали для защиты от коррозии и смазки.
- Он используется для контроля pH косметических средств и средств личной гигиены.
- В строительной отрасли он используется для удаления минеральных отложений и чистых пятен от жесткой воды,
Глобальный рынок
Многие развивающиеся страны начали сосредотачиваться на увеличении добычи фосфатов и производства фосфатов. Правительства некоторых стран уже сотрудничали с различными поставщиками по всему миру для создания заводов по добыче минералов для производства фосфорной кислоты.
В 2019 году объем мирового рынка фосфорной кислоты оценивался в 45,85 миллиарда долларов. Ожидается, что к 2027 году он достигнет более 61 миллиарда долларов, а совокупный годовой темп роста составит 3,7%.
Рынок подразделяется на Азиатско-Тихоокеанский регион, Европу, Северную Америку, Латинскую Америку, Ближний Восток и Африку. Ожидается, что в ближайшем будущем Азиатско-Тихоокеанский регион будет доминировать на мировом рынке. Рост рынка фосфорной кислоты в этих регионах будет дополнительно подпитываться развитым сельскохозяйственным сектором Индии и Китая.
Читайте также:


