Для определения количества живых бактерий в нитрагине делают глубинный посев
Посев на микрофлору отделяемого тракта женщины с определением чувствительности к антибиотикам — это бактериологическое исследование, с помощью которого определяется количественный и качественный состав микрофлоры и её чувствительность расширенному спектру антибиотиков, антимикотиков и бактериофагов.
Суть метода заключается в посеве исследуемого материала на питательные среды с целью выявления и идентификации чистой культуры возбудителя.
Микрофлора — совокупность микроорганизмов, обитающих на определённых участках среды. В организме человека существует постоянная и транзиторная микрофлора. Транзиторная микрофлора не может существовать в организме длительно. Постоянная микрофлора состоит из микроорганизмов, которые постоянно находятся в нем и она подразделяется на облигатную и факультативную микрофлору. Облигатная флора представлена лактобактериями, бифидобактериями, пептострептококками и кишечными бактериями, ее количественный состав преобладает над факультативной. Факультативная флора это стафилококки, стрептококки, клебсиеллы, клостридии, некоторые грибы. В организме человека микроорганизмы нормальной микрофлоры заключены в полисахаридную биологическую пленку, устойчивую к различным воздействиям.
- фактор неспецифической резистентности;
- защитная функция по отношению к патогенной и гнилостной микрофлоре;
- участие в водно-солевом обмене;
- участие в рециркуляции стероидных гормонов, желчных солей;
- участие в формировании и поддержании иммунитета;
- хранилище и источник хромосомных и плазмидных генов, в частности генов лекарственной устойчивости к антибиотикам.
Микрофлора урогенитального тракта
Слизистая оболочка передней уретры в норме может содержать стафилококки, непатогенные нейсерии, коринеморфные бактерии и др.
Нормальная микрофлора влагалища включает: лактобактерии, бифидобактерии, бактероиды, пропионибактерии, порфиромонады, превотеллы, пептострептококки, коринеформные бактерии др., в ней преобладают анаэробы. В норме соотношение анаэробы/аэробы равно 10:1. В репродуктивный период жизни преобладают грамположительные бактерии, в период менопаузы — грамотрицательные. Примерно у 5–60% здоровых женщин выявляются Gardenerella vaginalis, у 15–30% — Mycoplasma hominis, у 5% — бактерии рода Mobilunculus.
Качественный и количественный состав микрофлоры зависит от фазы менструального цикла, беременности и др. Эстрогены способствуют накоплению гликогена, который расщепляется лактобактериями с образованием молочной кислоты. В результате pH составляет 4–4,6. Подкисленный вагинальный секрет, наличие перекиси водорода и наличие бактерицидов подавляют рост посторонней микрофлоры.
Цервикальный канал и полость матки в норме стерильны.
Инфекционные заболевания
Инфекционные заболевания вызывают патогенные и условно-патогенные микроорганизмы. К условно-патогенным относят представителей нормальной микрофлоры человека, так как эволюционно они сохранили способность к паразитическому образу жизни. В отличие от патогенных микроорганизмов, они проявляют свои свойства при условии снижения сопротивляемости организма.
Бактериологический посев позволяет выделить: энтеробактерии (включая сальмонеллы), стрептококки, энтерококки, стафилококки, неферментирующие грамотрицательные микроорганизмы и дрожжеподобные грибы.
Определение чувствительности к антибиотикам проводится при выявлении роста 10 2 и более КОЕ/мл.
Определение дрожжеподобных грибов рода Candida и постановка чувствительности к антимикотическим средствам входит в данный анализ.
- инфекции мочевыводящих путей;
- контроль после лечения.
Сдача мазка не допускается в дни менструации. За трое суток до взятия необходимо отказаться от применения вагинальных свечей, тампонов, спермицидов, за сутки исключить половые контакты. Нельзя спринцеваться накануне проведения обследования. После УЗИ-исследования с применением вагинального датчика, кольпоскопии, биопсии должно пройти не менее 48 часов.
Интерпретация результатов
Интерпретация результатов исследования содержит информацию для лечащего врача и не является диагнозом. Информацию из этого раздела нельзя использовать для самодиагностики и самолечения. Точный диагноз ставит врач, учитывая результаты данного обследования и данные анамнеза, результатов других обследований и т.д.
На бланке результата указывается наличие или отсутствие роста; степень бактериурии, выраженная в КОЕ/мл, наименование возбудителя; степень бактериурии, выраженная в КОЕ/мл; чувствительность к антимикробным препаратам (определяется при бактериурии в титре более 10 4 КОЕ/мл).
В норме — рост микробной флоры отсутствует. При выделении ассоциации бактерий 10 5 КОЕ/мл и более является критическим. Повышение уровня говорит с большей вероятностью о развитии гнойной инфекции или генерализации процесса. При обсеменённости менее 10 5 КОЕ/мл, раны заживают без явлений нагноения.
Внимание!
При обнаружении роста нормальной, сопутствующей и условно-патогенной флоры в низком титре, и не имеющей диагностического значения, определение чувствительности к антимикробным препаратам не проводится.

Коллеги, добрый, почти день! Сегодня у второй подгруппы пара, как Вы помните, в 14.00. Занятие уже в Мудле. Заходим туда. Смотрим видео. Читаем презентации. Отвечаем рефлексию по тестам. Сюда делаем дубль ответа по тестам.
Тест:
1) Для определения количества живых бактерий в нитрагине делают глубинный посев:
1. на маннитный агар-агар
2. на бобовый агаг-агар
3. на дрожжевой агар-агар
4. на мясопептонный агар-агар
2) Для борьбы с плесенью используют:
1. ксилонафт-5
2. формалин
3. тиозон
4. оксидифенолят натрия
3) Перитрихи-это бактерии:
1. с полярно расположенными пучками жгутиков
2. со жгутиками по всей поверхности клетки
3. не имеющие жгутиков
4. с двумя полярными жгутиками
4) К осветительной системе биологического микроскопа не относится:
1. конденсор
2. диафрагма
3. окуляр
4. зеркало
5) К прямым санитарно-биологическим показателям эпидемической опасности почвы относятся:
1. обнаружение яиц гельминтов и их личинок
2. обнаружение сальмонелл и бактерий паратифа А и В
3. обнаружение стафилококков и стрептококков
4. обнаружение патогенных энтеробактерий и энтеровирусов
Глубинный метод посева в плотные среды. Жидкий продукт или разведение навески вносят параллельно в две чашки Петри и заливают не позднее чем через 15 мин расплавленной и охлажденной до температуры 45±0,5 °С питательной средой. Высота слоя питательной среды должна быть 4–5 мм.
Среду немедленно равномерно перемешивают с посевным материалом круговыми движениями чашки так, чтобы среда не вытекла из чашки и не загрязнила крышку. После застывания среды чашки с посевами вверх дном помещают в термостат.
На подсушенную среду наносят жидкий продукт или разведение навески и равномерно растирают по поверхности шпателем – изогнутой стеклянной палочкой.
Засеянную поверхность подсушивают, выдерживая чашки в горизонтальном положении в течение 15 мин.
Метод посева в жидкие среды. В колбу или пробирки с питательной средой вносят навеску продукта или разведения навески. При определении количества микроорганизмов питательные среды засевают продуктом и(или) разведениями навесок так, чтобы последовательно выдерживалась заданная кратность количества посевного материала.
Метод мембранных фильтров. Мембранные фильтры применяют для анализа легко фильтруемых жидких продуктов или продуктов, дающих растворы с высоким осмотическим давлением. При фильтрации раствора с высоким осмотическим давлением раствор предварительно разводят дистиллированной или пептонной водой в соотношении, позволяющем легко профильтровать разведенные растворы.
Жидкий продукт, содержащий небольшое число взвешенных частиц, фильтруют в два этапа. Для освобождения от частиц его фильтруют через фильтр со средним диаметром пор 4 мкм, а затем – через фильтр, диаметр и размеры пор которого выбраны в соответствии с группой или видом выявляемых микроорганизмов. Оба фильтра культивируют в аналогичных условиях.
После осаждения микроорганизмов на фильтре из растворов с высоким осмотическим давлением или из растворов, содержащих антимикробные вещества, его промывают дистиллированной водой или пептонно-солевым раствором.
Фильтрацию заканчивают в момент исчезновения влаги на поверхности фильтра. Немедленно после окончания фильтрации фильтр переносят на плотные или в жидкие питательные среды. На плотную среду фильтр накладывают нижней стороной так, чтобы она полностью соприкасалась с поверхностью среды. Посевы термостатируют в условиях, благоприятных для роста определяемых микроорганизмов.
Обработка результатов. После термостатирования, установленного соответствующим стандартом на конкретный метод испытания, подсчитывают количество колоний на каждой чашке, содержащей менее 300 колоний (или менее другого количества, установленного соответствующим стандартом на конкретный метод испытания).
В некоторых случаях подсчет колоний может быть затруднен (например, в присутствии инвазивных микроорганизмов). Эти случаи рассматриваются в соответствующих стандартах на конкретные методы испытаний.
Пример метода расчета (общий случай). Для получения достоверных результатов при подсчете количества колоний необходимо, чтобы хотя бы в одной чашке содержалось не менее 15 колоний. Количество микроорганизмов N в 1 г (см 3 ) пробы вычисляют как средневзвешенное значение из подсчетов на двух последовательных разведениях по формуле
где ΣС – сумма колоний, подсчитанных на всех чашках в двух последовательных разведениях, из которых хотя бы одна чашка содержит не менее 15 колоний; V– объем посевного материала, внесенного в каждую чашку, см 3 ; n1 – количество отобранных для подсчета чашек в первом разведении; n2 – количество отобранных для подсчета чашек во втором разведении; d – коэффициент разбавления, соответствующий первому разведению.
Результат вычисления округляют до двух значащих цифр. Для этого, если последняя цифра меньше 5, предшествующую цифру не изменяют; если последняя цифра равна или более 5, предшествующую увеличивают на единицу. Округление проводят поэтапно до получения двух значащих цифр.
За результат принимают количество микроорганизмов в 1 см 3 (жидкие продукты) или в 1 г (прочие продукты), выраженное в виде числа от 1,1 до 9,9, умноженного на 10 в соответствующей степени.
Округление результата дает 19 000, или 1,9·10 4 микроорганизмов в грамме продукта.
Метод расчета при проведении идентификации. Если используемый метод требует идентификации, определенное количество колоний (обычно 5) пересевают с каждой чашки, отобранной для подсчета колоний. После идентификации рассчитывают для каждой чашки количество идентифицированных микроорганизмов а по формуле
где А – количество колоний, отобранных для идентификации; b – количество колоний, соответствующих критериям идентификации; С – общее количество колоний.
Результат вычисления округляют до целого числа.
Количество N идентифицированных микроорганизмов, присутствующих в 1 г (см 3 ) испытуемой пробы, рассчитывают как средневзвешенное значение, заменив ΣС на Σa.
Прямой подсчет жидкого продукта дал следующие результаты:
- в первом выбранном разведении (10 -3 ) в двух чашках выявлено соответственно 66 и 80 колоний;
- во втором выбранном разведении (10 -4 ) – 4 и 7 колоний.
- из чашки с 66 колониями для идентификации отобрано 8 колоний, из которых 6 соответствовали критериям; следовательно, а = 50;
- из чашки с 80 колониями отобрано 9 колоний, из которых 6 соответствовали критериям; следовательно, а = 53;
- из чашки с 7 колониями отобрано 5 колоний, из которых 4 соответствовали критериям; следовательно, а = 6;
- из чашки с 4 колониями все 4 идентифицированы положительно; следовательно а = 4.
Таким образом, количество обнаруженных в пробе микроорганизмов составляет 5,1·10 4 в 1 см 3 .
Приближенные оценки количества микроорганизмов.
Если в каждой из двух чашек содержится менее 15 колоний на уровне исходной пробы (жидкие продукты) или исходной суспензии (прочие продукты), то рассчитывают среднее арифметическое у колоний, подсчитанных на этих чашках.
Результат выражают следующим образом:
- для жидких продуктов – приближенное количество микроорганизмов в 1 см 3 NE= Υ,
- для прочих продуктов – приближенное количество микроорганизмов в 1 г Ng = Υ/d, где d – коэффициент разбавления исходной суспензии.
Если две чашки не содержат колоний на уровне исходной пробы (жидкие продукты) или исходной суспензии (прочие продукты), то результаты выражают следующим образом:
- менее 1 микроорганизма в 1 см 3 (жидкие продукты);
- менее 1/d микроорганизмов в 1 г (прочие продукты), где d – коэффициент разбавления исходной суспензии.
Метод подсчета с использованием жидкой среды. Метод наиболее вероятного числа (НВЧ). Возможны два способа посева.
В наиболее часто используемом способе, называемом "симметричным", применяется одинаковое количество пробирок в каждом разведении, объемы соседних разведений обычно соотносятся как 1:10. Этот способ используют, если нужно определить не только превышение определенных предельных норм, но и количество присутствующих микроорганизмов.
Используют также способ, называемый "асимметричным", который предусматривает разное количество пробирок в отдельных разведениях.
В действующих стандартах рассматривается только "симметричный" способ с десятикратными разведениями.
В зависимости от требуемой точности результатов засевают необходимое количество флаконов или пробирок одним и тем же разведением (например, три, пять или десять). Как правило, применяемые методы требуют трех пробирок или флаконов на разведение.
Значения индекса НВЧ для приемлемых сочетаний находят по табл. 22.1. С помощью индекса НВЧ определяют наиболее вероятное количество микроорганизмов СS в заданном объеме VS по Формуле
где М – индекс НВЧ, взятый из табл. 22.1 для базового разведения V0; F – число, обратное коэффициенту разбавления исходной пробы. Это разведение (1,0) использовано в табл. 22.1 как базовое разведение (обычно F = 10,100 и т.д.); VS – заданный объем, выбранный для выражения содержания микроорганизмов; V0 - объем, использованный для посева базового разведения.
Если наименьшее разведение из отобранных соответствует пробирке, приготовленной из среды двойной концентрации (посев 10 см 3 ), индекс НВС, взятый из табл. 22.1, делят на 10.
Если НВЧ меньше 0,3 микроорганизма в 1 см 3 (жидкие продукты) или в 1 г (другие продукты) и если была использована методика, предназначенная для малых количеств микроорганизмов, результаты должны выражаться следующим образом: менее 1 микроорганизма в 1 см 3 для жидких продуктов или 1 г для прочих продуктов.
Для твердого продукта установлен индекс НВС, равный 24; первая выбранная пробирка соответствует посеву 1 см 3 исходной суспензии (F = 10), отсюда СS в 1 г составляет
Цель занятия. Освоить технику посева микроорганизмов на плотные и жидкие питательные среды и методы выделения чистых бактериальных культур. Ознакомить студентов с основными культуральными характеристиками микроорганизмов и методами определения количества бактерий.
Оборудование и материалы. Бульонные и агаровые культуры В. cereus, Е. coli и S. aureus в пробирках и в чашках Петри, смешанная бульонная культура Е. соli и S. aureus, стерильные МПА и МПБ в пробирках, чашках Петри, солевой МПА (8 % хлорида натрия) в чашках Петри, стеклянные шпатели, стерильные пипетки Пастера, бактериологические петли.
Культура микроорганизмов — это популяция (расплодка) клеток на питательной среде. Посев и пересев культур микроорганизмов на питательные среды — наиболее частый методический прием, который используют для первичного выделения микроорганизма из какого-либо объекта, а также для поддержания культур в жизнеспособном состоянии в лабораторных условиях.
Чистая культура — это популяция бактерий одного вида или биологического варианта (биовара), выращенная на питательной среде.
Штаммы — чистые культуры микроорганизмов одного вида, выделенные из разных объектов или из одного и того же объекта, но в разное время.
Колония — макроскопически видимое скопление клеток микроорганизма на поверхности или внутри плотной питательной среды, образовавшихся в результате размножения одной жизнеспособной клетки. По этой причине колонию обычно рассматривают как чистую культуру микроорганизма.
Посев на жидкую питательную среду. Пробирку с исследуемым материалом и пробирку с питательной средой держат в левой руке, в правую руку берут бактериологическую петлю или пипетку и'пробки от пробирок (рис. 37). Над пламенем горелки обжигают края пробирок, бактериологическую петлю (пипетку) вводят в пробирку с материалом, переносят материал в пробирку со стерильной питательной средой и стряхивают с петли в среду, не смачивая при этом петледержатель. Края пробирок вновь проводят над пламенем горелки, закрывают пробирки пробками, стерилизуют петлю и ставят ее в штатив. Использованную пипетку опускают концом вниз в банку с дезинфицирующим раствором.
Посев на плотную питательную среду. Выполняют разными способами.
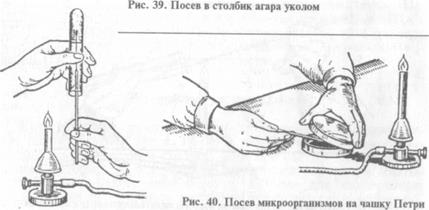
При посеве на чашку Петри: чашку берут в левую руку, большим пальцем левой руки слегка приподнимают крышку, обжигают на пламени горелки края чашки в зоне щели, вносят посевной материал на поверхность питательной среды, затем растирают его при помощи стеклянного шпателя или бактериологической петли (рис. 40).
Посев на полужидкую питательную среду. Выполняют методом укола в столбик питательной среды.
Выделение чистых культур микроорганизмов. При бактериологическом исследовании искомый микроорганизм обнаруживают в материале, как правило, в смеси с бактериями других видов. Классическими методами бактериологии возможно идентифицировать микроорганизм только при условии, что он находится в виде чистой культуры.
Методы, основанные на механическом разобщении клеток. Эти методы наиболее часто применяют при выделении чистых культур микроорганизмов.
Метод Пастера (метод разведений): из исследуемого материала готовят ряд последовательных, чаще десятикратных разведений на стерильной жидкой питательной среде в пробирках или колбах (10 -1 …10 -10 ). Предполагают, что количество микробных клеток в каждом последующем разведении будет меньше, чем в предыдущем, и в какой-то из пробирок останется только одна микробная клетка, которая и даст/начало чистой культуре Микроорганизма. Однако для успешного применения этого метода необходимо, чтобы искомый микроорганизм в материале количественно преобладал над сопутствующими видами.
Метод Коха (метод заливок): исследуемый материал в небольшом количестве вносят в пробирку с расплавленным и охлажденным до 45. 50 "С МПА, перемешивают, затем каплю питательной среды переносят во вторую пробирку с расплавленным МПА и т. д. Количество разведений зависит от предполагаемой численности микроорганизмов в исследуемом материале. Затем содержимое каждой пробирки выливают в стерильные чашки Петри, после затвердения среды посевы помещают в термостат. Фиксированные в плотной среде микробные клетки при размножении формируют колонии, из которых можно отвить (пересеять) чистую культуру микроорганизма.
Метод Дригальского: берут три—пять чашек Петри с плотной питательной средой. В одну из чашек вносят посевной материал и распределяют его шпателем по поверхности питательной среды. Не обжигая шпатель, оставшийся на нем материал последовательно растирают на поверхности среды во второй, третьей и остальных чашках. В последних чашках Петри после инкубирования в термостате обычно наблюдают формирование изолированных колоний бактерий.
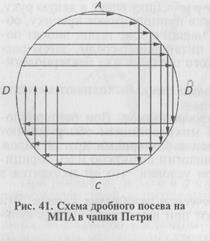
Более экономичен следующий способ получения изолированных колоний. Бактериологической петлей с посевным материалом несколько раз делают параллельные штрихи в одном секторе чашки Петри с питательным агаром (рис. 41). Пет- о лю прожигают в пламени горелки, дают остыть и часть материала из первого сектора <А) аналогичным образом распределяют во втором секторе (В), затем в третьем (С) и четвертом (Д) секторах. Даже при рассеве бактериальной массы из колоний в секторе Д при таком способе получают рост изолированных колоний.
Методы, основанные на биологических особенностях микроорганизмов. Направлены на подавление роста сопутствующей микрофлоры.
Прогревание: при выделении чистой культуры споро-образующего вида бактерий исследуемый материал прогревают при 80 °С 20 мин или кратковременно кипятят. Вегетативные клетки сопутствующей микрофлоры в этих условиях погибают, а споры искомого микроорганизма сохраняют жизнеспособность и прорастают после посева на питательные среды.
Использование селективных питательных сред, которые содержат вещества, подавляющие рост сопутствующей микрофлоры (антибиотики, красители и т. д.), — частый прием при исследовании контаминированного материала. Однако необходимо учитывать, что селективные факторы часто находятся не в бактерицидных, а в бактериостатических концентрациях, поэтому клетки сопутствующих микроорганизмов не растут, но остаются жизнеспособными на поверхности питательной среды и при отвивке колоний исследуемой культуры на обычные среды могут быть причиной получения смешанной культуры.
При выделении чистых культур некоторых видов бактерий используют их другие биологические особенности. Например, способность микроорганизма расти при низких (листерии) или высоких (термофильные бактерии) температурах, которые лежат за пределами температурных диапазонов сопутствующих видов бактерий. Для выделения культуры P. vulgaris используют способность данного вида давать ползучий рост (роение) на поверхности плотной питательной среды. С этой целью материал, содержащий P. vulgaris, засевают в конденсационную воду на дне пробирки со скошенным МПА, не касаясь поверхности среды. Сопутствующая микрофлора растет в нижней части питательной среды, а протей в виде прозрачной пленки распространяется вверХ.
Для выделения С. tetani материал засевают точечно на плотную питательную среду в чашках Петри и после выращивания отвивают культуру с периферии ползучего роста.
Культуральные свойства микроорганизмов. В процессе идентификации наряду с другими свойствами у микроорганизмов изучают культуральные признаки — особенности роста на плотных, жидких и полужидких питательных средах при определенных условиях.
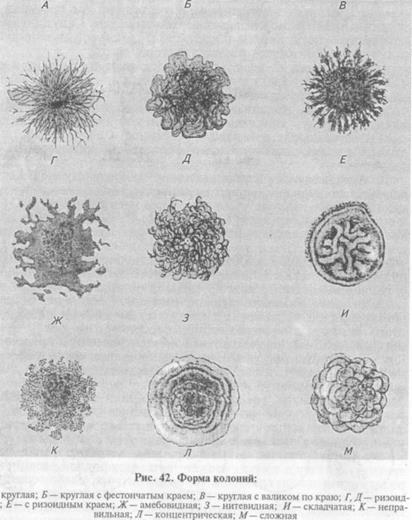
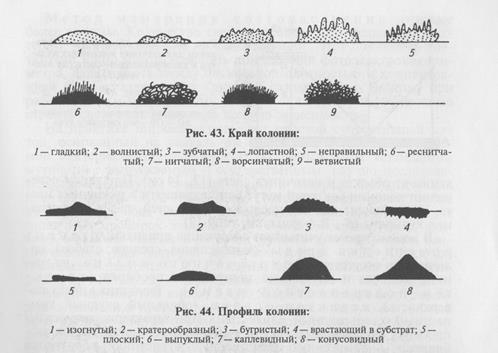
На плотных средах изучают колонии микроорганизмов. Бактерии каждого вида формируют колонии с определенными признаками, которые обычно учитывают при идентификации. Размер колоний: крупные — диаметром 4. 6 мм и более, средние—2. 4 мм, мелкие — 1. 2мм и точечные колонии диаметром менее 1 мм. Форма колоний может быть правильной круглой, неправильной (амебовидной, розеткообразной), корневидной (рис. 42). Цвет зависит от способности микроорганизма образовывать пигмент: белый, желтый, красный, сине-зеленый и т. д. Бактерии, не синтезирующие пигмент, формируют бесцветные колонии. Учитывают характер поверхности, которая может быть шероховатой, блестящей, матовой, сухой, влажной, гладкой, радиально или концентрически исчерченной. Края колонии могут быть ровными, волнистыми, зазубренными, бахромчатыми, их исследуют невооруженным глазом и под малым увеличением микроскопа (рис. 43). Рельеф (профиль) определяют, рассматривая колонию сбоку; различают плоские, конусообразные, куполообразные, плоские с конусовидным центром или углублением в центре колонии, с утолщенными (валикообразными) краями (рис. 44). Учитывают прозрачность колонии: непрозрачная, полупрозрачная, прозрачная. Структура может быть однородной, зернистой, волокнистой и т.д. (рис. 45). Ее выявляют при слабом увеличении микроскопа. Консистенция может быть пастообразной, слизистой, плотной (сухой) и т.д.; ее определяют, дотрагиваясь до колонии бактериологической петлей. Колонии некоторых видов врастают в толщу питательной среды, что также определяют при помощи бактериологической петли. Запах: многие виды бактерий в процессе роста на питательных средах выделяют специфические ароматические вещества.
Ценную дополнительную информацию об особенностях строения колоний дает их изучение в косопадающем пучке света (рис. 46). Культуры на прозрачной агаровой среде в чашках Петри помещают на предметный столик бинокулярной лупы. Между бинокулярной лупой и источником света помещают зеркало от микроскопа вогнутой стороной вверх таким образом, чтобы лучи, отраженные от него, попадали в плоскость изучаемого объекта под углом 40. 45°. Зеркало устанавливают на равном удалении от объекта и источника света (12. 14 см). При таком освещении колонии бактерий могут быть окрашены в различные цвета. Цвет зависит как от видовых особенностей, так и от состояния культуры (S-, R-формы, см. тему 12).
В жидких средах учитывают следующие признаки: степень помутнения среды (интенсивное, среднее, слабое), наличие или отсутствие пристеночного кольца на границе мениска и внутренней поверхности пробирки, характер поверхностной пленки (толщина, цвет, поверхность), характер осадка (обильный, скудный, компактный, хлопьевидный, слизистый). При характеристике осадка пробирку слегка встряхивают и учитывают результат: осадок разбивается в гомогенную равномерную суспензию; образуются мелкие или крупные хлопья, глыбки; слизистый осадок при встряхивании обычно поднимается в виде косички. Пигментообразующие микроорганизмы вызывают окрашивание питательной среды и осадка (желтое, зеленоватое, красное и т. д.).
Определение количества бактерий. При характеристике развития микробной популяции, санитарной оценке кормов, продуктов питания, при вычислении показателя вирулентности микроорганизма необходимо устанавливать количество микробных клеток в единице объема того или иного материала.
Определение общего количества микроорганизмов. Можно применять метод прямого счета и метод измерения светорассеяния.
Метод прямого счета: бактерии подсчитывают в камерах Горяева, Тома или в окрашенных мазках. В последнем случае 0,01 мл бактериальной суспензии микропипеткой наносят на предметное стекло и равномерно распределяют на 1 см2. Мазок фиксируют, окрашивают и подсчитывают клетки в 10. 15 полях зрения по диагонали квадрата. Определяют среднее число клеток в одном поле зрения. Делят 1 см 2 на площадь поля зрения, которую измеряют методом микрометрии (см. тему 1), затем частное умножают на среднее число микробных клеток в поле зрения, получают их количество в 0,01 мл взвеси бактерий.
Метод измерения светорассеяния считают более точным. Количество света, рассеиваемого суспензией бактерий, пропорционально их концентрации. Этот показатель достаточно точно можно измерить при помощи фотоэлектроколориметра. Зависимость между оптической плотностью и концентрацией клеток различна для бактерий разных видов. Поэтому при работе с таким прибором для каждого вида бактерий необходимо строить свою калибровочную кривую зависимости.
Например, в пробирку поместили 0,1 мл суспензии бактерий, содержащей неизвестное количество клеток. Для уравнивания оптической плотности исследуемой суспензии со стандартом мутности 10 ед. в пробирку добавили 0,9 мл физиологического раствора, т. е. исходную суспензию развели в 10 раз. Известно, что суспензия данного вида бактерий при оптической плотности 10 ед. содержит 1,3*10 9 кл/мл. Следовательно, концентрация исследуемой суспензии составляет 1,3*10 10 кл/мл.
Определение количества живых микроорганизмов. Метод основан на выводе, что бактериальная колония — это результат деления единичной клетки на плотной питательной среде (исключение составляют бактерии, образующие цепочки из клеток).
Мерной пипеткой объемом 1 мл добавляют 1 мл культуры Е. coli в бактериологическую пробирку с 9 мл стерильного физиологического раствора, подогретого до 37. 38 °С (разведение 10-1). Далее аналогичным способом готовят разведения культуры от 10 -2 до 10 -8 . Для каждого разведения используют новую пипетку того же объема и класса. Из пяти последних пробирок суспензию бактерий по 0,1 мл наносят на поверхность подсушенного МПА в две чашки Петри. Внесенный материал стерильным шпателем распределяют по поверхности питательной среды. Посевы инкубируют при 37. 38 ºС 24 ч.
Учет результатов: в чашках Петри, где выросло более 150. 300 и менее 10 колоний, результаты не учитывают. Выбирают чашки Петри с параллельными посевами (из одного разведения), содержащими 10. 150 колоний. Подсчитывают колонии на чашках из одного разведения, суммируют, определяют среднее число колоний и с учетом степени разведения рассчитывают содержание жизнеспособных клеток (колониеобразующих единиц) в 1 мл исходной суспензии бактерий.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
1. Провести пересев бульонной и агаровой культур бактерий на скошенный МПА и в МПБ в пробирках.
2. Провести посев смешанной бульонной культуры на МПА в чашках Петри по методу Дригальского.
3. Описать характер роста Е. coli, S. aureus, В. cereus на МПА (колонии) и в МПБ.
4. Определить количество микробных клеток в 1 мл бульонной культуры Е. coli методом прямого счета и при помощи стандарта мутности.
5. Провести посев бульонной культуры Е. coli на МПА в чашках Петри с целью определения количества жизнеспособных клеток.
Контрольные вопросы
1. Что такое культура, смешанная культура, чистая культура, штамм и колония бактерий?
2. Какие методы применяют для получения чистых культур микроорганизмов?
3. Какие культуральные признаки учитывают при идентификации бактерий?
4. Какими методами определяют общее число микроорганизмов и количество жизнеспособных клеток?
Читайте также:


