Corynebacterium amycolatum в посеве что это
В большинстве случаев, такая стратегия быстрее навредит, чем поможет, поскольку причиной может быть бактериальный вагиноз (БВ).
Что такое баквагиноз
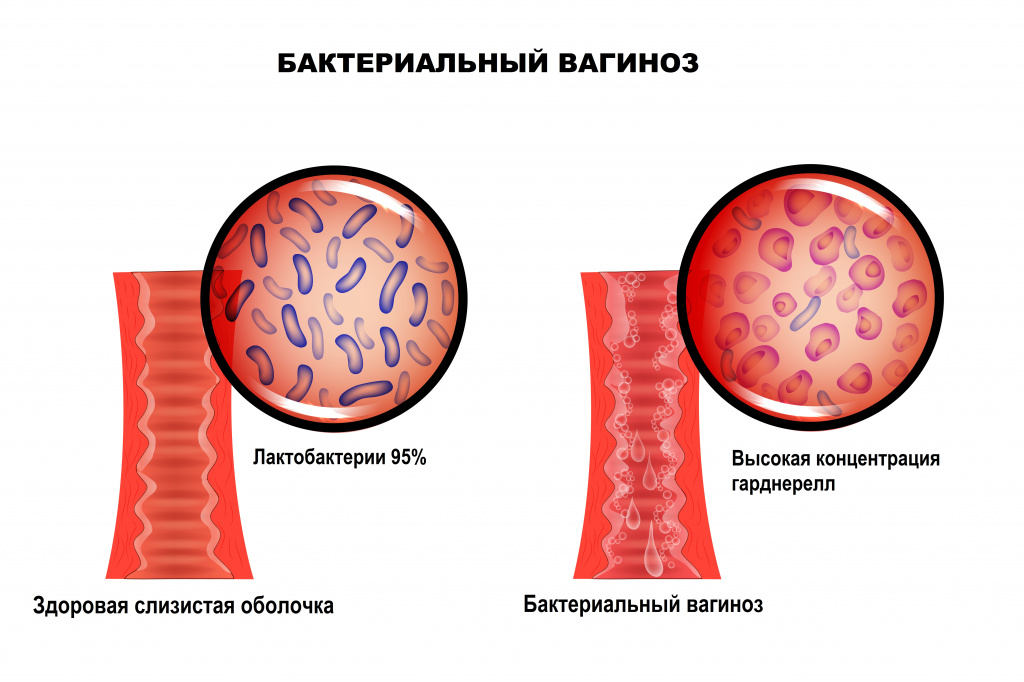
Согласно официальному определению, это невоспалительное заболевание влагалища, характеризующееся резким снижением или полным отсутствием лактофлоры и её заменой на анаэробные бактерии, среди которых наиболее распространены Gardnerella vaginalis (гарднерелла) и Atopobium vaginae (атопобиум).
У здоровых женщин репродуктивного возраста влагалищный микробиом на 95% представлен лактобактериями. Их способность к кислотообразованию (молочная кислота) и продукции перекиси водорода способствует поддержанию кислого pH и подавлению роста остальных микроорганизмов.
Оставшиеся 5% микрофлоры занимают более 300 видов аэробных и анаэробных микроорганизмов, среди которых:
- грамположительные палочки - Corynebacterium spp., Eubacterium spp., Bifidobacterium spp., Propionibacterium spp., Clostridium spp.;
- грамотрицательные палочки (14-55%) - Bacteroides spp., Fusobacterium spp., Prevotella spp., Porphyromonas spp., Leptotrichia spp.;
- грамположительные кокки (30-80%) - Peptostreptococcus spp., Peptococcus spp., Staphylococcus spp., Micrococcus varians, Enterococcus spp., Streptococcus viridans и др.
- грамотрицательные кокки - Veilonella spp., Acidominococcus fermentans, непатогенные Neisseria spp.,
- энтеробактерии - Echerihia coli, Klebsiella spp., Enterobacter spp., Citrobacter spp. и др.
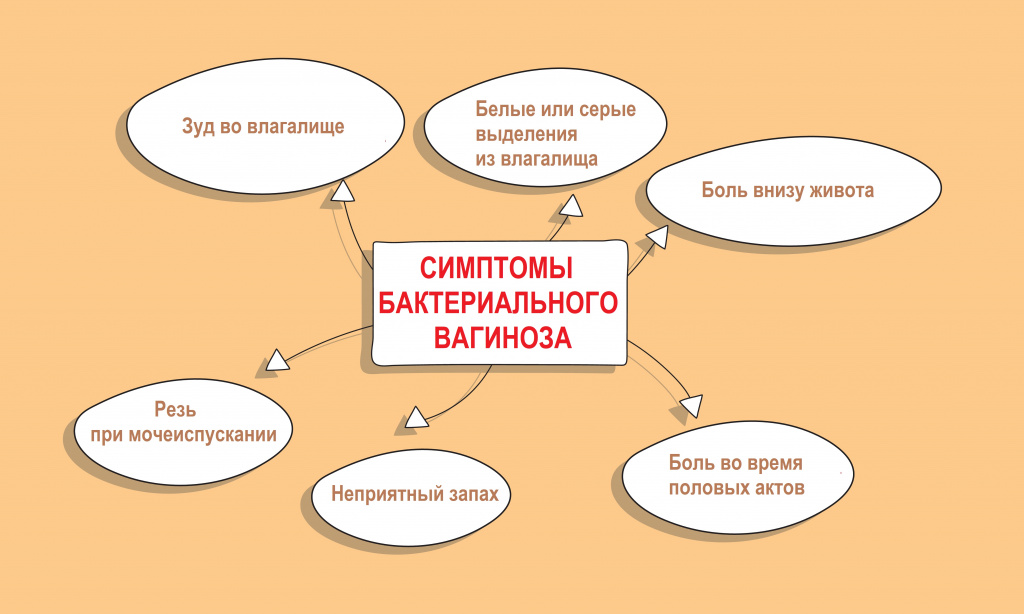
Факторы риска и симптомы
- ранее перенесенные воспалительные заболевания половых путей,
- длительный и бесконтрольный прием антибиотиков,
- гормональные нарушения (расстройства менструального цикла),
- длительное применение ВМС,
- прием оральных контрацептивов.
Колонизация влагалища микрофлорой, связанной с баквагинозом, особенно Gardnerella vaginalis и Atopobium vaginae, сопровождается:
Диагностика
Этот тест разработан научными специалистами совместно с практикующими клиницистами. И предназначен для определения состава и соотношения нормальной и условно-патогенной флоры влагалища методом ПЦР.
Исследование представлено в 3-х вариантах для различных клинических ситуаций:
- всех обнаруженных бактерий,
- ДНК Lactobacillus spp.,
- ДНК Atopobium vaginae,
- ДНК Gardnerella vaginalis.
- ДНК всех бактерий,
- ДНК Lactobacillus spp.,
- ДНК возбудителей бактериального вагиноза
- Gardnerella vaginalis
- и Atopobium vaginae,
- Enterobacteriaceae,
- Staphylococcus spp.,
- Streptococcus spp.,
- Ureaplasma urealyticum,
- Ureaplasma parvum,
- Mycoplasma hominis,
- Candida albicans,
- Candida glabrata,
- Candida krusei
- Candida paraps./ tropicalis.
- Neisseria gonorrhoeae (гонокок)
- Chlamydia trachomatis (хламидия)
- Mycoplasma genitalium (микоплазма гениталиум)
- Trichomonas vaginalis (трихомонада)
Готовность анализов составляет 4-5 дней, а результат можно получить по электронной почте, в личном кабинете на сайте или в любом удобном отделении KDL.
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Бактериальный вагиноз: причины появления, симптомы, диагностика и способы лечения.
Определение
Бактериальный вагиноз — это инфекционное полимикробное заболевание, связанное с изменением микрофлоры влагалища, при котором происходит значимое уменьшение количества или полное исчезновение палочек Додерлейна (лактобактерий) и их замещение факультативными анаэробными микроорганизмами и/или возбудителем гарднереллеза. Увеличение уровня лейкоцитов в вагинальном отделяемом и признаки воспаления стенок влагалища могут отсутствовать.![Вагиноз.jpg]()
Отличительной особенностью заболевания является отсутствие какого-либо одного конкретного возбудителя. Микрофлора, приходящая на смену лактобактериям, может быть различной и чаще всего представлена условно-патогенными бактериями. Кислотность среды влагалища смещается в сторону ощелачивания. При нарушении экосистемы влагалища формируется хорошо структурированная полимикробная пленка (биопленка - форма микробных сообществ), покрывающая вагинальный эпителий и состоящая из анаэробных бактерий, что приводит к рецидивирующему течению бактериального вагиноза. В биопленках бактерии защищены от компонентов врожденного и приобретенного иммунитета.
В норме ведущее место (95%) в вагинальном микробиоценозе занимают палочки Додерлейна, продуцирующие перекись водорода и молочную кислоту.
Они поддерживают постоянство богатой кислородом кислой рН-среды и играют роль местных факторов защиты. В случае нарушения защитных механизмов патогенные или условно-патогенные микроорганизмы транзиторной или факультативной флоры прикрепляются к клеткам влагалищного эпителия с последующим размножением и повреждением тканей.
Бактериальный вагиноз является наиболее частой причиной патологических вагинальных выделений у женщин репродуктивного возраста, однако иногда он может наблюдаться и у девочек до менархе, и у женщин в период менопаузы.
Причины появления бактериального вагиноза
Предрасполагающие факторы, ведущие к развитию бактериального вагиноза:- использование антибактериальных препаратов;
- длительное применение внутриматочных контрацептивов;
- ношение синтетического нижнего белья, злоупотребление прокладками на каждый день и тампонами, которые препятствуют проникновению кислорода;
- длительный прием антибиотиков;
- хронические заболевания кишечника и другие состояния, вызывающие дисбактериоз;
- использование пероральных контрацептивов;
- перенесенные ранее воспалительные заболевания урогенитального тракта;
- нарушение гормонального статуса, сопровождающееся нарушением менструального цикла, преимущественно по типу олигоменореи или аменореи;
- атрофия слизистой оболочки влагалища;
- снижение иммунитета;
- воздействие малых доз ионизирующего излучения;
- стрессовые воздействия на организм.
Классификация бактериального вагиноза на основании микроскопического исследования:
- Компенсированный бактериальный вагиноз — количество лактобактерий снижено, что является фактором риска заселения влагалища патогенными микроорганизмами.
- Субкомпенсированный — низкий уровень лактобактерий и растущее число условно-патогенных микроорганизмов.
- Декомпенсированный — в мазке выявляются условно-патогенные микроорганизмы, лактобактерии отсутствуют, выражены клинические симптомы бактериального вагиноза.
У большинства женщин бактериальный вагиноз протекает бессимптомно и может быть обнаружен случайно во время рутинного осмотра и взятия мазка.
Интенсивный рост факультативной флоры, образование патологических биопленок сопровождается появлением влагалищных выделений с характерным неприятным запахом.
![Симптомы вагиноза.jpg]()
Хронический бактериальный вагиноз — это непрерывное течение заболевания более 2-х месяцев, несмотря на проводимое лечение. Как правило, он сочетается с нарушением гормонального фона и атрофией слизистой оболочки влагалища.
Диагностика бактериального вагиноза
При постановке диагноза у врача есть четыре критерия, которыми он пользуется. Наличие у пациентки трех из них говорит в пользу бактериального вагиноза.Микроскопическое (бактериоскопическое) исследование мазка, окрашенного по Граму. Материалом для оценки состояния флоры влагалища служат гинекологические мазки (отделяемое наружных половых органов, уретры, влагалища, шейки матки, полости матки).
Микроскопическое исследование окрашенного нативного мазка проводят при диагностике инфекционно-воспалительных заболеваний мочеполовых путей; легких; ЛОР-органов; глаз; кожи, мягких тканей и др. Возможно применение данного теста в качестве дополнительного исследования к посевам на анаэробную инфекцию.
Род включает множество видов. Все представители — неспорообразуюшие неподвижные грамположительные плеоморфные бактерии, не образующие капсулу; характерно беспорядочное расположение возбудителей в препарате.
Corynebacterium diphtheriae
Передача инфекций, вызываемых Corynebacterium diphtheriae, осуществляется воздушно-капельным путём или при прямом контакте с кожными поражениями.
Патогенез дифтерии. Возбудитель — штамм С. diphtheriae, который содержит дифтерийный токсин, кодируемый геном бактериофага.
Дифтерийный токсин нарушает синтез белка в клетках и оказывает прямое воздействие на миокард (миокардит) и периферическую нервную систему (невропатия и паралич). Поверхностная (кожная) инфекция обычно протекает бессимптомно. Лечение пациентов включает их изоляцию, применение токсиннейтрализующего препарата и эритромицина. В некоторых случаях необходимо применение методов интенсивной терапии.
![коринобактерии дифтерии]()
Лабораторная диагностика возбудителя дифтерии - Corynebacterium diphtheriae
• Бактериологическое исследование: Corynebacterium diphtheriae образуют чёрные колонии на питательных средах с содержанием теллурита. На ранних стадиях исследования используют селективную среду Леффлера.
• Изучение биохимических свойств возбудителя.
• Реакция иммунодиффузии Элека (для подтверждения образования токсина).
• Молекулярно-тенетические методы (для определения гена токсичности).Профилактика дифтерии - Corynebacterium diphtheriae:
• Введение вакцины, содержащей анатоксин, детям (после иммунизации формируется стойкий продолжительный иммунитет). Взрослым необходима дополнительная иммунизация.
• Своевременная изоляция и обследование контактных лиц.Corynebacterium jeikeium
Возбудитель вызывает инфекции у больных после протезирования. У пациентов со сниженным иммунитетом может вызвать бактериемию. Устойчив к действию большинства антибиотиков (за исключением ванкомицина).
Другие коринебактерии. В редких случаях С. ulcerans вызывает дифтерийный фарингит, а С. pseudotuberculosis — гнойный гранулематозный лимфаденит. Rhodococcus equi у пациентов с СПИДом часто обусловливает развитие тяжёлой пневмонии.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.В статье представлено наблюдение за новорожденным ребенком, погибшим от раннего неонатального сепсиса, обусловленного Corynebacterium amycolatum. Описаны особенности клиники, результатов лабораторных исследований. Обозначены проблемы лечения подобного рода больных.
The case of early neonatal sepsis caused by Corynebacterium amycolatum
The paper presents the observation over the newborn child who died from the early neonatal sepsis caused by Corynebacterium аmycolatum. The peculiarities of clinical picture and the results of laboratory research are described. The problems of treatment of such patients are identified.
Сепсис − одна из основных причин заболеваемости и смертности новорожденных. Число такого рода процессов в этой возрастной группе составляет в среднем 0,1–0,2% у доношенных и 1–1,5% у недоношенных детей [1]. Несмотря на применение современных антибактериальных препаратов, летальность при сепсисе по-прежнему остается очень высокой и достигает 30-40% у доношенных и 75% – у недоношенных новорожденных [2, 3].
Инфицирование ребенка при развитии раннего неонатального сепсиса (РНС) может произойти как интра-, так и антенатально (восходящим, контактным или гематогенным путями). Микробиота родовых путей матери является в данном случае основным резервуаром инфекции. Вероятность развития РНС увеличивается при преждевременном разрыве околоплодных оболочек, длительном безводном периоде (более 12 часов), хориоамнионите, при лихорадочных состояниях и наличии очагов инфекции у матери незадолго до и в ходе родов. К факторам риска со стороны плода традиционно относят гестационный возраст менее 32 недель, задержку внутриутробного развития и др. 1. Прогностически значимым показателем является, в данном случае, и масса тела при рождении: так при исходной массе менее1,5 кгвероятность развития сепсиса в 10 раз, а при массе менее1 кг, соответственно, – в 100 раз выше, чем у доношенных новорожденных [4]. Клиника РНС в случаях развития тяжелой формы характеризуется полиорганным поражением в виде тяжелой легочной недостаточности, дисфункции пищеварительного тракта, развития тромбо-геморрагического синдрома 4.
В большинстве случаев этиологической причиной РНС является Streptococcus agalactiae, реже − представители семейства Enterobacteriaceae, прежде всего E.coli [2]. Развитие позднего неонатального сепсиса связывают с E.сoli, S.aureus, Kl.pneumoniae, Serratia spp., Pseudomonas spp., Enterobacter spp., коагулазонегативными стафилококками [2]. За рубежом описаны случаи неонатального сепсиса, ассоциированного с представителями резидентной микрофлоры кожи, в частности с недифтерийными коринебактериями (НК) [5].
НК – нормальные обитатели кожи и слизистых человека, присутствующие на разных участках тела: в области паха, подмышечных впадин и промежности. Наличие
у дифтероидов факторов патогенности (нейраминидазы, гиалуронидазы, сфингомиелиназы, способности к адгезии и др.) предполагает и возможность развития связанных с ними патологических состояний [6]. Действительно, в практике описаны случаи язвенно-некротических поражений кожи, ротоглотки, носа, трахеи, легких и т.д. Доказана роль НК в развитии фарингитов, пневмоний, абсцессов, эндокардитов, септицемий, заболеваний почек и половых органов у людей [6]. Речь, безусловно, идет о пациентах с иммуносупрессией: пожилые люди, пациенты, нуждающиеся в гемодиализе, больные с искусственными клапанами сердца 8.Один из видов НК – Corynebacterium amycolatum. Обычно его выделяют с кожи и со слизистых дыхательных путей. Впервые этот вид НК был описан в 1988 г. [10]. Традиционно микроорганизм рассматривается как микроб-комменсал, не выделяющий экзотоксина и, соответственно, не формирующий воспалительных изменений на неповрежденной коже и слизистых. Тем не менее, при определенных условиях он проявляет патогенные свойства и способен вызвать даже инвазивные варианты инфекции. На сегодняшний день в мире описано около трех сотен подобного рода заболеваний, ассоциированных, как правило, с нейтропенией, постановкой сосудистых катетеров, глубокой недоношенностью. Более того, рассматривая инфекцию, вызванную Corynebacterium amycolatum, в качестве оппортунистической у ряда онкологических больных, Martins C. и соавт. расценили ее как предиктор неблагоприятного исхода заболевания [11].
Ниже мы приводим собственный случай наблюдения сепсиса, обусловленного C.amycolatum, развившегося у новорожденного ребенка.
Ребенок от первой беременности у женщины 26 лет. Беременность протекала с признаками токсикоза. Женщина перенесла ОРВИ во II триместре. Роды первые, экстренные, оперативные на сроке 36-37 недель, связаны с ранним излитием околоплодных вод (мекониальные, зловонные). Масса тела при рождении2580 грамм, длина49 см. Ребенок рожден в состоянии тяжелой асфиксии (3-7 баллов по шкале Апгар).
В первые сутки жизни пациент переведен в инфекционную больницу. При поступлении: состояние тяжелое за счет синдрома интоксикации, дыхательной недостаточности, метаболических и водно-электролитных нарушений, недоношенности, неврологической симптоматики. Температура в норме (на протяжении всего периода госпитализации отмечалась тенденция к гипотермии). Кожа бледная. При беспокойстве – цианоз носогубного треугольника, мраморность кожных покровов. Отечность и гиперемия конъюнктив век, сукровичное отделяемое из обоих глаз. Пупочный остаток сухой. Сознание не нарушено. Менингеальные знаки – отрицательные. Большой родничок не пульсирует, не напряжен. Выраженная диффузная мышечная гипотония. Изо рта − периодически обильное пенистое отделяемое. Дыхание жесткое, в нижние отделы обоих легких проводится плохо, по всем полям выслушиваются сухие и мелкопузырчатые влажные хрипы. Одышка смешанного характера с втяжением уступчивых мест грудной клетки и раздуванием крыльев носа. Перкуторные границы сердца расширены. Тоны ритмичные, приглушены. Пульс удовлетворительных качеств до 140 ударов в минуту. Артериальное давление – 77/40 мм.рт.ст. Живот округлой формы, не вздут, доступен глубокой пальпации, безболезненный. Печень выступала на2 смниже края реберной дуги, эластичная, безболезненная. Селезенка не пальпировалась. Диурез снижен. Мочеиспускание – через мочевой катетер. Стула при осмотре не было.
На обзорной рентгенограмме органов грудной клетки на фоне неравномерной пневматизации — выраженное усиление легочного рисунка с периваскулярными и перибронхиальными изменениями в обоих легких. Справа в нижнемедиальной зоне сгущение бронхолегочного рисунка. Убедительных данных за инфильтративные изменения выявлено не было. Корни расширены, не структурны. Синусы свободны. Средостение не расширено.
На ЭКГ — ритм синусовый с ЧСС 142-150 ударов в мин., отклонение ЭОС вправо. Признаки гипертрофии правых отделов сердца. Нарушение процессов реполяризации желудочков.
ДНК СМV, HSV в крови ребенка методом ПЦР не обнаружены.
При бактериологическом исследовании отделяемого обоих глаз, пупочной ранки, крови (!) были выделены микроорганизмы, которые на питательной среде давали обильный рост серых плотных колоний с неровным краем, диаметром 1-2 мм, идентифицированные при дальнейшем исследовании как Corynebacterium amycolatum, устойчивые ко всему спектру антибактериальных средств.
В динамике состояние с ухудшением: на 2-й день госпитализации на коже ног появилась петехиальная сыпь, отмечалось нарастание проявлений ДН, снижение сатурации гемоглобина кислородом до 80%, в крови – усиление воспалительных изменений, лейкопения сменилась лейкоцитозом: к 4 дню жизни – L — 22×10 9 /л, нейтрофилов — 85%, нарастание анемии – гемоглобин 95 г/л, ЦП — 0,9. На 4-й день жизни/госпитализации на фоне нарастающих признаков ДН ребенок погиб.
Получал следующее лечение: антибактериальная терапия (цефтриаксон, амикацин в первые 3 дня, затем — меронем), инфузионная терапия, переливание эритроцитарной массы, увлажненный кислород, ИВЛ.
Окончательный клинический диагноз: Ранний неонатальный сепсис, тяжелый, вызванный C.amycolatum (пневмония, двухсторонний коньюктивит, пиелонефрит, гепатит). Осложнения: дыхательная недостаточность II степени, ДВС-синдром, сердечно-сосудистая недостаточность II степени.
Сопутствующие заболевания: период новорожденности, недоношенность 36 недель. ППЦНС. Анемия нормохромная тяжелая. Тяжелая асфиксия при рождении.
Диагноз патологоанатомический: ВУИ. Ранний неонатальный сепсис (обусловленный C.amycolatum): врожденная пневмония, менингит, вентрикулит, коньюктивит. Микроабсцессы надпочечников. Акцидентальная трансформация тимуса. Отек головного мозга. Недоношенность 36 недель. Тяжелая асфиксия при рождении.
При морфологическом исследовании последа были выявлены признаки бактериального мембранита, при микробиологическом исследовании выделены Corynebacterium amycolatum.
Таким образом, мы имели дело с клиническим случаем раннего неонатального сепсиса, обусловленного редким для такой патологии возбудителем – C.аmycolatum. При всей фатальности развивающихся событий в работе с этой инфекцией следует учитывать две ее важные составляющие:
- трудности не столько выделения микроорганизма, сколько интерпретации получаемых результатов; не секрет, что выделение микроорганизма подобного рода из крови обычно расценивается как контаминация забранного образца; очевидно, что одновременное выделение микроба с пораженных зон и из жидкостей организма может служить основанием для обозначения его в качестве возбудителя болезни;
- проблемы, связанные с лечением больного: особенностью возбудителя является его достаточно высокая антибиотикорезистентность; об этом пишет каждый из исследователей, описывающий случаи заболевания, вызванные недифтерийными коринебактериями. С этим пришлось столкнуться и нам. Устойчивость к широкому спектру препаратов, в первую очередь, беталактамного ряда с возможностью лечения только дорогостоящими резервными антибиотиками типа ванкомицина или даптомицина – типичная задача, которую приходится решать врачу в подобной ситуации.
Оба этих положения в равной мере относятся как к недоношенным детям (то, с чем пришлось столкнуться нам), так и к пациентам старшей возрастной группы, имеющим, как правило, иммунодефицит различного происхождения, либо разного рода внутренние катетеры и протезы (это, как показывает статистика, наиболее страдающая группа больных). Таких больных уже в ближайшем будущем станет существенно больше, а современная микробиологическая диагностика позволит эффективно выявлять и идентифицировать подобного рода микроорганизмы в качестве возбудителей новых инфекций.
В.А. Анохин, С.В. Халиуллина, О.А. Назарова, Х.С. Хаертынов
Казанский государственный медицинский университет
Анохин Владимир Алексеевич — доктор медицинских наук, профессор, заведующий кафедрой детских инфекций
Читайте также: