Задачи на получение металлов
Место урока: Урок входит в состав блока практических работ, которыми завершается тема «Металлы», проводится после изучения теоретического материала о получении и свойствах металлов главных и побочных подгрупп.
Цель урока: Проверить уровень практических навыков, умение применять теоретические знания в практических ситуациях, закрепить умения осуществлять качественные реакции и оформлять результаты наблюдений.
Задачи урока:
1.Закрепить знания о получении и химических свойствах металлов и их соединений.
2.Совершенствовать навыки работы с химическим оборудованием и реактивами.
3.Совершенствовать навыки проведения эксперимента и оформления его результатов.
4.Совершенствовать умения работать по инструкции, а также осуществлять планирование действий при решении экспериментальных задач.
5. Развивать навыки логического мышления при решении экспериментальных задач.
6.Совершенствовать навыки соблюдения требований безопасного обращения с химическим оборудованием и реактивами.
Тип урока : урок- практикум.
Оборудование: Минилаборатория (набор химических реактивов и оборудования ) на столах учащихся.
ТСО : компьютер, проектор.
1. Организационная часть . (3минуты)
( до начала урока учащимся предлагается одеть халаты)
Учитель : Богат и интересен мир металлов. Вы познакомились со строением и свойствами некоторых из них. Сегодня мы попадем в удивительный мир превращений металлов и их соединений. Цель сегодняшнего урока - применить теоретические знания при выполнении практических заданий, показать практические навыки безопасной работы с химическим оборудованием и реактивами.
Нам предстоит выполнить 4 практических задания. Напомните себе их содержание.(На предыдущем уроке учащиеся получили задание ознакомиться со всеми практическими заданиями, были проанализированы цели и содержание каждого. Из предложенных заданий для проведения практической работы были выбраны 4).
2. Повторение правил ТБ. (5 минут)
Учитель : Прежде, чем приступить к выполнению практической работы, мы должны напомнить себе правила техники безопасности при выполнении практических работ. Содержание и порядок выполнения опытов подскажут нам, с какими опасностями мы можем столкнуться при их выполнении. ( с учащимися обсуждается вопрос безопасного обращения с кислотами и щелочами, меры оказания первой помощи при их попадании на одежду и кожу, правили обращения с нагревательными приборами). А теперь вспомним общие правила , которые нам нужно соблюдать при выполнении практических работ. (обсуждаются вопросы содержания рабочего места, количества используемых веществ, обращения с химическим оборудованием, утилизации веществ после проведения опыта, гигиенические вопросы).
Учитель : Напоминаю вам общие требования по выполнению заданий.
( на экран выводится следующая информация)
Общие требования при выполнении химического эксперимента
1.Изучите инструкцию по проведению опыта.
2.Проведите описанный опыт, соблюдая правила техники безопасности.
3.Объясните результаты, полученные при проведении опыта.
4.Сделайте вывод.
5.Оформите отчет.
3.Выполнение практической работы. (2 минуты)
Учитель: Приступаем к выполнению работы. Подготовим тетради для ее оформления. Записываем номер и тему практической работы (записаны на доске : Практическая работа № 2. Получение и свойства соединений металлов.).
Учитель: При выполнении заданий будут учитываться навыки выполнения практической работы, соблюдение правил безопасного ее выполнения, а также письменный отчет по каждому из предложенных опытов. Отчет оформляется сразу же после проведения опыта.
Задание 1 (8 минут)
Осуществите следующие превращения:
Fe → FeCI 2 → Fe ( OH ) 2
Опишите происходящие с веществами изменения. Напишите уравнения соответствующих реакций. Рассмотрите первое уравнение с точки зрения окисления - восстановления, второе запишите в молекулярной и ионной формах.
Объясните изменения, происходящие с конечным продуктом последней реакции. Запишите соответствующее уравнение реакции.
Приступайте к выполнению задания.
Описание опыта:
В пробирку с железными опилками добавляется раствор соляной кислоты. Наблюдается растворение железа, изменение окраски раствора и выделение газообразного водорода:
Fe 0 + 2Н +1 С l -1 = Fe +2 Cl -1 2 + Н 2 0 ↑
Fe 0 - 2е = Fe +2 2 1 восстановитель
2Н +1 +2е = Н 2 0 2 1 окислитель
При добавлении к хлориду железа щелочи выпадает белый осадок.
FeCl 2 + 2NaOH = 2NaCl + Fe(OH) 2 ↓
Fe 2+ + 2 С l - + 2Na + + 2 О H - = 2Na + + 2 С l - + Fe(OH) 2 ↓
Fe 2+ + 2О H - = Fe (О H ) 2 ↓
На воздухе гидроксид железа ( II ) превращается в гидроксид железа( III ).
4 Fe ( OH ) 2 + 2Н 2 О + О 2 = 4 Fe ( OH )3
Учитель: Завершаем выполнение первого задания, приступаем к заданию 2. Напомните себе его содержание.
Задание 2 ( 8 минут)
Проведите реакции, подтверждающие качественный состав хлорида кальция. Запишите уравнения реакций в молекулярной и ионной формах.
Учитель : Что необходимо знать для выполнения этого опыта? Чем можно воспользоваться, чтобы не допустить ошибок. (знать, какие реакции называются качественными, могут помочь в выполнении заданий таблицы: таблица растворимости и таблица, показывающая качественные реакции на катионы и анионы).
Для доказательства качественного состава СаС1 2 проводятся реакции, характерные для катиона кальция и хлорид-аниона. Для этого раствор СаС1 2 наливается в 2 пробирки.
В одну из них добавляется раствор карбоната натрия:
Na 2 CО 3 + СаС1 2 = CaCО 3 ↓ + 2NaCl
2Na + + СО 3 2- + Са 2+ + 2Сl - = СаСО 3 ↓ +2Na + + 2Сl -
Са 2+ + СО 3 2- = CaCО 3 ↓
Наблюдается выделение белого осадка карбоната кальция СаСО 3. Данная реакция доказывает наличие катиона кальция.
В другую пробирку приливается раствор нитрата серебра.
СаС1 2 + 2AgNО 3 = Ca(NО 3 ) 2 + 2AgCl↓
Са 2+ + 2Сl - + 2Ag + + 2NО 3 - = Ca 2+ + 2NО 3 - + 2AgCl↓
Наблюдается выделение белого творожистого осадка. Это - качественная реакция на хлорид-анион.
Учитель : Приступаем к выполнению третьего задания, прочитайте его.
Задание 3 (8 минут)
Получите сульфат железа (II) не менее чем тремя способами. Уравнения реакций ионного обмена запишите в молекулярной и ионной формах, а реакции замещения рассмотрите с точки зрения окисления-восстановления.
Учитель : Что необходимо знать, чтобы осуществить эти превращения? (химические свойства веществ). В результате каких реакций получаются соли?
( при взаимодействии металла с неметаллом, оксида металла с кислотой, основания с кислотой, соли с кислотой. основания с солью , соли с металлом).
Проделайте соответствующие заданию реакции. Каждый способ получения должен проходить в одну стадию. При необходимости воспользуйтесь нагреванием. Твердые вещества берите в небольших количествах.
1 способ. В пробирку с железными опилками приливается разбавленный раствор серной кислоты. Наблюдается растворение железа, окрашивание раствора и выделение водорода.
Fe° + H 2 +1 'S0 4 -» Fe +2 S0 4 + H 2 °↑
В результате реакции образуется сульфат железа.
2 способ. В пробирку с раствором медного купороса добавляется железо. Наблюдается изменение окраски раствора, из голубого раствор становится светло-зеленым . В результате реакции выделяется красная медь.
Cu +2 SO 4 + Fe 0 = Fe +2 SO 4 + Cu 0
Fe 0 -2е= Fe +2 восстановитель
Cu +2 +2е = Cu 0 окислитель
3 способ . В пробирку с оксидом железа добавляется серная кислота. При необходимости проводится нагревание. Происходит изменение окраски раствора.
FeО + H 2 SО 4 = FeSО 4 + H 2 О
Возможен вариант получения сульфата железа( II ) действием на карбонат железа( II ) серной кислоты.
Учитель: Последним заданием для вас будет экспериментальная задача. Прочитайте ее.
Задание 4. ( 8 минут)
Экспериментальная задача.
В математике действует правило — «от перемены мест слагаемых сумма не изменяется». Справедливо ли оно для химии? Проверьте это на примере следующего опыта.
Получите гидроксид алюминия по реакции обмена . Для этого вы можете использовать реакцию, уравнение которой
AlCl3 + 3NaOH = Al(OH)3↓ + 3NaCl
Проведите эту реакцию в двух вариантах, используя в каждом варианте одинаковые объемы исходных веществ: сначала к раствору одного из исходных веществ (реагенту) прибавляйте по каплям раствор другого реагента, затем поменяйте последовательность введения в реакцию реагентов. Наблюдайте, в каком случае выпадет осадок, а в каком — нет.
Объясните результаты и запишите уравнения проведенных реакций в молекулярной форме.
Учитель: Давайте еще раз вместе обсудим план действий для проведения эксперимента.
(1.Взять две одинаковые пробирки.
2. В первую пробирку налить раствор хлорида алюминия.
3. Во вторую пробирку налить такой же объем гидроксида натрия.
4. В первую пробирку добавить несколько капель гидроксида натрия.
5. Во вторую пробирку добавить столько же капель хлорида алюминия.
6. Наблюдать, какие изменения произойдут в пробирках.
7. Найти объяснения изменениям и оформить результаты наблюдений.)
Учитель : Приступайте к выполнению задания.
В пробирку с раствором хлорида алюминия добавляют по каплям раствор щелочи:
А1С1 3 + 3NaOH(недостаток) = 3NaCl + Al(OH) 3 ↓
Наблюдают образование белого осадка гидроксида алюминия. Если же добавить еще гидроксид натрия, то образовавшийся гидроксид алюминия провзаимодействует с ним с образованием алюмината натрия и осадок растворится.
В другую пробирку с раствором щелочи добавляют раствор хлорида алюминия. В данном случае, щелочь присутствует в избытке, поэтому А1(ОН) 3 вначале не образуется, идет образование алюмината натрия:
А1С1 3 + 4NaOH (избыток) = NaA1О 2 + 3NaCl + 2Н 2 О
Алюминат натрия растворим, осадка не образуется.
Отсюда можно сделать вывод, что гидроксид алюминия можно получить только первым способом. Объясняется это амфотерными свойствами гидроксида алюминия.
4. Заключительная часть (3минуты)
Учитель :( предлагает сдать тетради, напоминает, как будет оцениваться работа). Оценка за работу будет выставляться с учетом правильности выполнения практической части работы и отчетов по ее выполнению.
( дается краткая информация по результатам наблюдений за действиями учащихся, указываются ошибки, собираются тетради, учащиеся убирают рабочее место, сдают халаты) .
Основные способы получения металлов

электрометаллургические - электролиз раствора или расплава.

Пирометал-лургически
получают : чугун, сталь, медь, свинец, никель, хром и другие металлы.
получение стали и чугуна

Гидрометаллургически получают : золото, цинк, никель и некоторые другие металлы.
Получаемые металлы: Cd, Ag, Au, Cu, Zn, Mo и др.
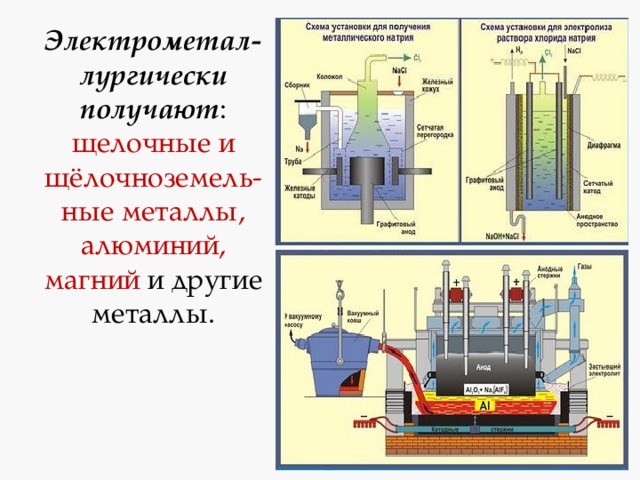
Электрометал-лургически получают : щелочные и щёлочноземель-ные металлы, алюминий, магний и другие металлы.

Общие способы получения металлов
1. Восстановление металлов из оксидов углем или угарным газом
Mе x O y + C = CO 2 + Me,
1. ZnO y + C t = CO + Zn
Mе x O y + C = CO + Me,
2. Fe 3 O 4 + 4CO t = 4CO 2 + 3Fe
3. MgO + C t = Mg + CO
Mе x O y + CO = CO 2 + Me
Не подходит для металлов, образующих карбиды с углём.
получают : Fe, Cu, Pb, Sn, Cd, Zn

2. Обжиг сульфидов с последующим восстановлением (если металл находится в руде в виде соли или основания, то последние предварительно переводят в оксид)
1 стадия –
Mе x S y +O 2 = Mе x O y +SO 2
1. 2ZnS + 3O 2 t = 2ZnO + 2SO 2 ↑
2 стадия –
Mе x O y + C = CO 2 + Me или
2. MgCO 3 t = MgO + CO 2 ↑

3 Алюмотермия ( в тех случаях, когда нельзя восстановить углём или угарным газом из-за образования карбида или гидрида )
1. 4SrO + 2Al t = Sr(AlO 2 ) 2 + 3Sr
Mе x O y + Al = Al 2 O 3 + Me
получают: Mn, Cr, Ti, Mo, W, V и др
2. 3MnO 2 + 4Al t = 3Mn + 2Al 2 O 3
3. 2Al + 3BaO t = 3Ba + Al 2 O 3 (получают барий высокой чистоты)

4. Водородотермия - для получения металлов особой чистоты
1. WO 3 + 3H 2 t = W + 3H 2 O↑
Mе x O y + H 2 = H 2 O + Me
2. MoO 3 + 3H 2 t = Mo + 3H 2 O↑
Получают металлы большей чистоты : Cu, Ni, W, Fe, Mo, Cd, Pb

Восстановление металлов электрическим током (электролиз)
А) Щелочные и щелочноземельные металлы получают в промышленности электролизом расплавов солей ( хлоридов ):
2NaCl расплав, электр. ток. 2 Na + Cl 2 ↑
CaCl 2 расплав, электр. ток. Ca + Cl 2 ↑
расплавов гидроксидов :
4NaOH расплав, электр. ток. 4Na + O 2 ↑ + 2H 2 O
(. используют изредка для Na)

Б) Алюминий в промышленности получают в результате электролиза расплава оксида алюминия в криолите Na 3 AlF 6 (из бокситов):
2Al 2 O 3 расплав в криолите, электр. ток. 4Al + 3 O 2 ↑
В) Электролиз водных растворов солей используют для получения металлов средней активности и неактивных:
2CuSO 4 +2H 2 O раствор, электр. ток. 2Cu + O 2 + 2H 2 SO 4
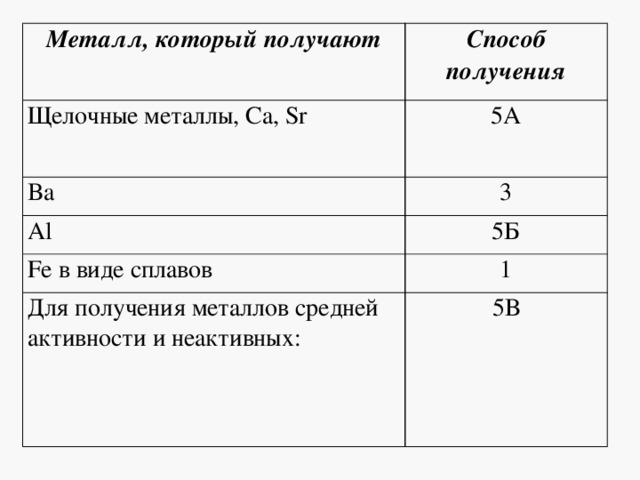
Металл, который получают
Способ получения
Щелочные металлы, Ca, Sr
Fe в виде сплавов
Для получения металлов средней активности и неактивных:

Примеры заданий по теме : «Общие способы получение металлов»
Задания с выбором ответа ( А10, А24, А29).
А1. Реакция возможна между
1) Ag и K 2 SO 4 (р-р)
3) Mg и SnCl 2 (р-р)
4) Ag и CuSO 4 (р-р)
А2. Какой из металлов вытесняет железо из сульфата железа (II)?
1) Cu 2) Zn 3) Sn 4) Hg

A3. Какой из металлов вытесняет медь из сульфата меди (II)?
1) Zn 2) Ag 3) Hg 4) Au
A4. Формула вещества, восстанавливающего оксид меди (II) - это
1) CO 2 2) H 2 3) HNO 3 4) Cl 2
A5. Формула вещества, не восстанавливающего оксид железа (III) -
1) HCl 2) Al 3) H 2 4) C

А6. Для осуществления превращений в соответствии со схемой:
Al(OH) 3 → AlCl 3 → Al необходимо последовательно использовать
1) хлор и водород
2) хлорид натрия и водород
3) хлороводород и цинк
4) соляную кислоту и калий
А7. Пирометаллургический метод получения металлов отражает реакция:
1) HgS + O 2 → Hg + SO 2
2) CuSO 4 + Fe → FeSO 4 + Cu
3) 2NaCl (ток)→ 2Na + Cl 2
4) CuSO 4 + Zn → ZnSO 4 + Cu

А8. Гидрометаллургический метод получения металлов отражает реакция:
4) AlCl 3 + 3K → Al + 3KCl
А9. В качестве восстановителя при выплавке железа в промышленности
наиболее часто используют

А10. Оксид углерода (II) проявляет восстановительные свойства при нагревании с
1) N 2 2) H 2 S 3) Fe 4) Fe 2 O 3
Задания с кратким ответом (В3)
В1. При электролизе раствора AgNO 3 на катоде выделяется
3) серебро и водород
4) кислород и водород

В2. Установите соответствие между формулой вещества и продуктом электролиза его водного раствора
ФОРМУЛА ВЕЩЕСТВА ПРОДУКТЫ ЭЛЕКТРОЛИЗА
Б) NaNO 3 2) Ag, O 2 , HF
B) Pb(NO 3 ) 2 3) H 2 , O 2
Г) NaF 4) Pb, O 2 , HNO 3
5) H 2 , NO 2 , O 2
6) NaOH, H 2 , F 2

В3. Установите соответствие между формулой вещества и продуктом электролиза его водного раствора
ФОРМУЛА ВЕЩЕСТВА ПРОДУКТЫ ЭЛЕКТРОЛИЗА ВОДНОГО РАСТВОРА ВОДНОГО РАСТВОРА
А) HgCl 2 1) металл, хлор
Б) AlCl 3 2) водород, хлор, гидроксид
В) Hg(ClO 4 ) 2 металла
Г) Na 2 SO 3 3) водород, кислород
4) металл, кислород, кислота
5) металл, сернистый газ
6) водород, сернистый газ

В4. Установите соответствие между формулой вещества и продуктом электролиза его водного раствора
А) нитрат цинка 1) цинк, кислород, азотная кислота
Б) бромид цинка 2) водород, кислород
В) бромид калия 3) водород, оксид азота (IV)
Г) нитрат калия 4) цинк, бром
5) водород, бром, гидроксид калия
7) калий, оксид азота (IV)
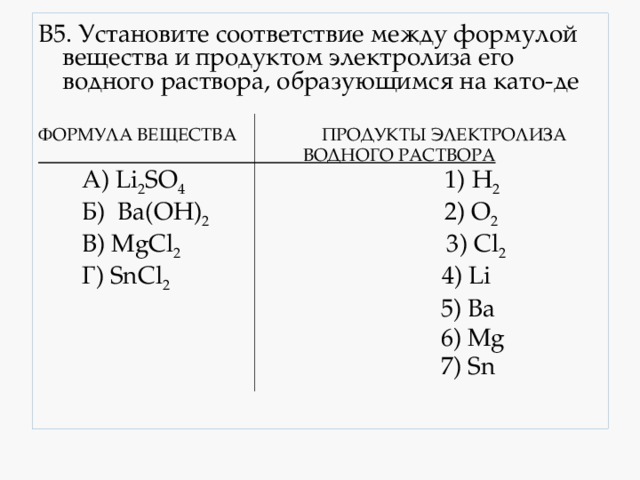
В5. Установите соответствие между формулой вещества и продуктом электролиза его водного раствора, образующимся на като-де
А) Li 2 SO 4 1) H 2
В) MgCl 2 3) Cl 2

В6. Верны ли следующие суждения о промышленных способах получения металлов?
А. В основе пирометаллургии лежит процесс восстановления металлов из руд при высоких температурах.
Б. В промышленности в качестве восстановителей используют оксид углерода (II) и кокс.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
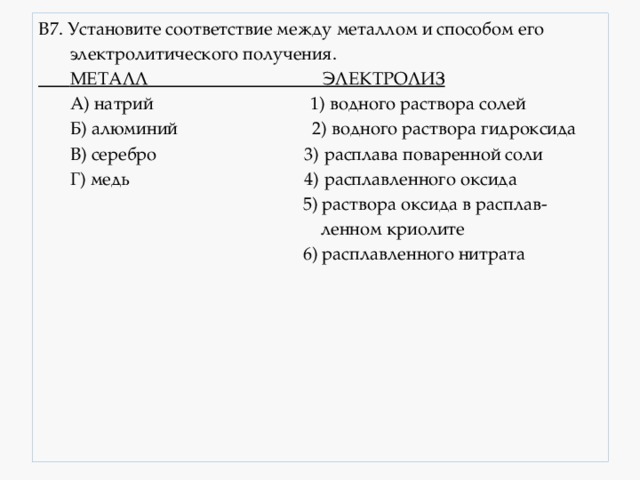
В7. Установите соответствие между металлом и способом его
А) натрий 1) водного раствора солей
Б) алюминий 2) водного раствора гидроксида
В) серебро 3) расплава поваренной соли
Г) медь 4) расплавленного оксида
5) раствора оксида в расплав-
6) расплавленного нитрата

В8. Установите соответствие между металлом и способом его электролитического получения.
А) калий 1) расплавленного нитрата
Б) магний 2) водного раствора гидроксида
В) медь 3) расплава хлорида
Г) свинец 4) расплавленного оксида
5) раствора оксида в расплавленном криолите
6) водного раствора солей

В9. Установите соответствие между металлом и способом его электролитического получения.
А) хром 1) водного раствора солей
В) литий 3) расплава соли
Г) барий 4) расплавленного оксида

Задания с развёрнутым ответом (С2)
С1. Напишите уравнения реакций, с помощью которых можно осуществить превращения:
Cu → Cu(NO 3 ) 2 → Cu(OH) 2 → Х → Сu → CuSO 4
Укажите условия протекания реакций.
C2. Даны вещества: алюминий, оксид марганца (IV), водный раствор сульфата меди и концентрированная соляная кислота.
Контрольно-измерительные материалы по теме: " Способы получения металлов" химия 9 класс
презентация составлена согласно ФГОС.Предусмотрена проверка ранее изученного материала и закрепление.
Просмотр содержимого документа
«Контрольно-измерительные материалы по теме: " Способы получения металлов" химия 9 класс»

1. Какие высказывания верны, а какие – нет:
- Металлы активно взаимодействуют с основаниями
- При взаимодействии металла с водой всегда образуется оксид.
- Щелочные металлы взаимодействуют с водой при обычных условиях
- С кислотами взаимодействуют все металлы
- Щелочные металлы не взаимодействуют с растворами кислот
2. Найдите ошибки в уравнениях реакций:

Объясните, используя знания о химических свойствах металлов, почему нельзя:
а)хранить литий на воздухе?
б)использовать для прекращения горения натрия воду.
в)хранить кислые щи в алюминиевой кастрюле.
г)готовить раствор сульфата меди в ведре, сделанном из оцинкованного железа.

«Жизнь учит тех, кто её изучает»
Д. И. Менделеев
Способы получения металлов .
Пирометаллургия.
Пирометаллургия – это получение металлов из природных руд реакциями восстановления при высокой температуре.

Получение из оксидов.
1) Восстановление углеродом.
2) Восстановление угарным газом.
Fe 2 O 3 + 3CO 2Fe + 3CO 2
Такими способами получают металлы средней активности и неактивные.

Получение из оксидов .
3) Восстановление водородом.
WO 3 + 3H 2 t W + 3H 2 O
Таким способом получают редкоземельные металлы.

Алюмотермия
4) 3MnO 2 + 4Al t 3Mn + 2Al 2 O 3
Таким способом получают Mn, Cr, Ti, Mo, W

Получение из сульфидов.
Получение происходит по схеме:
сульфиды оксиды металлы

а) 2ZnS + 3O 2 t 2ZnO + 2SO 2
б) ZnO + C t Zn + CO

Ученые, занимающиеся получением металлов .
Николай Николаевич Бекетов
Русский химик, физик.
Способствовал развитию физической химии как самостоятельной области науки.
Открыл химический процесс вытеснения металлов из растворов их солей под действием других металлов и водорода.

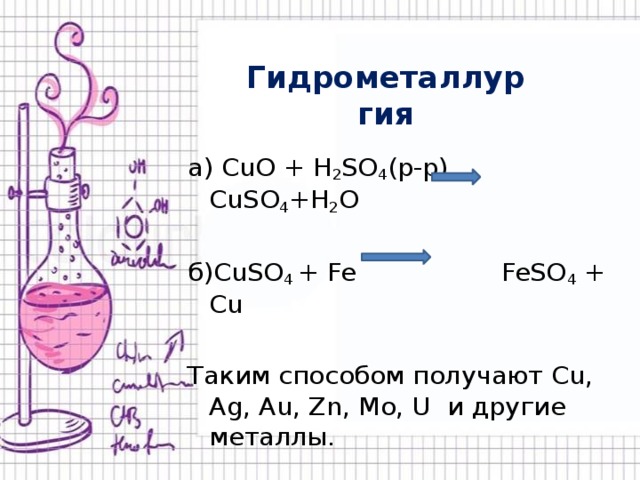
Гидрометаллургия.
получение металлов из растворов их солей.
Получение происходит по схеме:
Руда раствор соли металл
Гидрометаллургия
а) CuO + H 2 SO 4 (р-р) CuSO 4 +H 2 O
б)CuSO 4 + Fe FeSO 4 + Cu
Таким способом получают Cu, Ag, Au, Zn, Mo, U и другие металлы.

Электрометаллургия
Электрометаллургия – получение металлов с помощью электрического тока (электролиз).
2Na + Cl - Na 0 + Cl 2 0
Таким способом получают только самые активные металлы.
Ученые, занимающиеся получением металлов.
Английский химик и физик. Один из основателей электрохимии. Путем электролиза солей и щелочей получил калий, натрий, барий, кальций, амальгаму (раствор металла в ртути) стронция и магния.

Составьте уравнения реакций восстановления железа из его оксидов

Fe 2 O 3 + 2Al Al 2 O 3 + 2Fe
Fe 2 O 3 + 3H 2 3 H 2 O + 2Fe
Fe 2 O 3 +3CO 3CO 2 + 2Fe

Задание 1: Железнодорожные рельсы могут быть отремонтированы с помощью метода алюминотермии, при этом происходит следующая реакция:
Оксид железа (III) + алюминий = железо + оксид алюминия
Запишите уравнение реакции.

Задание 2: Заполните пропуски в уравнениях реакций:

Задание на дом
В начале века из Нью-Йоркского порта вышла в открытый океан красавица яхта. Ее владелец, американский миллионер, не пожалел денег. Корпус яхты был сделан из очень дорогого металла алюминия, листы которого скреплялись медными заклепками. Было очень красиво. Однако через несколько дней обшивка корпуса начала расходиться и яхта пошла ко дну. Почему?
Методическая разработка урока по химии "Общие способы получения металлов"

Методическая разработка по неорганической химии "Общие способы получения металлов"предназначена для изучения способов получения металлов: пирометаллургии,гидрометаллургии,металлотермии,электрометаллургии.На уроке используются карточки,тесты.Урок изучения нового материала.
Просмотр содержимого документа
«Методическая разработка урока по химии "Общие способы получения металлов"»
Методическая разработка урока неорганическая химия
данного на I курсе
преподавателем Анциферовой М.А.
Тема: Общие способы получения металлов
Цель: Создать условия для осознания и осмысления блока новой учебной
информации по теме «Общие способы получения металлов».
Задачи: обучающие – Способствовать запоминанию основных способов получения металлов.
- Способствовать формированию представления о металлургии, пирометаллургии, гидрометаллургии, обжиге, металлотермии.
развивающие - Способствовать обучению студентов умению выделять логические части в тексте, писать химические реакции.
воспитывающие – Показать, что взаимосвязь деятельности студента, его
интересов и знаний, их взаимодополняемость – условие успешного обучения.
Оборудование: 1 . Текст «Основные способы получения металлов»
2 . Карточки с заданиями.
3.Карта «Полезные ископаемые»
4.Карточки с тестом
5.ОК «Основные способы получения металлов» 6. Таблица «Периодическая система химических элементов Д.И.Менделеева»
7. Таблица «Растворимость солей, кислот и оснований в воде»
8. «Электрохимический ряд напряжений металлов»
9. Коллекция «Образцы минералов и руд»
Последовательность отдельных этапов урока
2. Целеполагание и мотивация
4. Первичное усвоение материала.
1) Металлы в лампочке
3)Карта «Полезные ископаемые»
5) Получение металлов
5. Осознание и осмысление учебной информации.
6. Первичное закрепление учебного материала (самостоятельная работа по карточкам)
7. Информация о домашнем задании (закончить уравнения реакций)
8. Рефлексия (подведение итогов урока)
ЛИТЕРАТУРА: 1. И.Г.Хомченко «Общая химия» М. 2013
І. Оргмомент
3. Актуализация
Повторение изученного материала
1) Где располагаются металлы в периодической системе Д.И. Менделеева?
2) Сколько электронов на внешнем электронном слое? Назовите металлы с 1ē, 2ē, 3ē электронов на внешнем слое
3) Как изменяются металлические свойства в периодах? В главных подгруппах?
4) Какой вид химической связи в металлах?
5) Какими физическими свойствами обладают металлы?
6) Как изменяются плотность металлов, температура кипения, температура плавления в периодах, главных подгруппах?
Письменная работа по карточкам
Имеется семь металлов:
Pb, Cu, Hg, Na, Au, Ag, W.
Определите эти металлы по следующим физическим характеристикам:
А) очень мягкий (режется ножом)
Б) жёлтого цвета
В) имеет матовую поверхность
Г) самый тугоплавкий
Д) жидкий при комнатной температуре
Е) красного цвета
Ж) обладает металлическим блеском и высокой электропроводностью.
Ответы: Na, Au, Pb, W, Hg, Cu, Ag.
Au, Ag, Li, Hg, Os, Cr, W.
Какой из этих металлов:
А) самый твёрдый
Б) самый легкоплавкий
В) самый тугоплавкий
Д) самый тяжёлый
Е) самый пластичный
Ж) самый теплопроводный.
Ответы: Cr, Hg, W, Li, Os, Au, Ag.
Таблица Д.И. Менделеева
Беседа с учащимися
1) Металл в лампочке
- Сколько металлов всего (88)
- Посмотрите на лампочку и скажите: Какие металлы входят в электрическую лампу накаливания?
- Как вы думаете, какие физические свойства должны были знать учёные, чтоб создать её?
- Какие металлы люди знали в древности и в средние века?
«Семь металлов создал свет по числу семи планет»
В древности и в средние века были известны только семь металлов. Это число соотносилось с числом известных тогда планет –
Под влиянием лучей этих небесных светил, учили, алхимики, в недрах Земли зарождаются и совершенствуются металлы. Каждая планета имела свой особый знак, который одновременно служил и символом металла, находящегося под её влиянием. Обычно принимают, что приведённые знаки – не что иное, как атрибуты соответствующих богов античной мифологии –
Щит и меч Марса
Но есть и другие объяснения.
- Из чего добывают металлы?
Посмотрите на карту.
3) Карта «Полезные ископаемые»
- Какие руды обозначены в условных обозначениях? Какие металлы в них?
- Где находятся железные руды, марганцевые, хромовые, никелевые?
Скопление полезных ископаемых, из которых получают металлы, называются рудными месторождениями.
Несмотря на возрастающий объём производства синтетических материалов, спрос на металлы не уменьшился. В связи с большой потребностью в металлах стоит задача выделения из соединений.
4) Наука о промышленных способах получения металлов называется металлургией.
Металлургия – чёрная (железо и его соединения), цветная (все остальные металлы).
Первый учебник по горнозаводскому делу был издан более 200 лет назад М.В.Ломоносовым. Несколько поколений русских инженеров воспитывалось на этом классическом труде.
П.П. Аносов – выдающийся металлург первой половины 19 века.
Д.К. Чернов – основоположник металлографии – науки о строении металлов и сплавов.
- В каком состоянии встречаются металлы в природе
- В самородном (Au, Pt)
- В виде соединений (соли, оксиды, сульфиды)
- Какие соли хлориды, сульфаты, карбонаты…
- Каким способом получают?
- Менее активные металлы – оксиды и сульфиды.
Почему одни металлы встречаются в самородном, а другие в виде солей (положение в электрохимическом ряду)
Читайте также:
