Взаимодействие ртути с металлами
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH - | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | - | - | Н | Н | Н | |
| F - | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | - | Н | Р | Р |
| Cl - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | - | - | - | Н | - | - | Н | - | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | - | Н | ? | Н | Н | ? | М | М | - | Н | ? | ? |
| HSO3 - | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | - | Н | Р | Р |
| HSO4 - | Р | Р | Р | Р | Р | Р | Р | Р | - | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р |
| NO2 - | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | - | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO - | Р | Р | Р | Р | Р | Р | Р | Р | Р | - | Р | Р | - | Р | Р | Р | Р | Р | Р | Р | - | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые (
Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую:
Скопируйте эту ссылку, чтобы разместить результат запроса " " на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Внимание, если вы не нашли в базе сайта нужную реакцию, вы можете добавить ее самостоятельно. На данный момент доступна упрощенная авторизация через VK. Здесь вы можете выбрать параметры отображения органических соединений. Эти параметры действуют только для верхнего изображения вещества и не применяются в реакциях.
Корректная работа сайта обеспечена на всех браузерах, кроме Internet Explorer. Если вы пользуетесь Internet Explorer, смените браузер. На сайте есть сноски двух типов: Подсказки - помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация - такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Соединения ртути
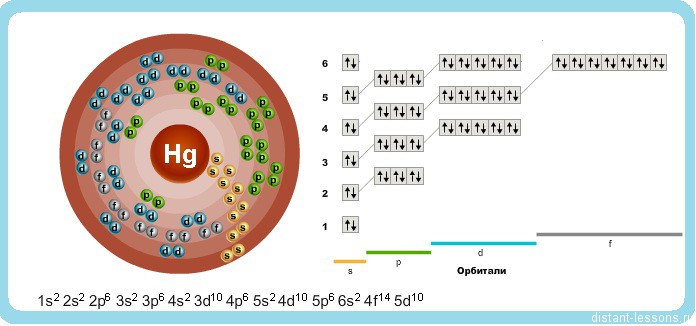
Исходя из электронного строения, можно сделать вывод, что для в соединениях ртуть будет проявлять степени окисления +2 и +1. Физические свойства ртути:
Как видите, все вышеперечисленные свойства — характеристики металлического вещества, хотя и в жидком состоянии. Химические свойства ртути: 1) Реакция с кислородом (при нагревании >300 ° С): 2Hg + O2 = 2HgO (красного цвета); 2) реагирует с водородом, но только с атомарным ( так же при нагревании): Hg + 2H = HgH2 — гидрид ртути; 3) C неметаллами ( при нагревании): Hg + S = HgS 4) Взаимодействие с кислотами: с кислотами-не окислителями не взаимодействует
В ряду активности металлов ртуть стоит после водорода, поэтому в реакциях с кислотами-окислителями водород не выделяется: Как видно из реакции, чаще всего в соединениях ртуть проявляет степень окисления + 2, но +1 тоже встречается, причем в очень необычном виде: Степень окисления Соединения ртути +1 Оксид — не выделен; Гидроксид — не выделен Катион ртути — Hg2 2+ , соответственно, соль — нитрат ртути (I) — Hg2(NO3)2 Кстати, таких соединений ртути (I) немало — смотрите таблицу растворимости: +2 Что касается соединений ртути (II), то не смотря на то, что простое вещество ртуть — металл, в веществах HgS (черные или красные кристаллы) и HgJ2 (желтые кристаллы) cвязь ковалентная. Связь ртуть-углерод в органических соединениях ртути самая прочная из всех известных металл-органических связей Соединения ртути чрезвычайно ядовиты, соответственно, как и большинство других ядов, их часто используют в медицине:
Еще на эту тему:Ввиду чрезвычайной токсичности современная медицина как лекарства соединения ртути не использует вообще. Перечисленные тутные диуретики сняты в производства в конце 60х годов, ртутные антисептики также более не используются — тем более, что в современных условиях имеется море аналогичных по эффекту, но практически нетоксичных и поэтому безопасных синтетических веществ. Ртуть – особенности, сферы применения и чем опасен жидкий металлИстория этого вещества накрепко связана со средневековыми алхимиками и китайскими даосами, искавшими эликсир (или пилюли) бессмертия. Ртуть есть в каждом доме, хотя весьма опасна. Что представляет собойРтуть – элемент периодической системы Менделеева №80. Международное обозначение – Hydrargyrum (Hg). Относится к металлам переходного типа. То есть сочетает характеристики жидкого и твердого вещества.
Жидкая ртуть в ампуле В стандартных условиях это массивная серебристо-белая жидкость с металлическим блеском.
По составу металл ртуть – это конгломерат из семи стабильных изотопов. Еще четыре десятка радиоактивных изотопов созданы человеком. ИсторияВ ртути обнаруживается примесь серебра и золота. Наверное, поэтому европейские алхимики эпохи Средневековья сделали ее одним из компонентов процедуры Великого Делания. То есть превращения простых металлов в золото либо серебро. Древний мирРтуть как жидкое серебро упоминается Теофрастом и Аристотелем. Описана технология получения металла древними греками путем нагрева киновари с углем. Однако на Востоке она была известна с XV века до нашей эры как один из семи священных металлов. Египтяне и китайцы также получали ее из киновари. Это был исходник для получения «пилюль бессмертия». Россия, ЕвропаНаучные опыты с веществом датируются серединой 18 века. Шведский химик Георг Брандт выделил чистую ртуть и описал процесс. Спустя 24 года российские ученые Михаил Ломоносов и Иосиф Браун получили твердое вещество. Попутно выявили свойства, присущие металлу (электропроводность в любом виде, ковкость).
Планета Меркурий (проявление ртути) в виде врача с лекарством. Миниатюра XV в НазваниеИстория латинских названий ртути связана с представлениями европейцев об этом металле:
Славянские корни термина «ртуть» восходят к слову «руда». Оно обозначало все красное – цвет, кровь, краску.
Физико-химические характеристикиГлавная особенность ртути, обусловленная структурой атома, – запредельный потенциал ионизации. Отсюда свойства вещества:
Поэтому классифицируется как легкоплавкий металл. Плотность ртути при нормальных условиях — 13 546 кг/м3, при других температурах — в таблице:
Технология полученияСпособы получения ртути не изменились со времен Средневековья. На предприятиях все так же обжигают киноварь (то есть сульфид ртути).
Месторождения, добычаРтутные месторождения планеты исчисляются поштучно: В природе выявлено два десятка ртутных минералов, однако промышленный интерес представляет только киноварь (сульфид с содержанием ртути 86%). Иногда рентабельна добыча самородной ртути и шватцита (до 17%).
Присутствие в природеПочти всегда вещество представлено в виде руды. Самые богатые ртутные руды содержат до 2,5% ртути. Наиболее богаты ртутью породы осадочного происхождения (особенно глинистые сланцы) – до 200 мг/т. Вдвое беднее продукты вулканизма.
Пары ртути ядовиты. Их выброс в атмосферу – «заслуга» вулканов и человека в равной мере. Люди создают такие осадки, эксплуатируя ТЭЦ, добывая золото, выплавляя цветные металлы, производя цемент, соду, утилизируя мусор. Где используетсяТрадиционная сфера применения жидкого металла – термометры всех видов и назначения. Это и домашние градусники для измерения температуры тела, и высокоточные аппараты для специальных целей. Например, барометры и манометры.
Без ртути невозможна работа серьезных отраслей.
Переливание ртути из сосуда в сосуд Промышленный комплексМеталл и его соединения применяются промышленниками и военными:
Ртутные соединения применялись при выделке фетра. Это было опасно для здоровья работников, отсюда, вероятно, пошли легенды о «сумасшедшем шляпнике». Другие сферыДо середины ХХ века ртутные соединения использовались медициной как материал зубных пломб, слабительное, антисептики, препарат для изничтожения вшей и лечения сифилиса. Сегодня ртуть закачивают лишь в термометры (по 2 г), добавляют микродозами в вакцины.
ПредостережениеДаже микродозы ртути при попадании в организм способны сделать человека инвалидом:
Содержание вещества регулируется санитарными нормами. Предельно допустимые концентрации в населенных пунктах или жилых помещениях – 0,0003 мг на кубометр. Если разбился градусникЕсли домашний градусник разбился, действовать нужно осторожно:
Шарики испаряются быстро. Поэтому демеркуризацию (очистку пространства от ртути) нужно проводить не мешкая. РТУТЬ — «кровь дракона» в лампах и реакторахУдивительный жидкий металл, который так любили алхимики и называли его «кровь дракона», «меркурий», живое или жидкое серебро. Может, не так неправы были алхимики, когда стремилась превратить «живое серебро» в золото. Ведь в таблице Менделеева элементы ртуть и золото стоят рядом. Их атомные структуры различаются всего на один электрон. Философский камень в пиаре ртутиИстория ртути неразрывно связана с развитием алхимии. Ученые упорно искали «философский камень», способный превращать любой металл в золото. В этих исследованиях они истратили тонны ртути. Философского камня не нашли, но очень продвинули вперед минералогию, химию и многие смежные науки.
Познавательно: Торричелли, ученик Галилея, изобрел ртутный барометр. Прибор настолько точен, что им до сих пор оборудуют метеостанции, по нему проверяют работу других барометров. СвойстваРтуть — удивительный элемент. Он относится к металлам, но при нормальных условиях представляет собой тяжелую жидкость. «Живое серебро» — металл малоактивный, в реакции с растворами кислот не вступает, но с царской водкой реагирует, как и с азотной и серной кислотами. Характеристики ртути вызывают удивление: При взаимодействии ртути с металлами жидкий металл образует двухъядерные катионы (Hg22+). Это редчайшее для металлов свойство. Этот легкоплавкий металл при замораживании всего до 39°С затвердевает. Из него можно даже сковать колечко, но носить его не получится — на пальце металл «растает».
Металл имеет высокую плотность — 13,5 г/см3. Ведро, с налитой в него ртутью, не под силу поднять человеку — настолько оно тяжелое.
Плотность ртути при нормальных условиях — 13 546 кг/м3, при других температурах — в таблице ниже:
МесторожденияУникальное, старейшее и крупнейшее в мире месторождение ртутных руд находится в Испании, в местности Альмаден. Добычу жидкого серебра там вели еще до новой эры.
Кроме этого, запасами ртути обладают:
Самородная ртуть происхождением из киноварных руд. Рассказ И. Ефремова «Озеро горных духов» получил неожиданное продолжение. В 2018 году на Аляске, под вечной мерзлотой обнаружили огромное озеро ртути. Ее там больше, чем общих запасов жидкого металла на планете. Пока мерзлота держит металл, опасности нет. Стоит растаять льдам — «живое смертоносное серебро» попадет в океан. Это будет глобальная экологическая катастрофа, а возможно, и конец жизни на Земле. ПрименениеРтуть широко применяется в разных сферах жизни:
В первых реакторах на БН (быстрых нейтронах) теплоносителем была ртуть. Познавательно: в прошлом веке ртуть использовали в манометрах и барометрах. Поэтому долгое время давление измеряли в миллиметрах ртутного столба. Польза «крови дракона» несомненна в разных отраслях промышленности. Однако она перечеркивается высокой токсичностью металла и его соединений.
Жидкое серебро в нашем домеПочти в каждом доме есть ртутный градусник, и разбить его очень просто. Ртуть окажется на полу, это создаст опасность для здоровья. Как правильно собрать шарики ртути:
Нельзя собирать разлившийся металл веником или пылесосом. Познавательно: если вы купили термометр, а в нем красная жидкость — не думайте, что это легендарная красная ртуть. Это просто спиртовой, а не ртутный термометр. Почем «кровь дракона»Цена металлической ртути от 5 тыс. рублей за килограмм. Соединения ртути имеют разную цену в зависимости от чистоты. ЧДА (чистый для анализа) — самые дорогие.
Мне 42 года и я специалист в области минералогии. Здесь на сайте я делюсь информацией про камни и их свойства — задавайте вопросы и пишите комментарии! Читайте также:
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||