Взаимодействие металлов с неметаллами а также с растворами солей и растворами кислот
Цель урока: познакомить учащихся с химическими свойствами металлов, рассмотреть ряд активности (электрохимический ряд напряжений) металлов, развивать умение наблюдать, сравнивать, анализировать, делать предположения и выводы; воспитывать ответственное отношение к учебе.
Задачи урока:
Образовательные:
- рассмотреть химическую активность металлов исходя из положения в периодической таблице Д.И. Менделеева и в электрохимическом ряду напряжения металлов;
- рассмотреть химические свойства металлов.
Развивающие:
- развивать умения составлять уравнения реакций в соответствие с химическими свойствами металлов.
Воспитательные:
- воспитывать интерес к предмету, формировать навыки поведения в коллективном и индивидуальном учебном труде.
Планируемые результаты
- знать химические свойства металлов;
- уметь составлять уравнения реакций в соответствие с химическими свойствами металлов.
- формировать уважительное отношение к чужому мнению;
- формировать ответственное отношение к учению.
Метапредметные:
Коммуникативные:
- уметь слушать собеседника и вести диалог; уметь признавать возможность существования различных точек зрения.
Регулятивные:
- продолжить развитие умения планировать и регулировать свою деятельность, самостоятельно планировать пути достижения цели.
Познавательные:
- умение определять понятия, устанавливать аналогии, строить логические заключения и делать выводы.
Тип урока: урок изучения нового материала
I Организационный момент
II Актуализация опорных знаний учащихся
1.Дайте определение реакции замещения. (Реакция замещения – это реакция между простым и сложным веществом, в результате которой атомы простого вещества замещают один из атомов в сложном веществе)
2.Какие реакции с участием металлов вам известны? (Взаимодействие металлов с растворами кислот, с солями менее активных металлов)
3.Какие реакции замещения лежат в основе реакций получения металлов? (Взаимодействие оксидов металлов с водородом, углем, алюминием, оксидом углерода( II ))
4.Являются ли реакции замещения ОВР? (Все реакции замещения являются ОВР)
5.Окислителями или восстановителями являются металлы в реакциях замещения? (Металлы являются восстановителями)
IV Мотивация учебной деятельности
Из курса химии 8 класса вы уже знаете, что металлы отличаются по своей активности, и знаете химические свойства классов неорганических соединений. Но все ли химические свойства металлов вам известны? Как вы считаете, какова цель нашего урока?
V Изложение нового материала
Химические свойства металлов
По своим химическим свойствам все металлы являются восстановителями, все они сравнительно легко отдают валентные электроны, переходят в положительно заряженные ионы, то есть окисляются. Восстановительную активность металла в химических реакциях, протекающих в водных растворах, отражает его положение в электрохимическом ряду напряжений металлов (Открыл и составил Н.Н.Бекетов)
Чем левее стоит металл в электрохимическом ряду напряжений металлов, тем более сильным восстановителем он является, самый сильный восстановитель – металлический литий, золото – самый слабый, и, наоборот, ион золото (III) – самый сильный окислитель, литий (I) – самый слабый.
Каждый металл способен восстанавливать из солей в растворе те металлы, которые стоят в ряду напряжений после него, например, железо может вытеснять медь из растворов ее солей. Однако следует помнить, что металлы щелочных и щелочно - земельных металлов будут взаимодействовать непосредственно с водой.
Металлы, стоящие в ряду напряжений левее водорода, способны вытеснять его из растворов разбавленных кислот, при этом растворяться в них.
Восстановительная активность металла не всегда соответствует его положению в периодической системе, потому что при определении места металла в ряду учитывается не только его способность отдавать электроны, но и энергия, которая затрачивается на разрушение кристаллической решетки металла, а также энергия, затрачиваемая на гидратацию ионов.
Физкультминутка
Чтобы голова не болела,
Ей вращаем вправо-влево. (Вращение головой)
А теперь руками крутим –
И для них разминка будет. ( Вращение прямых рук вперед и назад)
Тянем наши ручки к небу,
В стороны разводим. (Потягивания – руки вверх и в стороны)
Плавно производим. (Повороты туловища влево и вправо)
Достаем руками пол. ( Наклоны вперед)
Потянули плечи, спинки,
А теперь конец разминке. (Дети садятся)
I Взаимодействие с простыми веществами - неметаллами
1.С кислородом большинство металлов образует оксиды – амфотерные и основные:
Щелочные металлы, за исключением лития, образуют пероксиды:
2.С галогенами металлы образуют соли галогеноводородных кислот – галогениды:
3.С водородом самые активные металлы образуют ионные гидриды – солеподобные вещества, в которых водород имеет степень окисления -1.
4.С серой металлы образуют сульфиды:
5.С азотом некоторые металлы образуют нитриды, реакция практически всегда протекает при нагревании:
6.С углеродом образуются карбиды:
7.С фосфором – фосфиды:
II Взаимодействие со сложными веществами
1.Взаимодействие металлов с растворами кислот
Металлы, расположенные в ряду активности левее водорода взаимодействуют с растворами кислот по схеме:
Me + Hx КО → Ме x( КО )y + H2↑
2 Al + 6 HCl → 2 AlCl3 + 3 H2↑
2│Al 0 – 3e - → Al 3+ - окисление
3│2H + + 2e - → H2 – восстановление
2.Взаимодействие с водой
А) Щелочные и щелочно – земельные металлы (до Mg ) взаимодействуют с водой по схеме:
Б) Металлы от Mg до Pb взаимодействуют с водой по схеме:
Me + H 2 O → Me х O у + H 2 ↑
Металлы, стоящие в ряду активности после водорода с водой не взаимодействуют.
3. Взаимодействие металлов с солями менее активных металлов
Взаимодействие металлов с растворами солей.
В 1 пробирку налейте 2 – 3 мл раствора нитрата серебра ( I ), во 2 – 2 – 3 мл раствора сульфата меди ( II ), а в 3 – столько же раствора нитрата алюминия. В 1 пробирку положите тонкую медную проволоку, во 2 – стружку железа, а в 3 – медные стружки.
В 1 пробирке выпало серебро, во 2 пробирке выпала медь, в 3 пробирке ничего не произошло.
Вывод: металлы вытесняют только менее активные металлы из их солей.
VI Закрепление
1. Решите тестовые задания
1.Выберите группу элементов, в которой находятся только металлы:
А) Al, As, P; Б) Mg, Ca, Si; В) K, Ca, Pb
2. Укажите общее в строении атомов K и Li:
А) 2 электрона на последнем электронном слое;
Б) 1 электрон на последнем электронном слое;
В) одинаковое число электронных слоев.
3 . Металлический кальций проявляет свойства:
В) окислителя или восстановителя в зависимости от условий.
4. Металлические свойства натрия слабее, чем у –
А) магния; Б) калия; В) лития.
6. К неактивным металлам относятся:
А) алюминий, медь, цинк; Б) ртуть, серебро, медь;
В) кальций, бериллий, серебро.
2. Закончить уравнения практически осуществимых реакций, назвать продукты реакции
VII Домашнее задание
§ 41, выполнить упр. 2 стр. 14 8
VIII Рефлексия:
C какими трудностями вы столкнулись при изучении этой темы, и как вы решили эту проблему?
Взаимодействие металлов с простыми веществами — неметаллами
Более 80% известных элементов образуют простые вещества — металлы. К ним относятся s-элементы I и II групп (исключение — водород), все d- и f - элементы, а также р-элементы III группы (кроме бора), IV группы (олово, свинец), V группы cурьма, висмут) и VI группы (полоний).
Особенности строения атомов металлов:
♦ небольшое число электронов на внешнем энергетическом уровне (как правило, один-три электрона). Исключение — атомы р-элементов IV-VI групп;
♦ малые заряды ядер и большие радиусы атомов по сравнению с атомами неметаллов данного периода;
♦ сравнительно слабая связь валентных электронов с ядром;
♦ низкие значения электроотрицательности.
В связи с этим атомы металлов легко отдают валентные электроны и превращаются в положительно заряженные ионы, т. е. металлы - восстановители.
Однако способность отдавать электроны проявляется у металлов неодинаково. В периодах с увеличением зарядов ядер атомов уменьшаются их радиусы, увеличивается число электронов на внешнем уровне и усиливается связь валентных электронов с ядром. Поэтому в периодах слева направо восстановительная способностъ атомов металлов уменьшается.
В главных подгруппах с возрастанием атомных номеров элементов увеличиваются радиусы их атомов и уменьшается притяжение (валентных электронов к ядру. Поэтому в главных подгруппах сверху вниз восстановительная активность атомов металлов возрастает. Следовательно, наиболее активными восстановителями являются щелочные и щелочно-земельные металлы.
Только некоторые металлы (золото, платина) находятся в природе в виде простых веществ (в самородном состоянии). Металлы, расположенные в электрохимическом ряду напряжений между оловом и золотом, встречаются как в виде простых веществ, так и в составе соединений. Большинство же металлов находятся в природе в виде соединений — оксидов, сульфидов, карбонатов и т. д. Распространенность металлов в природе уменьшается в ряду:
Al, Fe, Ca, Na, К, Mg, Ti, Mn, Cr, Ni, Zn, Cu, Sn, Pb, W, Hg, Ag. Аu
Содержание в земной коре (массовая доля, %) уменьшается
Получение металлов из их соединений — задача металлургии. Металлургия — наука о промышленном получении металлов из природного сырья. Различают черную (производство железа и его сплавов) и цветную (производство всех остальных металлов сплавов) металлургию. Любой металлургический процесс является процессом восстановления ионов металла различными восстановителями:
Me n + + пе - = Me
В зависимости от условий проведения процесса восстановления различают несколько способов получения металлов.
Физические свойства металлов
Все металлы обладают металлической кристаллической решеткой, особенности которой определяют их общие физические и механические свойства.
Общие свойства металлов:
1).Все металлы являются твердыми веществами, за исключением ртути.
2). Металлический блески непрозрачность металлов — результат отражения световых лучей.
3). Электро- и теплопроводность обусловлены наличием в металлических решетках свободных электронов.
С повышением температуры электропроводность металлов уменьшается, а с понижением температуры — увеличивается. Около абсолютного нуля для многих металлов характерно явление сверхпроводимости.
4). Металлы обладают ковкостью и пластичностью. По определению М. В. Ломоносова, «металлом называется светлое тело, которое ковать можно». Металлы легко прокатываются в листы, вытягиваются в проволоку, поддаются ковке, штамповке, прессованию.
Специфические физические свойства металлов:
1). по значению плотности металлы делят на легкие (плотность меньше 5 г/см 3 ): Na, Са, Mg, Al, Ti — и тяжелые (плотность больше 5 г/см 3 ): Zn, Cr, Sn, Mn, Ni, Сu, Ag, Pb, Hg, Аи, W, Os -самый тяжелый;
2). по значению температуры плавления — на легкоплавкие (tпл < 1000 °С): Hg, Na, Sn, Pb, Zn, Mg, Al, Ca, Ag — и тугоплавкие (tпл > 1000 °C): Au, Cu, Mn, Ni, Fe, Ti, Cr, Os, W - самый тугоплавкий;
3). из металлов самые мягкие — щелочные (их можно резать ножом), самый твердый — хром (царапает стекло).
4). по отношению к магнитным полям металлы подразделяют на три группы:
а) ферромагнитные — способны намагничиваться под действием даже слабых магнитных полей (Fe, Со, Ni);
б) парамагнитные — проявляют слабую способность к намагничиванию даже в сильных магнитных полях (Al, Cr, Ti);
в) диамагнитные — не притягиваются к магниту (Sn, Сu, Bi).
Химические свойства металлов
Если атомы большинства неметаллов могут как отдавать, так и присоединять электроны, проявляя окислительно-восстановительную двойственность, то атомы металлов способны только отдавать валентные электроны, проявляя восстановительные свойства: Me - пе - = Me п+ (окисление)
Как восстановители металлы взаимодействуют с неметаллами, водой, растворами щелочей, кислот и солей.
Взаимодействие металлов с простыми веществами — неметаллами
Металлы при определенных условиях взаимодействуют с неметаллами, например с кислородом образуют оксиды:
Из щелочных металлов только литий сгорает на воздухе с образованием оксида:
Основной продукт окисления натрия — пероксид:
При горении других щелочных металлов образуются супероксиды, например:
Оксиды натрия и калия могут быть получены при нагревании смеси пероксида с избытком металла в отсутствие кислорода:
На реакции пероксида натрия с оксидом углерода (1V) основана регенерация воздуха в изолированных помещениях (например, на подводных лодках):
При нагревании металлы реагируют с другими неметаллами:
| Mg + Br2 = MgBr2 | 4А1 + 3С = А14С3 |
| бромид | карбид |
| магния | алюминия |
| 2А1 + N2 = 2A1N | 3Fe + С = Fe3C |
| нитрид | карбид |
| алюминия | железа |
| 3Са + 2Р = Са3Р2 | Са + 2С = СаС2 |
| фосфид | карбид |
| кальция | кальция |
| Сu + S = CuS | 2Mg + Si = Mg2Si |
| сульфид | силицид |
Если металл проявляет переменную степень окисления, то активные неметаллы (фтор, хлор, бром, кислород) окисляют его до более высокой степени окисления, в которой он образует устойчивое в данных условиях соединение, а менее активные — до более низкой степени окисления. Так, железо проявляет в соединениях степени окисления +2 и +3 (иногда +6), из них +3 наиболее устойчива. В связи с этим при взаимодействии железа с хлором, бромом оно окисляется до степени окисления +3, а при взаимодействии с серой или иодом — до степени окисления +2:
2Fe + ЗС12 = 2 FeCl3 Fe + S = FeS
Щелочные и щелочно-земельные металлы при нагревании вступают в реакцию с водородом, образуя гидриды. Атомы водорода в данных соединениях имеют отрицательную степень окисления:
Гидриды представляют собой кристаллические тугоплавкие солеобразные вещества белого цвета. Они активные восстановители за счет водорода в минимальной степени окисления (-1). Так, гидриды горят в атмосфере хлора, кислорода, энергично разлагаются водой с образованием щелочи и выделением водорода:
Гидриды применяют для получения водорода в полевых условиях (для водородной сварки), восстановления металлов из ихоксидов, а также в органическом синтезе.
Химические свойства металлов
Металлы занимают в Периодической таблице левый нижний угол. Металлы относятся к семействам s-элементов, d-элементов, f-элементов и частично – р-элементов.
Самым типичным свойством металлов является их способность отдавать электроны и переходить в положительно заряженные ионы. Причём металлы могут проявлять только положительную степень окисления.
1. Взаимодействие металлов с неметаллами.
а) Взаимодействие металлов с водородом.
С водородом непосредственно реагируют щелочные и щелочноземельные металлы, образуя гидриды.
Например:
Образуются нестехиометрические соединения с ионной кристаллической структурой.
б) Взаимодействие металлов с кислородом.
Все металлы за исключением Au, Ag, Pt окисляются кислородом воздуха.
Пример:
в) Взаимодействие металлов с галогенами.
Все металлы реагируют с галогенами с образованием галогенидов.
Пример:
В основном это ионные соединения: MeHaln
г) Взаимодействие металлов с азотом.
С азотом взаимодействуют щелочные и щелочноземельные металлы.
д) Взаимодействие металлов с углеродом.
Соединения металлов и углерода – карбиды. Они образуются при взаимодействии расплавов с углеродом. Активные металлы образуют с углеродом стехиометрические соединения:
Металлы – d-элементы образуют соединения нестехиометрического состава типа твердых растворов: WC, ZnC, TiC – используются для получения сверхтвёрдых сталей.
2. Взаимодействие металлов с водой.
С водой реагируют металлы, имеющие более отрицательный потенциал, чем окислительно-восстановительный потенциал воды.
Активные металлы более активно реагируют с водой, разлагая воду с выделением водорода.
Менее активные металлы медленно разлагают воду и процесс тормозится из-за образования нерастворимых веществ.
3. Взаимодействие металлов с растворами солей.
Такая реакция возможна, если реагирующий металл активнее, чем находящийся в соли:
Металл, обладающий более отрицательным или менее положительным стандартным электродным потенциалом, вытесняет другой металл из раствора его соли.
4. Взаимодействие металлов с растворами щелочей.
Со щелочами могут взаимодействовать металлы, дающие амфотерные гидрооксиды или обладающие высокими степенями окисления в присутствии сильных окислителей. При взаимодействии металлов с растворами щелочей, окислителем является вода.
1 Zn 0 + 4OH – – 2e = [Zn(OH)4] 2– окисление
Zn 0 – восстановитель
1 2H2O + 2e = H2 + 2OH – восстановление
Металлы, обладающие высокими степенями окисления, могут взаимодействовать со щелочами при сплавлении:
5. Взаимодействие металлов с кислотами.
Это сложные реакции, продукты взаимодействия зависят от активности металла, от вида и концентрации кислоты и от температуры.
По активности металлы условно делятся на активные, средней активности и малоактивные.
Кислоты условно делятся на 2 группы:
I группа – кислоты, обладающие невысокой окислительной способностью: HCl, HI, HBr, H2SO4(разб.), H3PO4, H2S, окислитель здесь H + . При взаимодействии с металлами выделяется кислород (H2↑). С кислотами первой группы реагируют металлы, обладающие отрицательным электродным потенциалом.
II группа – кислоты, обладающие высокой окислительной способностью: H2SO4(конц.), HNO3(разб.), HNO3(конц.). В этих кислотах окислителями являются анионы кислоты: . Продукты восстановления аниона могут быть самыми разнообразными и зависят от активности металла.
H2S↑ – c активными металлами
H2SO4 +6е S 0 ↓ – с металлами средней активности
SO2↑ – c малоактивными металлами
HNO3 +4,5e N2O, N2 – с металлами средней активности
NO – c малоактивными металлами
HNO3(конц.) – NO2↑ – c металлами любой активности.
Если металлы обладают переменной валентностью, то с кислотами I группы металлы приобретают низшую положительную степень окисления: Fe → Fe 2+ , Cr → Cr 2+ . При взаимодействии с кислотами II группы – степень окисления +3: Fe → Fe 3+ , Cr → Cr 3+ , при этом никогда не выделяется водород.
Некоторые металлы (Fe, Cr, Al, Ti, Ni и др.) в растворах сильных кислот, окисляясь, покрываются плотной оксидной плёнкой, которая защищает металл от дальнейшего растворения (пассивация), но при нагревании оксидная плёнка растворяется, и реакция идёт.
Малорастворимые металлы, обладающие положительным электродным потенциалом, могут растворяться в кислотах I группы, в присутствии сильных окислителей.
Общие химические свойства металлов
В химических реакциях металлы выступают в роли восстановителейи повышают степень окисления, превращаясь из простых веществ в катионы.
Химические свойства металлов различаются в зависимости от химической активности металла. По активности в водных растворах металлы расположены в ряд напряжений.

В этот ряд, составленный русским химиком Н.Н. Бекетовым, включен также неметалл водород. Активность металлов убывает слева направо:
Запомнить! Металлы, стоящие в ЭХ ряду после водорода, называют неактивными металлами.
Металлы, расположенные в ЭХ ряду до алюминия называют сильноактивными или активными металлами.
Общие химические свойства металлов
1) Многие металлы вступают в реакцию с типичными неметаллами – галогенами, кислородом, серой. При этом образуются соответственно хлориды, оксиды, сульфиды и другие бинарные соединения:
- с азотом некоторые металлы образуют нитриды, реакция практически всегда протекает при нагревании;
- с серой металлы образуют сульфиды – соли сероводородной кислоты;
- с водородом самые активные металлы образуют ионные гидриды (бинарные соединения, в которых водород имеет степень окисления -1);
- с кислородом большинство металлов образует оксиды – амфотерные и основные. Основной продукт горения натрия - пероксид Na2O2; а калий и цезий горят с образованием надпероксидов MeO2.
2) Следует обратить внимание на особенности взаимодействие металлов с водой:
- Активные металлы, находящиеся в ряду активности металлов до Mg (включительно), реагируют с водой с образованием щелочей и водорода:Ca+2H2O=Ca(OH)2+H2↑
- Активные металлы (например, натрий и литий), взаимодействуют с водой со взрывом.
- Металлы средней активности окисляются водой при нагревании до оксида:
- Неактивные металлы (Au, Ag, Pt) - не реагируют с водой.
→[Li……Mg]MOH+H2↑ активные металлы (до Al)
H2O+M→[Al……PbMxOy+H2↑ среднеактивные металлы (от Al до H), только при нагревании
→[Bi……Au]≠ неактивные металлы (после Н)
Более подробно взаимодействие металлов с водой рассмотрено в темах, посвященных химии отдельных групп.
3) С разбавленными кислотами реагируют металлы, стоящие в ЭХР до водорода: происходит реакция замещения с образованием соли и газообразного водорода. При этом кислота проявляет окислительные свойства за счет наличия катиона водорода:
4) Взаимодействие азотной кислоты (любой концентрации) и концентрированной серной кислоты протекает с образованием других продуктов: кроме соли и водорода в этих реакциях выделяется продукт восстановления серной (или азотной) кислоты. Подробнее см.тему "Взаимодействие азотной кислоты с металлами и неметаллами.
Запомнить! Все металлы, стоящие в ряду левее водорода, вытесняют его из разбавленных кислот, а металлы, расположенные справа от водорода, с растворами кислот не реагируют (азотная кислота – исключение).
5) Активность металлов также влияет на возможность протекания простого вещества металлас оксидом или солью другого металла. Металл вытесняет из солей менее активные металлы, стоящие правее его в ряду напряжений.
Запомнить! Для протекания реакции между металлом и солью другого требуется, чтобы соли, как вступающие в реакцию, так и образующиеся в ходе нее, были растворимы в воде. Металл вытесняет из соли только более слабый металл.
Например, для вытеснения меди из водного раствора сульфата меди подходит железо,
но не подходят свинец – так как он образует нерастворимый сульфат. Если опустить кусочек свинца в раствор сульфата меди, то с поверхности металла покроется тонким слоем сульфата, и реакция прекратится
Другой пример: цинк легко вытесняет серебро из раствора нитрата серебра, однако реакция цинка со взвесью сульфида серебра, нерастворимого в воде, практически не протекает.
Практическое занятие № 4. Взаимодействие металлов с растворами кислот и солей

Учебная цель: обобщить знания о металлах и их свойствах.
Образовательные результаты, заявленные во ФГОС третьего поколения:
Обучающийся должен знать:
- строение атомов металлов и неметаллов, как это отражается на их окислительно-восстановительных свойства;
- понятие металлической связи; типы кристаллических решеток разных металлов;
- зависимость физических свойств металлов от их строения;
- распространенность металлов в природе в зависимости от их активности.
Обучающийся должен уметь:
- характеризировать металлы малых и больших периодов по их положению в периодической системе Д.И. Менделеева;
- устанавливать связь между строением веществ и их свойствами.
Просмотр содержимого документа
«Практическое занятие № 4. Взаимодействие металлов с растворами кислот и солей»
Задачи практического занятия:
Закрепить теоретические знания о свойствах металлов.
Ответить на вопросы для закрепления теоретического материала.
Выполнить практические задачи.
Ответить на вопросы для контроля.
Обеспеченность занятия:
Габриелян О.С. и др. Естествознание. Химия: учебник для студентов профессиональных образовательных организаций, осваивающих профессии и специальности СПО. – М., 2017.
Периодическая система химических элементов им. Д.И. Менделеева;
Ряд стандартных электродных потенциалов Е 0 ;
Типы кристаллических решеток металлов.
Ряд напряженности металлов.
Тетрадь для практических и контрольных работ.
Краткие теоретические и учебно-методические материалы по теме практического занятия
Металлы – группа элементов, в виде простых веществ, обладающих характерными металлическими свойствами, такими, как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность, ковкость и металлический блеск.
Свойства металлов, обусловлены наличием в их кристаллической решетке большого числа свободных электронов.
Обычно металлы применяют в виде сплавов. Металлический сплав представляет собой вещество, обладающее свойствами металлов и получаемое в результате взаимодействия двух или нескольких элементов.
Все металлы и сплавы можно разделить на черные (железо и сплавы на его основе) и цветные (все остальные металлы и сплавы).
К физическим свойствам металлов относят плотность, температуру плавления, цвет, блеск, непрозрачность, теплопроводность, электропроводность, тепловое расширение. По плотности металлы разделяют на легкие (до 3000 кг/м 3 ) и тяжелые (от 6000 кг/м 3 и выше); по температуре плавления – на легкоплавкие (до 973 К) и тугоплавкие (свыше 1173 К). Каждый металл или сплав обладает определенным, присущим ему цветом.
Из химических свойств металлов и их сплавов наиболее важными в производстве художественных изделий являются растворение (взаимодействие с кислотами и щелочами) и окисление (антикоррозийная стойкость, т.е. стойкость к воздействию окружающей среды – газов, воды и т.д.).
Общее химическое свойство, присущее металлам, – способность отдавать свои электроны в химических реакциях:
Мерой прочности связи электронов в атомах является энергия ионизации. Наименьшая энергия ионизации – у щелочных металлов, являющихся энергичными восстановителями. Восстановительными свойствами металлов обусловлена их способность реагировать с различными окислителями: неметаллами, кислотами, солями менее активных металлов.
По степени легкости отдачи электронов в растворах металлы располагают в ряд – ряд стандартных электродных потенциалов Е 0 (приложение 4).
Ряд стандартных электродных потенциалов справедлив для окислительно-восстановительных процессов, происходящих только в водной среде.
Металлы взаимодействуют с неметаллами (обычно при нагревании):
Названия бинарных соединений металлов с неметаллами оканчиваются на -ид. Чем более электроотрицателен элемент, тем он сильнее окисляет металл. Например, железо в реакции соединения с хлором окисляется до степени окисления +3, а с серой до +2.
Важные химические свойства металлов проявляются в их отношении к воде, растворам кислот, щелочам, солям. При рассмотрении взаимодействия металлов с кислотами необходимо учитывать концентрацию кислот и активность металлов.
Щелочи взаимодействуют только с металлами, оксиды которых проявляют амфотерный характер.
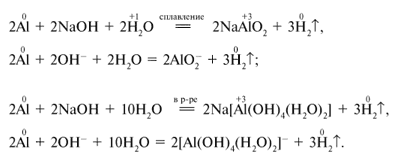
Более активные металлы вытесняют менее активные из растворов их солей.
Все металлы, затвердевающие в нормальных условиях, представляют собой кристаллические вещества, то есть укладка атомов в них характеризуется определённым порядком – периодичностью, как по различным направлениям, так и по различным плоскостям. Этот порядок определяется понятием кристаллическая решетка.
Другими словами, кристаллическая решетка – это воображаемая пространственная решетка, в узлах которой располагаются частицы, образующие твердое тело.
Элементарная ячейка – элемент объема из минимального числа атомов, многократным переносом которого в пространстве можно построить весь кристалл.
Элементарная ячейка характеризует особенности строения кристалла.
В металлических материалах, как правило, формируются три типа кристаллических решеток: объемноцентрированная кубическая (ОЦК), гранецентрированная кубическая (ГЦК) и гексагональная плотноупакованная (ГПУ).
Вопросы для закрепления теоретического материала к практическому занятию
Перечислить общие физические свойства металлов.
Что называется кристаллической решеткой, какие типы кристаллических решеток характерны для металлов?
Какие способы получения металлов Вы знаете?
Задания для практического занятия:
Решить предложенные задачи.
Правильно оформить их в тетрадь для практических и контрольных работ.
Отчитаться о выполненной работе преподавателю.
Напишите уравнение реакции взаимодействия металла с кислотой
алюминий + серная кислота
железо + соляная кислота
Образец решения задания № 1
Напишите управление реакции цинка с соляной кислотой.
Алгоритм решения
Известно, что активные металлы, стоящие в ряду напряженности металлов (приложение 6) до водорода вытесняют его из кислоты, поэтому уравнение реакции цинка с соляной кислотой имеет вид:
В результате реакции выделяется газ (H2) водород.
Напишите уравнение реакции замещения при взаимодействии металла с солью другого металла
алюминий + железный купорос
железо + медный купорос
Образец решения задания № 2
Напишите уравнение реакции замещения при взаимодействии цинка с медным купоросом.
Известно, что активные металлы, стоящие в ряду напряженности металлов (приложение 6) левее вытесняют металлы из их солей, которые стоят правее, поэтому уравнение реакции цинка с медным купоросом имеет вид:
В результате реакции выделяется металлическая медь (красный осадок).
Напишите уравнения реакции, с помощью которых можно осуществить следующие превращения. Укажите тип каждой реакции и под формулой каждого вещества подпишите, к какому классу оно относится.
Магний оксид магния хлорид магния гидроксид магния сульфат магния
Медь оксид меди сульфат меди гидроксид меди оксид меди
Образец решения задания № 3
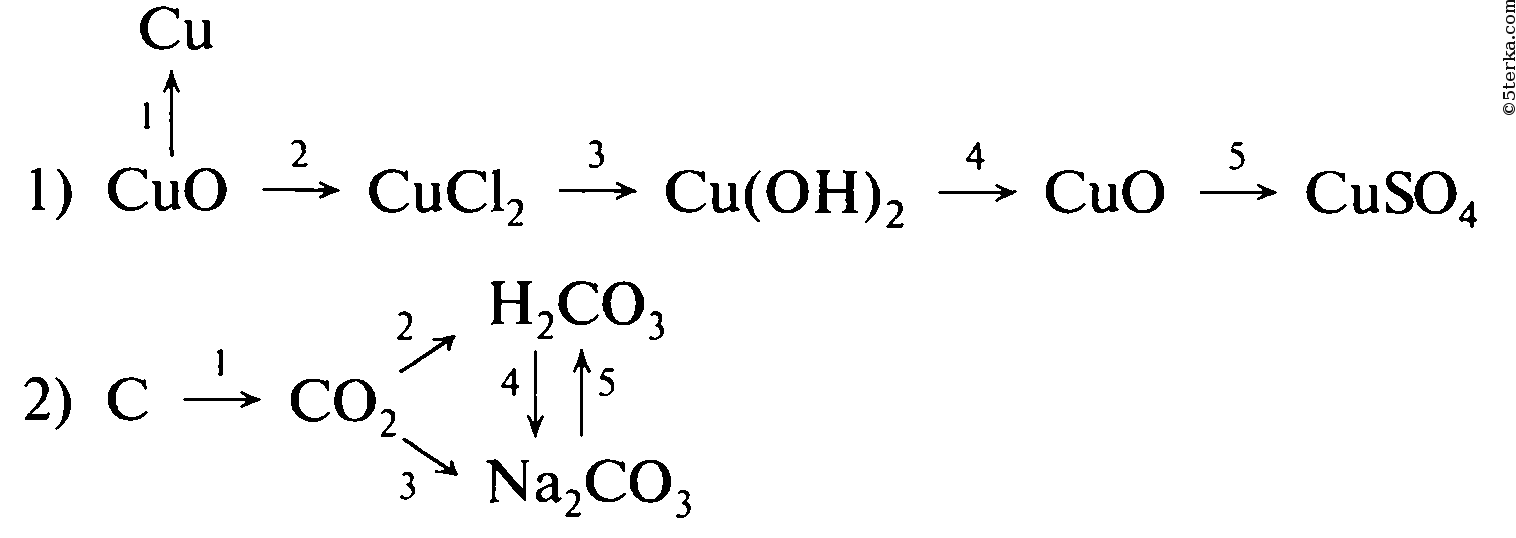
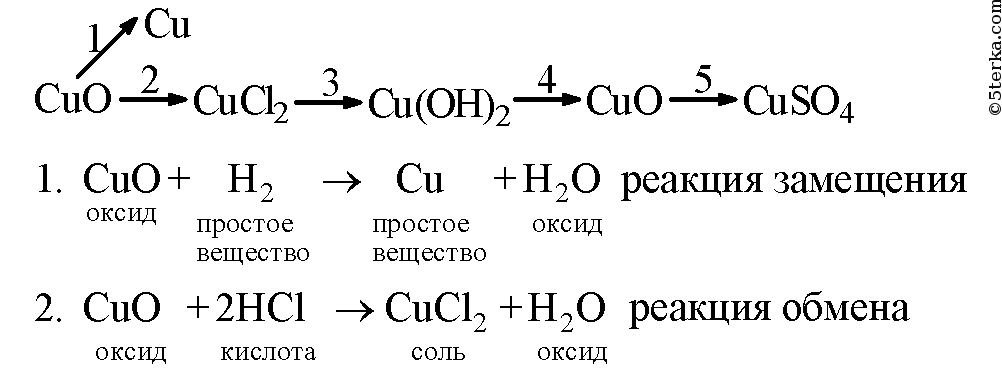
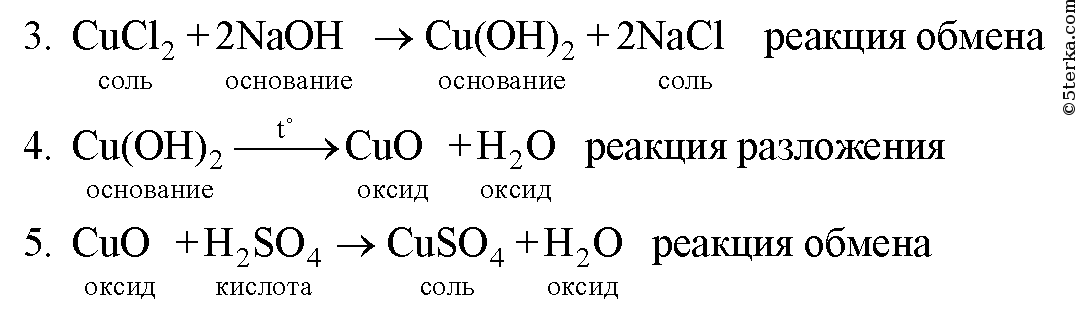
Вопросы для контроля
Перечислите основные химические свойства металлов?
Какую валентность проявляют металлы: натрий, цинк, серебро, медь, кальций, магний, железо, хром?
Запишите, где в вашей профессии и в жизни применяются металлы.
Форма контроля выполнения практического задания:
Выполненная работа представляется преподавателю в тетради для выполнения практических и контрольных работ по дисциплине «Естествознание».
Читайте также:
