Взаимодействие аминокислот с металлами
Амины – производные аммиака, в молекуле которого один, два или все три атома водорода замещены на углеводородные радикалы.
По количеству замещенных атомов водорода амины делят на:
| первичные | вторичные | третичные |
| R-NH2 |
По характеру углеводородных заместителей амины делят на
Общие особенности строения аминов
Также как и в молекуле аммиака, в молекуле любого амина атом азота имеет неподеленную электронную пару, направленную в одну из вершин искаженного тетраэдра:
По этой причине у аминов как и у аммиака существенно выражены основные свойства.
Так, амины аналогично аммиаку обратимо реагируют с водой, образуя слабые основания:
Связь катиона водорода с атомом азота в молекуле амина реализуется с помощью донорно-акцепторного механизма за счет неподеленной электронной пары атома азота. Предельные амины являются более сильными основаниями по сравнению с аммиаком, т.к. в таких аминах углеводородные заместители обладают положительным индуктивным (+I) эффектом. В связи с этим на атоме азота увеличивается электронная плотность, что облегчает его взаимодействие с катионом Н + .
Ароматические амины, в случае если аминогруппа непосредственно соединена с ароматическим ядром, проявляют более слабые основные свойства по сравнению с аммиаком. Связано это с тем, что неподеленная электронная пара атома азота смещается в сторону ароматической π-системы бензольного кольца в следствие чего, электронная плотность на атоме азота снижается. В свою очередь это приводит к снижению основных свойств, в частности способности взаимодействовать с водой. Так, например, анилин реагирует только с сильными кислотами, а с водой практически не реагирует.
Химические свойства предельных аминов
Как уже было сказано, амины обратимо реагируют с водой:
Водные растворы аминов имеют щелочную реакцию среды, вследствие диссоциации образующихся оснований:
Предельные амины реагируют с водой лучше, чем аммиак, ввиду более сильных основных свойств.
Основные свойства предельных аминов увеличиваются в ряду.
Вторичные предельные амины являются более сильными основаниями, чем первичные предельные, которые являются в свою очередь более сильными основаниями, чем аммиак. Что касается основных свойств третичных аминов, то то если речь идет о реакциях в водных растворах, то основные свойства третичных аминов выражены намного хуже, чем у вторичных аминов, и даже чуть хуже чем у первичных. Связано это со стерическими затруднениями, существенно влияющими на скорость протонирования амина. Другими словами три заместителя «загораживают» атом азота и мешают его взаимодействию с катионами H + .
Взаимодействие с кислотами
Как свободные предельные амины, так и их водные растворы вступают во взаимодействие с кислотами. При этом образуются соли:
Так как основные свойства предельных аминов сильнее выражены, чем у аммиака, такие амины реагируют даже со слабыми кислотами, например угольной:
Соли аминов представляют собой твердые вещества, хорошо растворимые в воде и плохо в неполярных органических растворителях. Взаимодействие солей аминов с щелочами приводит к высвобождению свободных аминов, аналогично тому как происходит вытеснение аммиака при действии щелочей на соли аммония:
2. Первичные предельные амины реагируют с азотистой кислотой с образованием соответствующих спиртов, азота N2 и воды. Например:
Характерным признаком данной реакции является образование газообразного азота, в связи с чем она является качественной на первичные амины и используется для их различения от вторичных и третичных. Следует отметить, что чаще всего данную реакцию проводят, смешивая амин не с раствором самой азотистой кислоты, а с раствором соли азотистой кислоты (нитрита) и последующим добавлением к этой смеси сильной минеральной кислоты. При взаимодействии нитритов с сильными минеральными кислотами образуется азотистая кислота, которая уже затем реагирует с амином:
Вторичные амины дают в аналогичных условиях маслянистые жидкости, так называемые N-нитрозаминами, но данная реакция в реальных заданиях ЕГЭ по химии не встречается. Третичные амины с азотистой кислотой взаимодействуют также как и с другими кислотами — с образованием соответствующих солей, в данном случае, нитритов.
Полное сгорание любых аминов приводит к образованию углекислого газа, воды и азота:
Взаимодействие с галогеналканами
Примечательно, что абсолютно такая же соль получается при действии хлороводорода на более замещенный амин. В нашем случае, при взаимодействии хлороводорода с диметиламином:
1) Алкилирование аммиака галогеналканами:
В случае недостатка аммиака вместо амина получается его соль:
2) Восстановление металлами (до водорода в ряду активности) в кислой среде:
с последующей обработкой раствора щелочью для высвобождения свободного амина:
3) Реакция аммиака со спиртами при пропускании их смеси через нагретый оксид алюминия. В зависимости от пропорций спирт/амин образуются первичные, вторичные или третичные амины:
Химические свойства анилина
Анилин – тривиальное название аминобензола, имеющего формулу:
Как можно видеть из иллюстрации, в молекуле анилина аминогруппа непосредственно соединена с ароматическим кольцом. У таких аминов, как уже было сказано, основные свойства выражены намного слабее, чем у аммиака. Так, в частности, анилин практически не реагирует с водой и слабыми кислотами типа угольной.
Взаимодействие анилина с кислотами
Анилин реагирует с сильными и средней силы неорганическими кислотами. При этом образуются соли фениламмония:
Взаимодействие анилина с галогенами
Как уже было сказано в самом начале данной главы, аминогруппа в ароматических аминах , втянута в ароматическое кольцо, что в свою очередь снижает электронную плотность на атоме азота, и как следствие увеличивает ее в ароматическом ядре. Увеличение электронной плотности в ароматическом ядре приводит к тому, что реакции электрофильного замещения, в частности, реакции с галогенами протекают значительно легче, особенно в орто- и пара- положениях относительно аминогруппы. Так, анилин с легкостью вступает во взаимодействие с бромной водой, образуя белый осадок 2,4,6-триброманилина:
Данная реакция является качественной на анилин и часто позволяет определить его среди прочих органических соединений.
Взаимодействие анилина с азотистой кислотой
Анилин реагирует с азотистой кислотой, но в виду специфичности и сложности данной реакции в реальном ЕГЭ по химии она не встречается.
Реакции алкилирования анилина
С помощью последовательного алкилирования анилина по атому азота галогенпроизводными углеводородов можно получать вторичные и третичные амины:
Получение анилина
1. Восстановление маталлами нитробензола в присутствии сильных кислот-неокислителей:
2. Далее полученную соль обрабатывают щелочью для высвобождения анилина:
В качестве металлов могут быть использованы любые металлы, находящиеся до водорода в ряду активности.
Реакция хлорбензола с аммиаком:
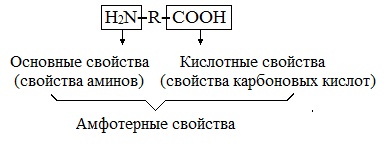
Химические свойства аминокислот
Аминокислотами называют соединения в молекулах которых присутствуют два типа функциональных групп – амино (-NH2) и карбокси- (-COOH) группы.
Другими словами, аминокислоты можно рассматривать как производные карбоновых кислот, в молекулах которых один или несколько атомов водорода замещены на аминогруппы.
Таким образом, общую формулу аминокислот можно записать как (NH2)xR(COOH)y, где x и y чаще всего равны единице или двум.
Поскольку в молекулах аминокислот есть и аминогруппа и карбоксильная группа, они проявляют химические свойства схожие как аминов, так и карбоновых кислот.
Кислотные свойства аминокислот
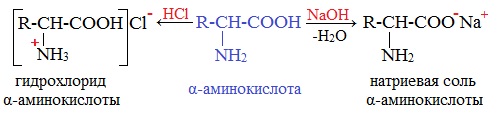
Образование солей с щелочами и карбонатами щелочных металлов
Этерификация аминокислот
Аминокислоты могут вступать в реакцию этерификации со спиртами:
Основные свойства аминокислот
1. Образование солей при взаимодействии с кислотами
2. Взаимодействие с азотистой кислотой
Примечание: взаимодействие с азотистой кислотой протекает так же, как и с первичными аминами
4. Взаимодействие аминокислот друг с другом
Аминокислоты могут реагировать друг с другом образуя пептиды – соединения, содержащие в своих молекулах пептидную связь –C(O)-NH-
При этом, следует отметить, что в случае проведения реакции между двумя разными аминокислотами, без соблюдения некоторых специфических условий синтеза, одновременно протекает образование разных дипептидов. Так, например, вместо реакции глицина с аланином выше, приводящей к глицилананину, может произойти реакция приводящая к аланилглицину:
Кроме того, молекула глицина не обязательно реагирует с молекулой аланина. Протекают также и реакции пептизации между молекулами глицина:
Помимо этого, поскольку молекулы образующихся пептидов как и исходные молекулы аминокислот содержат аминогруппы и карбоксильные группы, сами пептиды могут реагировать с аминокислотами и другими пептидами, благодаря образованию новых пептидных связей.
Отдельные аминокислоты используются для производства синтетических полипептидов или так называемых полиамидных волокон. Так, в частности с помощью поликонденсации 6-аминогексановой (ε-аминокапроновой) кислоты в промышленности синтезируют капрон:
Получаемая в результате этой реакции капроновая смола используется для производства текстильных волокон и пластмасс.
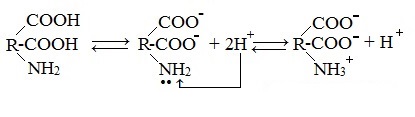
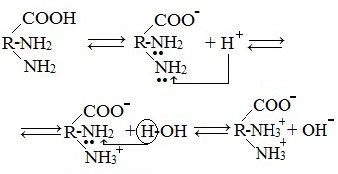
Образование внутренних солей аминокислот в водном растворе
В водных растворах аминокислоты существуют преимущественно в виде внутренних солей — биполярных ионов (цвиттер-ионов):
Получение аминокислот
1) Реакция хлорпроизводных карбоновых кислот с аммиаком:
2) Расщепление (гидролиз) белков под действием растворов сильных минеральных кислот и щелочей.
Аминокислоты
Природные аминокислоты можно разделить на следующие основные группы:

Номенклатура аминокислот
- Для природных α-аминокислот R-CH(NH2)COOH применяются тривиальные названия: глицин, аланин, серин и т. д.
- По систематической номенклатуре названия аминокислот образуются из названий соответствующих кислот прибавлением приставки амино- и указанием места расположения аминогруппы по отношению к карбоксильной группе:
| α-Аминомасляная кислота | β-Аминомасляная кислота |
Физические свойства аминокислот
Аминокислоты – твердые кристаллические вещества с высокой температурой плавления. Хорошо растворимы в воде, водные растворы хорошо проводят электрический ток.
Получение аминокислот
- Замещение галогена на аминогруппу в соответствующих галогензамещенных кислотах:

- Восстановление нитрозамещенных карбоновых кислот (применяется для получения ароматических аминокислот):

Химические свойства аминокислот
| При растворении аминокислот в воде карбоксильная группа отщепляет ион водорода, который может присоединиться к аминогруппе. При этом образуется внутренняя соль, молекула которой представляет собой биполярный ион: |
1. Кислотно-основные свойства аминокислот
| Аминокислоты — это амфотерные соединения. |
Они содержат в составе молекулы две функциональные группы противоположного характера: аминогруппу с основными свойствами и карбоксильную группу с кислотными свойствами.
| Водные растворы аминокислот имеют нейтральную, щелочную или кислую среду в зависимости от количества функциональных групп. |
Так, глутаминовая кислота образует кислый раствор (две группы -СООН, одна -NH2), лизин — щелочной (одна группа -СООН, две -NH2).
1.1. Взаимодействие с металлами и щелочами
Как кислоты (по карбоксильной группе), аминокислоты могут реагировать с металлами, щелочами, образуя соли:

1.2. Взаимодействие с кислотами
По аминогруппе аминокислоты реагируют с кислотами:

2. Взаимодействие с азотистой кислотой
Аминокислоты способны реагировать с азотистой кислотой.
| Например, глицин взаимодействует с азотистой кислотой: |

3. Взаимодействие с аминами
Аминокислоты способны реагировать с аминами, образуя соли или амиды.
4. Этерификация
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир:
| Например, глицин взаимодействует с этиловым спиртом: |

5. Декарбоксилирование
Протекает при нагревании аминокислот с щелочами или при нагревании.
| Например, глицин взаимодействует с гидроксидом бария при нагревании: |
| Например, глицин разлагается при нагревании: |
6. Межмолекулярное взаимодействие аминокислот
При взаимодействии аминокислот образуются пептиды. При взаимодействии двух α-аминокислот образуется дипептид.
| Например, г лицин реагирует с аланином с образованием дипептида (глицилаланин): |

Фрагменты молекул аминокислот, образующие пептидную цепь, называются аминокислотными остатками, а связь CO–NH — пептидной связью.
Взаимодействие аминокислот с металлами
Аминокислоты являются амфотерными соединениями, для них характерны кислотно-основные свойства. Это обусловлено наличием в их молекулах функциональных групп кислотного (-СООН) и основного (-NH2) характера.
Кислотно-основное равновесие в водных растворах
В водных растворах и твердом состоянии аминокислоты существуют в виде внутренних солей.
Ионизация молекул аминокислот в водных растворах зависит от кислотного или щелочного характера среды:
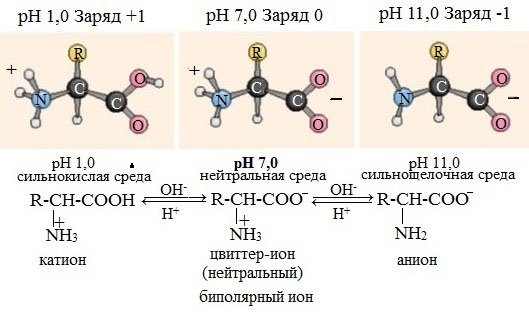
В кислой среде молекулы аминокислот представляю собой катион. В щелочной среде молекулы аминокислот представляют собой анион. В нейтральной среде аминокислоты представляют собой цвиттер-ион или биполярный ион.
Аминокислоты в твердом состоянии всегда существуют в виде биполярного, двухзарядного иона — цвиттер-иона.
Водные растворы аминокислот в кислой и щелочной среде проводят электрический ток.
1. Взаимодействие внутри молекулы – образование внутренних солей (биполярных ионов)
Молекулы аминокислот существуют в виде внутренних солей, которые образуются за счет переноса протона от карбоксила к аминогруппе.
Карбоксильная группа аминокислоты отщепляет ион водорода, который затем присоединяется к аминогруппе той же молекулы по месту неподеленной электронной пары азота. В результате действие функциональных групп нейтрализуется, образуется так называемая внутренняя соль.
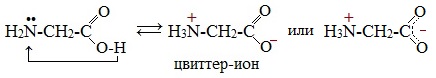
Водные растворы аминокислот в зависимости от количества функциональных групп имеют нейтральную, кислую или щелочную среду.
Аминокислоты с одной карбоксильной группой и одной аминогруппой имеют нейтральную реакцию.
Видеоопыт «Свойства аминоуксусной кислоты»
а) моноаминомонокарбоновые кислоты (нейтральные кислоты)
Внутримолекулярная нейтрализация — образуется биполярный цвиттер-ион.
Водные растворы моноаминомонокарбоновых кислот нейтральны (рН≈7).
б) моноаминодикарбоновые кислоты (кислые аминокислоты)
в) диаминомонокарбоновые кислоты (основные аминокислоты)
Водные растворы диаминомонокарбоновых кислот имеют рН>7 (щелочная среда), так как в результате образования внутренних солей этих кислот в растворе появляется избыток гидроксид-ионов ОН — .
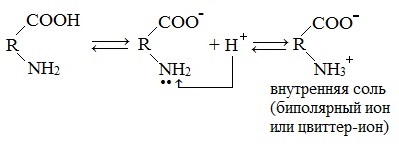
2. Взаимодействие с основаниями и кислотами
Аминокислоты как амфотерные соединения образуют соли как с кислотами (по группе NH2), так и со щелочами (по группе СООН).
Как кислота (участвует карбоксильная группа)
Как карбоновые кислоты α-аминокислоты образуют функциональные производные: соли, сложные эфиры, амиды.
а) взаимодействие с основаниями
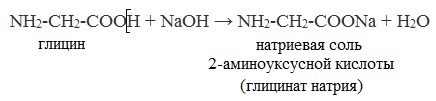
б) взаимодействие со спиртами (р. этерификации)
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир. Сложные эфиры аминокислот не имеют биполярной структуры и являются летучими соединениями.
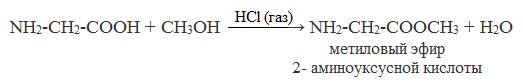
в) взаимодействие с аммиаком
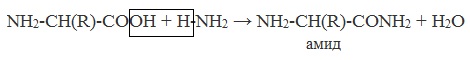
Как основание (участвует аминогруппа)
а) взаимодействие с сильными кислотами
Подобно аминам, аминокислоты реагируют с сильными кислотами с образованием солей аммония:
б) взаимодействие с азотистой кислотой (р. дезаминирования)
Подобно первичным аминам, аминокислоты реагируют с азотистой кислотой, при этом аминогруппа превращается в гидроксогруппу, а аминокислота – в гидроксикислоту:
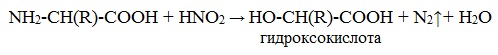
Измерение объёма выделившегося азота позволяет определить количество аминокислоты (метод Ван-Слайка).
3. Внутримолекулярное взаимодействие функциональных групп ε-аминокапроновой кислоты, в результате которого образуется ε-капролактам (полупродукт для получения капрона).
4. Межмолекулярное взаимодействие α-аминокислот – образование пептидов (р. поликонденсации)
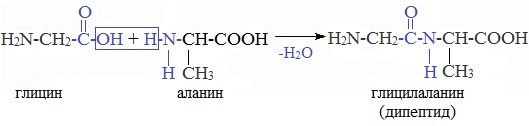
При взаимодействии карбоксильной группы одной молекулы аминокислоты и аминогруппы другой молекулы аминокислоты образуются пептиды. При взаимодействии двух α-аминокислот образуется дипептид.
Межмолекулярная реакция с участием трех α-аминокислот приводит к образованию трипептида и т.д.
Важнейшие природные полимеры – белки (протеины) – относятся к полипептидам, т.е представляют собой продукт поликонденсации a-аминокислот.
5. Качественные реакции!
а) нингидриновая реакция
Все аминокислоты окисляются нингидрином с образованием продуктов сине-фиолетового цвета:
Иминокислота пролин дает с нингидрином желтое окрашивание.
б) с ионами тяжелых металлов α-аминокислоты образуют внутрикомплексные соли. Комплексы меди (II), имеющие глубокую синюю окраску, используются для обнаружения α-аминокислот.
§ 1. СВЯЗЫВАНИЕ «МЕТАЛЛИЧЕСКИХ ЯДОВ» БИОЛОГИЧЕСКИМ МАТЕРИАЛОМ
Причину отравлений соединениями металлов долгое время объясняли образованием в организме так называемых альбуминатов. Однако сторонники этой гипотезы химизм образования, состав и прочность альбуминатов не приводят.
Благодаря успехам в области биологической химии, фармакологии, токсикологии и ряда других наук установлено, что в организме ионы металлов связываются не только с белковыми веществами, но и с аминокислотами, пептидами и рядом других жизненно важных веществ. Прочность образовавшихся при этом соединений (комплексов) зависит от природы металлов, наличия соответствующих функциональных групп в молекулах веществ, связывающихся с металлами, природы связи в образовавшихся соединениях или комплексах и т. д.
Связывание ионов металлов аминокислотами. Аминокислоты являются структурными элементами, из которых построены белки и которые определяют многие важные свойства этих белков. В настоящее время известно значительное число аминокислот. Однако в состав белков входит только около двадцати α-аминокислот. Все аминокислоты (кроме пролина), входящие в состав белков, содержат свободную карбоксильную группу и свободную незамещенную аминогруппу у α-углеродного атома. Пролин имеет замещенную α-аминогруппу и представляет собой α-иминокислоту.
Способность ионов металлов взаимодействовать с аминокислотами зависит от наличия в их составе определенных атомов и функциональных групп. С ионами металлов могут взаимодействовать концевые амино- и карбоксильные группы аминокислот. Большая роль в образовании связей между ионами металлов и аминокислотами принадлежит и боковым функциональным группам аминокислот. К числу боковых функциональных групп в аминокислотах относятся: спиртовые группы в молекулах се-рина и треонина, фенильная группа в тирозине, сульфгидрильная группа в цистеине, дисульфидная группа в цистине, вторые карбоксильные группы в аспарагиновой и глутаминовой кислотах, вторые азотсодержащие группы в аргинине и гистидине. Метионин содержит атомы серы в углеродной цепи.
В зависимости от наличия определенных групп атомов в молекулах аминокислот, природы и химических свойств металлов при взаимодействии между ними могут образовываться связи различной прочности.
Аминокислоты являются амфотерными соединениями. Диссоциация их на ионы зависит от рН среды. В кислой среде аминокислоты диссоциируют как основания, в щелочной — как кислоты:
Катионы металлов взаимодействуют с анионами аминокислот. В аминогруппах аминокислот содержатся атомы азота, имеющие неподеленную пару электронов, за счет которой образуется координационная связь между катионом металла и атомом азота. Эту связь следует рассматривать как один из видов ковалентной связи. При образовании координационной связи между катионом металла и атомом азота донором обоих связывающих электронов является атом азота аминогруппы.
Один атом кислорода в карбоксильной группе аминокислоты после ее диссоциации имеет отрицательный заряд. За счет этого атома кислорода катионы металлов с аминокислотой могут образовывать как ионные, так и ковалентные связи. Характер этих связей зависит от природы катионов. При взаимодействии отрицательно заряженных атомов кислорода в карбоксильных группах с катионами щелочных металлов возникают ионные связи (образуются соли), а с катионами тяжелых металлов — ковалентные связи.
Катионы металлов, являющиеся комплексообразователями, с аминокислотами образовывают внутрикомплексные соединения (хелаты). При этом положительные заряды катионов нейтрализуются отрицательными зарядами атомов кислорода в карбоксильных группах, а незаряженные атомы азота аминогрупп с катионами металлов образовывают координационные связи.
Катионы металлов также могут связываться с боковыми реакционноспособными функциональными группами (—SH,—NH 2, — СООН) аминокислот с образованием внутрикомплексных соединений. Из аминокислот большой способностью связывать металлы обладают гистидин, содержащий в молекуле имидазольное кольцо, и цистеин, в молекуле которого имеется сульфгидрильная группа.
Связывание металлов пептидами. Пептиды представляют собой продукты конденсации аминокислот, связанные между собой пептидными (амидными) связями (—NH—СО—). Приставки ди-, три-, тетра- и т. д. соответствуют числу остатков аминокислот в молекулах пептидов. Пептиды, включающие 20 и больше остатков аминокислот, называются полипептидами. Молекулярная масса их достигает 5000. Полипептиды с большей молекулярной массой называются белками.
Ди- и трипептиды могут связывать катионы металлов за счет образования связей с концевыми карбоксильными и аминными группами. Пептиды, представляющие собой продукты конденсации большого числа молекул аминокислот, не могут связываться с металлами указанными концевыми группами, так как эти группы значительно удалены друг от друга. Поэтому такие пептиды связываются с катионами металлов в основном за счет образования связей с боковыми функциональными группами или же с концевой карбоксильной группой и с атомом азота амидной группы, близко расположенной к карбоксильной группе. Координационная связь металла с атомом азота амидной группы менее прочная, чем связь металла с азотом аминной группы. Это объясняется тем, что электронодонорные свойства атома азота амидной (пептидной) группы выражены значительно слабее, чем у азота аминной группы.
При образовании связей между ионами металлов и пептидами-донорами электронов могут быть не только атомы азота, ко и атомы серы, находящиеся в дисульфидных мостиках.
Связывание металлов белками. Белки занимают центральное место в структуре живой материи и играют первостепенную роль в ее функционировании. В количественном отношении белки представляют собой основной материал тканей живых организмов. Белки составляют до 75 % сухой массы клеток.
Белки представляют собой макромолекулы с молекулярными массами от 5000 до нескольких миллионов. Они состоят из α-аминокислот, связанных между собой пептидными (амидными) связями, образованными карбоксильными и аминными группами соседних аминокислотных остатков.
В образовании связей с металлами могут принимать участие концевые амино- и карбоксильные группы белковых молекул. Однако число концевых групп в молекулах белков незначительное. Каждая молекула белка, представляющая длинную полипептидную цепь, содержит только две значительно удаленные друг от друга концевые (—NH 2 и —СООН) группы и большое число боковых функциональных групп. Поэтому образование связей между ионами металлов и белками происходит в основном за счет боковых функциональных групп (—SH, —NH 2, —ОН, —СООН). Полагают, что металлы связываются с белками главным образом через остатки гистидина, содержащего имидазольное кольцо, и цистеина, имеющего боковую сульфгидрильную группу.
Выше приведены сведения о связывании ионов металлов с аминокислотами, пептидами и белками в организме. Однако металлы могут связываться в организме и с другими соединениями, играющими важную роль во всех живых клетках. К таким соединениям относятся птеридины (в том числе фолиевая кислота), пурины, рибофлавин, нуклеиновые кислоты и многие др. В большинстве случаев ионы металлов с перечисленными выше соединениями образовывают прочные ковалентные связи.
При отравлениях соединениями металлов на химико-токсикологическое исследование могут поступать органы трупов, биологические жидкости и другие объекты биологического происхождения. Для изолирования «металлических ядов» из указанных объектов, в которых эти яды находятся в виде прочных соединений с аминокислотами, пептидами, белками и другими веществами, необходимо производить разрушение (минерализацию) органических веществ, а затем в минерализатах обнаруживать и определять количественное содержание соответствующих «металлических ядов».
Общие свойства аминокислот
Кислотно-основные свойства. Эти свойства аминокислот определяют многие физико-химические и биологические свойства белков. На этих свойствах основаны, кроме того, почти все методы выделения и идентификации аминокислот. Аминокислоты легко растворимы в воде. Они кристаллизуются из нейтральных водных растворов в форме биполярных (амфотерных) ионов (цвиттерионов), а не в виде недиссоциированных молекул (последнюю структуру приводят для удобства представления, однако все аминокислоты при физиологических значениях рН имеют структуру цвиттериона).
При растворении в воде кристаллическая аминокислота, например аланин, может реагировать или как кислота (донатор протона):
Если радикалы аминокислот нейтральные, то они почти не оказывают влияния на диссоциацию α-карбоксильной группы или α-аминогруппы, и величины рК (отрицательный логарифм константы диссоциации) остаются относительно постоянными. Вследствие этого кривые диссоциации почти всех нейтральных аминокислот накладываются друг на друга и могут быть рассмотрены на примере аланина. Если к раствору аланина (например, 0,1 М) в воде постепенно прибавлять сильную кислоту (0,1 М раствор НСl) или сильную щелочь (0,1 М раствор NaOH), то получим кривую титрования аланина, типичную для всех нейтральных аминокислот (рис. 1.6).
Кажущиеся величины рК' для α-карбоксильной группы и α-аминогрупп (т.е. значения рН, при которых эти группы в среднем наполовину диссоциированы) довольно сильно различаются, составляя pK1 = 2,34 и рК2 = 9,69. При низком значении рН (ниже pK1') почти все молекулы аланина являются полностью протонированными и несут положительный заряд. Другими словами, при высокой концентрации водородных ионов в растворе тенденция к диссоциации водорода из структуры аланина оказывается незначительной. Из кривой титрования видно, что точка перехода между ветвями кривой располагается при рН 6,02.
Это означает, что при данном значении рН суммарный (или средний) электрический заряд молекулы аланина равен нулю и она не перемещается в электрическом поле ни к аноду, ни к катоду (изоэлектрическое состояние). Такое значение рН получило название изоэлектрической точки и обозначается pI. Изоэлектрическая точка аминокислот, не содержащих дополнительных NH2- или СООН-групп, представляет собой среднее арифметическое между двумя значениями рК':
Изоэлектрическая точка ряда других аминокислот, содержащих дополнительные кислотные или основные группы (аспарагиновая и глутаминовая кислоты, лизин, аргинин, тирозин и др.), зависит, кроме того, от кислотности или основности радикалов этих аминокислот. Для лизина, например, рI должна вычисляться из полусуммы значений рК' для α- и ε-NН2-групп. Таким образом, в интервале рН от 4,0 до 9,0 почти все аминокислоты существуют преимущественно в форме цвиттерионов с протонированной аминогруппой и диссоциированной карбоксильной группой. Следует отметить, что при физиологических значениях рН тканей и крови (7,1 и 7,4 соответственно) аминокислоты (за ислючением гистидина) не обладают измеримой буферной емкостью. Эту способность они приобретают только при значениях рН, близких к величинам их рК (т.е. при рН 1,7-3,2 и 8,6-10,8).
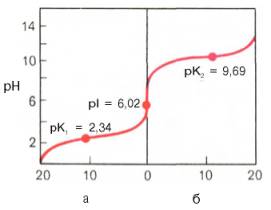
Рис. 1.6. Кривые, полученные при титровании 0,1 М раствора аланина 0,1 М раствором НСl (а) и 0,1 М раствором NaOH (б).
Стереохимия аминокислот. Важнейшим свойством аминокислот, освобождающихся в процессе гидролиза природных белков в условиях, исключающих рацемизацию, является их оптическая активность. Будучи растворенными в воде (или в НСl), они способны вращать плоскость поляризованного луча (исключение составляет глицин). Это свойство связано с наличием в молекуле всех природных аминокислот (за ислючением глицина) в α-положении асимметрического атома углерода (т. е. атома углерода, все четыре валентные связи которого заняты различными заместителями). Величины удельного вращения вправо или влево являются количественной характеристикой оптической активности, и для большинства аминокислот [а] 2 р составляет от 10 до 30°. Примерно половина аминокислот белков оказалась правовращающей, их обозначают знаком «+» (Ала, Иле, Глу, Лиз и др.), а чуть меньше половины - левовращающей (Фен, Трп, Лей и др.), их обозначают знаком «–». Все эти аминокислоты принадлежат к L-ряду, а величина и знак оптического вращения зависят от природы радикалов аминокислот и значения рН раствора, в котором измеряют оптическое вращение.
Стереохимию аминокислот принято оценивать не по оптическому вращению, а исходя из абсолютной конфигурации всех четырех замещающих групп, расположенных вокруг асимметрического атома углерода в вершинах модели тетраэдра. Абсолютную конфигурацию аминокислот принято соотносить стереохимически с соединением, произвольно взятым для сравнения, а именно с глицериновым альдегидом, также содержащим асимметрический атом углерода. Ниже представлены L- и D-стереоизомеры глицеринового альдегида. Рядом показаны пространственные конфигурации L-и D-аланина:
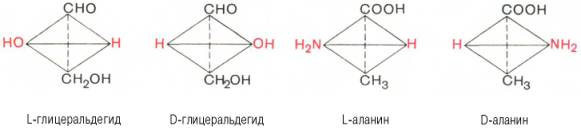
Все аминокислоты, образующиеся при гидролизе природных белков в условиях, исключающих рацемизацию, принадлежит к L-ряду. Таким образом, природные аминокислоты имеют пространственное расположение, аналогичное конфигурации L-глицеринового альдегида. Следует еще раз подчеркнуть, что символы L и D означают принадлежность данной аминокислоты по своей стереохимической конфигурации к L- или D-ряду, в то время как знак «+» или «–» указывает на направление изменения плоскости поляризации светового луча. Среди белковых аминокислот имеются две аминокислоты (треонин и изолейцин), которые содержат по два асимметрических атома углерода. Следовательно, если не в природе, то, во всяком случае, в лаборатории возможно получить четыре стереоизомерные формы этих аминокислот . Для треонина известны все четыре изомера. Если условно обозначить символом L выделенный из природных белков треонин, то его зеркальное отображение называют D-треонином. Два других изомера, получивших наименование диастереоизомеров, или аллоформ, также могут иметь L- и D-формы. Структурные конфигурации всех четырех стереоизомеров треонина можно представить следующими формулами:
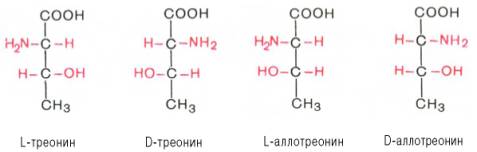
Как отмечалось, в белковой молекуле D-аминокислоты не обнаружены , однако в живой природе они широко распространены.
Так, D-изомеры глутаминовой кислоты, аланина, валина, фенилаланина, лейцина и ряда других открыты в клеточной стенке бактерий; в составе некоторых антибиотиков, в частности актиномицинов, бацитрацина, грамицидинов А и S, содержатся аминокислоты D-конфигурации.
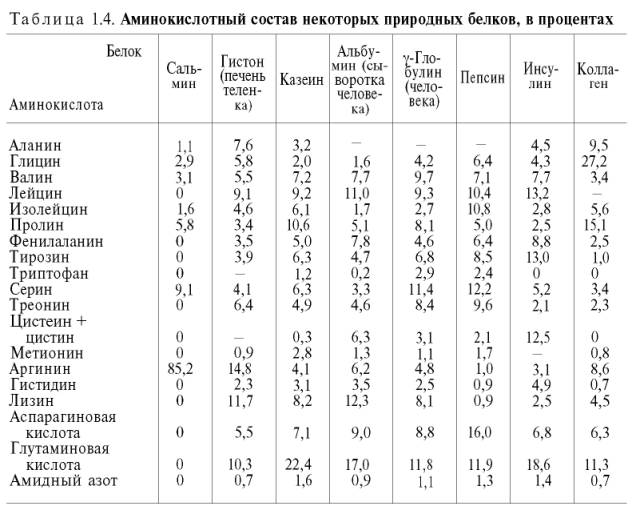
Аминокислотный состав (качественный и количественный) многих тысяч белков, полученных из разных источников, выяснен (табл. 1.4).
При анализе данных табл. 1.4 виден ряд закономерностей. На долю дикарбоновых аминокислот и их амидов в большинстве белков приходится до 25–27% всех аминокислот. Эти же аминокислоты вместе с лейцином и лизином составляют около 50% всех аминокислот. В то же время на долю таких аминокислот, как цистеин, метионин, триптофан, гистидин, приходится не более 1,5–3,5%. В протаминах и гистонах отмечено высокое содержание основных аминокислот аргинина и лизина, соответственно 26,4 и 85,2% (см. «Химия простых белков»).
Химические реакции для открытия и определения аминокислот в гидролизатах белков. В курсе органической химии подробно рассмотрено множество химических реакций, характерных для α-амино- и α-карбоксильных групп аминокислот (ацилирование, алкилирование, нитрование, этерификация и др.). Здесь будут рассмотрены общие цветные реакции для обнаружения индивидуальных аминокислот и аминокислот, входящих в состав белков, основанные на химической природе радикалов аминокислот (табл. 1.5).
Для открытия в биообъектах и количественного определения аминокислот успешно применяется реакция их с нингидрином. На I стадии реакции образуется восстановленный нингидрин за счет окислительного дезаминирования аминокислот (параллельно происходит декарбоксилирование аминокислот):
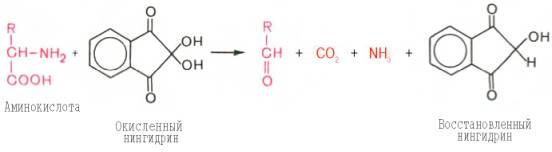
На II стадии образовавшийся аммиак реагирует с эквимолярными количествами окисленного и восстановленного нингидрина, образуя сине-фиолетовый продукт, интенсивность окраски которого (при 570 нм) пропорциональна количеству аминокислоты:
На основе нингидриновой реакции были разработаны методы количественного определения аминокислот, в частности метод распределительной хроматографии на бумаге, впервые внедренный в 1944 г. (А. Мартин и Р. Синдж). Эта же реакция используется благодаря своей высокой чувствительности в автоматическом анализаторе аминокислот. Впервые такой прибор сконструировали Д. Шпакман, С. Мур и У. Стейн (рис. 1.7). После разделения смеси аминокислот в колонках, заполненных специальными ионообменными смолами (сульфополистирольный катионит), ток элюента из колонки поступает в смеситель, туда же поступает раствор нингидрина; интенсивность образующейся окраски автоматически измеряется на фотоэлектроколориметре и регистрируется самописцем. Этот метод нашел широкое применение в клинической практике при исследовании крови, мочи, спинномозговой жидкости. С его помощью за 2–3 ч можно получить полную картину качественного состава аминокислот в биологических жидкостях и выявить наличие в них необычных азотсодержащих веществ, что имеет важное диагностическое и прогностическое значение.
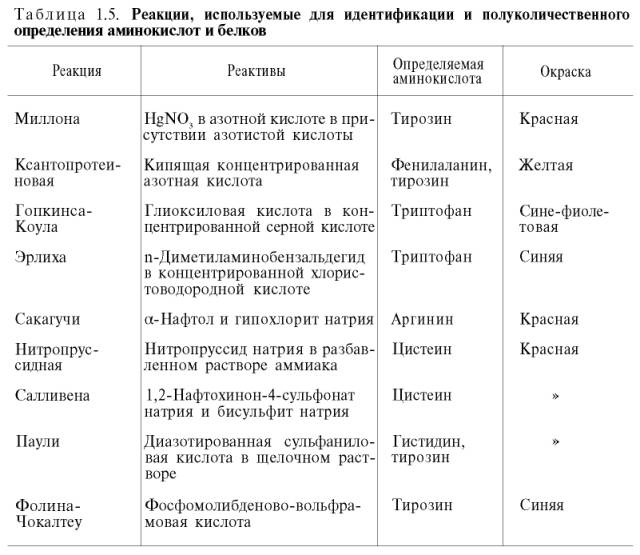
Рис. 1.7. Работа автоматического анализатора аминокислот (принципиальная схема
по Шпакману, Муру и Стейну).
1 - смеситель; 2 - фотоэлектроколориметр; 3 - самописец.
Автоматические анализаторы аминокислот все время совершенствуются, повышаются чувствительность методов и скорость проведения анализа. Так, в современных приборах высокоэффективной жидкостной хроматографии (ВЭЖХ) удается проводить анализ гидролизата белка за 45 мин, определяя при этом концентрацию аминокислот в пикомолях (рис. 1.8).
Смесь аминокислот может быть успешно разделена также методом электрофореза на бумаге. При рН 6,0 возможно хорошее разделение кислых и основных аминокислот с нейтральными. В этом случае отрицательно заряженные (кислые) аминокислоты будут двигаться к аноду, а положительно заряженные – к катоду. Нейтральные аминокислоты остаются на линии старта.
Для их разделения электрофорез обычно проводят при рН 1,8–2,0, когда все они мигрируют к аноду с незначительным, но уловимым различием в подвижности. После электрофореза местоположение аминокислот на электофореграмме выявляют с помощью химических реакций, а после элюции окрашенных продуктов определяют их количественно.
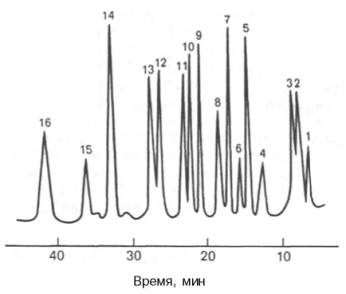
Рис. 1.8. ВЭЖХ аминокислот по Цеху и Вольтеру. Разделение на колонке (3 х 250 мм), наполненной ионообменной смолой – полистиролдивинилбензолом. Концентрация аминокислот 500 пмоль/л, реактив для детектирования – флюорескамин, образующий с аминогруппой сильно флюоресцирующее соединение.
1 - Асп; 2 - Тре; 3 - Сер; 4 - Глу; 5 - Гли; 6 - Ала; 7 - Цис; 8 - Вал; 9 - Мет; 10 -Иле; 11 - Лей; 12 - Тир; 13 - Фен; 14 -Лиз; 15 - Гис; 16 - Арг.
Читайте также:
