Выберите свойства характерные для щелочных металлов
Щелочные металлы — общая характеристика, строение атомов, физические и химические свойства
Щелочные металлы — металлы, расположенные в главной подгруппе первой группы периодической системы химических элементов Д.И. Менделеева (в 1 группе в длиннопериодной форме ПСХЭ).
К щелочным металлам относят:
- литий Li;
- натрий Na;
- калий K;
- цезий Cs;
- рубидий Rb;
- франций Fr.
Внешний энергетический уровень щелочных металлов обладает следующей электронной конфигурацией: n s 1 . На внешнем энергетическом уровне расположен 1 s-электрон. Таким образом, для щелочных металлов типичной является степень окисления в соединениях +1.
В ряду L i - N a - K - R b - C s - F r , согласно Периодическому закону, можно выявить следующие закономерности:
- увеличение атомного радиуса;
- усиление металлических свойств;
- ослабление неметаллических свойств;
- снижение степени электроотрицательности.
Общие физические свойства щелочных металлов:
- металлическая кристаллическая решетка у твердого вещества;
- высокая теплопроводность;
- высокая электропроводимость;
- низкие температуры кипения;
- низкие температуры плавления;
- небольшие показатели плотности.
Щелочные металлы являются мягкими веществами с серебристой окраской. На свежем срезе можно наблюдать характерный блеск.
Высокая химическая активность щелочных металлов при контакте с водой, кислородом, в некоторых случаях с азотом ( L i ) , объясняет наличие особых требований к режиму хранения. Материалы помещают под слой керосина. Перед проведением химического опыта от щелочного металла отделяют фрагмент необходимого размера с помощью скальпеля под слоем керосина. Затем в атмосфере аргона удаляют с металлической поверхности продукты, образованные при его реакции с воздухом. После этого фрагмент перемещают в резервуар для проведения реакций.
Одним из ключевых свойств щелочных металлов является высокая степень активности при взаимодействии с водой.
Относительно спокойная реакция без взрыва наблюдается при контакте лития с водой:
2 L i + 2 H 2 O ⟶ 2 L i O H + H 2 ↑ 2 L i + 2 H 2 O ⟶ 2 L i O H + H 2 ↑
Аналогичный химический процесс с натрием сопровождается горением пламенем желтого цвета и небольшим взрывом. Калий проявляет большую активность по сравнению с натрием. При такой реакции происходит сильный взрыв, а пламя приобретает фиолетовую окраску.
Щелочные металлы взаимодействуют с кислородом. В результате горения щелочных металлов в воздушной среде образуются вещества различного состава. Компонентный набор продуктов реакции определяется активностью металла.
Горение лития в воздушной среде приводит к образованию оксида стехиометрического состава:
4 L i + O 2 ⟶ 2 L i 2 O 4 L i + O 2 ⟶ 2 L i 2 O
Натрий горит на воздухе, что сопровождается синтезом пероксида N a 2 O 2 с небольшой добавкой в виде надпероксида N a O 2 :
2 N a + O 2 ⟶ N a 2 O 2 2 N a + O 2 ⟶ N a 2 O 2
Продукты, образованные в процессе горения калия, рубидия и цезия, включают в состав, как правило, надпероксиды:
K + O 2 ⟶ K O 2 K + O 2 ⟶ K O 2
R b + O 2 ⟶ R b O 2 R b + O 2 ⟶ R b O 2
C s + O 2 ⟶ C s O 2 C s + O 2 ⟶ C s O 2
Синтезировать оксиды натрия и калия можно путем повышения температуры смеси гидроксида, пероксида или надпероксида с избытком металла в отсутствии кислорода:
2 N a + 2 N a O H ⟶ 2 N a 2 O + H 2 ↑ 2 N a + 2 N a O H ⟶ 2 N a 2 O + H 2 ↑
2 N a + N a 2 O 2 ⟶ 2 N a 2 O 2 N a + N a 2 O 2 ⟶ 2 N a 2 O
3 K + K O 2 ⟶ 2 K 2 O 3 K + K O 2 ⟶ 2 K 2 O
Кислородные соединения щелочных металлов обладают уникальной особенностью. Закономерно с увеличением радиуса катиона щелочного металла повышается степень устойчивости кислородных соединений, в состав которых входят пероксид-ион ( О 2 ) 2 - и надпероксид-ион ( О 2 ) - .
Тяжелые щелочные металлы способны формировать достаточно устойчивые озониды Э О 3 . Кислородные соединения щелочных металлов обладают различной окраской, интенсивность которой повышается от Li до Cs:
Проявление пероксидами и надпероксидами свойств сильных окислителей:
N a 2 O 2 + 2 N a I + 2 H 2 S O 4 ⟶ I 2 + 2 N a 2 S O 4 + 2 H 2 O N a 2 O 2 + 2 N a I + 2 H 2 S O 4 ⟶ I 2 + 2 N a 2 S O 4 + 2 H 2 O
Интенсивное взаимодействие пероксидов и надпероксидов с водой, что сопровождается формированием гидроксидов:
N a 2 O 2 + 2 H 2 O ⟶ 2 N a O H + H 2 O 2 N a 2 O 2 + 2 H 2 O ⟶ 2 N a O H + H 2 O 2
2 K O 2 + 2 H 2 O ⟶ 2 K O H + H 2 O 2 + O 2 ↑ 2 K O 2 + 2 H 2 O ⟶ 2 K O H + H 2 O 2 + O 2 ↑
Щелочные металлы вступают в химические реакции со многими неметаллами. В процессе нагрева вещества формируют соединения с водородом. В результате образуются гидриды. Щелочные металлы могут взаимодействовать со следующими веществами:
- галогены;
- сера;
- азот;
- фосфор;
- углерод;
- кремний.
В результате таких химических реакций образуются соответственно:
- галогениды;
- сульфиды;
- нитриды;
- фосфиды;
- карбиды;
- силициды.
2 N a + H 2 ⟶ 2 N a H 2 N a + H 2 ⟶ 2 N a H
2 N a + C l 2 ⟶ 2 N a C l 2 N a + C l 2 ⟶ 2 N a C l
2 K + S ⟶ K 2 S 2 K + S ⟶ K 2 S
6 L i + N 2 ⟶ 2 L i 3 N 6 L i + N 2 ⟶ 2 L i 3 N
Последняя реакции протекает при комнатной температуре.
2 L i + 2 C ⟶ L i 2 C 2 2 L i + 2 C ⟶ L i 2 C 2
При повышении температуры происходят химические реакции щелочных металлов с другими металлами. Продуктами данной реакции являются соединения металлов — интерметаллиды.
Активно протекает взаимодействие щелочных металлов с кислотами. Процесс сопровождается взрывом.
Растворение щелочных металлов в жидком аммиаке и его производных — аминах и амидах:
2 N a + 2 N H 3 ⟶ 2 N a N H 2 + H 2 ↑ 2 N a + 2 N H 3 ⟶ 2 N a N H 2 + H 2 ↑
Растворяясь в жидком аммиаке, щелочной металл утрачивает электрон, который сольватируется молекулами аммиака и окрашивает раствор в голубой цвет. Образованные в результате амиды достаточно просто разлагаются водой, что приводит к образованию щелочи и аммиака:
K N H 2 + H 2 O ⟶ K O H + N H 3 ↑ K N H 2 + H 2 O ⟶ K O H + N H 3 ↑
Щелочные металлы вступают в химические реакции с органическими веществами.
При взаимодействии щелочных металлов со спиртами образуются алкоголяты. Если вещество контактирует с карбоновыми кислотами, продуктом реакции являются соли.
2 N a + 2 C H 3 C H 2 O H ⟶ 2 C H 3 C H 2 O N a + H 2 ↑ 2 N a + 2 C H 3 C H 2 O H ⟶ 2 C H 3 C H 2 O N a + H 2 ↑
2 N a + 2 C H 3 C O O H ⟶ 2 C H 3 C O O N a + H 2 ↑ 2 N a + 2 C H 3 C O O H ⟶ 2 C H 3 C O O N a + H 2 ↑
Щелочные металлы распознают по окраске пламени спиртовки, если в него вносить их соединения. По причине небольших потенциалов ионизации щелочных металлов при нагреве металла или его соединений в пламени происходит ионизация атомов. В результате пламя приобретает определенную окраску:
Соединения щелочных металлов, примеры
Получение гидроксидов щелочных металлов связано с применением электролитических способов. Самым крупнотоннажным является получение гидроксида натрия с помощью реакции электролиза концентрированного водного раствора поваренной соли:
2 N a C l + 2 H 2 O ⟶ H 2 ↑ + C l 2 ↑ + 2 N a O H 2 N a C l + 2 H 2 O ⟶ H 2 ↑ + C l 2 ↑ + 2 N a O H
катод: 2 H + + 2 e ⟶ H 2 ↑ 2 H + + 2 e ⟶ H 2 ↑
анод: 2 C l - - 2 e ⟶ C l 2 ↑ 2 C l - - 2 e ⟶ C l 2 ↑
В прошлом для получения щелочи применяли реакцию обмена:
N a 2 C O 3 + C a ( O H ) 2 ⟶ C a C O 3 ↓ + 2 N a O H N a 2 C O 3 + C a ( O H ) 2 ⟶ C a C O 3 ↓ + 2 N a O H
Продуктом данной реакции является щелочь с большой концентрацией соды N a 2 C O ) 3 .
Гидроксиды щелочных металлов представляют собой гигроскопичные вещества с белой окраской, водные растворы которых являются сильными основаниями.
Гидроксиды щелочных металлов, как и все основания, вступают в химические реакции с кислотами, кислотными и амфотерными оксидами, амфотерными гидроксидами:
2 L i O H + H 2 S O 4 ⟶ L i 2 S O 4 + 2 H 2 O 2 L i O H + H 2 S O 4 ⟶ L i 2 S O 4 + 2 H 2 O
2 K O H + C O 2 ⟶ K 2 C O 3 + H 2 O 2 K O H + C O 2 ⟶ K 2 C O 3 + H 2 O
K O H + A l ( O H ) 3 ⟶ K [ A l ( O H ) 4 ] K O H + A l ( O H ) 3 ⟶ K [ A l ( O H ) 4 ]
Если нагреть гидроксиды щелочных металлов, то вещества возгоняются без разложения. Исключение составляет гидроксид лития, который аналогично гидроксидам металлов главной подгруппы II группы, в процессе прокаливания разлагается на оксид и воду:
2 L i O H ⟶ L i 2 O + H 2 O 2 L i O H ⟶ L i 2 O + H 2 O
Гидроксид натрия используют в производстве твердого мыла и других веществ:
- моющих средств синтетического состава;
- волокон искусственного происхождения;
- органических соединений таких, как фенол.
Ценным продуктом, в состав которого входит щелочной металл, является сода N a 2 C O 3 . Большую часть от объемов мирового производства соды получают с помощью методики Сольве. Данный метод был изобретен в начале XX столетия. Принцип технологии заключается в следующем: водный раствор N a C l с добавлением аммиака насыщают углекислым газом при температуре 26—30 °C. В результате синтезируют гидрокарбонат натрия с низкой степенью растворимости, который получил название питьевой соды:
N a C l + N H 3 + C O 2 + H 2 O ⟶ N a H C O 3 ↓ + N H 4 C l N a C l + N H 3 + C O 2 + H 2 O ⟶ N a H C O 3 ↓ + N H 4 C l
С целью нейтрализовать кислотную среду, которая формируется при пропускании углекислого газа через раствор, добавляют аммиак. Таким образом, получают гидрокарбонат-ион ( H C O 3 ) - , который требуется для того, чтобы продукт выпал в осадок. После того, как отделяется питьевая сода, раствор с хлоридом аммония нагревают с известью и выделяют аммиак, что позволяет вернуть его в зону реакции:
2 N H 4 C l + C a ( O H ) 2 ⟶ 2 N H 3 ↑ + C a C l 2 + 2 H 2 O 2 N H 4 C l + C a ( O H ) 2 ⟶ 2 N H 3 ↑ + C a C l 2 + 2 H 2 O
Аммиачный способ производства соды характеризуется наличием единственного отхода в виде хлорида кальция. Данное вещество остается в растворе и обладает ограниченным применением.
С помощью прокаливания гидрокарбоната натрия можно получить кальцинированную, или стиральную, соду Na_CO_ и диоксид углерода, который используют в синтезе гидрокарбоната натрия:
2 N a H C O 3 ⟶ N a 2 C O 3 + C O 2 ↑ + H 2 O 2 N a H C O 3 ⟶ N a 2 C O 3 + C O 2 ↑ + H 2 O
Большую часть произведенной соды потребляют предприятия стекольной промышленности.
Гидрокарбонат калия K H C O 2 по сравнению с малорастворимой кислой солью N a H C O 3 хорошо растворяется в воде. По этой причине карбонат калия, или поташ, K 2 C O 3 получают путем химической реакции углекислого газа с раствором гидроксида калия:
Поташ активно применяют в производстве стекла и жидкого мыла.
Литий является единственным из всех щелочных металлов, для которого не получен гидрокарбонат. Данное обстоятельство объясняется слишком маленьким радиусом иона лития, не позволяющим ему удерживать достаточно крупный ион ( H C O 3 ) - .
Оксиды щелочных металлов, за исключением лития, получают исключительно косвенными методами. В процессе натрий взаимодействует с окислителями в расплаве.
Получение оксида натрия путем реакции натрия с нитратом натрия в расплаве:
Взаимодействие натрия с пероксидом натрия:
Химическая реакция между натрием и расплавом щелочи:
Получение оксида лития путем разложения гидроксида лития:
Оксиды щелочных металлов по описанию являются типичными основными оксидами. Соединения взаимодействуют со следующими веществами:
- кислотные оксиды;
- амфотерные оксиды;
- кислоты;
- вода.
Взаимодействие оксида натрия с оксидом фосфора (V):
Реакция оксида натрия с амфотерным оксидом алюминия:
При взаимодействии оксидов щелочных металлов с кислотами образуются средние и кислые соли (с многоосновными кислотами). К примеру, оксид калия вступает в химическую реакцию с соляной кислотой, что сопровождается образованием хлорида калия и воды:
Можно наблюдать активное взаимодействие оксидов щелочных металлов с водой. Продуктом такой реакции являются щелочи. К примеру, оксид лития взаимодействует с водой, что сопровождается образованием гидроксида лития:
Окисление оксидов щелочных металлов кислородом (за исключением оксида лития) происходит так, что оксид натрия окисляется до пероксида, оксиды калия, рубидия и цезия — до надпероксида. К примеру, уравнение реакции:
Получение и применение щелочных металлов
Существует несколько основных способов получения щелочных металлов:
- электролиз расплавов галогенидов;
- электролиз расплавов гидроксидов;
- восстановление из галогенидов.
Получить щелочные металлы можно с помощью электролиза расплавов их галогенидов. Это основной способ получения данных веществ. Как правило, применяют хлориды, которые образуют природные минералы:
2 L i C l ⟶ 2 L i + C l 2 ↑ 2 L i C l ⟶ 2 L i + C l 2 ↑
катод: L i + + e ⟶ Li L i + + e ⟶ Li
В некоторых случаях оправдано получение щелочных металлов с помощью электролиза расплавов их гидроксидов (гидроксиды зачастую имеют более низкие температуры плавления):
4 N a O H ⟶ 4 N a + 2 H 2 O + O 2 ↑ 4 N a O H ⟶ 4 N a + 2 H 2 O + O 2 ↑
катод: N a + + e ⟶ Na N a + + e ⟶ Na
анод: 4 O H - - 4 e ⟶ 2 H 2 O + O 2 ↑ 4 O H - - 4 e ⟶ 2 H 2 O + O 2 ↑
Щелочной металл удается восстановить из соответствующего хлорида или бромида кальцием, магнием, кремнием и другими восстановителями в процессе повышения температуры в вакуумной среде до 600—900 °C:
2 M C l + C a ⟶ 2 M ↑ + C a C l 2 2 M C l + C a ⟶ 2 M ↑ + C a C l 2
С целью задать химической реакции нужное направление необходимо удалить образованный свободный щелочной металл (M) с помощью отгонки. Таким же способом восстанавливают цирконий из хромата. Известно, что получить натрий можно, если восстановить его из карбоната углем при температуре в 1000 °C с добавлением известняка.
В связи с тем, что щелочные металлы в электрохимическом ряду напряжений расположены слева от водорода, электролитическое получение их из водных растворов солей не представляется возможным. В таком случае продуктами реакции являются соответствующие щелочи и водород.
Характерные химические свойства щелочных металлов

Щелочные металлы — это элементы I группы периодической системы: литий (Li), натрий (Na), калий (K), рубидий (Rb), цезий (Cs), франций (Fr); очень мягкие, пластичные, легкоплавкие и легкие, как правило, серебристо-белого цвета; химически очень активны; бурно реагируют с водой, образуя щёлочи (откуда название).
•Все щелочные металлы чрезвычайно активны, во всех химических реакциях проявляют восстановительные свойства, отдают свой единственный валентный электрон, превращаясь в положительно заряженный катион, проявляют единственную степень окисления +1.
•Вследствие своей активности щелочные металлы хранят под слоем керосина, чтобы преградить доступ воздуха и влаги. Литий очень легкий и в керосине всплывает на поверхность, поэтому его хранят под слоем вазелином.
Химические свойства щелочных металлов
1. Щелочные металлы активно взаимодействуют с водой:

2. Реакция щелочных металлов с кислородом:
4Li + O 2 → 2Li 2 O (оксид лития)
2Na + O 2 → Na 2 O 2 ( пероксид натрия)
K + O 2 → KO 2 (надпероксид калия)
На воздухе щелочные металлы мгновенно окисляются. Поэтому их хранят под слоем органических растворителей (керосин и др.).
3. В реакциях щелочных металлов с другими неметаллами образуются бинарные соединения:
2Li + Cl 2 → 2LiCl (галогениды)
2Na + S → Na 2 S (сульфиды)
2Na + H 2 → 2NaH (гидриды)
6Li + N 2 → 2Li 3 N (нитриды)
2Li + 2C → Li 2 C 2 (карбиды)
4. Реакция щелочных металлов с кислотами
(проводят редко, идет конкурирующая реакция с водой):
2Na + 2HCl → 2NaCl + H 2
5. Взаимодействие щелочных металлов с аммиаком
(образуется амид натрия):
6. Взаимодействие щелочных металлов со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
7. Качественная реакция на катионы щелочных металлов — окрашивание пламени в следующие цвета:

Li + – карминово-красный
K + , Rb + и Cs + – фиолетовый
Получение щелочных металлов
Металлические литий, натрий и калий получают электролизом расплава солей (хлоридов), а рубидий и цезий – восстановлением в вакууме при нагревании их хлоридов кальцием: 2CsCl+Ca=2Cs+CaCl 2
В небольших масштабах используется также вакуум-термическое получение натрия и калия:
Активные щелочные металлы выделяются в вакуум-термических процессах благодаря своей высокой летучести (их пары удаляются из зоны реакции).

![shhelochnyk-met]()
Особенности химических свойств s-элементов I группы и их физиологическое действие
Электронная конфигурация атома лития 1s 2 2s 1 . У него самый большой во 2-м периоде атомный радиус, что облегчает отрыв валентного электрона и возникновение иона Li + со стабильной конфигурацией инертного газа (гелия). Следовательно, его соединения образуются с передачей электрона от лития к другому атому и возникновением ионной связи с небольшой долей ковалентности. Литий ‑ типичный металлический элемент. В виде вещества это щелочной металл. От других членов I группы он отличается малыми размерами и наименьшей, по сравнению с ними, активностью. В этом отношении он напоминает расположенный по диагонали от Li элемент II группы ‑ магний. В растворах ион Li + сильно сольватирован; его окружают несколько десятков молекул воды. Литий по величине энергии сольватации — присоединения молекул растворителя, стоит ближе к протону, чем к катионам щелочных металлов.
Малый размер иона Li + , высокий заряд ядра и всего два электрона создают условия для возникновения вокруг этой частицы довольно значительного поля положительного заряда, поэтому в растворах к нему притягивается значительное число молекул полярных растворителей и его координационное число велико, металл способен образовывать значительное число литийорганических соединений.
Натрием начинается 3-й период, поэтому у него на внешнем уровне всего 1е — , занимающий 3s-орбиталь. Радиус атома Na — наибольший в 3-м периоде. Эти две особенности определяют характер элемента. Его электронная конфигурация 1s 2 2s 2 2p 6 3s 1 . Единственная степень окисления натрия +1. Электроотрицательность его очень мала, поэтому в соединениях натрий присутствует только в виде положительно заряженного иона и придает химической связи ионный характер. По размеру ион Na + значительно больше, чем Li + , и сольватация его не так велика. Однако в растворе в свободном виде он не существует.
Физиологическое значение ионов К + и Na + связано с их различной адсорбируемостью на поверхности компонентов, входящих в состав земной коры. Соединения натрия лишь незначительно подвержены адсорбции, в то время как соединения калия прочно удерживаются глиной и другими веществами. Мембраны клеток, являясь поверхностью раздела клетка ‑ среда, проницаемы для ионов К + , вследствие чего внутриклеточная концентрация К + значительно выше, чем ионов Na + . В то же время в плазме крови концентрация Na + превышает содержание в ней калия. С этим обстоятельством связывают возникновение мембранного потенциала клеток. Ионы К + и Na + ‑ одни из основных компонентов жидкой фазы организма. Их соотношение с ионами Са 2+ строго определенно, а его нарушение приводит к патологии. Введение ионов Na+ в организм не оказывает заметного вредного влияния. Повышение же содержания ионов К + вредно, но в обычных условиях рост его концентрации никогда не достигает опасных величин. Влияние ионов Rb + , Cs + , Li + еще недостаточно изучено.
Из различных поражений, связанных с применением соединений щелочных металлов, чаще всего встречаются ожоги растворами гидроксидов. Действие щелочей связано с растворением в них белков кожи и образованием щелочных альбуминатов. Щелочь вновь выделяется в результате их гидролиза и действует на более глубокие слои организма, вызывая появление язв. Ногти под влиянием щелочей становятся тусклыми и ломкими. Поражение глаз, даже очень разбавленными растворами щелочей, сопровождается не только поверхностными разрушениями, но нарушениями более глубоких участков глаза (радужной оболочки) и приводит к слепоте. При гидролизе амидов щелочных металлов одновременно образуется щелочь и аммиак, вызывающие трахеобронхит фибринозного типа и воспаление легких.
Калий был получен Г. Дэви практически одновременно с натрием в 1807 г. при электролизе влажного гидроксида калия. От названия этого соединения ‑ «едкое кали» и получил свое наименование элемент. Свойства калия заметно отличаются от свойств натрия, что обусловлено различием величин радиусов их атомов и ионов. В соединениях калия связь более ионная, а в виде иона К + он обладает меньшим поляризующим действием, чем натрий, из-за больших размеров. Природная смесь состоит из трех изотопов 39 К, 40 К, 41 К. Один из них 40 К ‑ радиоактивен и определенная доля радиоактивности минералов и почвы связана с присутствием этого изотопа. Его период полураспада велик ‑ 1,32 млрд. лет. Определить присутствие калия в образце довольно легко: пары металла и его соединения окрашивают пламя в фиолетово-красный цвет. Спектр элемента довольно прост и доказывает наличие 1е — на 4s-орбитали. Изучение его послужило одним из оснований для нахождения общих закономерностей в строении спектров.
В 1861 г. при исследовании соли минеральных источников спектральным анализом Роберт Бунзен обнаружил новый элемент. Его наличие доказывалось темно-красными линиями в спектре, которых не давали другие элементы. По цвету этих линий элемент и был назван рубидием (rubidus—темно-красный). В 1863 г. Р. Бунзен получил этот металл и в чистом виде восстановлением тартрата рубидия (виннокислой соли) сажей. Особенностью элемента является легкая возбудимость его атомов. Электронная эмиссия у него появляется под действием красных лучей видимого спектра. Это связано с небольшой разницей в энергиях атомных 4d и 5s-орбиталей. Из всех щелочных элементов, имеющих стабильные изотопы, рубидию (как и цезию) принадлежит один из самых больших атомных радиусов и маленький потенциал ионизации. Такие параметры определяют характер элемента: высокую электроположительность, чрезвычайную химическую активность, низкую температуру плавления (39 0 C) и малую устойчивость к внешним воздействиям.
Открытие цезия, как и рубидия, связано со спектральным анализом. В 1860 г. Р.Бунзен обнаружил две яркие голубые линии в спектре, не принадлежащие ни одному известному к тому времени элементу. Отсюда произошло и название «цезиус» (caesius), что значит небесно-голубой. Это последний элемент подгруппы щелочных металлов, который ещё встречается в измеримых количествах. Наибольший атомный радиус и наименьшие первые потенциалы ионизации определяют характер и поведение этого элемента. Он обладает ярко выраженной электроположительностью и ярко выраженными металлическими качествами. Стремление отдать внешний 6s-электрон приводит к тому, что все его реакции протекают исключительно бурно. Небольшая разница в энергиях атомных 5d- и 6s-орбиталей обусловливает легкую возбудимость атомов. Электронная эмиссия у цезия наблюдается под действием невидимых инфракрасных лучей (тепловых). Указанная особенность структуры атома определяет хорошую электрическую проводимость тока. Все это делает цезий незаменимым в электронных приборах. В последнее время все больше внимания уделяется цезиевой плазме как топливу будущего и в связи с решением проблемы термоядерного синтеза.
На воздухе литий активно реагирует не только с кислородом, но и с азотом и покрывается пленкой, состоящей из Li 3 N (до 75%) и Li 2 O. Остальные щелочные металлы образуют пероксиды (Na 2 O 2 ) и надпероксиды (K 2 O 4 или KO 2 ).
Перечисленные вещества реагируют с водой:
Для регенерации воздуха на подводных лодках и космических кораблях, в изолирующих противогазах и дыхательных аппаратах боевых пловцов (подводных диверсантов) использовалась смесь «оксон»:
В настоящее время это стандартная начинка регенерирующих патронов изолирующих противогазов для пожарных.
Щелочные металлы реагируют при нагревании с водородом, образуя гидриды:
Гидрид лития используется как сильный восстановитель.
Гидроксиды щелочных металлов разъедают стеклянную и фарфоровую посуду, их нельзя нагревать и в кварцевой посуде:
Гидроксиды натрия и калия не отщепляют воду при нагревании вплоть до температур их кипения (более 1300 0 С). Некоторые соединения натрия называют содами :
а) кальцинированная сода, безводная сода, бельевая сода или просто сода – карбонат натрия Na 2 CO 3 ;
б) кристаллическая сода – кристаллогидрат карбоната натрия Na 2 CO 3 . 10H 2 O;
в) двууглекислая или питьевая – гидрокарбонат натрия NaHCO 3 ;
г) гидроксид натрия NaOH называют каустической содой или каустиком.
Основные характеристики и свойства щелочных металлов
Название «щелочные металлы» произошло от их способности в реакциях с водой образовывать щелочи — основания, растворимые в воде. Слово «выщелачивать» славянского происхождения. В переводе оно означает «растворять».
Щелочными называют металлы IA группы таблицы Менделеева. Их шесть: литий, натрий, рубидий, калий, цезий, франций. По внешнему виду они представляют собой металлы серебристо-белого цвета, за исключением цезия — он золотисто-желтый. Основные физические свойства простых веществ:
- пластичность;
- мягкость;
- невысокая плотность;
- высокая химическая активность;
- легкая окисляемость;
- электропроводность;
- теплопроводность;
- легкоплавкость.
В связи со способностью быстро окисляться, т.е. вступать в реакцию с кислородом и другими веществами, в природе они встречаются в форме соединений.
Соли щелочных металлов окрашивают пламя спиртовки в различные цвета:
В отличие от этих двух представителей, литий, рубидий, цезий не встречаются в природе часто. Следовательно, они относятся к группе редких металлов. Франций — искусственно полученный элемент, отличающийся радиоактивностью.
Калий и натрий являются участниками водно-солевого, а также кислотно-щелочного баланса организма человека. Эти элементы важны для циркуляторных процессов крови, деятельности энзимов. Для жизнедеятельности растений особенно важен калий.
Щелочные металлы имеют валентность, равную единице (степень окисления +1).
Поскольку данная группа элементов в системе Менделеева следует непосредственно за инертными газами, у атомов щелочных металлов появляется новый энергетический уровень, на котором содержится один электрон. Электронная конфигурация — ns1.
Поскольку любой атом стремится приобрести конфигурацию инертного газа, атомы щелочных металлов способны легко отдать валентные электроны и проявлять восстановительные свойства. Этот факт свидетельствует о невысоких значениях энергии ионизации их атомов, а также о низких значениях электроотрицательности.
Сверху вниз по группе наблюдается увеличение радиуса атомов, снижение электроотрицательности, увеличение восстановительных свойств простых веществ.
Какие элементы относятся к щелочным металлам
Перечень щелочных металлов:
- литий — Li;
- натрий — Na;
- калий — K;
- рубидий — Rb;
- цезий — Zs;
- франций — Fr.
Они занимают IA группу в Периодической системе Д. И. Менделеева.
Электронная формула, в какую группу входят
Строение атомов щелочных металлов, которые расположены в IA группе, можно свести к таблице следующего вида:
В роли окислителей в таких взаимодействиях участвуют простые и сложные вещества. Это могут быть неметаллы, органические соединения, кислоты, соли, оксиды.
Каждый элемент взаимодействует индивидуально.
Оксид в качестве продукта образовывается только в реакциях лития:
4 L i + O 2 = 2 L i 2 O
В случае с натрием в ходе реакции образуется пероксид, а с калием, рубидием, цезием — надпероксид:
2 N a + O 2 = N a 2 O 2
- К реакциям с простыми веществами относится образование галогенидов:
2 N a + C l 2 = 2 N a C l
Рассматривая взаимодействие с H2, S, P, C, Si, необходимо знать, что для протекания данных реакций необходимо нагревание.
Литий реагирует с азотом при комнатной температуре.
- Реакции с водой протекают у щелочных металлов по-разному: литий — спокойно, всплывая на поверхность жидкости, натрий реагирует более активно с образованием пламени, калий, цезий и рубидий реагируют со взрывом. В общем виде
2 M + 2 H 2 O = 2 M O H + H 2 (М – металл)
- В два этапа протекают реакции с кислотами. Металл сначала вступает в реакцию с водой, а после, в момент образования щелочи, она реагирует с разбавленной кислотой и нейтрализуется. Такие реакции часто протекают со взрывом, поэтому на практике проводятся редко.
- В результате реакции с аммиаком образуются амиды:
2 L i + 2 N H 3 = 2 L i N H 2 + H 2
- Взаимодействие с этанолом, фенолами, в ходе которого щелочные металлы замещают атомы водорода в гидроксильной группе ОН этих соединений:
2 N a + 2 C 2 H 5 O H = 2 C 2 H 5 O N a + H 2
- Щелочные металлы могут использоваться для восстановления других металлов, к примеру, алюминия:
3 N a + A l C l 3 = A l + 3 N a C l
Физические свойства щелочных металлов объясняются металлической связью в кристаллической решетке. Для них характерен металлический блеск, отличная ковкость, пластичность, тепло- и электропроводность.
Самым твердым из всей группы является литий, а самая высокая плотность у цезия. Некоторые физические свойства щелочных металлов в сравнении представлены в следующей таблице:
Из таблицы следует, что все элементы получили свое применение благодаря низким температурам плавления (кипения). Их значения снижаются по мере увеличения порядкового номера в Периодической системе Менделеева.
Все металлы, за исключением лития, настолько мягки, что их можно разрезать ножом или на специальном оборудовании раскатать в лист фольги.
Еще одно свойство, которое имеет практическое значение в промышленности — низкая плотность. Плотность лития, натрия и калия ниже плотности воды.
Указанные физические свойства обусловлены слабой связью электронов внешних слоев с атомами щелочных металлов. Поэтому энергия ионизации атомов невысокая, и они при взаимодействии друг с другом образуют металлическую связь.
В периодической таблице в начале каждого периода стоит элемент с низкой температурой плавления (щелочной металл). По мере увеличения порядковых номеров в периоде слева направо этот показатель сначала увеличивается к середине периода (IV А группа), где расположены элементы, образующие преимущественно атомные кристаллические решетки (C, Si).
Затем в конце периода температуры плавления снова уменьшаются, поскольку в VII-VIII группах расположены элементы, простые вещества которых характеризуются молекулярными кристаллическими решетками (галогены, благородные газы).
Меры предосторожности при работе с ними
Из-за высокой химической активности работа со щелочными металлами должна осуществляться с большой осторожностью. Для их хранения выделяются отдельные емкости, которые запаивают и помещают в них слой вазелинового масла или керосина. Тогда предотвращается взаимодействие с воздухом, в частности с кислородом, и исключается горение.
На каждом предприятии, где осуществляются работы с этими химическими элементами и их соединениями, разрабатываются специальные правила безопасности и меры предосторожности, исключающие наступление аварийных ситуаций и производственных травм.
Все сотрудники перед получением допуска к работе должны пройти обязательный производственный инструктаж, который бывает предварительный (перед началом работы) и периодический (через равные промежутки времени — ежеквартально, ежегодно). Они включают качественное изучение требований нормативных документов по безопасности труда и производственному нормированию.
Сотрудники на своих рабочих местах должны находиться в защитной спецодежде, быть оснащены средствами индивидуальной защиты (для органов зрения, дыхания, кожных покровов).
Поскольку растворы щелочных металлов — щелочи, их воздействие на кожу может привести к ожогам и раздражениям. Щелочи при попадании брызг в глаза могут спровоцировать отторжение ветвей глазного нерва и вызвать полную слепоту.
Выше описана возможность бурной реакции металлов с кислородом вплоть до взрыва. Поэтому рабочие места укомплектовываются средствами пожаротушения, которые периодически проходят технические проверки своей исправности. Щелочные металлы нельзя тушить водой, так как они вступают в реакцию с ней.
Натрий и калий можно тушить аргоном и азотом. Аргон эффективнее, поскольку существенно тяжелее воздуха. Литий продолжает гореть в атмосфере азота и диоксида углерода. Для тушения горящего лития разработаны специальные порошковые составы Вексон-D3 на основе различных флюсов и графита с гидрофобизирующими добавками.
С соблюдением техники безопасности проводится и утилизация отходов после работы. Они подвергаются нейтрализации с применением специальных составов, разрешенных для применения компетентными органами.
Получение простых веществ, где применяются
Чистый натрий можно получать путем электролиза расплава хлорида натрия с графитовыми электродами, обладающими инертностью. Поскольку в таком расплаве имеются ионы Na и Cl, в ходе электролиза на катоде восстанавливаются катионы натрия до металлического натрия, а на аноде — окисляются анионы хлора до газообразного хлора.
Щелочные металлы
К щелочным металлам относят химические элементы: одновалентные металлы, составляющие Ia группу: литий, натрий, калий, рубидий, цезий и франций.
Эти металлы очень активны, быстро окисляются на воздухе и бурно реагируют с водой. Их хранят под слоем керосина из-за их сильной реакционной способности.

Общая характеристика
От Li к Fr (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств, реакционной способности. Уменьшается электроотрицательность, энергия ионизации, сродство к электрону.

- Li - 2s 1
- Na - 3s 1
- K - 4s 1
- Rb - 5s 1
- Cs - 6s 1
- Fr - 7s 1
Природные соединения
- NaCl - галит (каменная соль)
- KCl - сильвин
- NaCl*KCl - сильвинит

Получение
Получить такие активные металлы электролизом водного раствора - невозможно. Для их получения применяют электролиз расплавов при высоких температурах (естественно - безводных):
NaCl → Na + Cl2↑ (электролиз расплава каменной соли)
Химические свойства
Одной из особенностей щелочных металлов является их реакция с кислородом. Литий в такой реакции преимущественно образует оксид, натрий - пероксид, калий, рубидий и цезий - супероксиды.
K + O2 → KO2 (супероксид калия)
Помните, что металлы никогда не принимают отрицательных степеней окисления. Щелочные металлы одновалентны, и проявляют постоянную степень окисления +1 в различных соединениях: гидриды, галогениды (фториды, хлориды, бромиды и йодиды), нитриды, сульфиды и т.д.
Li + H2 → LiH (в гидридах водород -1)
Na + F2 → NaF (в фторидах фтор -1)
Na + S → Na2S (в сульфидах сера -2)
K + N2 → K3N (в нитридах азот -3)
Щелочные металлы бурно взаимодействуют с водой, при этом часто происходит воспламенение, а иногда - взрыв.
Na + H2O → NaOH + H2↑ (воду можно представить в виде HOH - натрий вытесняет водород)
Иногда в задачах может проскользнуть фраза такого плана: ". в ходе реакции выделился металл, окрашивающий пламя горелки в желтый цвет". Тут вы сразу должны догадаться: речь, скорее всего, про натрий.
Щелочные металлы по-разному окрашивают пламя. Литий окрашивает в алый цвет, натрий - в желтый, калий - в фиолетовый, рубидий - синевато-красный, цезий - синий.

Оксиды щелочных металлов
Имеют общую формулу R2O, например: Na2O, K2O.
Получение оксидов щелочных металлов возможно в ходе реакции с кислородом. Для лития все совсем несложно:
В подобных реакциях у натрия и калия получается соответственно пероксид и супероксид, что приводит к затруднениям. Как из пероксида, так и из супероксида, при желании можно получить оксид:
По свойствам эти оксиды являются основными. Они хорошо реагируют c водой, кислотными оксидами и кислотами:
Li2O + H2O → LiOH (осн. оксид + вода = основание - реакция идет, только если основание растворимо)
Na2O + SO2 → Na2SO3 (обратите внимание - мы сохраняем СО серы +4)
Гидроксиды щелочных металлов
Относятся к щелочам - растворимым основаниям. Наиболее известные представители: NaOH - едкий натр, KOH - едкое кали.
Гидроксиды щелочных металлов получаются в ходе электролиза водных растворов их солей, в реакциях обмена, в реакции щелочных металлов и их оксидов с водой:
KCl + H2O → (электролиз!) KOH + H2 + Cl2 (на катоде выделяется водород, на аноде - хлор)

Проявляют основные свойства. Хорошо реагируют с кислотами, кислотными оксидами и солями, если в ходе реакции выпадает осадок, выделяется газ или образуется слабый электролит (вода).
LiOH + H2SO4 → LiHSO4 + H2O (соотношение 1:1, кислота в избытке - получается кислая соль)
2LiOH + H2SO4 → Li2SO4 + 2H2O (соотношение 2:1, основание в избытке - получается средняя соль)
KOH + SO2 → KHSO3 (соотношение 1:1 - получается кислая соль)
2KOH + SO2 → K2SO3 + H2O (соотношение 2:1 - получается средняя соль)
С амфотерными гидроксидами реакции протекают с образованием комплексных солей (в водном растворе) или с образованием окиселов - смешанных оксидов (при высоких температурах - прокаливании).
NaOH + Al(OH)3 → Na[Al(OH)4] (в водном растворе образуются комплексные соли)
NaOH + Al(OH)3 → NaAlO2 + H2O (при прокаливании образуется окисел - смесь двух оксидов: Al2O3 и Na2O, вода испаряется)
Реакции щелочей с галогенами заслуживают особого внимания. Без нагревания они идут по одной схеме, а при нагревании эта схема меняется:
NaOH + Cl2 → NaClO + NaCl + H2O (без нагревания хлор переходит в СО +1 и -1)
NaOH + Cl2 → NaClO3 + NaCl + H2O (с нагреванием хлор переходит в СО +5 и -1)
В реакциях щелочей с йодом образуется исключительно иодат, так как гипоиодит неустойчив даже при комнатной температуре, не говоря о нагревании. С серой реакция протекает схожим образом:
NaOH + I2 → NaIO3 + NaI + H2O (с нагреванием)

NaOH + S → Na2S + Na2SO3 + H2O (сера переходит в СО -2 и +4)
Уникальным является также взаимодействие щелочей с кислотным оксидом NO2, который соответствует сразу двум кислотам - и азотной, и азотистой.
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
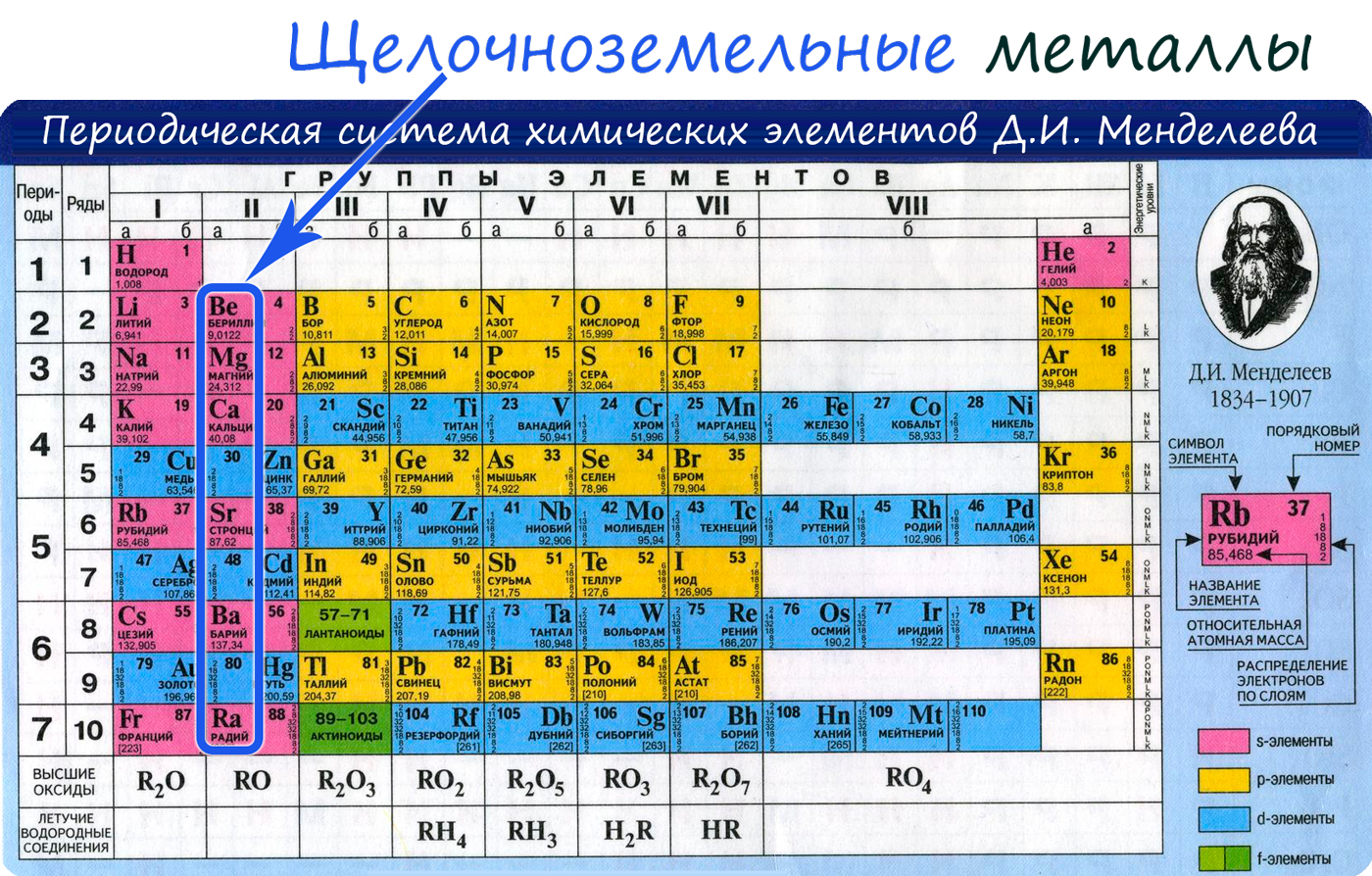
Щелочноземельные металлы
К щелочноземельным металлам относятся металлы IIa группы: бериллий, магний, кальций, стронций, барий и радий. Отличаются легкостью, мягкостью и сильной реакционной способностью.
От Be к Ra (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств, реакционная способность. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
- Be - 2s 2
- Mg - 3s 2
- Ca - 4s 2
- Sr - 5s 2
- Ba - 6s 2
- Ra - 7s 2
- Be - BeO*Al2O3*6SiO2 - берилл
- Mg - MgCO3 - магнезит, MgO*Al2O3 - шпинель, 2MgO*SiO2 - оливин
- Ca - CaCO3 - мел, мрамор, известняк, кальцит, CaSO4*2H2O - гипс, CaF2 - флюорит

Это активные металлы, которые нельзя получить электролизом раствора. С целью их получения применяют электролиз расплавов, алюминотермию и вытеснением их из солей другими более активными металлами.
MgCl2 → (t) Mg + Cl2 (электролиз расплава)
CaO + Al → Al2O3 + Ca (алюминотермия - способ получения металлов путем восстановления их оксидов алюминием)

Все щелочноземельные металлы (кроме бериллия и магния) реагируют с холодной водой с образованием соответствующих гидроксидов. Магний реагирует с водой только при нагревании.
Щелочноземельные металлы - активные металлы, стоящие в ряду активности левее водорода, и, следовательно, способные вытеснить водород из кислот:
Хорошо реагируют с неметаллами: кислородом, образуя оксиды состава RO, с галогенами (F, Cl, Br, I). Степень окисления у щелочноземельных металлов постоянная +2.
Mg + O2 → MgO (оксид магния)
При нагревании реагируют с серой, азотом, водородом и углеродом.
Mg + S → (t) MgS (сульфид магния)
Ca + H2 → (t) CaH2 (гидрид кальция)
Ba + C → (t) BaC2 (карбид бария)

Ba + TiO2 → BaO + Ti (барий, как более активный металл, вытесняет титан)
Оксиды щелочноземельных металлов
Имеют общую формулу RO, например: MgO, CaO, BaO.
Оксиды щелочноземельных металлов можно получить путем разложения карбонатов и нитратов:
Рекомендую взять на вооружение общую схему разложения нитратов:

Проявляют преимущественно основные свойства, все кроме BeO - амфотерного оксида.
- Реакции с кислотами и кислотными оксидами
В нее вступают все, кроме оксида бериллия.
Амфотерные свойства оксида бериллия требуют особого внимания. Этот оксид проявляет двойственные свойства: реагирует с кислотами с образованием солей, и с основаниями с образованием комплексных солей.
BeO + NaOH + H2O → Na2[Be(OH)4] (тетрагидроксобериллат натрия)
Если реакция проходит при высоких температурах (в расплаве) комплексная соль не образуется, так как происходит испарение воды:
BeO + NaOH → Na2BeO2 + H2O (бериллат натрия)

Гидроксиды щелочноземельных металлов
Проявляют основные свойства, за исключением гидроксида бериллия - амфотерного гидроксида.
Получают гидроксиды в реакции соответствующего оксида металла и воды (все кроме Be(OH)2)
Основные свойства большинства гидроксидов располагают к реакциям с кислотами и кислотными оксидами.

Реакции с солями (и не только) идут в том случае, если соль растворимы и по итогам реакции выделяется газ, выпадает осадок или образуется слабый электролит (вода).
Гидроксид бериллия относится к амфотерным: проявляет двойственные свойства, реагируя и с кислотами, и с основаниями.
Жесткость воды
Жесткостью воды называют совокупность свойств воды, зависящую от присутствия в ней преимущественно солей кальция и магния: гидрокарбонатов, сульфатов и хлоридов.
Различают временную (карбонатную) и постоянную (некарбонатную) жесткость.
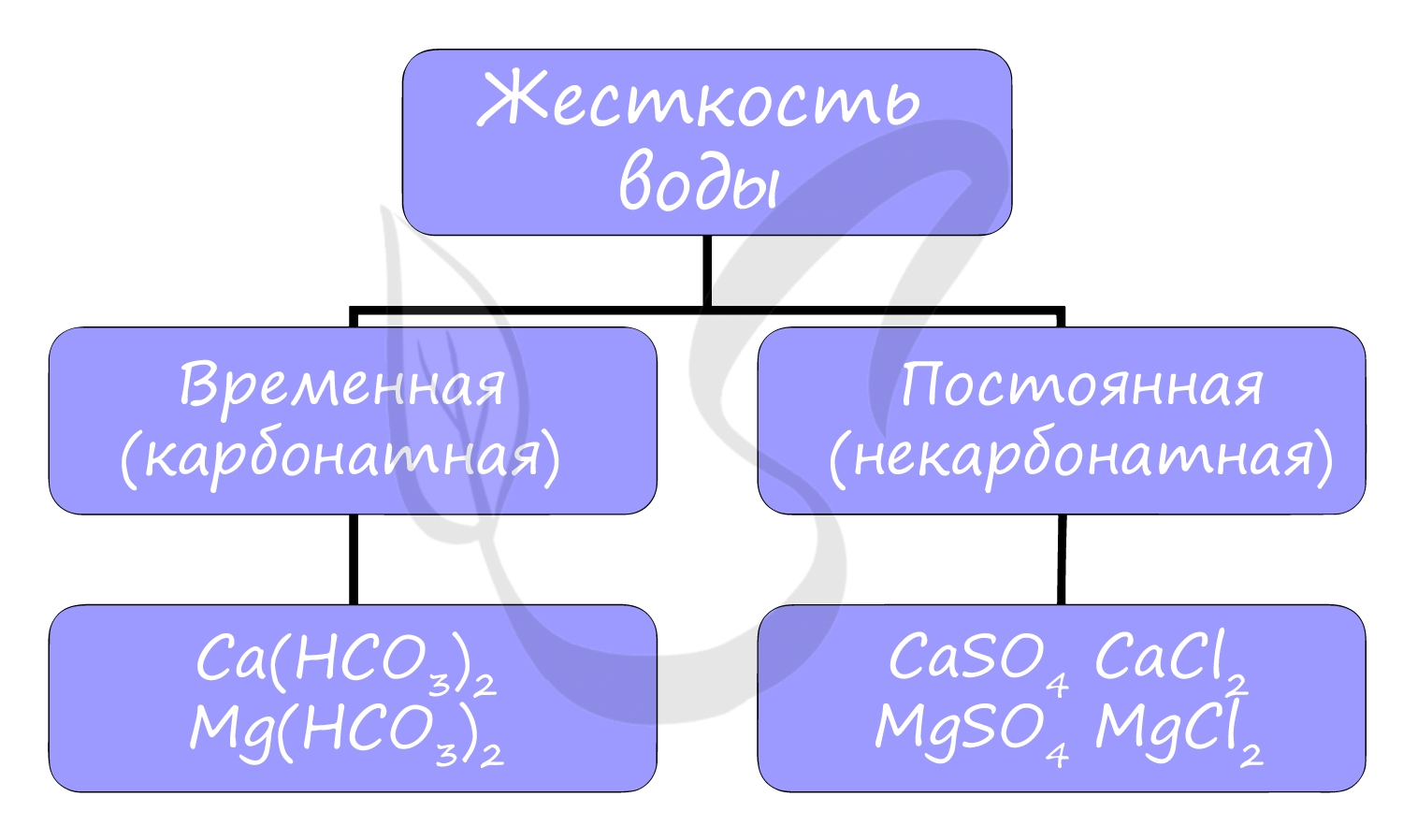
Вероятно, вы часто устраняете жесткость воды у себя дома, осмелюсь предположить - каждый день. Временная жесткость воды устраняется обычным кипячением воды в чайнике, и известь на его стенках - CaCO3 - бесспорное доказательство устранения жесткости:
Также временную жесткость можно устранить, добавив Na2CO3 в воду:
С постоянной жесткостью бороться кипячением бесполезно: сульфаты и хлориды не выпадут в осадок при кипячении. Постоянную жесткость воды устраняют добавлением в воду Na2CO3:
Жесткость воды можно определить с помощью различных тестов. Чрезмерно высокая жесткость воды приводит к быстрому образованию накипи на стенках котлов, труб, чайника.

Читайте также:

