Восстанавливать металлы из их оксидов способен
В основе данного метода, охватывающего широкий круг реакций, лежит восстановление выбранного металла каким-либо восстановителем в газообразной или жидкой фазе. Реакции в твердой фазе не получили широкого распространения вследствие трудностей, возникающих при разделении продуктов реакции и непрореагировавших исходных веществ.
Восстановителями могут быть вещества в различных агрегатных состояниях, в том числе и твердом состоянии. В последнем случае крайне желательно, чтобы продукты реакции находились в другом агрегатном состоянии (жидком или газообразном). Применение восстановителей в различных агрегатных состояниях приводит и к различию в кинетических характеристиках системы, что, безусловно, следует учитывать при проведении синтеза.
Чаще всего металлы получают из их оксидов или сульфидов, поскольку, с одной стороны, многие руды представляют собой либо оксиды, либо сульфиды металлов, и, с другой стороны, термодинамика и кинетика подобных реакций достаточно хорошо изучены.
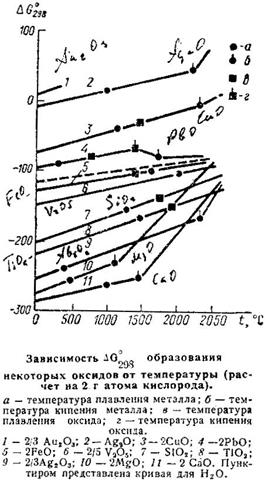
Как уже неоднократно упоминалось, возможность протекания реакции восстановления зависит от соотношения изобарно-изотермичеоких потенциалов конечных и начальных продуктов реакции. Чем больше их разница, тем вероятнее протекание реакции. Зависимость для некоторых оксидов от температуры представлена на рисунке.
Из рисунка видно, что чем ниже линии , тем устойчивее оксид и тем сильнее восстановительная способность свободного металла.
Для сравнения на рисунка приведена зависимость ∆G 0 от температуры для реакции 2Н2+О2=2Н2О (пунктирная линия). Из рисунка видно, что наиболее активным восстановителем является кальцин, водород же способен восстанавливать далеко не все металлы из их оксидов.
В табл. 5 приведены справочные данные о стандартных изобарно-изотермических потенциалах ( ) образования некоторых оксидов, сульфидов и галогенидов.
Чаще других для непосредственного восстановления металлов из их оксидов применяется один из достаточно сильных восстановителей – алюминий. Металлотермические реакции довольно подробно описаны в литературе, поэтому останавливаться на условиях их протекания нет большой необходимости. Однако следует заметить, что синтезировать достаточно чистые металлы таким путем, как правило, не удается. Дальнейшая очистка требует существенных затрат времени и энергии, что приводит к нерентабельности применения данного метода для получения чистых металлов. Металлотермию, по-видимому, следует применять только в тех случаях, когда другие методы не в состоянии обеспечить получения металла или когда чистота металла не играет существенной роли.
Более выгодно применение восстановителей, находящихся в другом агрегатном состоянии, в частности в газообразном, ибо продукты окисления, появляющиеся в результате проведения восстановления металла из оксидов, легко удаляются из зоны реакции, смещая равновесие в сторону получения металла.
Как уже упоминалось, возможно, применение восстановителей и в твердом состоянии в том случае, если продукты реакции получаются в газообразном или жидком состоянии.
При проведении синтезов в подобных системах необходимо обращать особое внимание на кинетику удаления продуктов реакции из твердой фазы, применяя соответствующие условия синтеза.
Естественно, что процесс восстановления возможен только в тех случаях, которые разрешены термодинамикой. Проводя восстановление подобного вида, нужно помнить, что с уменьшением степени окисления металла в оксиде прочность связи металл-кислород возрастает, в результате чего могут воз никнуть условия, при которых восстановление, Например, водородом, остановится на какой-либо ступени окисления металла, к.е. образуется не свободный металл, а оксид в более низком состоянии окисления металла.
Стандартные изобарно-изотермические потенциалы ( ) (кДж/моль) образования некоторых оксидов, галогенидов и сульфидов.
| Вещество | Вещество | Вещество | |||
| Оксиды | Оксиды | Галогениды | |||
| Ag2O A12O3 As2O3 As2O5 BaO BaO2 BeO B2O3 Bi2O3 CaO Ce2O3 CeO2 CdO CoO Co3O4 Cr2Os CrO3 Cu2O CuO Fe2O3 GeO GeO2 HgO HfO2 In2O3 La2O3 Li2O MgO MnO Mn2O3 MnO2 Mn2O7 MoO2 | 10,5 1583,8 569,8 773,0 511,2 584,5 579,0 1195,0 494,4 605,0 1709,5 1026,6 228,8 215,4 765,2 1060,9 505,7 148,3 128,2 743,3 209,9 502,8 58,7 1154,6 831,7 1707,8 562,7 570,3 363,3 882,6 465,9 544,7 536,0 | MoO3 Na2O Nb2O3 Nb2O5 Nb2O4 NiO PbO PbO2 Rb2O Re2O7 SnO SnO2 Sb2O3 Sb2O5 SeO2 SeO3 SiO2 SrO Ta205 TeO2 TiO2 VO V203 VO2 V2O3 UO2 WO2 WO3 ZnO ZrO2 | 668,7 379,6 1772,4 1766,5 1516,8 212,0 189,0 217,9 293,3 1050,4 257,3 520,8 636,9 866,1 171,8 84,2 857,7 574,9 1915,2 264,8 890,4 404,8 1150,5 1320,3 1428,8 1033,7 534,6 765,1 321,4 1044,56 | AgBr AgCl AgF AgI AlF3 A1C13 A1I3 AuF AuCl AuF3 AuCl BaF2 BaCl2 BeF2 BeCl2 CaF2 CaCl2 CaI2 CdF2 CdCl2 CdBr2 CdI2 CrCl2 CrI2 CrCl3 CeCl3 CoCl2 CuF CuCl CuBr CuI CuCl2 CuF2 | 97,6 109,8 186,5 66,2 1433,0 629,8 314,3 58,7 19,7 297,5 49,0 1139,7 798,6 988,8 446,2 1177,8 750,4 529,6 652,0 344,8 297,5 204,0 357,0 230.0 446,6 985,5 270,2 230,5 119,4 102,2 71,2 172,2 492,7 |
| Галогениды | Галогениды | Сульфиды | |||
| MoI2 NiF2 NiCl2 NaF NaCl NaBr NaI PbF2 PbCl2 PbBr2 PbI2 PbCl4 RbCl RbI SrF2 SrBr2 SbCl3 SeCl4 ThF4 ThCl4 TiCl2 TiCl3 TiI4 TiBr4 TiCl4 | 54,5 611,3 259,4 547,2 385,1 349,5 285,8 628,5 314,6 262,3 176,4 356,0 408,1 329,3 1182,4 709,4 324,3 859,0 2004,5 1106,2 469,7 665,8 381,3 590,8 754,0 | TlCl TlI TlCl3 VCl2 VC13 UF4 WI2 ZnF2 ZnCl2 ZnBr2 ZnI2 ZrF4 ZrCl4 | 185,2 125,3 293,3 397,6 515,0 1836,5 10,5 714,4 571,1 313,0 212,0 1812,6 976,3 | Ag2S Bi2S3 CdS CoS CoS2 Co2S4 CuS Cu2S FeS FeS2 Fe2S2 GeS GeS2 HgS MnS MnS2 MoS2 NiS Ni2S3 PbS Sb2S3 SnS T12S3 WS2 ZnS | 40,6 153,4 140,8 84,6 137,4 323,9 53,6 86,3 100,6 163,0 281,1 70,0 187,7 49,0 218,3 232,5 226,3 79,6 197,3 98,9 156,3 98,5 93,9 204,1 198,6 |

Восстановление галогенидов (кроме фторидов) или сульфитов водородом протекает обычно с большим трудом, чем восстановление оксидов, так как изменение изобарно-изотермического потенциала при образовании галогеноводородов или сероводорода гораздо менее благоприятно, нежели при образовании воды, в чем можно убедиться, проанализировав нижеприведенные данные.
| Соединение | H20 | H2S | HF | HCl | HBr | HI |
| 228.8 | 33.5 | 270.3 | 95.3 | 53.6 | –1.3 |
Кроме того, применение галогенидов в качестве восстанавливающихся объектов не имеет каких-либо преимуществ по сравнению с оксидами, ибо безводные галогениды получаются газ оксидов (особенно тугоплавких), как правило, с большим трудом. Использовать галогениды, вероятно, целесообразно только тогда, когда образование низшего оксида затрудняет полное восстановление. Так, например, V2O4 восстанавливается водородом только до VO и то при высоких температурах (~1700°С). Получение же металла если и возможно, то при еще больших температурах и повышенном давлении. В то же время VCl3 или VC14 восстанавливается водородом до металла. С помощью восстановления водородом можно получить достаточно чистые металлы, так как сам водород легко получается в чистом состоянии; при этом водород не образует мешающих побочных продуктов и без труда может быть удален откачиванием при нагревании.
Иногда вместо водорода используют оксид углерода или аммиак. Восстановление с помощью оксида углерода (II) начинается часто при более низкой температуре, чем с помощью водорода (оксид железа восстанавливается угарным газом при температуре меньшей 240°С). Однако в большинстве случаев образующийся металл катализирует побочную реакцию 2СО 2, что приводит к неизбежному выделению углерода и загрязнению металла, если процесс проводить при температуре не ниже 1000°С. Лишь немногие металлы не оказывают каталитического действия на реакцию диспропорционирования оксида углерода, например, серебро, медь, свинец, сурьма и висмут.
Применение аммиака в качестве восстановителя ограничено системами, в которых исключается образование устойчивых нитридов (системы с кобальтом, никелем, висмутом).
До сих пор мы рассматривали реакции, протекающие в отсутствие растворителя. Однако восстановление металлов из их солей может осуществляться и путем применения так называемых гидрометаллургических (или сольвометаллургических, если реакция идет не в водном растворе) процессов. В основе подобного вида синтезов металлов лежит ряд напряжения металлов и, в частности, общеизвестное следствие из него, говорящее о возможности вытеснения каждым предыдущим металлом этого ряда любого последующего металла из его соли. При проведении реакций восстановления в водных растворах (особенно подкисленных) нужно помнить, что в присутствии металлов сильных восстановителей ионы гидроксония восстанавливаются до водорода. Протекание окислительно-восстановительной реакции, как известно, зависит не только от активности самого восстановителя (металла или его амальгамы), но также от активности связанного иона. В качестве металлов-восстановителей в водном растворе прежде всего имеют значение цинк, кадмий, алюминий и магний, а также амальгамы щелочных и щелочноземельных металлов. Названные металлы образуют в большинстве случаев легкорастворимые соли, редко мешающие выделению и дальнейшей очистке восстановленного металла. Вследствие легкой восстанавливаемости иона водорода такие сильные восстановители, как натрий, калий или кальций в водном и даже спиртовом растворе почти не применимы. Однако жидкий аммиак растворяет эти металлы без изменения степени окисления и в отсутствие катализатора реагирует с ними лишь крайне медленно с выделением водорода. Восстановление в этих условиях в большинстве случаев протекает настолько гладко, что избыток восстановителя не требуется. Реакционная способность калия и натрия, растворенных в жидком аммиаке, примерно одинакова; раствор кальция по сравнению с ними во многих случаях оказывается более реакционноспособным. Взаимодействие калия с галогенидами металлов в жидком аммиаке чаще всего ведет к образованию свободного металла, который выделяется в очень тонко измельченной форме или образует с избытком восстановителя интерметаллическое соединение. Часто выделившиеся металлы (никель, железо, марганец, серебро) катализируют разложение избыточного восстановителя на щелочной амид и водород.
Вытеснение менее активных металлов металлами более активными осуществляется и в средах, содержащих алкилы металлов. Например, диметилртуть Hg(CH3)2 реагирует с литием, натрием, магнием или алюминием с выделением металлической ртути и образованием алкилов соответствующих металлов.
Из рассмотрения окислительно-восстановительных потенциалов многих систем можно заключить, что лишь небольшая часть восстановителей-неметаллов может быть пригодна для восстановления некоторых металлов из растворов их солей. Нужно заметить, что такие окислительно-восстановительные системы во многих случаях необратимы и непосредственно измеряемые потенциалы не всегда совпадают с рассчитанными по термодинамических данных. Метастабильный характер участвующих в реакции ионов и связанное с этим замедление реакции часто устраняют катализаторами, например тонкоизмельченным палладием.
Стандартные электродные потенциалы (φ0) некоторых неметаллов в водных растворах
| Реакция | φ0, В | |
| pH0 | pH14 | |
| S 2- 3PO2 + H2O 3PO3 + 2H + + 2ē HS2O4 - + 2H2O 2SO3 + H + + 2ē H3PO3 + H2O 3PO4 + 2H + + 2ē Sn 2+ 2S CO2 + 2H + + 2ē CH2O + H2O 3OH 2O + 2H + + 2ē H2C2O4 2 + 2H + + 2ē 2H2SO3 2O6 2- + 4H + + 2ē 2NH2OH 2O + H2O + 4H + + 4ē N2H4 2 + 4H + + 4ē H2O2 2 + 2H + + 2ē HNO2 + 2H2O 3 - + 3H + + 2ē | – 0,55 – 0,50 – 0,23 – 0,20 + 0,15 + 0,14 – 0,20 + 0,06 + 0,19 – 0,49 + 0,20 – 0,05 – 0,23 + 0,68 + 0,93 | – – 1,57 – 1,13 – 1,12 – 0,90 – 0,48 – 1,0 – 1,11 – 0,59 – – 0,90 – 1,05 – – 0,07 + 0,01 |
В табл. 6 приведены наиболее употребительные в водных растворах восстановители, окислительный потенциал (φ0) которых позволяет восстанавливать некоторые (металлы из их солей. Значения φ0 рассчитаны по отношению к водородному электроду при 25°С для водных растворов с активностью ионов водорода, равной единице. Для сравнения стандартные окислительные потенциалы приведены в таблице при двух значениях рН раствора (0 и 14). Интервал значений φ0 для систем, приведенных в таблице, колеблется от –1,57 В до +93 В, в то время как для систем М/М+ (табл. 7) интервал значений φ0 находится в пределах от –3,02 В (для системы Li/Li+) до + 1,68 В (для системы Au/Au+). С одной стороны, это говорит о том, что часть металлов (φ00 часто изменяется при введении комплексообразователя и образования осадка. Данное обстоятельство нужно иметь в виду при получении металлов с применением восстановителей.
Стандартные электродные потенциалы (φ0) некоторых металлов в водных растворах
| Реакция | φ0, В | Реакция | φ0, В |
| Csтв тв тв тв тв тв тв тв тв тв тв тв тв тв ↔ Zn 2+ + 2e - Cr тв ↔ Cr 3+ + 3e - Fe тв ↔ Fe 2+ + 2e - Cd тв ↔ Cd 2+ + 2e - | – 3.02 – 3.02 – 2.92 – 2.92 – 2.90 – 2.87 – 2.89 – 2.71 – 2.40 – 2.34 – 1.67 – 1.05 – 0.83 – 0.76 – 0.71 – 0.44 – 0.40 | Tlтв тв тв тв тв тв 2газ тв тв тв тв ж 2 2+ + 2ē Pdтв тв ↔ Ag + + e - Hg ж ↔ Hg 2+ + 2e - Au тв ↔ Au 3+ + 3e - Au тв ↔ Au + + e - | – 0.33 – 0.28 – 0.25 – 0.14 – 0.13 – 0.04 0.0 0.2 0.2 0.34 0.52 0.80 0.82 0.80 0.85 1.42 1.68 |

Химические свойства основных оксидов

Подробно про оксиды, их классификацию и способы получения можно прочитать здесь.
1. Взаимодействие с водой. С водой способны реагировать только основные оксиды, которым соответствуют растворимые гидроксиды (щелочи). Щелочи образуют щелочные металлы (литий, натрий, калий, рубидий и цезий) и щелочно-земельные (кальций, стронций, барий). Оксиды остальных металлов с водой химически не реагируют. Оксид магния реагирует с водой при кипячении.
CuO + H2O ≠ (реакция не идет, т.к. Cu(OH)2 — нерастворимый гидроксид)
2. Взаимодействие с кислотными оксидами и кислотами. При взаимодействии основным оксидов с кислотами образуется соль этой кислоты и вода. При взаимодействии основного оксида и кислотного образуется соль:
основный оксид + кислота = соль + вода
основный оксид + кислотный оксид = соль
При взаимодействии основных оксидов с кислотами и их оксидами работает правило:
Хотя бы одному из реагентов должен соответствовать сильный гидроксид (щелочь или сильная кислота).
Иными словами, основные оксиды, которым соответствуют щелочи, реагируют со всеми кислотными оксидами и их кислотами. Основные оксиды, которым соответствуют нерастворимые гидроксиды, реагируют только с сильными кислотами и их оксидами (N2O5, NO2, SO3 и т.д.).
| Основные оксиды, которым соответствуют щелочи | Основные оксиды, которым соответствуют нерастворимые основания |
| Реагируют со всеми кислотами и их оксидами | Реагируют только с сильными кислотами и их оксидами |
| Na2O + SO2 → Na2SO3 | CuO + N2O5 → Cu(NO3)2 |
3. Взаимодействие с амфотерными оксидами и гидроксидами.
При взаимодействии основных оксидов с амфотерными образуются соли:
основный оксид + амфотерный оксид = соль
С амфотерными оксидами при сплавлении взаимодействуют только основные оксиды, которым соответствуют щелочи . При этом образуется соль. Металл в соли берется из более основного оксида, кислотный остаток — из более кислотного. В данном случае амфотерный оксид образует кислотный остаток.
CuO + Al2O3 ≠ (реакция не идет, т.к. Cu(OH)2 — нерастворимый гидроксид)
(чтобы определить кислотный остаток, к формуле амфотерного или кислотного оксида добавляем молекулу воды: Al2O3 + H2O = H2Al2O4 и делим получившиеся индексы пополам, если степень окисления элемента нечетная: HAlO2. Получается алюминат-ион AlO2 — . Заряд иона легко определить по числу присоединенных атомов водорода — если атом водорода 1, то заряд аниона будет -1, если 2 водорода, то -2 и т.д.).
Амфотерные гидроксиды при нагревании разлагаются, поэтому реагировать с основными оксидами фактически не могут.
4. Взаимодействие оксидов металлов с восстановителями.
При оценке окислительно-восстановительной активности металлов и их ионов можно использовать электрохимический ряд напряжений металлов:

Восстановительные свойства (способность отдавать электроны) у простых веществ-металлов здесь увеличиваются справа налево, окислительные свойства ионов металлов — увеличиваются наоборот, слева направо. При этом некоторые ионы металлов в промежуточных степенях окисления могут проявлять также восстановительные свойства (например ион Fe 2+ можно окислить до иона Fe 3+ ).
Более подробно про окислительно-восстановительные реакции можно прочитать здесь.
Таким образом, ионы некоторых металлов — окислители (чем правее в ряду напряжений, тем сильнее). При взаимодействии с восстановителями металлы переходят в степень окисления 0.
4.1. Восстановление углем или угарным газом.
Углерод (уголь) восстанавливает из оксидов до простых веществ только металлы, расположенные в ряду активности после алюминия. Реакция протекает только при нагревании.
FeO + C = Fe + CO

Активные металлы, расположенные в ряду активности левее алюминия, активно взаимодействуют с углеродом, поэтому при взаимодействии их оксидов с углеродом образуются карбиды и угарный газ:
CaO + 3C = CaC2 + CO
Угарный газ также восстанавливает из оксидов только металлы, расположенные после алюминия в электрохимическом ряду:
CuO + CO = Cu + CO2

4.2. Восстановление водородом .
Водород восстанавливает из оксидов только металлы, расположенные в ряду активности правее алюминия. Реакция с водородом протекает только в жестких условиях – под давлением и при нагревании.
CuO + H2 = Cu + H2O

4.3. Восстановление более активными металлами (в расплаве или растворе, в зависимости от металла)
При этом более активные металлы вытесняют менее активные. То есть добавляемый к оксиду металл должен быть расположен левее в ряду активности, чем металл из оксида. Реакции, как правило, протекают при нагревании.
Например , оксид цинка взаимодействует с алюминием:
3ZnO + 2Al = Al2O3 + 3Zn
но не взаимодействует с медью:
ZnO + Cu ≠
Восстановление металлов из оксидов с помощью других металлов — это очень распространенный процесс. Часто для восстановления металлов применяют алюминий и магний. А вот щелочные металлы для этого не очень подходят – они слишком химически активны, что создает сложности при работе с ними.
Алюмотермия – это восстановление металлов из оксидов алюминием.
Например : алюминий восстанавливает оксид меди (II) из оксида:
3CuO + 2Al = Al2O3 + 3Cu
Магниетермия – это восстановление металлов из оксидов магнием.
CuO + Mg = Cu + MgO

Железо можно вытеснить из оксида с помощью алюминия:
При алюмотермии образуется очень чистый, свободный от примесей углерода металл.
4.4. Восстановление аммиаком.
Аммиаком можно восстанавливать только оксиды неактивных металлов. Реакция протекает только при высокой температуре.
Например , аммиак восстанавливает оксид меди (II):
3CuO + 2NH3 = 3Cu + 3H2O + N2
5. Взаимодействие оксидов металлов с окислителями.
Под действием окислителей некоторые основные оксиды (в которых металлы могут повышать степень окисления, например Fe 2+ , Cr 2+ , Mn 2+ и др.) могут выступать в качестве восстановителей.
Например , оксид железа (II) можно окислить кислородом до оксида железа (III):
Понятие о металлургии: общие способы получения металлов
Металлургия — это наука о промышленных способах получения металлов. Различают черную и цветную металлургию.
Черная металлургия — это производство железа и его сплавов (сталь, чугун и др.).
Цветная металлургия — производство остальных металлов и их сплавов.
Широкое применение находят сплавы металлов. Наиболее распространенные сплавы железа — чугун и сталь.
Чугун — это сплав железа, в котором содержится 2-4 масс. % углерода, а также кремний, марганец и небольшие количества серы и фосфора.
Сталь — это сплав железа, в котором содержится 0,3-2 масс. % углерода и небольшие примеси других элементов.
Легированные стали — это сплавы железа с хромом, никелем, марганцем, кобальтом, ванадием, титаном и другими металлами. Добавление металлов придает стали дополнительные свойства. Так, добавление хрома придает сплаву прочность, а добавление никеля придает стали пластичность.
Основные стадии металлургических процессов:
- Обогащение природной руды (очистка, удаление примесей)
- Получение металла или его сплава.
- Механическая обработка металла
1. Нахождение металлов в природе
Большинство металлов встречаются в природе в виде соединений. Наиболее распространенный металл в земной коре — алюминий. Затем железо, кальций, натрий и другие металлы.
2. Получение активных металлов
Активные металлы (щелочные и щелочноземельные) классическими «химическими» методами получить из соединений нельзя. Такие металлы в виде ионов — очень слабые окислители, а в простом виде — очень сильные восстановители, поэтому их очень сложно восстановить из катионов в простые вещества. Чем активнее металл, тем сложнее его получить в чистом виде — ведь он стремится прореагировать с другими веществами.
Получить такие металлы можно, как правило, электролизом расплавов солей, либо вытеснением из солей другими металлами в жестких условиях.
Натрий в промышленности получают электролизом расплава хлорида натрия с добавками хлорида кальция:
2NaCl = 2Na + Cl2
Калий получают пропусканием паров натрия через расплав хлорида калия при 800°С:
KCl + Na = K↑ + NaCl
Литий можно получить электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
2LiCl = 2Li + Cl2
Цезий можно получить нагреванием смеси хлорида цезия и специально подготовленного кальция:
Са + 2CsCl = 2Cs + CaCl2
Магний получают электролизом расплавленного карналлита или хлорида магния с добавками хлорида натрия при 720–750°С:
Кальций получают электролизом расплавленного хлорида кальция с добавками фторида кальция:
Барий получают из оксида восстановлением алюминием в вакууме при 1200 °C:
4BaO+ 2Al = 3Ba + Ba(AlO2)2
Алюминий получают электролизом раствора оксида алюминия Al2O3 в криолите Na3AlF6:
3. Получение малоактивных и неактивных металлов
Металлы малоактивные и неактивные восстанавливают из оксидов углем, оксидом углерода (II) СО или более активным металлом. Сульфиды металлов сначала обжигают.
3.1. Обжиг сульфидов
При обжиге сульфидов металлов образуются оксиды:
2ZnS + 3O2 → 2ZnO + 2SO2
Металлы получают дальнейшим восстановлением оксидов.
3.2. Восстановление металлов углем
Чистые металлы можно получить восстановлением из оксидов углем. При этом до металлов восстанавливаются только оксиды металлов, расположенных в ряду электрохимической активности после алюминия.
Например , железо получают восстановлением из оксида углем:
2Fe2O3 + 6C → 2Fe + 6CO
ZnO + C → Zn + CO
Оксиды металлов, расположенных в ряду электрохимической активности до алюминия, реагируют с углем с образованием карбидов металлов:
CaO + 3C → CaC2 + CO
3.3. Восстановление металлов угарным газом
Оксид углерода (II) реагирует с оксидами металлов, расположенных в ряду электрохимической активности после алюминия.
Например , железо можно получить восстановлением из оксида с помощью угарного газа:
3.4. Восстановление металлов более активными металлами
Более активные металлы вытесняют из оксидов менее активные. Активность металлов можно примерно оценить по электрохимическому ряду металлов:
Восстановление металлов из оксидов другими металлами — распространенный способ получения металлов. Часто для восстановления металлов применяют алюминий и магний. А вот щелочные металлы для этого не очень подходят – они слишком химически активны, что создает сложности при работе с ними.
Активные металлы вытесняют менее активные из растворов их солей.
Например , при добавлении меди (Cu) в раствор соли менее активного металла – серебра (AgNO3) произойдет химическая реакция:
2AgNO3 + Cu = Cu(NO3)2 + 2Ag
Медь покроется белыми кристаллами серебра.
При добавлении железа (Fe) в раствор соли меди (CuSO4) на железном гвозде появился розовый налет металлической меди:
CuSO4 + Fe = FeSO4 + Cu
При добавлении цинка в раствор нитрата свинца (II) на цинке образуется слой металлического свинца:
3.5. Восстановление металлов из оксидов водородом
Водород восстанавливает из оксидов только металлы, расположенные в ряду активности правее алюминия. Как правило, взаимодействие оксидов металлов с водородом протекает в жестких условиях – под давлением или при нагревании.
4. Производство чугуна
Чугун получают из железной руды в доменных печах.
Печь последовательно загружают сверху шихтой, флюсами, коксом, затем снова рудой, коксом и т.д.

1- загрузочное устройство, 2 — колошник, 3 — шахта, 4 — распар, 5 — горн, 6 — регенератор
Доменная печь имеет форму двух усеченных конусов, соединенных основаниями. Верхняя часть доменной печи — колошник, средняя — шахта, а нижняя часть — распар.
В нижней части печи находится горн. Внизу горна скапливается чугун и шлак и отверстия, через которые чугун и шлак покидают горн: чугун через нижнее, а шлак через верхнее.
Наверху печи расположено автоматическое загрузочное устройство. Оно состоит из двух воронок, соединенных друг с другом. Руда и кокс сначала поступают в верхнюю воронку, а затем в нижнюю.
Из нижней воронки руда и кокс поступают в печь. во время загрузки руды и кокса печь остается закрытой, поэтому газы не попадают в атмосферу, а попадают в регенераторы. В регенераторах печной газ сгорает.
Шихта — это железная руда, смешанная с флюсами.
Снизу в печь вдувают нагретый воздух, обогащенный кислородом, кокс сгорает:
Образующийся углекислый газ поднимается вверх и окисляет кокс до оксида углерода (II):
CO2 + С = 2CO
Оксид углерода (II) (угарный газ) — это основной восстановитель железа из оксидов в данных процессах. Последовательность восстановления железа из оксида железа (III):
Последовательность восстановления оксида железа (III):
FeO + CO → Fe + CO2
Суммарное уравнение протекающих процессов:
При этом протекает также частичное восстановление примесей оксидов других элементов (кремния, марганца и др.). Эти вещества растворяются в жидком железе.
Чтобы удалить из железной руды тугоплавкие примеси (оксид кремния (IV) и др.). Для их удаления используют флюсы и плавни (как правило, известняк CaCO3 или доломит CaCO3·MgCO3). Флюсы разлагаются при нагревании:
и образуют с тугоплавкими примесями легкоплавкие вещества (шлаки), которые легко можно удалить из реакционной смеси:
Какие свойства водорода типичны для металлов неметаллов?
Водород – неметалл, имеет молекулярное строение. Характерно двойственное положение в периодической системе химических элементов – расположен в I и VII группах. Проявляет свойства как окислителя, так и восстановителя. При определенных условиях и с определенными элементами он может проявлять себя как металл и как неметалл.
Сходство водорода с другими элементами
Ниже представлены сходства водорода с другими элементами.
Сходство с металлами:
- Одинаковая конфигурация внешнего электронного уровня;
- В большинстве соединений способен проявлять степень окисления +1;
- Обладает хорошо выраженными восстановительными свойствами, то есть способен отдавать электроны и восстанавливать другие элементы;
- Типичны реакции замещения.
Сходство с неметаллами:
- Атом водорода может присоединять электроны, то есть обладает окислительными свойствами;
- Образуя химические соединения с металлами, приобретает степень окисления -1;
- Молекула водорода представляет собой газообразное вещество из двух атомов;
Рассмотрим на примерах химические свойства водорода как восстановители и как окислителя.
Восстановительные свойства водорода
Для водорода типична реакция горения с кислородом. Причем при нормальных условиях данная реакция не протекает. Необходимым условием является нагрев и чем больше нагревание, тем реакция протекает энергичнее. При смеси двух объемов водорода и одного объема кислорода образуется «гремучий газ» и происходит взрыв.
Типичны реакции с неметаллами:
- Взаимодействует с серой, продуктом реакции является сероводород. Реакция происходит, когда водород проходит через расплавленную серу.H2 + S → H2S↑
- При нагревании водород может вступать в реакцию с азотом с образованием аммиака. Главным условием этой реакции является высокая температура и давление, а также наличие катализатора.3H2 + N2 → 2NH3↑
- Из галогенов при обычной температуре водород реагирует лишь с фтором.H2 + F2 → 2HFС хлором реагирует только на свету, образуя хлороводород, с бромом реакция протекает менее энергично, с йодом не идет до конца даже при высоких температурах.H2 + Cl2 → 2HCl
Взаимодействие водорода с оксидами неметаллов
Взаимодействие водорода с оксидами неметаллов протекают при нагревании с оксидами азота, углерода и галогенов. К примеру, реакция с оксидом углерода (II) протекает при высоких температурах и продуктом реакции является метанол, а смесь СО и Н2 называется «синтез-газ»2H2 + CO → CH3OH
Водород способен восстанавливать металлы из их оксидов. Предпосылкой такой реакции является расположение металла в электрохимическом ряду напряжений справа от алюминия.CuO + H2 → Cu + H2OВодород является универсальным восстановителем, который используется в большинстве процессов химического синтеза для получения чистых веществ.
Свободный хлор очень реакционноспособен, хотя его активность и меньше, чем у фтора. Он непосредственно реагирует со всеми простыми веществами, за исключением кислорода, азота и благородных газов.
Галогеноводороды – это типичные кислоты-неокислители. Но так как в их состав входят атомы галогенов в низших степенях окисления, то эти кислоты способны окисляться.
1. Углерод. Аллотропия углерода
Углерод — химический элемент № \(6\). Он расположен в IVА группе втором периоде Периодической системы.
На внешнем слое атома углерода содержатся четыре валентных электрона, и до его завершения не хватает четырёх электронов. Поэтому в соединениях с металлами углероду характерна степень окисления \(–4\), а при взаимодействии с более электроотрицательными неметаллами он проявляет положительные степени окисления: \( +2\) или \(+4\).
В природе углерод встречается как в виде простых веществ, так и в виде соединений. В воздухе содержится углекислый газ . В земной коре распространены карбонаты (например, Ca CO 3 образует мел, мрамор, известняк). Горючие ископаемые (уголь, торф, нефть, природный газ) состоят из органических соединений , главным элементом которых является углерод.
Углерод относится к жизненно важным элементам, так как входит в состав молекул всех органических веществ.
Существует несколько аллотропных видоизменений, образованных атомами углерода. Наиболее распространены алмаз и графит .
Алмаз имеет атомную кристаллическую решётку. Каждый атом углерода в алмазе связан четырьмя прочными ковалентными связями с соседними атомами, расположенными в вершинах тетраэдра.

Благодаря такому строению алмаз — самое твёрдое из известных природных веществ. Все четыре валентных электрона каждого атома углерода участвуют в образовании связей, поэтому алмаз не проводит электрический ток. Это бесцветное прозрачное кристаллическое вещество, хорошо преломляющее свет.
Графит тоже имеет атомную кристаллическую решётку, но устроена она иначе. Решётка графита слоистая. Каждый атом углерода соединён прочными ковалентными связями с тремя соседними атомами. Образуются плоские слои из шестиугольников, которые между собой связаны слабо. Один валентный электрон у атома углерода остаётся свободным.

Графит представляет собой тёмно-серое вещество с металлическим блеском, жирное на ощупь. В отличие от алмаза графит непрозрачный, проводит электрический ток и оставляет серый след на бумаге. У графита очень высокая температура плавления (\(3700\) °С).

Алмаз и графит взаимопревращаемы. При сильном нагревании без доступа воздуха алмаз чернеет и превращается в графит. Графит можно превратить в алмаз при высокой температуре и большом давлении.
Из мельчайших частиц графита состоят сажа , древесный уголь и кокс . Сажа образуется при неполном сгорании топлива. Древесный уголь получают при нагревании древесины без доступа воздуха, а кокс — переработкой каменного угля.
Древесный уголь имеет пористое строение и обладает способностью поглощать газы и растворённые вещества. Такое свойство называется адсорбцией .

Аллотропные модификации углерода в химических реакциях могут проявлять и окислительные , и восстановительные свойства. Окислительные свойства углерода выражены слабее, чем у других неметаллов второго периода (азота, кислорода и фтора).
Углерод горит в кислороде с образованием углекислого газа и проявляет в этой реакции восстановительные свойства:
Читайте также:
