Виды защиты от коррозии металлов
Металлы вследствие своей высокой прочности, пластичности, износоустойчивости, тепло- и электропроводности являются наиболее важными конструкционными материалами.
В процессе эксплуатации в результате воздействия окружающей среды происходит их разрушение, так называемая коррозия.
Потери от коррозии в ведущих индустриальных странах составляют около 3-5% валового национального продукта, а затраты на возмещениекоррозионных потерь во всем мире исчисляются сотнями миллиардов долларов, поэтому раздел «Коррозия металлов и методы защиты их от коррозии» является одним из важнейших в курсе химии для инженерных специальностей.
Обычно корродируют металлы, которые встречаются в природе не в самородном состоянии, как Au, Pt, а в виде различных руд. На извлечение этих металлов из природных соединений расходуется значительное количество энергии (Ме +n + n? → Me 0 ; ΔG>0), которая накапливается в металлах, делая их термодинамически неустойчивыми, химически активными веществами (Ме 0 - n? → Me + n ; ΔG<0). В результате такого самопроизвольно протекающего коррозионного процесса металлы переходят в оксиды, гидроксиды, карбонаты, сульфиды и другие соединения и теряются безвозвратно.
Итак, коррозию можно определить как самопроизвольно протекающий окислительно-восстановительный процесс (ΔG<0) разрушения металла под воздействием окружающей среды, происходящий с выделением энергии (ΔН<0) и рассеиванием вещества (ΔS>0).
Механическое разрушение металлов, происходящее по физическим причинам, не называют коррозией, а называют эрозией, истиранием, износом.
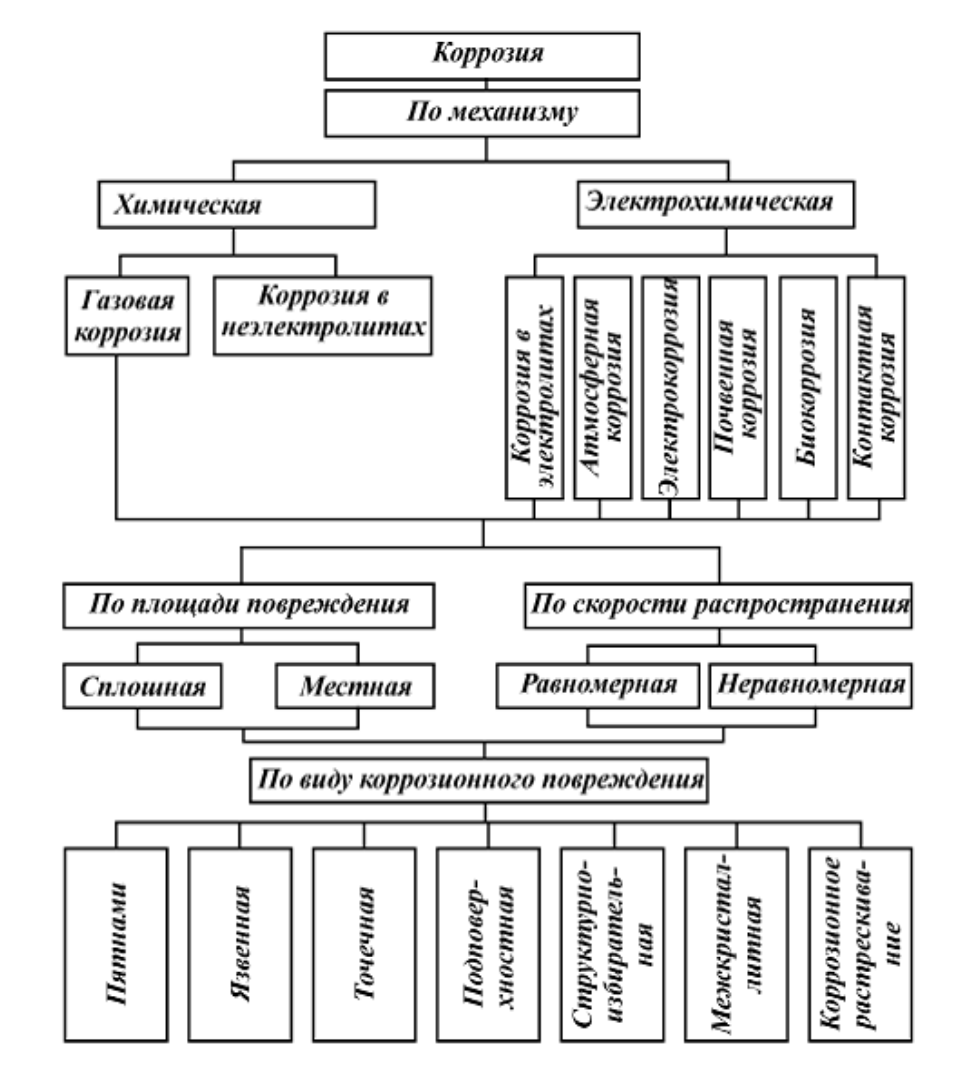
По характеру разрушения поверхности коррозию подразделяют на сплошную и местную. Сплошная коррозия подразделяется на равномерную, если процесс окисления происходит по всей поверхности металла с одинаковой скоростью, и неравномерную – процесс окисления происходит по всей поверхности с различной скоростью на различных участках металла.
Местная коррозия подразделяется на коррозию пятнами, точечную, питтинг (углубленно-точечную), межкристаллитную (наиболее опасна, т.к. ослабляет связи между зернами структуры сплавов), растрескивающуюся, селективную (избирательную).
По механизму протекания различают следующие виды коррозии:
- электрохимическая (концентрационная, контактная, электрокоррозия);
- особые виды (биологическая, радиационная, ультразвуковая).
По характеру дополнительных воздействий различают:
- коррозию под влиянием механических напряжений;
- коррозию при трении;
- кавитационную коррозию (возникает при одновременном коррозионном и ударном воздействии агрессивной среды, когда лопаются пузырьки воздуха при работе лопастей гребного винта, роторов насосов).
Рассмотрим более подробно виды коррозии по механизму протекания.
Под химической коррозией понимают разрушение металлов окислением в окружающей среде без возникновения электрического тока в системе.
Газовая коррозия протекает при обычных условиях, но чаще при высоких температурах. Наблюдается при разливе расплавленных металлов, их термической обработке, ковке, прокатке, сварке и т.д.
Самый распространенный случай газовой коррозии – взаимодействие металла с кислородом:
Образующаяся при такой коррозии оксидная пленка в ряде случаев играет защитную функцию. Для этого она должна быть сплошной, беспористой, иметь хорошее сцепление с металлом, обладать твердостью, износостойкостью и иметь коэффициент термического расширения, близкий к этой величине для металла. Все эти качества оксидной пленки можно оценить по фактору Пиллинга-Бэдвордса (a). Металлы (щелочные, щелочноземельные), у которых a2O3, ZnO, NiO и т.д.).
При значениях a значительно больше единицы пленки получаются неслошные, лекго отделяющиеся от поверхности металла (железная окалина). Коррозионно-активными газами, кроме кислорода, являются: угарный газ, углекислый газ, сернистый ангидрид, азот, его оксиды и галогены. Например, при разливе расплавленного алюминия, происходит его взаимодействие не только с кислородом, но и с азотом воздуха.
Жидкостная коррозия протекает, как правило, в жидких неэлектролитах: спиртах, хлороформе, бензоле, бензине, керосине и других нефтепродуктах. Ускоряет процесс жидкостной коррозии сера,кислород, галогены, влага, атакже повышенная температура (коррозия поршней в двигателях внутреннего сгорания),что можно описать уравнениями : Me(II) + R1 – S – R2 → MeS + R1 – R2
Me(I) + nR – Cl → MeCl + 1/2nR – R ,
где R1 – S – R2и nR – Cl углеводороды, содержащие серу и хлор.
Электрохимическая коррозия наиболее распространенный вид коррозии. Это разрушение деталей, машин, конструкций в грунтовых, речных, морских водах, под влиянием воды (росы), под воздействием смазочно-охлаждающих жидкостей, используемых при механической обработке металлов, атмосферная коррозия и т.д.
Электрохимическая коррозия – это пространственно разделенный окислительно-восстановительный процесс разрушения металла, протекающий в среде электролита, с возникновением внутри системы электрического тока, называемого коррозионным током.
Рассмотрим химизм атмосферной коррозии стального изделия. Сталь – это сплав железа с углеродом, в котором углерода менее 2%, например, цементит (Fe3C4). При электрохимической коррозии во влажном воздухе (О2 + 2Н2О) железо и цементит образуют микрогальванопару, в которой роль анода выполняет железо, а цементит – роль катода.
Схема процесса:
Анодный процесс: Fe 0 - 2? → Fe 2+ 2 поляризация
Катодный процесс: 2H2O + O2 + 4? → 4OH - 1 деполяризация
Суммарное уравнение коррозионного процесса разрушения стального изделия, находящегося во влажном воздухе:
Для железа более характерна степень окисления (3+), поэтому процесс окисления идет дальше:
4Fe(OH)2+2H2O+O2→4Fe(OH)3, образующийся Fe(OH)3 при нагревании может терять воду.
То есть продуктами коррозии железа (ржавчина) является смесь различных соединений. Если учесть, что в воздухе присутствуют углекислый газ, сернистый газ, следовательно, могут образовываться и соли железа.
Часто из-за различной рельефности металлических конструкций, в том числе и стальных, на некоторых участках скапливается вода, при этом происходит так называемая концентрационная коррозия, обусловленная различной концентрацией деполяризатора кислорода (в случае атмосферной коррозии), водорода (в кислой среде) на различных участках металла. Там, где концентрация деполяризатора больше (края капли воды), формируется катодный участок, где концентрация деполяризатора меньше (центр капли воды) – анодный участок (рис.15).
После высыхания капли в её центре обнаруживается углубление, а иногда даже и отверстие (для пластин толщиной 0,1-0,2 мм). Такие процессы часто наблюдаются при атмосферной и почвенной коррозии железных и стальных изделий (троса, стопки листов и т.д.) – точечная коррозия, переходящая в питтинг. Следует отметить, что хотя конечный продукт коррозии (ржавчина) нерастворим, однако он не препятствует процессу растворения металла, поскольку формируется за пределами анодного участка (на границе соприкосновения его с катодами) в виде кольца внутри капли.
На практике часто встречаются случаи, когда металлы различной активности находятся в контакте друг с другом, образуя гальванопары. Кроме того, технические металлы содержат примеси других металлов, сплавы содержат различные металлы. Такой металл или сплав, находясь в среде электролита, дает множество микро - и макрогальванопар, в которых анодом является более активный металл, т.е. металл с меньшим значением электродного потенциала, именно он и подвергается коррозии.
Рассмотрим случай контактной коррозии с водородной деполяризациейцинка и меди, в сернокислой среде. Цинк и медь, имеют различные значения электродных потенциалов. Более активным в этой гальвано паре является цинк (Е 0 Zn2+/Zn = -0,76 В), он имеет меньшее значение электродного потенциала и будет анодом, т. е именно цинк будет подвергаться коррозионным процессам, менее активным металлом является медь (Е 0 Cu2+/Cu = +0,34 В), она будет катодом.
Запишем схему: (А) Zn | H2SO4 | Cu (K)
Анодный процесс: Zn 0 - 2? → Zn 2+
Катодный процесс: 2Н + + 2? → Н2 деполяризатор
Суммарное ионное уравнение: Zn + 2H + → Zn 2+ + H2
Факторы, влияющие на скорость коррозии:
а) напряжение и деформация при механической обработке металлов;
б) перемешивание агрессивной среды;
в) дифференциальная аэрация;
д) кислотность среды (рН).
Рассматривая фактор (д) обратите внимание, что электродные потенциалы металлов существенно зависят от состава электролита и рН среды. Так, в случае контактной (Al-Zn) коррозии в 1М растворе HCl
возникает гальвано пара, в которой роль анода выполняет Al, а катода- Zn, схема такого процесса: (А) Al | HCl | Zn (K)
В 0,1 М растворе HCl в этом случае большую активность имеет цинк, он будет в гальвано паре анодом, алюминий – катодом, а схему запишем так: (А) Zn | HCl | Al (K)
Электрокоррозия – протекает под действием блуждающих токов, возникает от постоянных источников тока (электротранспорт, трансформаторы, линии электропередач). Рассматривая коррозию под действием блуждающих токов, надо помнить, что место выхода тока – будет анодным участком, входа тока – катодным, участок протекания тока – нейтральной зоной. Радиус действия блуждающих токов может достигать нескольких десятков километров. Ток силой 1А за год разрушает до 3 кг алюминия, 9 кг железа, 11 кг цинка или меди, 34 кг свинца.
ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ
Потери от коррозии в мировой экономике огромны. Около 1/3 вводимого в эксплуатацию металла подвергается коррозии, при этом примерно 10% теряется безвозвратно.
Борьба с коррозией осуществляется различными методами. Наиболее рациональный и надежный путь – изготовление аппаратов и машин изкоррозионно-стойких металлических или неметаллических материалов,но из-за дороговизны таких материалов, чаще используют дешевые и доступные металлы с последующей защитой их от коррозии. Полностью избежать коррозии невозможно, но, применив определенные методы защиты, можно снизить ее воздействие.
Можно условно выделить следующие группы методов защиты металлов от коррозии:
1. Создание рациональных конструкций, т.е. таких, которые не имеют застойных зон и других мест скопления влаги, грязи и других коррозионно-агрессивных сред, допускают быструю очистку и аэрацию.
2. Легирование металлов. Это эффективный, хотя обычно дорогой метод повышения коррозионной стойкости металлов. При легировании в состав сплава вводят компоненты (Cr, Ni, W, Si, V, Mo, Re и другие), вызывающие пассивирование металла. Механизм защиты (например, в нержавеющих сталях) состоит в образовании на поверхности плотных оксидных слоев, типа шпинелей состава NiO . Cr2O, FeO . Cr2O3, которые оказываются более устойчивыми, чем просто оксиды хрома или никеля.
3. Создание аморфных структур металлов. Путь к этому способу защиты открыла сверхбыстрая закалка. Расплавленный металл из тигля подают в тончайший зазор между двумя массивными валками и подвергают формированию и резкому охлаждению. В этих условиях атомы не успевают выстраиваться в присущие металлам кристаллические решетки, фиксируется «хаос атомов», свойственный расплавленному металлу. В результате получается аморфная структура, подобная стеклу, резко возрастает коррозионная устойчивость металлов.
4. Защитные покрытия – самый распространенный метод защиты металлов от коррозии. Смысл их нанесения – изоляция от агрессивной среды. Различают неметаллические и металлические покрытия.
а) неметаллические покрытия получают нанесением на поверхность металла лака, краски, смолы, олифы, эмали или стеклоэмали. Поверхность металла покрывают также резиной, эбонитом, полимерными материалами, цементом, бетоном, оксидными пленками: ZnO, Al2O3 (оксидирование) и нитридными пленками: Fe4N, Fe2N (азотирование). Покрыть поверхность металла можно осаждением нерастворимых фосфатов этого металла: Fe(H2PO4)2 + 2 Fe 2+ ® Fe3(PO4)2¯ + 4H ( фосфатирование) или насыщением поверхности металла углеродом (цементация).
б) защитные покрытия металлами. Для этого используют коррозионно-устойчивые металлы (Sn, Zn, Al, Au, Ag, Ni, Cr и др.) Различают анодные и катодные металлические покрытия. Если защищаемый металл покрывают более активным металлом, то такое покрытие называют анодным. При нарушении покрытия разрушается металл покрытия. Рассмотрим это на примере оцинкованного железа. Составим схему коррозионного разрушения.
A: Zn 0 - 2? → Zn 2+ 2
Если защищаемый металл покрыт менее активным металлом, например, железо покрыто оловом, то такой вид покрытия называется катодным. При нарушении покрытия разрушается основной металл. Рассмотрим этот случай коррозии.
(А) Fe | 2H + | Sn (K)
A: Fe 0 - 2? → Fe 2+ 1
Fe + 2H + → Fe 2+ + H2
5. Электрохимические методы защиты:
а) защита внешним потенциалом);
б) анодная (протекторная).
Защита внешним потенциалом (чаще катодная) осуществляется подключением защищаемой конструкции к отрицательному полюсу (катоду) внешнего источника тока с очень малым напряжением (0,1 В). К положительному полюсу подсоединяется лом, который и разрушается. Этот вид защиты используют для металлических сооружений: трубопроводов, резервуаров и т.д.
Протекторная защита заключается в том, что к изделию, подвергающемуся электрохимической коррозии, подключают деталь – протектор из более активного металла, чем металл изделия. Протектор будет разрушаться, а изделие останется неизменным. Применяют в паровых котлах, для защиты корпусов морских и речных судов, трубопроводов, рельсов и т.д.
Задача. Приведите пример протекторной защиты в электролите, содержащем растворенный кислород. Составьте уравнения анодного и катодного процессов и вычислите ЭДС реакции.
Решение. Протекторная защита осуществляется путем присоединения к железу более активного металла, обычно цинка, магния и их сплавов. Таким образом, создается искусственный микрогальванический элемент. Чаще всего используют протекторную защиту в растворах электролитов (паровые котлы, химические аппараты), в морской воде и в почве (защита трубопроводов). Рассмотрим протекторную защиту от почвенной коррозии:
Среда нейтральная или слабощелочная, так как концентрация солей невелика. В этом, созданном нами, коррозионном элементе анодом служит протектор (цинк), он растворяется.
Анод: Zn 0 – 2 ® Zn 2+ .
Электроны передаются на железо. Деполяризатором в этом случае является кислород.
Катод: O2 + 2H2O + 4® 4OH - ; E 0 = 0,40 B.
ЭДС реакции определяем: DЕ = Екатода – Еанода = 0,40 – (-0,75) = 1,16 В.
Ответ: протектор Zn, он окисляется и защищает железо; DЕ = 1,16 В.
6. Воздействие на агрессивную среду. Для замедления коррозии в агрессивную среду вводят вещества, называемые ингибиторами (замедлителями). Это чаще всего органические вещества, пассивирующие поверхность металла: тиомочевина C(NH2)2S, диэтиламин C2H5 — NH — C2H5, уротропин (CH2)6N4, неорганические вещества SiO3 2- , NO2 - , Cr2O7 2- , а также освобождение воды от растворенного в ней кислорода (воду фильтруют через слой железных опилок). Либо удаляют активаторы коррозии, например, ионы Cl - , Br - , F - , SO4 2- , NO3 - .
Литература:
1. Фролов В.В. Химия. Гл.V, §51-56.
3. Общая химия под ред. Соколовской Е.М. и др. Гл.6, §1-11.
4. Абраменко В.Л. Методические указания к самостоятельному изучению темы “Коррозия и защита металлов от нее”. Луганск, 1991 г.
Коррозия. Виды и способы защиты от коррозии
Коррозия – это процесс самопроизвольного разрушения металлов, сплавов и других материалов – бетонов, цементов в результате физико-химического взаимодействия с окружающей средой.
Среда, в которой происходит разрушение металлов, называется коррозионной. Химические соединения, образующиеся в результате коррозии, называются продуктами коррозии. Способность металлов сопротивляться коррозии воздушной среды называется коррозионной стойкостью.
Коррозия материалов является одной из важных мировых проблем. Практика показывает, что только прямые безвозвратные потери металла от коррозии составляют 10…12% всей производимой стали, при этом суммарный ущерб в промышленных странах достигает 4-5% от национального дохода. Ведь корродирует не только черный металл ( сталь, чугун, железо и некоторые его сплавы ), но и бетон, дерево, камень, даже полимеры.
Наиболее интенсивная коррозия наблюдается в зданиях и сооружениях химических производств, что объясняется действием различных газов, жидкостей и мелкодисперсных частиц непосредственно на строительные конструкции, оборудование и сооружения, а также проникновением этих агентов в грунты и действием их на фундаменты. Агрессивному воздействию подвержено до 75% строительного фонда. Коррозия металла приводит к ослаблению конструктива и, как следствие, снижению безопасности эксплуатации сооружений.

По характеру самого процесса коррозию разделяют на две основные группы: химическую и электрохимическую.
Химическая коррозия протекает в не электролитах – жидкостях, не проводящих электрического тока и в сухих газах при высокой температуре.
Электрохимическая коррозия происходит в электролитах и во влажных газах и характеризуется наличием двух параллельно идущих процессов: окислительного (растворение металлов) и восстановительного (выделение металла из раствора).
По внешнему виду коррозию различают: пятнами, язвами, точками, внутрикристаллитную, подповерхностную.
По характеру коррозионной среды различают следующие основные виды коррозии: газовую, атмосферную, жидкостную и почвенную.
Газовая коррозия происходит при отсутствии конденсации влаги на поверхности. На практике такой вид коррозии встречается при эксплуатации металлов при повышенных температурах.
Атмосферная коррозия относится к наиболее распространенному виду электрохимической коррозии, так как большинство металлических конструкций эксплуатируются в атмосферных условиях. Коррозия, протекающая в условиях любого влажного газа, также может быть отнесена к атмосферной коррозии.
Жидкостная коррозия в зависимости от жидкой среды бывает кислотная, щелочная, солевая, морская и речная. По условиям воздействия жидкости на поверхность металла эти виды коррозии получают добавочные характеристики : с полным и переменным погружением, капельная, струйная. Кроме того, по характеру разрушения различают коррозию равномерную и неравномерную.
По степени воздействия на металлы коррозионные среды делятся на неагрессивные, слабоагрессивные, среднеагрессивные и сильноагрессивные.
В атмосферных условиях железо и сталь подвергаются общей равномерной коррозии.
- коррозия в растворах электролитов – жидкостях, проводящих электрический ток;
- почвенная или подземная коррозия металлических сооружений, находящихся под землей;
- биологическая коррозия – это коррозия, протекающая под влиянием жизнедеятельности микроорганизмов.
По видам дополнительных воздействий различают следующие случаи коррозии:
- электрокоррозия под действием внешнего источника тока, т.е. коррозия изделий, находящихся под землей, вызванная блуждающими токами;
- контактная коррозия металлов – разрушение металла в растворе электролита вследствие контакта с другим металлом, имеющим более положительный электродный потенциал, чем потенциал основного металла.
- радиационная коррозия – это процессы коррозии в условиях радиоактивного облучения;
- коррозия в условиях механического воздействия .
Наиболее типичными видами подобного разрушения являются коррозионные растрескивание, усталость, кавитация, эрозия и фреттинг-коррозия
Бетон и железобетон находят широкое применение в качестве конструкционного материала при строительстве зданий и сооружений химических производств. Но они не обладают достаточной химической стойкостью против действия кислых сред. Свойства бетона и его стойкость в первую очередь зависит от химического состава цемента из которого он изготовлен.
Наибольшее применение в конструкциях и оборудовании находят бетоны на портландцементе. Причиной пониженной химической стойкости бетона к действию минеральных и органических кислот является наличие свободной гидроокиси кальция (до 20%), трехкальциевого алюмината (3CaO×Al2O3) и других гидратированных соединений кальция.
Коррозия бетона происходит тем интенсивнее, чем выше концентрация водных растворов кислот. При повышенных температурах агрессивной среды коррозия бетонов ускоряется. Несколько более высокой кислотостойкостью обладает бетон, изготовленный на глиноземистом цементе, из-за пониженного содержания оксида кальция.
Кислотостойкость бетонов на цементах с повышенным содержанием оксида кальция в некоторой степени зависит от плотности бетона. При большей плотности бетона кислоты оказывают на него несколько меньшее воздействие из-за трудности проникновения агрессивной среды внутрь материала.
Щелочестойкость бетонов определяется главным образом химическим составом вяжущих, на которых они изготовлены, а также щелочестойкостью мелких и крупных заполнителей.
Увеличение срока службы строительных конструкций и оборудования достигается путем правильного выбора материала с учетом его стойкости к агрессивным средам, действующим в производственных условиях. Кроме того, необходимо принимать меры профилактического характера.
К таким мерам относятся:
- герметизация производственной аппаратуры и трубопроводов, хорошая вентиляция помещения, улавливание газообразных и пылевидных продуктов, выделяющихся в процессе производства;
- правильная эксплуатация различных сливных устройств, исключающая возможность проникновения в почву агрессивных веществ;
- применение гидроизолирующих устройств и др.
Непосредственная защита металлов от коррозии осуществляется нанесением на их поверхность неметаллических и металлических покрытий либо изменением химического состава металлов в поверхностных слоях:
- оксидированием,
- азотированием,
- фосфатированием.
Для защиты поверхностей от коррозии существуют разнообразные покрытия:
- лакокрасочные (антистатичные и армированные, полиуретановые, акриловые, порошковые эпоксидно – полиэфирные, органосиликатные и кремнийорганические),
- металлизационные с цинком, алюминием, медью и комбинациями этих металлов.
Это краски, лаки, эмали, тонкодисперсные порошки, пленки.
Лакокрасочные покрытия вследствие экономичности, удобства и простоты нанесения, хорошей стойкости к действию промышленных агрессивных газов нашли широкое применение для защиты металлических и железобетонных конструкций от коррозии.
Защитные свойства лакокрасочного покрытия в значительной степени обуславливаются механическими и химическими свойствами, сцеплением пленки с защищаемой поверхностью.
Лакокрасочные материалы в зависимости от назначения и условий эксплуатации делятся на десять групп:
- А – покрытия стойкие на открытом воздухе;
- АН – то же, под навесом;
- П – то же, в помещении;
- Х – химически стойкие;
- Т – термостойкие;
- М – маслостойкие;
- В – водостойкие;
- ХК – кислотостойкие;
- ХЩ – щелочестойкие;
- Б – бензостойкие.
Наиболее распространены в промышленности покрытия металлические, неметаллические (органического и неорганического происхождения), а также покрытия, образованные в результате химической и электрохимической обработки металла.
Выбор вида покрытия зависит от условий, в которых используется защищаемое изделие (перепад температур, повышенная влажность, морская или пресная вода, щелочь, кислота, соли металлов, радиация, электроток и огонь), и технологичность возможностей формирования покрытия.
Наиболее часто применяемые способы защиты металлов:
- легирование;
- электрохимическая защита;
- покрытие металлами;
- защитные пленки.
Легирование – это введение в металл на стадии его производства определенного количества специальных добавок, например – хрома или марганца. Это придает сталям особые свойства, необходимые для использования в сложных условиях. Для возведения современных зданий, особенно повышенной этажности, необходима высококачественная атмосферостойкая легированная сталь, например, погодоустойчивая марка COR-TEN. Такой материал позволяет решить проблемы эксплуатации сооружений даже в экстремальных климатических условиях.
Одними из самых популярных и относительно недорогих мер защиты от коррозии сегодня являются методы, изменяющие химический состав металла в поверхностных слоях. Как правило, это электрохимические способы нанесения покрытий на металл. Наиболее известный процесс называется оцинковкой, которая в зависимости от способа обработки металла делится на горячую и холодную.
В первом случае обрабатываемый материал погружается в специальную ванну. Затем под воздействием переменного тока осуществляется его обработка в растворе фосфата цинка при плотности тока 4 А/дм², напряжении 20 В и температуре 600-700ºС. В результате электрохимической реакции образуется ферроцинковый сплав. При применении второго способа на подготовленную поверхность стального листа наносится защитный слой из цинка. Оцинковка толщиной 0,3 мм позволяет обеспечить защиту обработанной поверхности металла более чем на 30 лет.
Итальянская фирма «Metalnastri» разработала метод, сочетающий в себе качество горячего и технологичность холодного цинкования. Это простая идея наклейки цинковой фольги на стальную поверхность. Высокую антикоррозийность создает сплошной цинковый слой, а токопроводящие клеевые композиции обеспечивают и электрохимическую защиту поверхности.
ЦНИИПСК им. А.П. Мельникова предложил метод термодиффузионного цинкования (ТДЦ) метизных и малогабаритных изделий из стали и чугуна. Метод заключается в нагреве металлоизделий в среде, содержащей порошок цинка. В результате на поверхности изделия образуется цинковое покрытие с хорошими защитными и декоративными свойствами.
Технологический процесс такого цинкования экологически чист и практически безотходен. В качестве сырья используются отечественные материалы, не требующие специальной обработки. ТДЦпокрытие обладает высокой адгезией и износостойкостью, обеспечиваемой в результате взаимной диффузии железа и цинка. Срок службы покрытия в 1,5-4 раза больше по сравнению с традиционными цинковыми покрытия.
Широкое распространение цинковых покрытий обусловлено их хорошими химическими свойствами. Для стали (катод) цинк является анодом, за счет этого образуется гальваническая пара, имеющая высокие защитные свойства, хорошо сохраняемые даже при малой толщине слоя. Скорость разрушения цинкового покрытия составляет примерно 1-10 мкм в год в зависимости от различных факторов. Оцинковка может осуществляться совместно с другими металлами – с добавлением алюминия (Al) или железа (Fe). В настоящее время в России широко используется сталь Galfan c цинкоалюминиевым покрытием и сталь Galvannealed с цинкожелезным покрытием.
При покрытии другими металлами в зависимости от вида коррозии покрывающий слой наносят различными способами. В качестве покрывающего материала часто используется хром или никель. Хромирование – электролитическое нанесение покрытия из хрома на поверхность металлического изделия. Никелирование, также нанесение на поверхность изделий никеля толщиной от 2 до 50 мкм.
На практике обычно применяются следующие методы:
- Погружение изделий в расплавленный металл (горячий способ). Заключается в том, что изделия погружают в ванну с расплавленным металлом или же нагретую поверхность деталей обволакивают расплавленным металлом.
- Метод термической диффузии. Основан на диффузии (проникновении) в поверхностные слои деталей присадок при высокой температуре. Диффузионные покрытия наносятся при нагреве деталей в твердой (порошкообразной), жидкой или газообразной фазе металла.
- Металлизация. Заключается в нанесении (распылении) на поверхность деталей слоя присадок расплавленного металла с помощью пульверизаторов.
- Контактный метод осаждения металла. Осуществляется без применения внешнего источника тока за счет вытеснения менее благородными металлами более благородных из растворов их солей. Толщина таких покрытий невелика и защитные свойства их невысоки.
Следует отметить, что металлические покрытия достаточно хорошо защищают металл от коррозии. Однако при нарушении защитного слоя она может протекать даже более интенсивно, чем без покрытия. Поэтому в промышленности для улучшения свойств металлических поверхностей, обработанных электротехническим методом, используется способ нанесения защитных покрытий из полимерных материалов. Такие продукты получили широкое распространение в строительной индустрии.
Использование полимерных материалов для антикоррозионной защиты обусловлено их уникальными физико-химическими показателями. Полимеры имеют небольшой удельный вес, высокую стойкость к не механическим воздействиям (соприкосновение с водой, солями, щелочами или кислотами). Обладают пластичностью и светостойкостью. В настоящее время наибольшее распространение получили « трехслойные» продукты с двойным уровнем защиты.
Первый уровень – непосредственно оцинковка, второй – полимер. Благодаря такой структуре сталь становится стойкой к воздействию агрессивных сред, механическим повреждениям и ультрафиолетовому изучению. Срок их службы составляет порядка 50 лет, в зависимости от качества и толщины покрытия. Необходимо также учесть, что высокие эксплуатационные характеристики таких материалов напрямую зависят от качества оцинковки исходного металла, а потребительские качества – от применяемого в составе полимера.
Альтернативой полимерным материалам являются конструкционные пластмассы и стеклопластики, получаемые на основе различных синтетических смол и стекловолокнистых наполнителей. В настоящее время выпускается значительный ассортимент материалов, особое место среди них занимает полиэтилен. Он инертен во многих кислотах, щелочах и растворителях, а также имеет высокую теплостойкость.
Другим направлением использования полиэтилена в качестве химически стойкого материала является порошковое напыление. Применение полиэтиленовых покрытий объясняется их дешевизной и хорошими защитными свойствами. Покрытия легко наносятся на поверхность различными способами, в том числе пневматическим и электростатическим распылением.
Защитные пленки. Способ заключается в нанесении на металл защитной оболочки из различных компонентов в следующей последовательности: шпатлевка, грунтовка, краска, лак или эмаль.
Для противокоррозионной защиты конструкций зданий и сооружений (ферм, ригелей, балок, колонн, стеновых панелей), а также наружных и внутренних поверхностей емкостного технологического оборудования, трубопроводов, газоводов, воздуховодов вентиляционных систем, которые в процессе эксплуатации не подвергаются механическим воздействиям абразивных частиц, применяют лакокрасочные покрытия. Такие покрытия наиболее эффективны для защиты от атмосферной коррозии. Однако срок службы лакокрасочных покрытий невелик и составляет 4-5 лет. Для повышения коррозионной стойкости лакокрасочных покрытий используют различные противокоррозионные пигменты.
Следует назвать антикоррозионные пигменты фирмы SNCZ (Франция): фосфаты цинка; модифицированные фосфаты цинка; фосфаты, не содержащие цинк; полифосфаты; феррит кальция, а также тетраоксихромат цинка; хроматы стронция, цинка, бария.
Наиболее часто используются фосфаты цинка PZ 20 и PZ W2 в большинстве лакокрасочных систем: органоразбавляемых, водоразбавляемых, воздушной и горячей сушки.
Там, где нельзя использовать противокоррозионные пигменты, содержащие цинк (контакт с пищевыми продуктами), используются пигменты на основе щелочеземельных фосфатов Новинокс РАТ 30, Новинокс РАТ 15 и Новинокс РС01.
Металлоконструкции, подвергающиеся воздействию соляного тумана, могут быть защищены лакокрасочными материалами, содержащими фосфат щелочеземельных металлов. Фосфат щелочеземельных металлов – нетоксичный пигмент, что повышает экологичность лакокрасочного покрытия и увеличивает сферу его применения.
Тетраоксихромат цинка ТС 20, хромат стронция L203E и хромат цинка CZ20 – применяются в лакокрасочных материалах, использующихся в авиационных, судовых покрытиях, а также в составе адгезивов для легких сплавов.
Для защитных покрытий, эксплуатирующихся в условиях высоких температур (до 600ºС), используются хромат бария М 20 и феррит кальция FC 71. Применение феррита кальция для защитных покрытий – новое направление в лакокрасочных материалах. В табл. 1 представлена стойкость различных лакокрасочных материалов (ЛКМ) к агрессивным средам.
Таблица 1. Стойкость лакокрасочных материалов
Примечания: ++ отлично, + хорошо, ± удовлетворитльно
Наиболее распространенным способом защиты от коррозии строительных конструкций, сооружений и оборудования является использование неметаллических химически стойких материалов: кислотоупорной керамики, жидких резиновых смесей, листовых и пленочных полимерных материалов (винипласта, поливинилхлорида, полиэтилена, резины), лакокрасочных материалов, синтетических смол и др.
Для правильного использования неметаллических химически стойких материалов необходимо знать не только их химическую стойкость, но и физико-химические свойства, обеспечивающие условия совместной работы покрытия и защищаемой поверхности. При использовании комбинированных защитных покрытий, состоящих из органического подслоя и футеровочного покрытия, важным является обеспечение на подслое температуры, не превышающей максимальной для данного вида подслоя.
Для листовых и пленочных полимерных материалов необходимо знать величину их адгезии с защищаемой поверхностью. Ряд неметаллических химически стойких материалов, широко используемых в противокоррозионной технике, содержит в своем составе агрессивные соединения, которые при непосредственном контакте с поверхностью металла или бетона могут вызвать образование побочных продуктов коррозии, что, в свою очередь, снизит величину их адгезии с защищаемой поверхностью. Эти особенности необходимо учитывать при использовании того или иного материала для создания надежного противокоррозионного покрытия.
Коррозия металлов. Виды коррозии металлов
Материалы из металлов под химическим или электрохимическим воздействием окружающей среды подвергаются разрушению, которое называется коррозией.
Коррозия металлов вызывается окислительно-восстановительными реакциями, в результате которых металлы переходят в окисленную форму и теряют свои свойства, что приводит в негодность металлические материалы.
Можно выделить 3 признака, характеризующих коррозию:
- Коррозия – это с химической точки зрения процесс окислительно-восстановительный.
- Коррозия – это самопроизвольный процесс, возникающий по причине неустойчивости термодинамической системы металл – компоненты окружающей среды.
- Коррозия – это процесс, который развивается в основном на поверхности металла. Однако, не исключено, что коррозия может проникнуть и вглубь металла.
Виды коррозии металлов
Наиболее часто встречаются следующие виды коррозии металлов:
- Равномерная – охватывает всю поверхность равномерно
- Неравномерная
- Избирательная
- Местная пятнами – корродируют отдельные участки поверхности
- Язвенная (или питтинг)
- Точечная
- Межкристаллитная – распространяется вдоль границ кристалла металла
- Растрескивающая
- Подповерхностная

Основные виды коррозии металлов
С точки зрения механизма коррозионного процесса можно выделить два основных типа коррозии: химическую и электрохимическую.
Химическая коррозия металлов
Химическая коррозия металлов — это результат протекания таких химических реакций, в которых после разрушения металлической связи, атомы металла и атомы, входящие в состав окислителей, образуют химическую связь.
Электрический ток между отдельными участками поверхности металла в этом случае не возникает. Такой тип коррозии присущ средам, которые не способны проводить электрический ток – это газы, жидкие неэлектролиты.
Виды химической коррозии
Химическая коррозия металлов бывает газовой и жидкостной.
Газовая коррозия металлов – это результат действия агрессивных газовых или паровых сред на металл при высоких температурах, при отсутствии конденсации влаги на поверхности металла. Это, например, кислород, диоксид серы, сероводород, пары воды, галогены. Такая коррозия в одних случаях может привести к полному разрушению металла (если металл активный), а в других случаях на его поверхности может образоваться защитная пленка (например, алюминий, хром, цирконий).
Жидкостная коррозия металлов– может протекать в таких неэлектролитах, как нефть, смазочные масла, керосин и др. Этот тип коррозии при наличии даже небольшого количества влаги, может легко приобрести электрохимический характер.
При химической коррозии скорость разрушения металла пропорциональна скорости химической реакции и той скорости с которой окислитель проникает сквозь пленку оксида металла, покрывающую его поверхность. Оксидные пленки металлов могут проявлять или не проявлять защитные свойства, что определяется сплошностью.
Фактор Пиллинга-Бэдворса
Сплошность такой пленки оценивают величине фактора Пиллинга—Бэдвордса: (α = Vок/VМе) по отношению объема образовавшегося оксида или другого какого-либо соединения к объему израсходованного на образование этого оксида металла
где Vок — объем образовавшегося оксида
VМе — объем металла, израсходованный на образование оксида
Мок – молярная масса образовавшегося оксида
ρМе – плотность металла
n – число атомов металла
AMe — атомная масса металла
ρок — плотность образовавшегося оксида
Оксидные пленки, у которых α < 1, не являются сплошными и сквозь них кислород легко проникает к поверхности металла. Такие пленки не защищают металл от коррозии. Они образуются при окислении кислородом щелочных и щелочно-земельных металлов (исключая бериллий).
Оксидные пленки, у которых 1 < α < 2,5 являются сплошными и способны защитить металл от коррозии.
При значениях α > 2,5 условие сплошности уже не соблюдается, вследствие чего такие пленки не защищают металл от разрушения.
Ниже представлены значения сплошности α для некоторых оксидов металлов
| Металл | Оксид | α | Металл | Оксид | α |
| K | K2O | 0,45 | Zn | ZnO | 1,55 |
| Na | Na2O | 0,55 | Ag | Ag2O | 1,58 |
| Li | Li2O | 0,59 | Zr | ZrO2 | 1.60 |
| Ca | CaO | 0,63 | Ni | NiO | 1,65 |
| Sr | SrO | 0,66 | Be | BeO | 1,67 |
| Ba | BaO | 0,73 | Cu | Cu2O | 1,67 |
| Mg | MgO | 0,79 | Cu | CuO | 1,74 |
| Pb | PbO | 1,15 | Ti | Ti2O3 | 1,76 |
| Cd | CdO | 1,21 | Cr | Cr2O3 | 2,07 |
| Al | Al2O2 | 1,28 | Fe | Fe2O3 | 2,14 |
| Sn | SnO2 | 1,33 | W | WO3 | 3,35 |
| Ni | NiO | 1,52 |
Электрохимическая коррозия металлов
Электрохимическая коррозия металлов – это процесс разрушения металлов в среде различных электролитов, который сопровождается возникновением внутри системы электрического тока.
При таком типе коррозии атом удаляется из кристаллической решетки результате двух сопряженных процессов:
- Анодного – металл в виде ионов переходит в раствор.
- Катодного – образовавшиеся при анодном процессе электроны, связываются деполяризатором (вещество — окислитель).
Сам процесс отвода электронов с катодных участков называется деполяризацией, а вещества способствующие отводу – деполяризаторами.
Наибольшее распространение имеет коррозия металлов с водородной и кислородной деполяризацией.
Водородная деполяризация
Водородная деполяризация осуществляется на катоде при электрохимической коррозии в кислой среде:
2H + +2e — = H2 разряд водородных ионов
Кислородная деполяризация
Кислородная деполяризация осуществляется на катоде при электрохимической коррозии в нейтральной среде:
O2 + 4H + +4e — = H2O восстановление растворенного кислорода
Все металлы, по их отношению к электрохимической коррозии, можно разбить на 4 группы, которые определяются величинами их стандартных электродных потенциалов:
- Активные металлы (высокая термодинамическая нестабильность) – это все металлы, находящиеся в интервале щелочные металлы — кадмий (Е 0 = -0,4 В). Их коррозия возможна даже в нейтральных водных средах, в которых отсутствуют кислород или другие окислители.
- Металлы средней активности (термодинамическая нестабильность) – располагаются между кадмием и водородом (Е 0 = 0,0 В). В нейтральных средах, в отсутствии кислорода, не корродируют, но подвергаются коррозии в кислых средах.
- Малоактивные металлы (промежуточная термодинамическая стабильность) – находятся между водородом и родием (Е 0 = +0,8 В). Они устойчивы к коррозии в нейтральных и кислых средах, в которых отсутствует кислород или другие окислители.
- Благородные металлы (высокая термодинамическая стабильность) – золото, платина, иридий, палладий. Могут подвергаться коррозии лишь в кислых средах при наличии в них сильных окислителей.
Виды электрохимической коррозии
Электрохимическая коррозия может протекать в различных средах. В зависимости от характера среды выделяют следующие виды электрохимической коррозии:
- Коррозия в растворах электролитов — в растворах кислот, оснований, солей, в природной воде.
- Атмосферная коррозия – в атмосферных условиях и в среде любого влажного газа. Это самый распространенный вид коррозии.
Например, при взаимодействии железа с компонентами окружающей среды, некоторые его участки служат анодом, где происходит окисление железа, а другие – катодом, где происходит восстановление кислорода:
А: Fe – 2e — = Fe 2+
K: O2 + 4H + + 4e — = 2H2O
Катодом является та поверхность, где больше приток кислорода.
- Почвенная коррозия – в зависимости от состава почв, а также ее аэрации, коррозия может протекать более или менее интенсивно. Кислые почвы наиболее агрессивны, а песчаные – наименее.
- Аэрационная коррозия — возникает при неравномерном доступе воздуха к различным частям материала.
- Морская коррозия – протекает в морской воде, в связи с наличием в ней растворенных солей, газов и органических веществ.
- Биокоррозия – возникает в результате жизнедеятельности бактерий и других организмов, вырабатывающих такие газы как CO2, H2S и др., способствующие коррозии металла.
- Электрокоррозия – происходит под действием блуждающих токов на подземных сооружениях, в результате работ электрических железных дорог, трамвайных линий и других агрегатов.
Методы защиты от коррозии металла
Основной способ защиты от коррозии металла – это создание защитных покрытий – металлических, неметаллических или химических.
Металлические покрытия
Металлическое покрытие наносится на металл, который нужно защитить от коррозии, слоем другого металла, устойчивого к коррозии в тех же условиях. Если металлическое покрытие изготовлено из металла с более отрицательным потенциалом (более активный) , чем защищаемый, то оно называется анодным покрытием. Если металлическое покрытие изготовлено из металла с более положительным потенциалом (менее активный), чем защищаемый, то оно называется катодным покрытием.
Например, при нанесении слоя цинка на железо, при нарушении целостности покрытия, цинк выступает в качестве анода и будет разрушаться, а железо защищено до тех пор, пока не израсходуется весь цинк. Цинковое покрытие является в данном случае анодным.
Катодным покрытием для защиты железа, может, например, быть медь или никель. При нарушении целостности такого покрытия, разрушается защищаемый металл.
Неметаллические покрытия
Такие покрытия могут быть неорганические (цементный раствор, стекловидная масса) и органические (высокомолекулярные соединения, лаки, краски, битум).
Химические покрытия
В этом случае защищаемый металл подвергают химической обработке с целью образования на поверхности пленки его соединения, устойчивой к коррозии. Сюда относятся:
оксидирование – получение устойчивых оксидных пленок (Al2O3, ZnO и др.);
азотирование – поверхность металла (стали) насыщают азотом;
воронение стали – поверхность металла взаимодействует с органическими веществами;
цементация – получение на поверхности металла его соединения с углеродом.
Изменение состава технического металла и коррозионной среды
Изменение состава технического металла также способствует повышению стойкости металла к коррозии. В этом случае в металл вводят такие соединения, которые увеличивают его коррозионную стойкость.
Изменение состава коррозионной среды (введение ингибиторов коррозии или удаление примесей из окружающей среды) тоже является средством защиты металла от коррозии.
Электрохимическая защита
Электрохимическая защита основывается на присоединении защищаемого сооружения катоду внешнего источника постоянного тока, в результате чего оно становится катодом. Анодом служит металлический лом, который разрушаясь, защищает сооружение от коррозии.
Протекторная защита – один из видов электрохимической защиты – заключается в следующем.
К защищаемому сооружению присоединяют пластины более активного металла, который называется протектором. Протектор – металл с более отрицательным потенциалом – является анодом, а защищаемое сооружение – катодом. Соединение протектора и защищаемого сооружения проводником тока, приводит к разрушению протектора.
Примеры задач с решениями на определение защитных свойств оксидных пленок, определение коррозионной стойкости металлов, а также уравнения реакций, протекающих при электрохимической коррозии металлов приведены в разделе Задачи к разделу Коррозия металлов
Защита металла от коррозии
Металлы используются человеком с доисторических времен, изделия из них широко распространены в нашей жизни. Самым распространенным металлом является железо и его сплавы. К сожалению, они подвержены коррозии, или ржавлению — разрушению в результате окисления. Своевременная защита от коррозии позволяет продлить срок службы металлических изделий и конструкций.

Защита от коррозии
Виды коррозии
Ученые давно борются с коррозией и выделили несколько основных ее типов:
- Атмосферная. Происходит окисление вследствие контакта с кислородом воздуха и содержащимися в нем водяными парами. Присутствие в воздухе загрязнений в виде химически активных веществ ускоряет ржавление.
- Жидкостная. Проходит в водной среде, соли, содержащиеся в воде, особенно морской, многократно ускоряют окисление.
- Почвенная. Этому виду подвержены изделия и конструкции, находящиеся в грунте. Химический состав грунта, грунтовые воды и токи утечки создают особую среду для развития химических процессов.
Исходя из того, в какой среде будет эксплуатироваться изделие, подбираются подходящие методы защиты от коррозии.
Характерные типы поражения ржавчиной
Различают следующие характерные виды поражения коррозией:
- Поверхность покрыта сплошным ржавым слоем или отдельными кусками.
- На детали возникли небольшие участки ржавчины, проникающей в толщину детали.
- В виде глубоких трещин.
- В сплаве окисляется один из компонентов.
- Глубинное проникновение по всему объему.
- Комбинированные.

Виды коррозионных разрушений
По причине возникновения разделяют также:
- Химическую. Химические реакции с активными веществами.
- Электрохимическую. При контакте с электролитическими растворами возникает электрический ток, под действием которого замещаются электроны металлов, и происходит разрушение кристаллической структуры с образованием ржавчины.
Коррозия металла и способы защиты от нее
Ученые и инженеры разработали множество способов защиты металлических конструкций от коррозии.
Защита от коррозии индустриальных и строительных конструкций, различных видов транспорта осуществляется промышленными способами.
Зачастую они достаточно сложные и дорогостоящие. Для защиты металлических изделий в условиях домовладений применяют бытовые методы, более доступные по цене и не связанные со сложными технологиями.
Промышленные
Промышленные методы защиты металлических изделий подразделяются на ряд направлений:
- Пассивация. При выплавке стали в ее состав добавляют легирующие присадки, такие, как Cr, Mo, Nb, Ni. Они способствуют образованию на поверхности детали прочной и химически стойкой пленки окислов, препятствующей доступу агрессивных газов и жидкостей к железу.
- Защитное металлическое покрытие. На поверхность изделия наносят тонкий слой другого металлического элемента — Zn , Al, Co и др. Этот слой защищает железо о т ржавления.
- Электрозащита. Рядом с защищаемой деталью размещают пластины из другого металлического элемента или сплава, так называемые аноды. Токи в электролите текут через эти пластины, а не через деталь. Так защищают подводные детали морского транспорта и буровых платформ.
- Ингибиторы. Специальные вещества, замедляющие или вовсе останавливающие химические реакции.
- Защитное лакокрасочное покрытие.
- Термообработка.

Порошковая покраска для защиты от коррозии
Способы защиты от коррозии, используемые в индустрии, весьма разнообразны. Выбор конкретного метода борьбы с коррозией зависит от условий эксплуатации защищаемой конструкции.
Бытовые
Бытовые методы защиты металлов от коррозии сводятся, как правило, к нанесению защитных лакокрасочных покрытий. Состав их может быть самый разнообразный, включая:
- силиконовые смолы;
- полимерные материалы;
- ингибиторы;
- мелкие металлические опилки.
Отдельной группой стоят преобразователи ржавчины — составы, которые наносят на уже затронутые коррозией конструкции. Они восстанавливают железо из окислов и предотвращают повторную коррозию. Преобразователи делятся на следующие виды:
- Грунты. Наносятся на зачищенную поверхность, обладают высокой адгезией. Содержат в своем составе ингибирующие вещества, позволяют экономить финишную краску.
- Стабилизаторы. Преобразуют оксиды железа в другие вещества.
- Преобразователи оксидов железа в соли.
- Масла и смолы, обволакивающие частички ржавчины и нейтрализующие ее.

При выборе грунта и краски лучше брать их от одного производителя. Так вы избежите проблем совместимости лакокрасочных материалов.
Защитные краски по металлу
По температурному режиму эксплуатации краски делятся на две большие группы:
- обычные, используемые при температурах до 80 °С;
- термостойкие.
По типу связующей основы краски бывают:
- алкидные;
- акриловые;
- эпоксидные.
Лакокрасочные покрытия по металлу имеют следующие достоинства:
- качественная защита поверхности от коррозии;
- легкость нанесения;
- быстрота высыхания;
- много разных цветов;
- долгий срок службы.
Большой популярностью пользуются молотковые эмали, не только защищающие метал, но и создающие эстетичный внешний вид. Для обработки металла распространена также краска-серебрянка. В ее состав добавлена алюминиевая пудра. Защита металла происходит за счет образования тонкой пленки окиси алюминия.

Эпоксидные смеси из двух компонентов отличаются исключительной прочностью покрытия и применяются для узлов, подверженных высоким нагрузкам.
Защита металла в бытовых условиях
Чтобы надежно защитить металлические изделия от коррозии, следует выполнить следующую последовательность действий:
- очистить поверхность от ржавчины и старой краски с помощью проволочной щетки или абразивной бумаги;
- обезжирить поверхность;
- сразу же нанести слой грунта;
- после высыхания грунта нанести два слоя основной краски.
При работе следует использовать средства индивидуальной защиты:
- перчатки;
- респиратор;
- очки или прозрачный щиток.
Способы защиты металлов от коррозии постоянно совершенствуются учеными и инженерами.
Методы противостояния коррозионным процессам
Основные методы, применяемые для противодействия коррозии, приведены ниже:
- повышение способности материалов противостоять окислению за счет изменения его химического состава;
- изоляция защищаемой поверхности от контакта с активными средами;
- снижение активности окружающей изделие среды;
- электрохимические.
Первые две группы способов применяются во время изготовления конструкции, а вторые – во время эксплуатации.
Методы повышения сопротивляемости
В состав сплава добавляют элементы, повышающие его коррозионную устойчивость. Такие стали называют нержавеющими. Они не требуют дополнительных покрытий и отличаются эстетичным внешним видом. В качестве добавок применяют никель, хром, медь, марганец, кобальт в определенных пропорциях.

Нержавеющая сталь AISI 304
Стойкость материалов к ржавлению повышают также, удаляя их состава ускоряющие коррозию компоненты, как, например, кислород и серу — из стальных сплавов, а железо – из магниевых и алюминиевых.
Снижение агрессивности внешней среды и электрохимическая защита
С целью подавления процессов окисления во внешнюю среду добавляют особые составы — ингибиторы. Они замедляют химические реакции в десятки и сотни раз.
Электрохимические способы сводятся к изменению электрохимического потенциала материала путем пропускания электрического тока. В результате коррозионные процессы сильно замедляются или даже вовсе прекращаются.
Пленочная защита
Защитная пленка препятствует доступу молекул активных веществ к молекулам металла и таким образом предотвращают коррозионные явления.
Пленки образуются из лакокрасочных материалов, пластмассы и смолы. Лакокрасочные покрытия недороги и удобны в нанесении. Ими покрывают изделие в несколько слоев. Под краску наносят слой грунта, улучшающего сцепление с поверхностью и позволяющего экономить более дорогую краску. Служат такие покрытия от 5 до 10 лет. В качестве грунта иногда применяют смесь фосфатов марганца и железа.
Защитные покрытия создают также из тонких слоев других металлов: цинка, хрома, никеля. Их наносят гальваническим способом.
Покрытие металлом с более высоким электрохимическим потенциалом, чем у основного материала, называется анодным. Оно продолжает защищать основной материал, отвлекая активные окислители на себя, даже в случае частичного разрушения. Покрытия с более низким потенциалом называют катодными. В случае нарушения такого покрытия оно ускоряет коррозию за счет электрохимических процессов.
Металлическое покрытие также можно наносить также методом распыления в струе плазмы.
Применяется также и совместный прокат нагретых до температуры пластичности листов основного и защищающего металла. Под давлением происходит взаимная диффузия молекул элементов в кристаллические решетки друг друга и образование биметаллического материала. Этот метод называют плакированием.
Читайте также:
