Установите соответствие между названием металла и промышленным электролитическим способом его получения
Установите соответствие между веществом и возможным способом его получения путём электролиза: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
2) раствора в расплавленном криолите
3) водного раствора
4) водного раствора
5) водного раствора
Запишите в ответ цифры, расположив их в порядке, соответствующем буквам:
В случае электролиза растворов порядок разрядки на катоде:
Катионы металлов в ряду активности до алюминия, включая алюминий, не разряжаются, поэтому образуется только водород. Катионы металлов от алюминия до водорода разряжаются с образованием металла и водорода, катионы металлов после водорода разряжаются до чистого металла.
В случае электролиза растворов порядок разрядки на аноде:
Бескислородные анионы кроме фтора разряжаются до чистого неметалла, органические анионы — до углекислого газа и удвоенного оставшегося органического скелета. Фтор и кислородсодержащие анионы не разряжаются, образуется кислород.
Таким образом, водород и хлор можно получить электролизом водного раствора хлорида алюминия, калий — электролизом расплава фторида калия, а алюминий — электролизом раствора оксида алюминия в расплавленном криолите.
Тип 20 № 24479Установите соответствие между веществом и способом его получения с помощью электролиза: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
В случае электролиза растворов, порядок разрядки на катоде:
В случае электролиза растворов, порядок разрядки на аноде:
А. калий — активный металл, поэтому получаем из расплава его соли (2);
Б. при электролизе раствора хлорида натрия будет происходить восстановление воды (появятся гидроксид-анионы), которые потом дадут гидроксид натрия (1);
В. алюминий получают электролизом расплава его оксида (5);
Г. аналогично пункту Б, электролизом раствора хлорида калия (3).
Тип 20 № 245161) холодного раствора
А. цинк получаем из раствора его соли (2);
Б. при электролизе раствора хлорида калия будет происходить восстановление воды (появятся гидроксид-анионы), которые потом дадут гидроксид калия (5);
В. фтор получают электролизом расплава гидрофторида калия (3);
Г. аналогично пункту Б, электролизом раствора хлорида натрия (1).
Тип 20 № 25318Установите соответствие между формулой вещества и продуктами электролиза водного раствора или расплава этого вещества, выделившимися на инертных электродах: к каждой позиции, обозначенной буквой, подберите
соответствующую позицию, обозначенную цифрой.
1) водород и кислород
2) металл и галоген
3) металл, вода и кислород
4) водород и галоген
5) металл, углекислый газ и углеводород
6) водород, углекислый газ и углеводород
А. При электролизе неорганических кислородсодержащих кислот образуется кислород и водород (1);
Б. При электролизе ацетата серебра выделяется серебро, углекислый газ и этан (5);
В. Выделяется водород и иод (4);
Г. При электролизе расплава фторида калия выделяется калий и фтор (2).
Тип 20 № 27081Установите соответствие между формулой вещества и продуктами электролиза водного раствора этого вещества, выделившимися на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
1) металл, водород, кислород
2) водород, кислород
3) металл, водород, галоген
4) металл, галоген
5) водород, галоген
6) металл, кислород
А. При электролизе раствора нитрата кальция выделяется водород и кислород (2);
Б. При электролизе сульфата лития ситуация аналогичная (2);
В. Выделяется водород и хлор (5);
Г. При электролизе нитрата серебра выделяется серебро и кислород (6).
Тип 20 № 279991) водород и сернистый газ
2) металл и сероводород
3) водород и кислород
5) металл и кислород
6) металл и галоген
А. При электролизе раствора бромида магния выделяется бром и водород (4);
Б. При электролизе гидроксида бария выделяется водород и кислород (3);
В. Выделяется медь и кислород (5);
Г. При электролизе серной кислоты выделяется водород и кислород (3).
Тип 20 № 284541) водород, углекислый газ и этан
2) водород и кислород
3) водород и галоген
4) металл и кислород
5) металл и галоген
6) металл и углекислый газ
А. При электролизе раствора перхлората калия выделяется водород и кислород (2);
Б. При электролизе раствора иодида калия выделяется иод и водород (3);
В. Выделяется серебро и кислород (4);
Г. При электролизе раствора ацетата кальция выделяется водород, углекислый газ и этан (1).
Тип 20 № 30426Установите соответствие между формулой вещества и продуктом(-ами) электролиза водного раствора этого вещества, образовавшим(и)ся на инертном аноде: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
1) углекислый газ и углеводород
Запишите в таблицу выбранные цифры под соответствующими буквами.
В случае электролиза растворов, порядок разрядки на аноде следующий:
В процессе электролиза на катоде происходят процессы восстановления. Положительно заряженные частицы восстанавливаются на катоде следующим образом:
Катионы активных металлов, стоящих в электрохимическом ряду активности левее алюминия (включительно), разряжаются тяжело, поэтому электролизу подвергается вода и на катоде выделяется водород.
Катионы менее активных металлов, стоящих в электрохимическом ряду активности правее алюминия и до водорода, подвергаются гидролизу с выделением на катоде и простого вещества — металла, и водорода.
Катионы неактивных металлов, стоящих в электрохимическом ряду активности металлов правее водорода, подвергаются гидролизу с выделением на катоде простого вещества — металла.
А. При электролизе раствора йодида калия на аноде выделяется галоген (йод) (3);
Б. При электролизе раствора бензоата калия на аноде выделяются углекислый газ и углеводород (дифенил) (1);
В. При электролизе раствора сульфата железа(II) на аноде выделяется кислород (2).
Установите соответствие между названием металла и промышленным электролитическим способом его получения
Тип 20 № 205791) водного раствора
А. Натрий активный металл и получается электролизом расплавов его солей (2).
Б. Водород можно получить путём электролиза раствора фторида натрия (5).
В. Фтор невозможно получить электролизом раствора фторида металла, но можно получить с помощью электролиза расплава фторида металла (2).
Г. Кислород можно получить электролизом водного раствора фторида металла (5).
Тип 20 № 7496Установите соответствие между названием металла и электролитическим способом его получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
1) электролиз водного раствора сульфата
2) электролиз расплавленного хлорида
3) электролиз расплавленного нитрата
4) электролиз водного раствора гидроксида
Калий и кальций — активные металлы, поэтому их получают не из растворов, а при (2) электролизе расплавленного хлорида (нитрат при нагревании разлагается).
Медь и хром — малоактивные — их можно получить при электролизе растворов, а именно (1) электролизе водного раствора сульфата (гидроксиды меди и хрома нерастворимы).
Тип 20 № 7589Установите соответствие между названием металла и промышленным электролитическим способом его получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
1) электролиз водного раствора хлорида
2) электролиз водного раствора нитрата
4) электролиз расплавленного хлорида
Кальций и натрий — активные металлы, поэтому их получают при 4) электролизе расплавленного хлорида.
Серебро и свинец — можно получить при 2) электролизе водного раствора нитрата.
А почему нельзя получить серебро и свинец электролизом водного раствора хлорида?! На мой взгляд, такой вариант тоже имеет право на существование! Правильный ответ:4141
хлориды серебра и свинца плохо растворимы
Тип 25 № 9782Установите соответствие между простым веществом и основным способом его промышленного получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
1) восстановление оксида углеродом
2) восстановление оксида водородом
3) реакция замещения в водном растворе
4) электролиз раствора
5) электролиз расплава
А) Алюминий образует прочную химическую связь с кислородом. По сравнению с другими металлами, восстановление алюминия из руды более сложно в связи с его высокой реакционной способностью и с высокой температурой плавления большинства его руд (таких, как бокситы). Прямое восстановление углеродом применяться не может, потому что восстановительная способность алюминия выше, чем у углерода. Современный метод получения заключается в растворении оксида алюминия в расплаве криолита с последующим электролизом с использованием расходуемых коксовых или графитовых анодных электродов.
Б) В промышленности железо получают из железной руды, в основном из гематита () и магнетита ().
Существуют различные способы извлечения железа из руд. Наиболее распространённым является доменный процесс.
Первый этап производства — восстановление железа углеродом в доменной печи при температуре 2000 °C. В доменной печи углерод в виде кокса, железная руда в виде агломерата подаются сверху, а снизу их встречает поток нагнетаемого горячего воздуха. В печи углерод в виде кокса окисляется до монооксида углерода. Данный оксид образуется при горении в недостатке кислорода. В свою очередь, монооксид углерода восстанавливает железо из руды. Чтобы данная реакция шла быстрее, нагретый угарный газ пропускают через оксид железа (III).
В) Первым промышленным способом получения натрия была реакция восстановления карбоната натрия углем при нагревании тесной смеси этих веществ в железной ёмкости до 1000 °C (способ Девилля). С появлением электроэнергетики более практичным стал другой способ получения натрия — электролиз расплава едкого натра или хлорида натрия. В настоящее время электролиз — основной способ получения натрия.
Г) В промышленности кремний технической чистоты получают, восстанавливая расплав коксом при температуре около 1800 °C в рудотермических печах шахтного типа. Чистота полученного таким образом кремния может достигать 99,9%.
Тема "Электролиз"

Установите соответствие между формулой вещества и продуктом, выделяющимся на катоде при электролизе водного раствора это вещества.
ФОРМУЛА ВЕЩЕСТВА КАТОДНЫЙ ПРОДУКТ
А) NaNO3 1) кислород
В) RbHCO3 3) только водород
Г) SnCI2 4) металл и водород
Установите соответствие между названием металла и промышленным электролитическим способом его получения.
МЕТАЛЛ СПОСОБ ПОЛУЧЕНИЯ
А) кальций 1) электролиз водного раствора хлорида
Б) серебро 2) электролиз водного раствора нитрата
В) натрий 3) электролиз расплавленного нитрата
Г) свинец 4) электролиз расплавленного хлорида
Установите соответствие между формулой вещества и продуктом, выделяющимся на катоде при электролизе водного раствора этого вещества.
Б) AgNO3 2) только металл
B) ZnCI2 3) только водород
Г) NaHC2O4 4) металл и водород
Установите соответствие между формулой вещества и продуктом, выделяющимся на аноде при электролизе водного раствора этого вещества
ФОРМУЛА ВЕЩЕСТВА АНОДНЫЙ ПРОДУКТ
А) NaF 1) кислород
В) ZnCI2 3) водород
5) углекислый газ
Установите соответствие между формулой соли и продуктом, выделяющимся на аноде при электролизе водного раствора этого вещества.
ФОРМУЛА СОЛИ АНОДНЫЙ ПРОДУКТ
Установите соответствие между формулой вещества и продуктом, выделяющимся на аноде при электролизе водного раствора этого вещества.
А) KI 1) кислород
Установите соответствие между названием металла и электролитическим способом его получения.
А) калий 1) электролиз водного раствора сульфата
Б) медь 2) электролиз расплавленного хлорида
В) хром 3) электролиз расплавленного нитрата
Г) кальций 4) электролиз водного раствора гидроксида
Установите соответствие между формулой моли и продуктом, выделяющимся на катоде при электролизе водного раствора этого вещества
ФОРМУЛА СОЛИ КАТОДНЫЙ ПРОДУКТ
ТЕМА: ПЕРЕХОДНЫЕ МЕТАЛЛЫ. 11 класс
В основном состоянии сокращенные электронные конфигурации атомов хрома и меди имеют вид:
1)…3d 5 4s 1 и …3d 10 4s 1 2)…3d 4 4s 2 и …3d 9 4s 2 3)…3d 5 4s 1 и …d 9 4s 2 4) …3d 4 4s 2 и …3d 10 4s 1
2. Какое из указанных свойств не характерно для d-элементов и их соединений?
1) способность к образованию комплексных соединений;
2) образование окрашенных соединений;
3) наличие переменных степеней окисления;
4) максимальное значение степени окисления определяется номером периода
3. При взаимодействии какого вещества с медью выделяется SO2?
4. В каких двух из перечисленных реакций образуются соединения Cu (II)?
А) Cu + I2 → Б) Cu + CI2 → В) Cu + FeSO4 → Г) Cu + HCI (разб) →
1) а,б; 2) б,в; 3) в,г; 4) а,г.
5. Соединения желез в степени окисления +3 могут образоваться в результате следующих двух реакций:
1) а,б; 2) б,в; 3) в,г; 4) а,в
6. Дано уравнение реакции:
Какая масса продукта (г) образуется и какое количество теплоты (кДж) выделится при взаимодействии 0,4 моль железа?
65 и 319,6; 2) 65 и 159,8 3) 32,5 и 159,8; 4) 32,5 и 319,6.
1)кислотным оксидом; 2)типичным амфотерным оксидом;
3)ангидридом хромовой и дихромовой кислот; 4)несолеобразующим оксидом.
8. Хром нельзя получить в результате реакции:
9. В избытке концентрированной соляной кислоты растворили 8,7 г диоксида марганца. Укажите выделившийся при этом газ и его объем (л; н.у)
1) хлор, 2,24; 2) кислород, 2,24; 3) водород, 2,24; 4) хлор, 1,12.
9. В избытке концентрированной соляной кислоты растворили 8,7 г диоксида марганца. Укажите выделившийся при этом газ и его объем (л)
Тренажер по подготовке к ЕГЭ по химии «Решение задач на электролиз растворов и расплавов электролитов»
В тренажере представлена теоретичесая часть и показан алгоритм решения заданий ЕГЭ на электролиз, а также подготовлены задания для самостоятельной работы с ответами для закрепления полученных знаний.
Просмотр содержимого документа
«Тренажер по подготовке к ЕГЭ по химии «Решение задач на электролиз растворов и расплавов электролитов»»
Региональный конкурс «Лучшая методическая разработка»
Номинация №3 «Лучшая авторская разработка комплекта учебно-методических материалов/ методических рекомендаций»
Методическая разработка: Тренажер по подготовке к ЕГЭ по химии «Решение задач на электролиз растворов и расплавов электролитов»
Разработала: Сластная Оксана Анатольевна, учитель химии и биологии
МБОУ «Мишелёвская СОШ №19»
Немного теории 3
Задание 20 7
Задание 20 для самостоятельной работы 10
Задание 31 13
Задание 31 для самостоятельной работы 14
Задание 32 14
Задание 32 для самостоятельной работы 15
Ответы к заданиям для самостоятельной работы 16-17
Немного теории
Электролиз – совокупность окислительно-восстановительных процессов, протекающих на катоде и аноде при пропускании электрического тока через растворы или расплавы электролитов.
Катод–отрицательно заряженный электрод, к которому притягиваются катионы.
Анод– положительно заряженный электрод, к которому притягиваются анионы.
Инертные электроды состоят из вещества, не участвующего в реакции электролиза
Катион – положительно заряженный ион.
Анион – отрицательно заряженный ион
1. Установите соответствие между формулой соли и продуктом, образующимся на инертном аноде при электролизе ее водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ПРОДУКТ НА АНОДЕ
А) Б) В) Г) 1) 2) 3) 4) 5) 6)2. Установите соответствие между формулой соли и продуктом, образующимся на катоде при электролизе ее водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ПРОДУКТ НА КАТОДЕ
A) B)3. Установите соответствие между названием вещества и способом его получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
1) раствора 2) расплава 3) раствора 4) раствора 5) расплава 6) расплава4. Установите соответствие между формулой соли и продуктом, образующимся на катоде при электролизе её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
5. Установите соответствие между формулой соли и продуктом, образующимся на инертном аноде при электролизе её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
2) сернистый газ
6. Установите соответствие между формулой соли и уравнением процесса, протекающего на катоде при электролизе её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
УРАВНЕНИЕ КАТОДНОГО ПРОЦЕССА
7. Установите соответствие между формулой соли и схемой процесса, протекающего на инертном аноде при электролизе её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА ПРОЦЕССА НА АНОДЕ
8. Установите соответствие между формулой вещества и простым веществом, которое образуется на катоде в результате электролиза его водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
9. Установите соответствие между формулой вещества и продуктом, который образуется на инертном аноде в результате электролиза водного раствора этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ПРОДУКТ ЭЛЕКТРОЛИЗА НА АНОДЕ
10. Установите соответствие между формулой соли и продуктом, образующимся на инертном аноде при электролизе её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Задание 20 для самостоятельной работы
1. Установите соответствие между формулой соли и схемой процесса, протекающего на инертном аноде при электролизе её водного раствора: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
2. Установите соответствие между формулой вещества и продуктом, выделяющимся на аноде при электролизе водного раствора этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
3. Установите соответствие между формулой вещества и продуктом, выделяющимся на катоде при электролизе водного раствора этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
4. Установите соответствие между названием металла и электролитическим способом его получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
5. Установите соответствие между формулой вещества и продуктом, выделяющимся на катоде при электролизе водного раствора этого вещества: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
2) только металл
3) только водород
4) металл и водород
6. Установите соответствие между названием металла и промышленным электролитическим способом его получения: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
7. Установите соответствие между формулой соли и продуктами электролиза водного раствора этой соли, которые выделились на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
ПРОДУКТЫ ЭЛЕКТРОЛИЗА В РАСТВОРЕ
8. Установите соответствие между веществом и возможным способом его получения путём электролиза: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
1) расплава 2) раствора 3) водного раствора 4) водного раствора 5) водного раствора1. При электролизе водного раствора нитрата меди(II) получили металл. Металл обработали концентрированной серной кислотой при нагревании. Выделившийся в результате газ прореагировал с сероводородом с образованием простого вещества. Это вещество нагрели с концентрированным раствором гидроксида калия. Напишите молекулярные уравнения четырех описанных реакций.
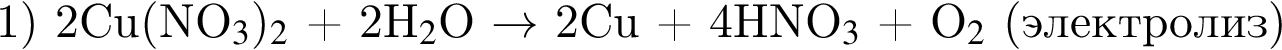

2. Газ, выделившийся на аноде при электролизе раствора хлорида натрия, ввели в колбу с нагретым фосфором. Полученную в колбе жидкость растворили в воде. Образовавшийся раствор обесцвечивает бромную воду. Напишите уравнения четырёх описанных реакций.
1. 2. 3. 4.3. Провели электролиз раствора нитрата меди(II). Выделившийся газ прореагировал с натрием. Полученное вещество растворили в холодной воде. К образовавшемуся раствору добавили раствор сульфата хрома(III) и нагрели. При этом окраска раствора изменилась на жёлтую. Напишите уравнения описанных реакций.
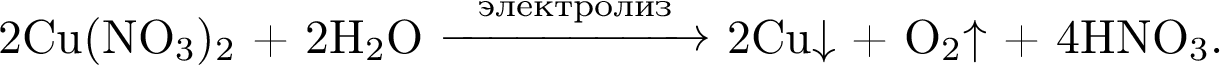

Задание 31 для самостоятельной работы
1. Газ, выделившийся на аноде при электролизе раствора хлорида натрия, собрали в колбу, в которую затем опустили небольшой кусочек нагретого фосфора. После окончания реакции в колбу добавили воду и получили раствор, при добавлении к которому нитрата серебра выпал белый творожистый осадок. Напишите уравнения четырёх описанных реакций.
2. При электролизе водного раствора нитрата меди(II) получили металл. Металл обработали концентрированной серной кислотой при нагревании. Выделившийся в результате газ прореагировал с сероводородом с образованием простого вещества. Это вещество нагрели с концентрированным раствором гидроксида калия. Напишите уравнения четырёх описанных реакций.
3. Раствор нитрата меди (II) подвергли электролизу на инертном аноде. Выделившееся на катоде простое вещество растворили в концентрированной серной кислоте, при этом наблюдали выделение бесцветного газа с резким запахом. Газ собрали и пропустили через раствор сероводородной кислоты, в результате чего в осадок выпало простое вещество желтого цвета. Это вещество прореагировало с расплавленным гидроксидом калия. Напишите уравнения четырёх описанных реакций.
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
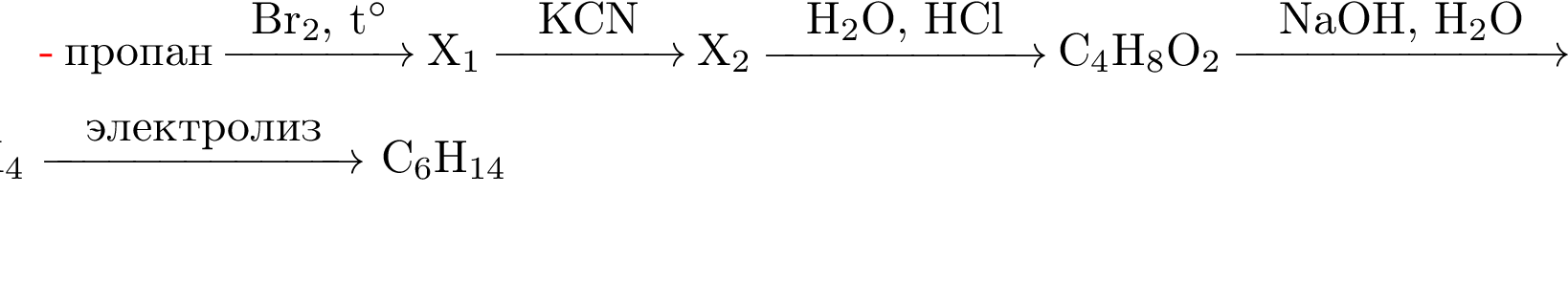
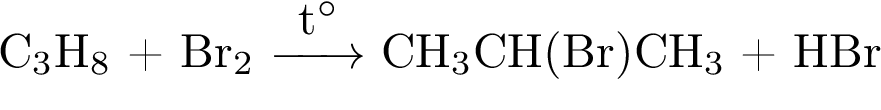
1.

2.
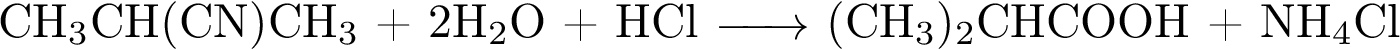
3.

4.

5.
2. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
→
Решение. 1)
2)
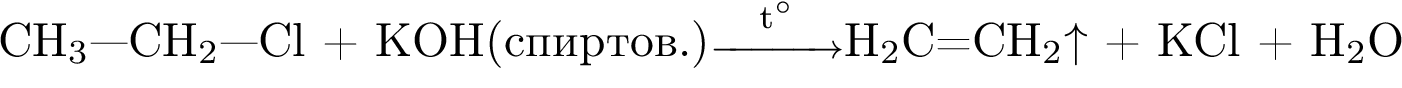
4)
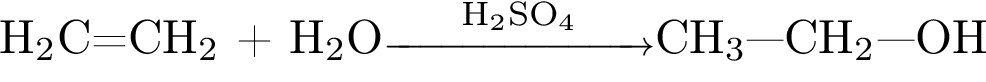
5)
Задание 32 для самостоятельной работы
1.Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Читайте также:
