Уравнение хлора с металлом
Хлор – химический элемент VII группы 3 периода Периодической системы химических элементов Д.И. Менделеева. Неметалл.
Относится к элементам – p -семейства. Галоген. Порядковый номер – 17. Строение внешнего электронного уровня – 3s 2 3 p 5 . Относительная атомная масса – 35,5 а.е.м. Молекула хлора двухатомна – Cl2.
Химические свойства хлора
Хлор реагирует с простыми веществами металлами:
Cl2 + 2Sb = 2SbCl3 (t );
Хлор взаимодействует с простыми веществами неметаллами. Так, при взаимодействии с фосфором и серой образуются соответствующие хлориды, с фтором – фториды, с водородом – хлороводород, с кислородом – оксиды и т.д.:
Хлор способен вытеснять бром и йод из их соединений с водородом и металлами:
Хлор способен растворяться в воде и щелочах, при этом происходят реакции диспропорционирования хлора, а состав продуктов реакции зависит от условий её проведения:
Cl2 + 2NaOH = NaCl + NaClO + H2O;
Хлор взаимодействует с несолеобразующим оксидом – СО с образованием вещества с тривиальным названием – фосген, с аммиаком с образованием трихлорида аммония:
В реакциях хлор проявляет свойства окислителя:
Хлор вступает в реакции взаимодействия с органическими веществами класса алканов, алкенов и аренов:
Физические свойства хлора
Хлор – газ желто-зеленого цвета. Термически устойчив. При насыщении охлажденной воды хлором образуется твердый кларат. Хорошо растворяется в воде, в большой степени подвергается дисмутации («хлорная вода»). Растворяется тетрахлориде углерода, жидких SiCl4 и TiCl4. Плохо растворяется в насыщенном растворе хлорида натрия. Не реагирует с кислородом. Сильный окислитель. Температура кипения — -34,1 С, плавления — -101,03 С.
Получение хлора
Ранее хлор получали по методу Шееле (реакция взаимодействия оксида марганца (VI) c соляной кислотой) или по методу Дикона (реакция взаимодействия хлороводорода с кислородом):
В наше время для получения хлора используют следующие реакции:
NaOCl + 2HCl = NaCl + Cl2↑ + H2O;
2NaCl + 2H2O = 2NaOH + Cl2↑ + H2↑ (условие – электролиз).
Применение хлора
Хлор нашел широкое применение в различных областях промышленности, так его используют в производстве полимерных материалов (поливинилхлорид), отбеливателей, хлорорганических инсектицидов (гексахлоран), боевых отравляющих веществ (фосген), для обеззараживания воды, в пищевой промышленности, в металлургии и т.д.
Примеры решения задач
| Задание | При взаимодействии хлора с водородом образовалось 0,25 моль хлороводорода. Определите объем хлора, который потребовался для этого. |
| Решение | Запишем уравнение реакции взаимодействия хлора и водорода: |
Согласно уравнению реакции n(Cl2):n(HCl) = 1:2, следовательно, n(Cl2) = 1/2× n(HCl) = 0,125 моль. Тогда, объем хлора будет равен:
| Задание | Какой объем, масса и количество вещества хлора выделится (н.у.) при взаимодействии 17,4 г оксида марганца (IV) с соляной кислотой, взятой в избытке? |
| Решение | Запишем уравнение реакции взаимодействия оксида марганца (IV) с соляной кислотой: |
Молярные массы оксида марганца (IV) и хлора, рассчитанные с использованием таблицы химических элементов Д.И. Менделеева – 87 и 71 г/моль, соответственно. Рассчитаем количество вещества оксида марганца (IV):
n(MnO2) = 17,4 / 87 = 0,2 моль.
Согласно уравнению реакции n(MnO2): n(Cl2) = 1:1, следовательно, n(Cl2) = n(MnO2) = 0,2 моль. Тогда масса и объем хлора будут равны:
Физические и химические свойства хлора
Физические свойства
Cl2 при об. Т - газ желто-зеленого цвета с резким удушающим запахом, тяжелее воздуха - в 2,5 раза, малорастворим в воде (~ 6,5 г/л); х. р. в неполярных органических растворителях. В свободном виде встречается только в вулканических газах.
Способы получения
Основаны на процессе окисления анионов Cl -
2Cl - - 2e - = Cl2 0
Промышленный
Электролиз водных растворов хлоридов, чаще - NaCl:
Лабораторные
Окисление конц. HCI различными окислителями:
Химические свойства
Хлор - очень сильный окислитель. Окисляет металлы, неметаллы и сложные вещества, превращаясь при этом в очень устойчивые анионы Cl - :
Реакции с металлами
Активные металлы в атмосфере сухого газообразного хлора воспламеняются и сгорают; при этом образуются хлориды металлов.
Малоактивные металлы легче окисляются влажным хлором или его водными растворами:
Реакции с неметаллами
Хлор непосредственно не взаимодействует только с O2, N2, С. С остальными неметаллами реакции протекают при различных условиях.
Образуются галогениды неметаллов. Наиболее важной является реакция взаимодействия с водородом.
Вытеснение свободных неметаллов (Вr2, I2, N2, S) из их соединений
Диспропорционирование хлора в воде и водных растворах щелочей
В результате самоокисления-самовосстановления одни атомы хлора превращаются в анионы Cl - , а другие в положительной степени окисления входят в состав анионов ClO - или ClO3 - .
Cl2 + Н2O = HCl + НClO хлорноватистая к-та
Эти реакции имеют важное значение, поскольку приводят к получению кислородных соединений хлора:
КClO3 и Са(ClO)2 - гипохлориты; КClO3 - хлорат калия (бертолетова соль).
Взаимодействие хлора с органическими веществами
а) замещение атомов водорода в молекулах ОВ
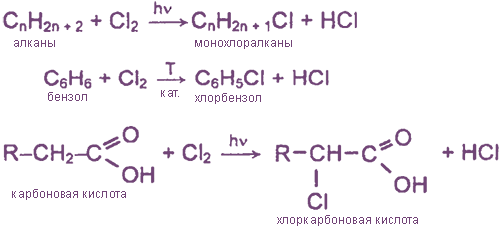
б) присоединение молекул Cl2 по месту разрыва кратных углерод-углеродных связей
Хлороводород и соляная кислота
Газообразный хлороводород
Физические и химические свойства
HCl - хлорид водорода. При об. Т - бесцв. газ с резким запахом, достаточно легко сжижается (т. пл. -114°С, т. кип. -85°С). Безводный НСl и в газообразном, и в жидком состояниях неэлектропроводен, химически инертен по отношению к металлам, оксидам и гидроксидам металлов, а также ко многим другим веществам. Это означает, что в отсутствие воды хлороводород не проявляет кислотных свойств. Только при очень высокой Т газообразный HCl реагирует с металлами, причем даже такими малоактивными, как Сu и Аg.
Восстановительные свойства хпорид-аниона в HCl также проявляются в незначительной степени: он окисляется фтором при об. Т, а также при высокой Т (600°С) в присутствии катализаторов обратимо реагирует с кислородом:
Газообразный HCl широко используется в органическом синтезе (реакции гидрохлорирования).
1. Синтез из простых веществ:
2. Образуется как побочный продукт при хлорировании УВ:
R-H + Cl2 = R-Cl + HCl
3. В лаборатории получают действием конц. H2SO4 на хлориды:
H2SО4(конц.) + NaCl = 2HCl↑ + NaHSО4 (при слабом нагревании)
H2SО4(конц.) + 2NaCl = 2HCl↑ + Na2SО4 (при очень сильном нагревании)
Водный раствор HCl - сильная кислота (хлороводородная, или соляная)
HCl очень хорошо растворяется в воде: при об. Т в 1 л Н2O растворяется ~ 450 л газа (растворение сопровождается выделением значительного количества тепла). Насыщенный раствор имеет массовую долю HCl, равную 36-37 %. Такой раствор имеет очень резкий, удушающий запах.
Молекулы HCl в воде практически полностью распадаются на ионы, т. е. водный раствор HCl является сильной кислотой.
Химические свойства соляной кислоты
1. Растворенный в воде HCl проявляет все общие свойства кислот, обусловленные присутствием ионов Н +
а) с металлами (до Н):
б) с основными и амфотерными оксидами:
в) с основаниями и амфотерными гидроксидами:
г) с солями более слабых кислот:
Реакции с сильными окислителями F2, MnO2, KMnO4, KClO3, K2Cr2O7. Анион Cl - окисляется до свободного галогена:
Уравнения реакция см. "Получение хлора". Особое значение имеет ОВР между соляной и азотной кислотами:
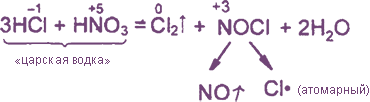
Реакции с органическими соединениями
а) с аминами (как органическими основаниями)
б) с аминокислотами (как амфотерными соедимнеиями)

Оксиды и оксокислоты хлора
Кислородсодержащие соединения хлора - чрезвычайно неустойчивые вещества, так как включают атомы Cl в нестабильных положительных с. о. Тем не менее некоторые из них имеют важное практическое значение.
VII группа главная подгруппа периодический таблицы Менделеева (галогены)
К элементам главной подгруппы VII группы периодической таблицы Менделеева относятся элементы с общим названием «галогены»:
Общая характеристика галогенов
От F к At (сверху вниз в периодической таблице)
Увеличивается
Уменьшается
- электроотрицательность,
- энергия ионизация,
- сродство к электрону.

Электронные конфигурации у данных элементов схожи, они содержат 7 электронов на внешнем слое ns 2 np 5 :
Br – 3d 10 4s 2 4p 5 ;
I — 4d 10 5s 2 5p 5 ;
At – 4f 14 5d 10 6s 2 6p 5
Электронная конфигурация фтора и хлора

Электронная конфигурация брома и йода

Нахождение в природе галогенов
Галогены являются химически активными веществами, в связи с чем, в природе они встречаются только в виде соединений. Их распространённость в земной коре снижается при увеличении атомного радиуса (от фтора к иоду). Например, содержание астата в земной коре исчисляется граммами.
Наиболее распространённые соединения фтора — флюорит CaF2, криолит Na3AlF6 и др., хлора — каменная соль (галит) NaCl, сильвин KCl и сильвинит KCl⋅NaCl.
Бром и иод не образуют индивидуальных минералов, но их соединения содержатся в морской воде и могут накапливаться водорослями.

Способы получения фтора
Фтор получают методом электролиза расплава гидрофторида калия (смеси HF и KF):
Физические свойства фтора

Фтор при обычной температуре — зеленовато-жёлтый ядовитый газ, с резким запахом, очень реакционноспособный, хорошо растворим в жидких водороде и кислороде.
Химические свойства фтора
Фтор является самым сильным окислителем из всех простых веществ. Непосредственно он не взаимодействует только с N2, Не, Ne, Аr, а при нормальных условиях также и с O2.
Взаимодействие с простыми веществами
С кислородом
Реакция протекает при электрическом разряде (2100-2400 В, 25-30 мА), температуре от -196°C до -183°C и давлении 12 мм рт.ст. с образованием дифторида трикислорода (триоксодифторид, фторид озона) или фторида кислорода:
С галогенами (Cl, Br, I)
Фтор вступает в реакции с другими галогенами:
Например, Cl2 + F2 → 2ClF
С водородом
Взаимодействует с водородом со взрывом даже в темноте:
С серой
Реакция с серой протекает легко даже при сильном охлажлении:
С углеродом
Реакция окисления порошкообразного углерода сопровождается самовоспламенением последнего:
С азотом
При нагревании фтор реагирует и с азотом:
С фосфором
Фтор взаимодействует с P энергично (со взрывом) на свету и в темноте, даже при охлаждении жидким N2:
С кремнием
Взаимодействует с кремнием с образованием фторида кремния
C инертными газами
Окисляет ксенон, образуя фторид ксенона:
С металлами
При взаимодействии с металлами образуются фториды:
- К, Na, Pb, Feзагораются при обычной температуре на свету. С щелочными металлами реакция протекает со взрывом:
- Mg, Zn, Sn, Al, Ag, Cu и др. загораются на свету при слабом нагревании:
- с малоактивными металлами – Au, Pt реагирует при нагревании до 300-400°С
Взаимодействие со сложными веществами
С водой
Фтор активно разлагает воду с образованием таких соединений, как фториды кислорода OF2, O2F2; пероксид водорода Н2O2; кислород, озон, фтороводород:
С кислотами
- Взаимодействует с безводной азотной кислотой при комнатной температуре с образованием диоксида-гипофторита азота и фтороводорода:
- С серной кислотой образует гексафторид серы, фтороводород и кислород:
С щелочами и аммиаком
Фтор окисляет щелочи:
Реагирует с газообразным аммиаком:
С солями
Не взаимодействует
Взаимодействие фтора с водными растворами солей невозможны, т.к. он ступает в реакцию с водой.
С оксидами
Реагирует с оксидом кремния, который загорается в атмосфере F2:
Способы получения хлора
Промышленный способ
Электролиз расплавов или водных растворов хлоридов, чаще – NaCl.
- Электролиз расплава хлорида натрия:
A(+): 2Cl − ̶ 2e → Cl2 0
2Na + + 2Cl − → 2Na º + Cl2º
Таким образом, получаем:
- Электролиз раствора хлорида натрия.
Лабораторный способ
Окисление концентрированной HCI сильными окислителями:
Физические свойства хлора
Хлор Cl2 при обычной температуре – тяжелый, желто-зеленый газ с резким удушающим запахом.

Cl2 в 2,5 раза тяжелее воздуха, малорастворим в воде (~ 6,5 г/л); хорошо растворим в неполярных органических растворителях. В свободном состоянии встречается только в вулканических газах.
Химические свойства хлора
Хлор — очень сильный окислитель. Окисляет металлы, неметаллы и сложные вещества, с образованием в устойчивые хлорид-ионы:
Непосредственно не взаимодействует
С галогенами
Хлор взаимодействует с другими галогенами – более активные галогены окисляют менее активные. В зависимости от условий могут получиться различные соединения:
Реакция с водородом при обычных условиях не протекает. Однако, при нагревании, УФ — освещении или электрическом разряде реакция протекает со взрывом:
С фосфором
Непосредственно не взаимодействует
С кремнием
2Cl2 + Si = SiCl4 (при нагревании)
- Активные металлы самовоспламеняются и горят в атмосфере сухого газообразного хлора:
- Окисление малоактивных металлов происходит легче влажным хлором или его водными растворами:
Окисляет сложные вещества:
2Cl2 + 2H2O → 4HCl + O2 (на свету или кипячении)
С водой
При растворении хлора в воде вступает в реакцию диспропорционирования (самоокисления-самовосстановления), с образованием хлорноватистой кислоты:
С водными растворами щелочей
При взаимодействии с щелочами хлор диспропорционирует с образованием солей, состав которых зависит от условий проведения реакции:
- с холоднымраствором щелочи образуются хлорид и гипохлорит:
- с горячимраствором щелочи образуются хлорид и хлорат:
- Хлор также растворяется в холодном растворе гидроксида кальция:
Эти реакции имеют важное практическое значение, приводят к получению гипохлоритов — КClO3 и Са(ClO)2; хлората калия (бертолетова соль) — КClO3
Более активные галогены вытесняют менее активные галогены из солей и галогеноводородов:
HC ≡ CH + 2Cl2 → Cl2HC — CHCl2 1,1,2,2-тетрахлорэтан
Способы получения брома
- Исходное сырьё для получения брома — морская вода, озёрные и подземные рассолы и щелока калийного производства, содержащие бром в виде бромид-иона Br-
Бром втесняют при помощи хлора:
Далее бром отгоняют из раствора водяным паром или воздухом.
Лабораторный способ
- В лаборатории для получения брома используют сильные окислители:
Физические свойства брома

В обычных условиях бром – красно-бурая жидкость с резким зловонным запахом. При Т=-7,2°C жидкий бром застывает, образуя красно-коричневые игольчатые кристаллы.
Пары брома жёлто-бурого цвета, Ткип = 58,78°C.
В воде бром растворяется лучше других галогенов (3,58 г брома в 100 г H2O при 20°C). Хорошо растворим во многих органических растворителях.
Бромная вода имеет желто-бурую окраску, быстро исчезающую, при взаимодействии растворенного Br2 с каким-либо веществом. «Обесцвечивание бромной воды» — широко используется в качестве теста на обнаружение в растворе многих неорганических и органических веществ.
Химические свойства брома
Химические свойства брома сходны с хлором. Различаются только условия протекания реакций.
Взаимодействие с простыми веществами
С металлами
Жидкий бром сильный окислитель. Например, железо и алюминий самовозгораются при соприкосновении с бромом даже при обычной температуре.
Взаимодействие брома с водородом происходит лишь при повышенной температуре. Реакция эндотермической и обратимой.
С азотом, углеродом, кислородом и благородными газами
Бром окисляется более активными галогенами:
Взаимодействие со сложными веществами
- диспропорционирует в водном растворе:
3BrO — ↔ BrO3 — + 2Br —
4BrO — ↔ BrO4 — + 3Br —
Обесцвечивание бромной воды
Обесцвечивание бромной воды – качественная реакция на многие неорганические и органические соединения:
- в воде SO2 и H2S в газообразном и растворенном виде, а также растворимые сульфиты и сульфиды реагируют с бромной водой, обесцвечивая ее:
- Обесцвечивание бромной воды непредельными органическими соединениями:
- Фенол и анилин также легко взаимодействуют с бромной водой:
Способы получения йода
- Йод, также как и бром, извлекают из морской воды, соленых озер, подземных рассолов и буровых вод, где он содержится в виде I — .
- Получение свободного йода с помощью различных окислителей, чаще всего газообразного хлора:
- Йод можно получить также как и хлор или бром действием различных окислителей (КМnО4, МnО2, КСlO3, КВrО3, FеСl3 и СuSO4) на иодоводородную кислоту:
2 FеC3 + 2 НI = 2 FeCl2 + I2 + 2 НСl
Физические свойства йода
Свободный йод I2 при обычной температуре — черно-серое с фиолетовым оттенком кристаллическое вещество с металлическим блеском. Легко возгоняется. Пары йода имеют своеобразный запах и очень ядовиты.

Среди галогенов I2 обладает самой меньшей растворимостью в воде, однако он хорошо растворим в спирте и других органических растворителях.
Химические свойства йода
Химическая активность йода – наименьшая по сравнению с другими галогенами. Со многими элементами йод непосредственно не взаимодействует, а с некоторыми реагирует только при повышенных температурах (водород, кремний, многие металлы).
Йод-крахмальная реакция
Обнаружить I2 даже в самой минимальной концентрации можно с помощью раствора крахмала, который при наличии I2 окрашивается в грязно-синий цвет.
Йод-крахмальная реакция используется при качественном обнаружении йода, а также его количественного анализа
С водородом
Реакция обратима и возможна только при высокой температуре:
При добавлении капли воды в качестве катализатора цинк, железо и алюминий в смеси с порошком йода горят, образуя йодиды:
С азотом, углеродом, кислородом
С водой
Частично реагирует с водой (реакция диспропорционирования):
С щелочью
Диспропорционирует в водном растворе щелочи:
C аммиаком
C аммиаком образует аддукт нитрид трииодида:
С иодидами щелочных металлов
Молекулы галогенов присоединяются к иодидам щелочных металлов с образованием полииодидов (периодидов):
С окислителями
Йод проявляет восстановительные свойства в реакциях с сильными окислителями:
C восстановителями
Иод менее сильный окислитель, чем фтор, хлор и бром. Восстановители, такие как H2S, Na2S2O3 и др. восстанавливают его до иона I − :
Уравнение хлора с металлом
Простое вещество хлор (CAS-номер: 7782-50-5) при нормальных условиях — ядовитый газ желтовато-зелёного цвета, с резким запахом. Молекула хлора двухатомная (формула Cl2).
Впервые хлор был получен в 1772 г. Шееле, описавшим его выделение при взаимодействии пиролюзита с соляной кислотой в своём трактате о пиролюзите:
Шееле отметил запах хлора, схожий с запахом царской водки, его способность взаимодействовать с золотом и киноварью, а также его отбеливающие свойства.
Однако Шееле, в соответствии с господствовавшей в химии того времени теории флогистона, предположил, что хлор представляет собой дефлогистированную соляную кислоту, то есть оксид соляной кислоты. Бертолле и Лавуазье предположили, что хлор является оксидом элемента мурия, однако попытки его выделения оставались безуспешными вплоть до работ Дэви, которому электролизом удалось разложить поваренную соль на натрий и хлор.
Распространение в природе
В природе встречаются два изотопа хлора 35 Cl и 37 Cl. В земной коре хлор самый распространённый галоген. Хлор очень активен — он непосредственно соединяется почти со всеми элементами периодической системы. Поэтому в природе он встречается только в виде соединений в составе минералов: галита NaCI, сильвина KCl, сильвинита KCl · NaCl, бишофита MgCl2 · 6H2O, карналлита KCl · MgCl2 · 6Н2O, каинита KCl · MgSO4 · 3Н2О. Самые большие запасы хлора содержатся в составе солей вод морей и океанов.
На долю хлора приходится 0,025 % от общего числа атомов земной коры, кларковое число хлора — 0,19%, а человеческий организм содержит 0,25 % ионов хлора по массе. В организме человека и животных хлор содержится в основном в межклеточных жидкостях (в том числе в крови) и играет важную роль в регуляции осмотических процессов, а также в процессах, связанных с работой нервных клеток.
Изотопный состав
В природе встречаются 2 стабильных изотопа хлора: с массовым числом 35 и 37. Доли их содержания соответственно равны 75,78 % и 24,22 %.
| Изотоп | Относительная масса, а.е.м. | Период полураспада | Тип распада | Ядерный спин |
|---|---|---|---|---|
| 35 Cl | 34.968852721 | Стабилен | — | 3/2 |
| 36 Cl | 35.9683069 | 301000 лет | β-распад в 36 Ar | 0 |
| 37 Cl | 36.96590262 | Стабилен | — | 3/2 |
| 38 Cl | 37.9680106 | 37,2 минуты | β-распад в 38 Ar | 2 |
| 39 Cl | 38.968009 | 55,6 минуты | β-распад в 39 Ar | 3/2 |
| 40 Cl | 39.97042 | 1,38 минуты | β-распад в 40 Ar | 2 |
| 41 Cl | 40.9707 | 34 c | β-распад в 41 Ar | |
| 42 Cl | 41.9732 | 46,8 c | β-распад в 42 Ar | |
| 43 Cl | 42.9742 | 3,3 c | β-распад в 43 Ar |
Физические и физико-химические свойства
При нормальных условиях хлор — жёлто-зелёный газ с удушающим запахом. Некоторые его физические свойства представлены в таблице.
Некоторые физические свойства хлора
| Свойство | Значение |
|---|---|
| Температура кипения | −34 °C |
| Температура плавления | −101 °C |
| Температура разложения (диссоциации на атомы) | ~1400°С |
| Плотность (газ, н.у.) | 3,214 г/л |
| Сродство к электрону атома | 3,65 эВ |
| Первая энергия ионизации | 12,97 эВ |
| Теплоемкость (298 К, газ) | 34,94 (Дж/моль·K) |
| Критическая температура | 144 °C |
| Критическое давление | 76 атм |
| Стандартная энтальпия образования (298 К, газ) | 0 (кДж/моль) |
| Стандартная энтропия образования (298 К, газ) | 222,9 (Дж/моль·K) |
| Энтальпия плавления | 6,406 (кДж/моль) |
| Энтальпия кипения | 20,41 (кДж/моль) |
При охлаждении хлор превращается в жидкость при температуре около 239 К, а затем ниже 113 К кристаллизуется в орторомбическую решётку с пространственной группой Cmca и параметрами a=6,29 Å b=4,50 Å, c=8,21 Å. Ниже 100 К орторомбическая модификация кристаллического хлора переходит в тетрагональную, имеющую пространственную группу P42/ncm и параметры решётки a=8,56 Å и c=6,12 Å.
Растворимость
| Растворитель | Растворимость г/100 г |
|---|---|
| Бензол | Растворим |
| Вода (0 °C) | 1,48 |
| Вода (20 °C) | 0,96 |
| Вода (25 °C) | 0,65 |
| Вода (40 °C) | 0,46 |
| Вода (60 °C) | 0,38 |
| Вода (80 °C) | 0,22 |
| Тетрахлорметан (0 °C) | 31,4 |
| Тетрахлорметан (19 °C) | 17,61 |
| Тетрахлорметан (40 °C) | 11 |
| Хлороформ | Хорошо растворим |
| TiCl4, SiCl4, SnCl4 | Растворим |
Степень диссоциации молекулы хлора Cl2 → 2Cl. При 1000 К равна 2,07*10 -4 %, а при 2500 К 0,909 %.
Порог восприятия запаха в воздухе равен 0,003 (мг/л).
В реестре CAS — номер 7782-50-5.
По электропроводности жидкий хлор занимает место среди самых сильных изоляторов: он проводит ток почти в миллиард раз хуже, чем дистиллированная вода, и в 10 22 раз хуже серебра. Скорость звука в хлоре примерно в полтора раза меньше, чем в воздухе.
Строение электронной оболочки
На валентном уровне атома хлора содержится 1 неспаренный электрон: 1S² 2S² 2p 6 3S² 3p 5 , поэтому валентность равная 1 для атома хлора очень стабильна. За счёт присутствия в атоме хлора незанятой орбитали d-подуровня, атом хлора может проявлять и другие валентности. Схема образования возбуждённых состояний атома:
Также известны соединения хлора, в которых атом хлора формально проявляет валентность 4 и 6, например ClO2 и Cl2O6. Однако, эти соединения являются радикалами, то есть у них есть один неспаренный электрон.
Взаимодействие с металлами
Хлор непосредственно реагирует почти со всеми металлами (с некоторыми только в присутствии влаги или при нагревании):
Взаимодействие с неметаллами
На свету или при нагревании активно реагирует (иногда со взрывом) с водородом по радикальному механизму. Смеси хлора с водородом, содержащие от 5,8 до 88,3 % водорода, взрываются при облучении с образованием хлороводорода. Смесь хлора с водородом в небольших концентрациях горит бесцветным или желто-зелёным пламенем. Максимальная температура водородно-хлорного пламени 2200 °C.:
При реакции с фтором, образуется не хлорид, а фторид:
Другие свойства
Хлор вытесняет бром и иод из их соединений с водородом и металлами:
При растворении в воде или щелочах, хлор дисмутирует, образуя хлорноватистую (а при нагревании хлорную) и соляную кислоты, либо их соли:
Действие хлора на аммиак можно получить трёххлористый азот:
Окислительные свойства хлора
Хлор очень сильный окислитель.
Реакции с органическими веществами
Присоединяется к ненасыщенным соединениям по кратным связям:
Ароматические соединения замещают атом водорода на хлор в присутствии катализаторов (например, AlCl3 или FeCl3):
Хлор способы получения хлора
Промышленные методы
Первоначально промышленный способ получения хлора основывался на методе Шееле, то есть реакции пиролюзита с соляной кислотой:
В 1867 году Диконом был разработан метод получения хлора каталитическим окислением хлороводорода кислородом воздуха. Процесс Дикона в настоящее время используется при рекуперации хлора из хлороводорода, являющегося побочным продуктом при промышленном хлорировании органических соединений.
Сегодня хлор в промышленных масштабах получают вместе с гидроксидом натрия и водородом путём электролиза раствора поваренной соли:
Так как параллельно электролизу хлорида натрия проходит процесс электролиз воды, то суммарное уравнение можно выразить следующим образом:
1,80 NaCl + 0,50 H2O → 1,00 Cl2↑ + 1,10 NaOH + 0,03 H2↑
Применяется три варианта электрохимического метода получения хлора. Два из них электролиз с твердым катодом: диафрагменный и мембранный методы, третий — электролиз с жидким ртутным катодом (ртутный метод производства). В ряду электрохимических методов производства самым легким и удобным способом является электролиз с ртутным катодом, но этот метод наносит значительный вред окружающей среде в результате испарения и утечек металлической ртути.
Диафрагменный метод с твердым катодом
Полость электролизера разделена пористой асбестовой перегородкой — диафрагмой — на катодное и анодное пространство, где соответственно размещены катод и анод электролизёра. Поэтому такой электролизёр часто называют диафрагменным, а метод получения — диафрагменным электролизом. В анодное пространство диафрагменного электролизера непрерывно поступает поток насыщенного анолита (раствора NaCl). В результате электрохимического процесса на аноде за счёт разложения галита выделяется хлор, а на катоде за счёт разложения воды — водород. При этом прикатодная зона обогащается гидроксидом натрия.
Мембранный метод с твердым катодом
Мембранный метод по сути, аналогичен диафрагменному, но анодное и катодное пространства разделены катионообменной полимерной мембраной. Мембранный метод производства эффективнее, чем диафрагменный, но сложнее в применении.
Ртутный метод с жидким катодом
Процесс проводят в электролитической ванне, которая состоит из электролизера, разлагателя и ртутного насоса, объединённых между собой коммуникациями. В электролитической ванне под действием ртутного насоса циркулирует ртуть, проходя через электролизёр и разлагатель. Катодом электролизера служит поток ртути. Аноды — графитовые или малоизнашивающиеся. Вместе с ртутью через электролизер непрерывно течет поток анолита — раствора хлорида натрия. В результате электрохимического разложения хлорида на аноде образуются молекулы хлора, а на катоде выделившийся натрий растворяется в ртути образуя амальгаму.
Лабораторные методы
В лабораториях для получения хлора обычно используют процессы, основанные на окислении хлороводорода сильными окислителями (например, оксидом марганца (IV), перманганатом калия, дихроматом калия):
Хранение хлора
Производимый хлор хранится в специальных «танках» или закачивается в стальные баллоны высокого давления. Баллоны с жидким хлором под давлением имеют специальную окраску — болотный цвет. Следует отметить что при длительной эксплуатации баллонов с хлором в них накапливается чрезвычайно взрывчатый треххлористый азот, и поэтому время от времени баллоны с хлором должны проходить плановую промывку и очистку от хлорида азота.
Стандарты качества хлора
Применение
Хлор применяют во многих отраслях промышленности, науки и бытовых нужд:
Многие развитые страны стремятся ограничить использование хлора в быту, в том числе потому, что при сжигании хлорсодержащего мусора образуется значительное количество диоксинов.
Биологическая роль хлора

Хлор относится к важнейшим биогенным элементам и входит в состав всех живых организмов.
У животных и человека, ионы хлора участвуют в поддержании осмотического равновесия, хлорид-ион имеет оптимальный радиус для проникновения через мембрану клеток. Именно этим объясняется его совместное участие с ионами натрия и калия в создании постоянного осмотического давления и регуляции водно-солевого обмена. Под воздействием ГАМК (нейромедиатор) ионы хлора оказывают тормозящий эффект на нейроны путём снижения потенциала действия. В желудке ионы хлора создают благоприятную среду для действия протеолитических ферментов желудочного сока. Хлорные каналы представлены во многих типах клеток, митохондриальных мембранах и скелетных мышцах. Эти каналы выполняют важные функции в регуляции объёма жидкости, трансэпителиальном транспорте ионов и стабилизации мембранных потенциалов, участвуют в поддержании рН клеток. Хлор накапливается в висцеральной ткани, коже и скелетных мышцах. Всасывается хлор, в основном, в толстом кишечнике. Всасывание и экскреция хлора тесно связаны с ионами натрия и бикарбонатами, в меньшей степени с минералокортикоидами и активностью Na + /K + — АТФ-азы. В клетках аккумулируется 10-15 % всего хлора, из этого количества от 1/3 до 1/2 — в эритроцитах. Около 85 % хлора находятся во внеклеточном пространстве. Хлор выводится из организма в основном с мочой (90-95 %), калом (4-8 %) и через кожу (до 2 %). Экскреция хлора связана с ионами натрия и калия, и реципрокно с HCO3 - (кислотно-щелочной баланс).
Человек потребляет 5-10 г NaCl в сутки. Минимальная потребность человека в хлоре составляет около 800 мг в сутки. Младенец получает необходимое количество хлора через молоко матери, в котором содержится 11 ммоль/л хлора. NaCl необходим для выработки в желудке соляной кислоты, которая способствует пищеварению и уничтожению болезнетворных бактерий. В настоящее время участие хлора в возникновении отдельных заболеваний у человека изучено недостаточно хорошо, главным образом из-за малого количества исследований. Достаточно сказать, что не разработаны даже рекомендации по норме суточного потребления хлора. Мышечная ткань человека содержит 0,20-0,52 % хлора, костная — 0,09 %; в крови — 2,89 г/л. В организме среднего человека (масса тела 70 кг) 95 г хлора. Ежедневно с пищей человек получает 3-6 г хлора, что с избытком покрывает потребность в этом элементе.
Ионы хлора жизненно необходимы растениям. Хлор участвует в энергетическом обмене у растений, активируя окислительное фосфорилирование. Он необходим для образования кислорода в процессе фотосинтеза изолированными хлоропластами, стимулирует вспомогательные процессы фотосинтеза, прежде всего те из них, которые связаны с аккумулированием энергии. Хлор положительно влияет на поглощение корнями кислорода, соединений калия, кальция, магния. Чрезмерная концентрация ионов хлора в растениях может иметь и отрицательную сторону, например, снижать содержание хлорофилла, уменьшать активность фотосинтеза, задерживать рост и развитие растений.
Но существуют растения, которые в процессе эволюции либо приспособились к засолению почв, либо в борьбе за пространство заняли пустующие солончаки на которых нет конкуренции. Растения произрастающие на засоленных почвах называются — галофиты, они накапливают хлориды в течение вегетационного сезона, а потом избавляются от излишков посредством листопада или выделяют хлориды на поверхность листьев и веток и получают двойную выгоду притеняя поверхнисти от солнечного света. В России галофиты произрастают на соляных куполах, выходах соляных отложений и засоленных понижениях вокруг соляных озёр Баскунчак, Эльтон.
Среди микроорганизмов, так же известны галофилы — галобактерии — которые обитают в сильносоленых водах или почвах.
Особенности работы и меры предосторожности
Хлор — токсичный удушливый газ, при попадании в лёгкие вызывает ожог лёгочной ткани, удушье. Раздражающее действие на дыхательные пути оказывает при концентрации в воздухе около 0,006 мг/л (т.е. в два раза выше порога восприятия запаха хлора). Хлор был одним из первых химических отравляющих веществ, использованных Германией в Первую мировую войну. При работе с хлором следует пользоваться защитной спецодеждой, противогазом, перчатками. На короткое время защитить органы дыхания от попадания в них хлора можно тряпичной повязкой, смоченной раствором сульфита натрия Na2SO3 или тиосульфата натрия Na2S2O3.
ПДК хлора в атмосферном воздухе следующие: среднесуточная — 0,03 мг/м³; максимально разовая — 0,1 мг/м³; в рабочих помещениях промышленного предприятия — 1 мг/м³.
Читайте также:
