Таблица сравнительная характеристика металлов и неметаллов
· воспитывать дисциплинированность и чувство ответственности.
Оборудование: презентация
Тип урока: урок усвоения новых знаний.
Методы обучения: словесные (рассказ, объяснение, беседа); иллюстративные (схемы); наглядные (презентация).
Ход работы:
I. Организационный момент.
II. Актуализация знаний.
Ответьте на вопросы:
· на какие 2 большие группы условно делятся все Х.Э.?
· каково положение в ПС металлов?
· что такое восстановитель и окислитель
III. Изучение нового материала
1. Положение неметаллов в ПС
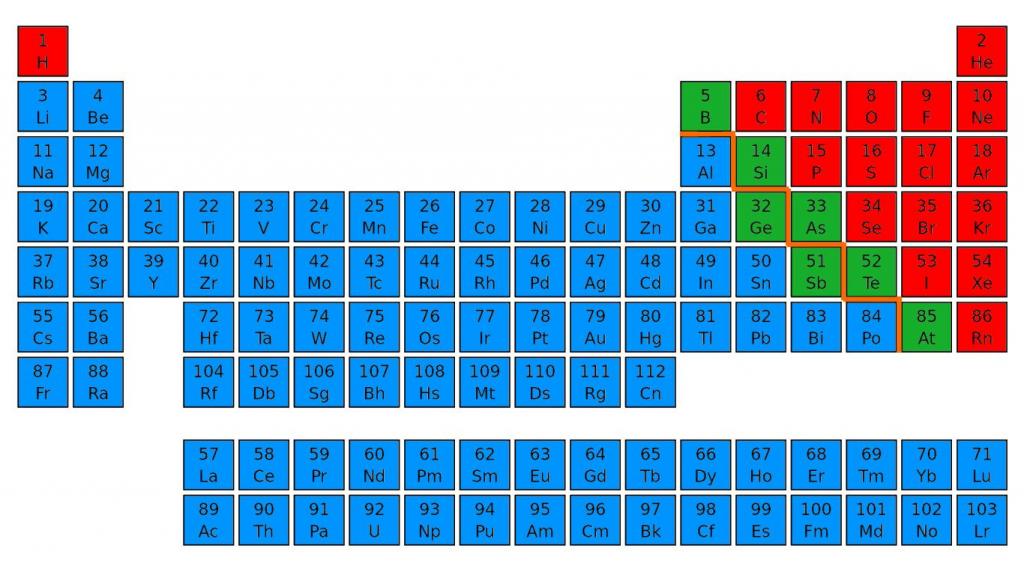
Неметаллы расположены в основном в правом верхнем углу ПС, условно ограниченном диагональю бор-астат. Самым активным является фтор.
2. Особенности строения атомов неметаллов .
А.Во внешнем электронном слое атомов неметаллов находится от четырех до восьми электронов.
1) Составить электронную формулу атома фтора и хлора и сравнить их свойства, сделать выводы
2) Составить электронную формулу кислорода и серы и сравнить их свойства, сделать выводы
В.Для атомов неметаллов, по сравнению с атомами металлов характерны:
· меньший атомный радиус;
· четыре и более электрона на внешнем энергетическом уровне.
3. Кристаллическое строение неметаллов-простых веществ. Аллотропия.
Если металлы – простые вещества образованы за счет металлической связи, то для неметаллов – простых веществ характерна ковалентная неполярная химическая связь. В отличие от металлов неметаллы – простые вещества, характеризуются большим многообразием свойств. Неметаллы имеют различное агрегатное состояние при обычных условиях:
· твердые вещества – модификации серы, фосфора, кремния, углерода и др.
Гораздо богаче у неметаллов и спектр цветов: красный – у фосфора, красно-бурый – у брома, желтый – у серы, желто-зеленый – у хлора, фиолетовый – у паров йода. Элементы – неметаллы более способны, по сравнению с металлами, к аллотропии.
4. Физические свойства неметаллов.
1. Ковкость отсутствует
3. Теплопроводность (только графит)
4. Цвет разнообразный: желтый, желтовато-зеленый, красно-бурый.
5. Электропроводность (только графит и черный Фосфор.)
6. Агрегатное состояние:
5. Химические свойства неметаллов.
Неметаллы в химических реакциях могут быть восстановителями и окислителями (фтор, кислород.)
6. Приготовить презентации "Состав воздуха и круговорот кислорода в природе".
"Нахождение в природе неметаллов хлора, фтора, йода серы, фосфора, азота, углерода".
Выводы:
1. Элементы-неметаллы расположены в главных подгруппах IV–VIII групп ПС Д.И. Менделеева, занимая её верхний правый угол.
2. На внешнем электронном слое атомов элементов-неметаллов находятся от 3 до 8 электронов.
3. Неметаллические свойства элементов усиливаются в периодах и ослабевают в подгруппах с увеличением порядкового номера элемента.
4. Высшие кислородные соединения неметаллов имеют кислотный характер (кислотные оксиды и гидроксиды).
5. Атомы элементов-неметаллов способны как принимать электроны, проявляя окислительные функции, так и отдавать их, проявляя восстановительные функции.
IV. Закрепление изученного.
1) Вставьте слова, пропущенные в тексте.
Атомы ____ в отличие от атомов ____ легко принимают наружные электроны, являются ____
2) Вставьте слова , пропущенные в тексте.
Неметаллические свойства элементов с увеличением порядкового номера в периодах ____
В группах неметаллические свойства элементов ____
3) Пользуясь периодической таблицей, запишите молекулярные формулы высших кислородных соединений неметаллов III периода. Как будет изменяться кислотный характер?
Металлы и неметаллы
Наш мир наполняют различные простые вещества – металлы или неметаллы. При существовании 120 химических элементов, Вселенную наполняют более 400 простых веществ. Этот парадокс связан с понятием аллотропии – явлением образования одним химическим элементом двух и более простых веществ. Например, атом кислорода может формировать молекулярный кислород О2 и озон О3.
План урока:
Физические свойства металлов
Металлы – химические элементы, атомы которых в процессе реакции стремятся отдавать электроны. Они обладают металлической кристаллической решеткой и общими физическими свойствами. На данный момент известно более 87 металлов.
Для металлов характерен ряд свойств:
- твердость (кроме ртути, которая представляет собой жидкость);
- металлический блеск;
- проводимость электрического тока и тепла;
- пластичность.
Металлы при ударах не разрушаются, а меняют форму. С этой особенностью связано то, что из них производят проволоку, металлические листы и др. Развитие бронзового и железного века связано с производством товаров из металлов.
Физические свойства неметаллов
Неметаллы – химические элементы, атомы которых стремятся принять чужие электроны. Для них характерны атомные и молекулярные кристаллические решетки. Для атомов неметаллов не характерны общие физические свойства. На данный момент существует 22 неметалла.
Для неметаллов характерен ряд свойств:
- хрупкость (неметаллы нельзя ковать);
- отсутствие блеска;
- непроводимость электрического тока и тепла.
Расположение металлов и неметаллов в периодической таблице Д.И. Менделеева
Определить, является простое вещество металлом или неметаллом, можно с помощью периодической таблицы Менделеева. Металлы располагаются ниже диагонали «водород-бор- кремний-мышьяк-теллур-астат», а неметаллы выше.
Красные ячейки – неметаллы, синие – металлы
Элементы, расположенные вблизи диагонали, обладают смешанными свойствами: проявляют как металлические, так и неметаллические свойства. Они называются полуметаллами.
Красные ячейки – полуметаллы
Полуметаллы имеют ковалентную кристаллическую решетку при наличии металлической проводимости (электропроводности). Валентных электронов у них либо недостаточно для образования полноценной ковалентной связи, либо они не удерживаются достаточно прочно из-за больших размеров атома. Поэтому связь в ковалентных кристаллах этих элементов имеет частично металлический характер.
Закономерности в таблице Д.И. Менделеева
Каждый атом состоит из протонов, нейтронов и электронов. Протоны и нейтроны находятся в ядре, который несет положительный заряд. Вокруг ядра движутся отрицательно заряженные электроны. Атомный номер указывает на количество протонов.
Чем больше заряд ядра, тем сильнее к нему притягиваются электроны. Т.о., атому сложнее отдавать электроны. Поэтому в периоде слева направо, с увеличением порядкового номера металлические свойства ослабевают, а неметаллические – усиливаются.
Неметаллы стремятся принять электроны от других атомов. Период в таблице указывает на количество электронных уровней. По мере увеличения числа орбиталей электроны отдаляются от ядра и атому сложнее удерживать электроны на последних уровнях. Т.о., в группе сверху вниз количество орбиталей возрастает, поэтому металлические свойства усиливаются, а неметаллические – уменьшаются.
Способы получения металлов
Большую часть металлов получают из оксидов при нагревании.
Металлы, имеющие на внешнем уровне один-два электрона, получают с помощью электролиза расплавов.
Химические свойства металлов
Все металлы проявляют восстановительные свойства. Легкость в отдачи внешнего электрона применяется в фотоэлементах. Степень активности определяется рядом активности. У самых активных на внешнем уровне располагается по одному электрону.
Общие химические свойства металлов выражаются в реакциях со следующими соединениями.
Активные металлы реагируют с галогенами и кислородом. С азотом взаимодействуют только литий, кальций и магний. Большинство металлов при взаимодействии с кислородом образуют оксиды, а наиболее активные металлы – пероксиды (N2O2).
2 Ca + MnO2 → 2 CaO + Mn(нагревание)
Водород в кислотах вытесняют только те металлы, которые в ряду напряжений стоят до водорода.
Более активные металлы вытесняют из соединений менее активные.
- Химические свойства щелочных и щелочно-земельных металлов (реакции с водой)
2 Na + 2 H2O → 2 NaOH + H2
Способы получения неметаллов
Неметаллы синтезируют из природных соединений с помощью электролиза.
2 KCl → 2 K + Cl2
Также неметаллы получают в результате окислительно-восстановительных реакций.
SiO2 + 2 Mg → 2 MgO + Si
Химические свойства неметаллов
Неметаллы проявляют окислительные свойства. Самый активный неметалл – фтор. Он бурно реагирует со всеми веществами, а некоторые реакции сопровождаются горением и взрывом. В атмосфере фтора горят даже вода и платина. Фтор окисляет кислород и образует фторид кислорода OF2.
Неметаллы вступают в реакции со следующими веществами.
3 F + 2 Al → 2 AlF3 (нагревание)
S + Fe →FeS (нагревание)
Меньшей активностью обладают такие неметаллы как бор, графит, алмаз. Они могут проявлять восстановительные свойства.
2 C + MnO2 → Mn + 2 CO
Коррозия металла
Коррозия – это процесс разрушения металлов или металлических конструкций под действием кислорода, воды и вредных примесей. Не все металлы подвергаются коррозии. Их стойкость зависит от ряда факторов.
- На благородных металлах не образуется коррозия.
- На поверхности алюминия, титана, цинке, хрома и никеля есть оксидная пленка, которая предотвращает процессы коррозии.
Различают несколько видов коррозии – химическую и электрохимическую.
Химическая коррозия
Химическая коррозия сопровождается химическими реакциями. Она образуется под действием газов.
Электрохимическая коррозия
Электрохимическая коррозия – процесс разрушения металлов или металлических конструкций, который сопровождается электрохимическими реакциями. В большинстве металлов находятся примеси. В процессе коррозии электродами могут служить не только металлы, но и его примеси.
Например, в железе могут находиться примеси олова. В этом случае на аноде электроны переносятся от олова к железу и металлы растворяются, т.е. железо подвергаются коррозии. На катоде восстанавливается водород из воды или растворенного кислорода. Электрохимическая коррозия может сопровождаться следующими процессами.
Анод: Fe 2+ - 2e → Fe 0
Катод: 2H + + 2e → H2
Способы защиты от коррозии
В промышленности популярны различные методы защиты металлов от коррозии.
Покрытия защищают поверхности от действия окислителей. Ими служат различные вещества:
- покрытие менее активным металлом (железо покрывают оловом);
- краски, лаки, смазки.
- Создание специальных сплавов
Физические свойства сплавов и чистых металлов отличаются. Поэтому для повышения стойкости в сплав необходимо добавить дополнительные металлы.
Биологическая роль металлов и неметаллов
В организмах содержится множество различных металлов и неметаллов. Различных химических элементов в организме может не хватать, поэтому приходится потреблять их извне.Химические элементы можно разделить на две большие группы – макроэлементы и микроэлементы.
К макроэлементам относятся вещества, содержание которых в организме превышает 0,005 %. Эта группа включает водород, углерод, кислород, азот, натрий, магний, фосфор, сера, хлор, калий, кальций.Микроэлементы – элементы, содержание которых не превышает 0,005%. К ним относятся железо, медь, селен, йод, хром, цинк, фтор, марганец, кобальт, молибден, кремний, бром, ванадий, бор. Каждый макро- и микроэлемент в организме выполняет определенную функцию.
Применение металлов и неметаллов
В синтезе химических препаратов и лекарств применяются чистые металлы и неметаллы. В органической химии металлы используются в качестве катализаторов, а также при получении металлорганических соединений. Неметаллы служат исходным сырьем для получения чистых кислот и других химических соединений.
Металлы и неметаллы: сравнительная характеристика

Все химические элементы условно можно разделить на неметаллы и металлы. Знаете ли вы, по каким признакам они отличаются? Как определить их положение в таблице химических элементов? На эти и другие вопросы вы найдете ответы в нашей статье.
Положение неметаллов и металлов: таблица Менделеева
По внешним признакам и физическим свойствам не всегда можно выяснить, к какой группе относится химический элемент. Свойства металлов и неметаллов можно определить по расположению в периодической таблице.
Для этого нужно зрительно провести диагональ от бора до астата, от 5 до 85 номера. В правом верхнем углу будут преимущественно находиться неметаллы. Их в таблице меньшинство, всего 22 элемента. Металлы находятся в правой части периодической таблицы наверху - в основном в I, II и III группах.
Энергетический уровень
Отличия неметаллов и металлов первоначально обусловлены строением их атомов. Начнем с количества электронов на внешнем энергетическом уровне. У атомов металлов оно варьирует от одного до трех. Как правило, они обладают большим радиусом, поэтому атомы металлов достаточно легко отдают наружные электроны, так как имеют сильные восстановительные свойства.
У неметаллов число электронов на внешнем уровне больше. Это объясняет их окислительную активность. Неметаллы присоединяют недостающие электроны, полностью заполняя энергетический уровень. Самые сильные окислительные свойства проявляют неметаллы второго и третьего периода VI-VII групп.
Заполненный энергетический уровень содержит 8 электронов. Самой большой окислительной способностью обладают галогены с валентностью I. Среди них лидирует фтор, так как у этого элемента нет свободных орбиталей.

Строение металлов и неметаллов: кристаллические решетки
Физические свойства веществ определяются порядком расположения элементарных частиц. Если условно соединить их воображаемыми линиями, то получится структура, которая называется кристаллической решеткой. В ее узлах могут находиться разные структуры: атомы, молекулы или заряженные частицы - ионы.
У некоторых неметаллов формируется атомная кристаллическая решетка, частицы которой соединены ковалентными связями. Вещества с таким строением твердые и нелетучие. К примеру, фосфор, кремний и графит.
В молекулярной кристаллической решетке связь между элементарными частицами слабее. Обычно подобные неметаллы находятся в жидком или газообразном агрегатном состоянии, но в некоторых случаях - это твердые легкоплавкие неметаллы.
В любом образце металла часть атомов теряет наружные электроны. При этом они превращаются в положительно заряженные частицы - катионы. Последние снова соединяются с электронами, образуя нейтрально заряженные частицы - в металлической решетке одновременно находятся катионы, электроны и атомы.

Физические свойства
Начнем с агрегатного состояния. Традиционно принято считать, что все металлы - твердые вещества. Исключением является только ртуть, тягучая жидкость серебристого цвета. Ее пары являются контаминантом - токсичным веществом, вызывающим отравление организма.
Еще одна характерная черта - металлический блеск, который объясняется тем, что поверхность металла отражает световые лучи. Еще одна важная особенность - электро- и теплопроводность. Это свойство обусловлено наличием в металлических решетках свободных электронов, которые в электрическом поле начинают двигаться направленно. Лучше всех проводит тепло и ток ртуть, наименьшими показателями обладает серебро.
Металлическая связь обусловливает ковкость и пластичность. По этим показателям лидирует золото, из которого можно раскатать лист толщиной в человеческий волос.
Чаще всего физические свойства металлов и неметаллов противоположны. Так, последние характеризуются невысокими показателями электро- и теплопроводности, отсутствием металлического блеска. При обычных условиях неметаллы находятся в газообразном или жидком состоянии, а твердые всегда хрупкие и легкоплавкие, что объясняется молекулярным строением неметаллов. Алмаз, красный фосфор и кремний - тугоплавкие и нелетучие, это вещества с немолекулярным строением.

Что такое полуметаллы
В периодической таблице между металлами и неметаллами находится ряд химических элементов, которые занимают промежуточное положение. Их называют полуметаллами. Атомы полуметаллов связаны ковалентной химической связью.
Эти вещества совмещают признаки металлов и неметаллов. К примеру, сурьма является кристаллическим веществом серебристо-белого цвета и вступает в реакцию с кислотами, образуя соли - типичные металлические свойства. С другой стороны, сурьма - очень хрупкое вещество, которое не поддается ковке, а измельчить его можно даже вручную.
Итак, типичные неметаллы и металлы обладают противоположными свойствами, но деление это достаточно условно, поскольку ряд веществ сочетает в себе и те и другие признаки.
Разработка открытого урока по химии 10 класс "Сравнительная характеристика металлов и неметаллов"
Тема урока совпадает с темой календарно-тематического планирования.
Цель урока: сформировать понятие о положении металлов и неметаллов в ПС, строении их атомов, физических и химических свойствах металлов и неметаллов и их окислительных и восстановительных способностях.
Задачи урока: - образовательные: - сформировать понятие о строении и свойствах металлов и неметаллов; - научить использовать приобретённые знания для объяснения явлений окружающей среды; - проверить знания о строении металлов и их физических свойствах. - развивающие: - совершенствовать умения записывать уравнения химических реакций; применять знания; - развивать познавательную активность учащихся, вырабатывать умение анализировать, делать выводы; - создать условия для развития познавательного интереса к предмету, эмоциональные ситуации удивления, занимательности. - воспитательные: - воспитывать экологическую культуру (на примере последствий загрязнения окружающей среды некоторыми неметаллами и тяжелыми металлами); - воспитывать коммуникативные компетенции, умение высказывать собственное мнение, сотрудничать в группе.
Тип урока: комбинированный, традиционный, изучение нового материала.
Форма урока: урок систематизации полученных ранее знаний
Методы и приемы: приемы активизации познавательной деятельности учащихся; групповая деятельность; исследовательская деятельность; ИКТ (презентация).
Средства обучения: компьютер; периодическая система химических элементов Д.И. Менделеева; коллекции металлов и неметаллов; учебник «Химия» для 10 класса естественно-математического направления, авторы Н.Н. Нурахметов, К.Бекишев, Н.А Заграничная и др., Алматы: Мектеп, 2014 г.
Основные понятия: окислитель, восстановитель, электроотрицательность, аллотропия.
Организационный момент ц .
I. Подготовка учащихся к активному и сознательному усвоению нового материала.
II. Актуализация знаний (выявление уровня ЗУН и корректировка, первичное закрепление и контроль):
1) Характеристика элемента металла и неметалла
ü Положение металлов и неметаллов в ПСХЭ Д.И. Менделеева
ü Нахождение в природе
ü Строение атомов металлов и неметаллов
ü Окислительно-восстановительные возможности атомов металлов и неметаллов
ü Изменение свойств атомов металлов и неметаллов в периоде и группе
2) Характеристика простых веществ металлов и неметаллов
ü Строение металлов и неметаллов
ü Физическиесвойства металлов и неметаллов
ü Химические свойства металлов и неметаллов
III. Закрепление.
IV . Подведение итогов урока.
Организационный этап.
I. Актуализация знаний.
Несмотря 1 на то, что урок проводится в 10 классе, можно предложить учащимся загадки по теме урока. – Ребята, вам будут предложены загадки, которые нужно отгадать.
1.В чем горят дрова и газ,
Фосфор, водород, алмаз?
Дышит чем любой из нас
Каждый миг и каждый час?
Без чего мертва природа?
Правильно, без …(кислорода 1 )
2.Удивить готов он нас -
Он и уголь, и алмаз,
Он в карандашах сидит,
Потому что он — графит.
Грамотный народ поймет
То, что это …(углерод 1 )
3. Быть символом не каждому дано,
Но именем моим не без причины
Назвали руки, дождь, тельца, руно,
Сечение и мнений середину.
И в честь меня был назван даже век,
Когда был очень счастлив человек.
Что нынче в имени моем? А встарь
Считали все, что я - металлов царь. (ЗОЛОТО 1 )
4. Из глины я обыкновенной,
Но я на редкость современный.
Я не боюсь электротока,
Бесстрашно в воздухе лечу;
Служу на кухне я без срока -
Мне все задачи по плечу.
Горжусь своим я именем:
Зовусь я (АЛЮМИНИЙ 1 )
- Как вы думаете, к каким элементам относятся 1 эти элементы? Следовательно ц , какова тема нашего урока? Верно, сегодня на уроке мы будем говорить о металлах и неметаллах. Итак, запишите тему нашего урока: «Сравнительная характеристика металлов и неметаллов, их физические и химические свойства». (На слайде показана тема урока и цель).
Изучение нового материала.
- Действительно, все ц элементы делятся на две большие группы: металлы и неметаллы. Еще в древности люди обращали внимание на то, что известным в то время металлам в присущи определенные признаки, такие как металлический блеск, ковкость, теплопроводность, пластичность. Эти общие существенные и отличительные признаки стали характеризовать весь класс металлов. Так в результате такого обобщения появилось понятие «металл». А противоположностью этого понятия стало такое понятие как «неметалл».
- Вообще же в химии принято делить все элементы на металлы и неметаллы в зависимости от химических и физических свойств простых веществ (т.е от способа, которым осуществляется связывание отдельных атомов в простом веществе). Если связь металлическая, то соответственно простое вещество – металл с набором свойств. Неметаллам в определение дать труднее из-за их разнообразия. Главным у критерием может служить отсутствие ВСЕХ (без исключения) свойств металлов.
Но мы то с вами не «древние» люди, и легко вспомним определение понятий элементов металлов и неметаллов.
Неметаллы – хим ические ц элементы, атомы которых принимают электроны для завершения внешнего энергетического уровня 4 и более электронов и малому радиусу 3 атомов , отрицательно образуя при этом отрицательно заряженные ионы (анионы). Исключение составляют водород (1s 1 ) и гелий (1s 2 ), которые тоже рассматривают как неметаллы. Неметаллы обычно обладают большим спектром степеней окисления в своих соединениях. Металлы – это химические элементы, атомы которых отдают электроны внешнего (предвнешнего) электронного слоя, превращаясь при этом в положительно заряженные ионы (катионы).
1. Положение металлов и неметаллов в ПСХЭ.
В настоящее у время известно 88 элементов, относящихся к металлам и 22 элемента, включая инертные газы, - к неметаллам.
-Все Неметаллы (кроме Н) находятся в верхнем правом углу ПС над диагональю В - Si – As – Te - Аt. Металлы, соответственно, - в левом нижнем углу. Окислительные свойства неметаллов по ПСХЭ усиливаются к концу периода и к началу группы главной подгруппы. Элементы, расположенные вблизи диагонали (назовите – Ве, А l , Ti , Ge ) – являются амфотерными. Если металлы занимают полностью 1-2 группы ПС, то неметаллы расположены вместе с металлами в главных подгруппах 3 - 8 групп.
2. Нахождение в природе.
- Металлов, как вы поняли, в природе в значительно больше, чем неметаллов в . Металлы в природе встречаются в 3-х формах:
1. в свободном виде;
2. как в свободном виде, так и соединениях;
3. только в виде соединений.
Самый в распространенный у металл на Земле – алюминий (более 8% от земной коры).
Только в соединениях – щелочные, щелочно-земельные металлы, как в свободном виде, так и виде соединений – никель, олово, свинец, главным в образом в виде соединений – медь, серебро, ртуть; только в свободном в виде – золото и платина.
Неметаллы в в природе бывают самородными м (азот и кислород в составе воздуха), сера в земной коре. Чаще всего – в виде соединений а (в первую очередь – это вода и растворенные в ней минеральные соли, затем – минералы и горные породы. Самыми распространенными м из неметаллов являются – кремний, водород и кислород, а редкими являются – иод, селен и теллур и мышьяк.
- 3. А) Каковы ми же особенности ми строения ап атомов неметаллов?
- на внешнем уровне имеют от 4 до 8 электронов
- небольшой радиус атомов
- стремятся принять электроны
- характерные связи: ионная и ковалентная
- все неметаллы – р-элементы.
Способность принимать электроны – это проявление окислительных свойств атомов элементов.
В) Особенности м строения атомов с металлов:
- имеют сравнительно большие размеры (радиусы), поэтому и их внешние электроны значительно удалены от ядра и слабо с ним связаны. 2.
- наличие на внешнем энергетическом уровне 1—3 электронов.
- характерный тип химической связи – металлическая. Это означает, что валентные электроны слабо связаны с конкретным атомом, поэтому в узлах кристаллических решеток находятся + ионы, между ними – свободно вращаются электроны, образуя так называемый «электронный газ»;
- металлы делятся на s -, p -, d - и f -элементы.
Самое характерное химическое свойство всех металлов — их восстановительная способность, т. е. способность атомов легко отдавать внешние электроны, превращаясь в положительные ионы .
4. Характеристика простых веществ металлов и неметаллов.
Какое понятие используется для количественной характеристики неметаллов? (ЭО)
Сравнивая значения ЭО неметаллов, можно сделать вывод, что один и тот же элемент в зависимости от расположения в ряду ЭО по отношению к одним элементам проявляет себя как окислитель, к другим – как восстановитель. Ниже всего значения ЭО – у металлов, выше всего – у неметаллов. Это мера неметалличности.
5. Физические и химические свойства металлов . Поработаем с учебником и раздаточным материалом (коллекции металлов и неметаллов, заранее на столы раздаются коллекции металлов и неметаллов, по возможности на каждую пару). Вам предлагается провести небольшое исследование. Сравните физические свойства полученных образцов металлов и неметаллов. Заполните в виде таблицы. В таблице должны быть отражены следующие моменты:
На задание дается около 8 минут, затем на слайде проверяем записи учеников.
6. Общие химические свойства металлов и неметаллов. – Металлы проявляют следующие химические свойства, характерные для большинства представителей этой группы (металлов). Все металлы – сильные восстановители. В реакциях отдают свои электроны, превращаясь в положительно заряженные ионы – катионы. Взаимодействуют с неметаллами, с водой (не все металлы, рассмотрим более подробно на следующих уроках), реагируют с кислотами (за исключением некоторых представителей) и некоторыми солями. Запишем в виде схемы:

Для неметаллов характерны следующие общие химические свойства: если металлы проявляют себя исключительно восстановителями, то неметаллы могут проявлять и окислительные и восстановительные свойства в зависимости от природы взаимодействующего вещества. Среди неметаллов есть исключения, например фтор, который проявляет себя только как окислитель.

1.Назовите расположение металлов и неметаллов в ПСХЭ Д.И.Менделеева. (неметаллы расположены в верхнем правом углу ПС от линии бор-астат, остальные элементы - металлы).
2. Разделите элементы на две группы:
Se, Ca, Zn, Fr, As, Ar, Li, Rn, N, Sr.
А) Металлы : Ca, Zn, Fr, Li, Sr.
Б ) Неметаллы : Se, As, Ar, Rn, N
3. В чем заключается особенность физических свойств металлов, характерных только для них (ковкость, электропроводность, металлический блеск и т.д)? (данная особенность связана с наличием металлической кристаллической решетки у металлов).
VI . Рефлексия . Что я узнал сегодня на уроке?
Что для меня уже известный факт?
Чтобы я хотел еще узнать?
Металлы

К металлам относится большая часть элементов периодической системы – 82 химических элементов. Какими свойствами они обладают, и чем отличаются от неметаллов?
Общая характеристика
Металлами называют группу элементов, в виде простых веществ, которые обладают металлическими свойствами (пластичность, ковкость, блеск, электронная проводимость и т. д.)
Основное отличие элементов-металлов – они обладают только восстановительными свойствами, а в реакциях могут только окисляться. В соединениях они могут иметь только положительные степени окисления как в элементарных положительно заряженных ионах, так и в сложных ионах, где они образуют положительные центры.
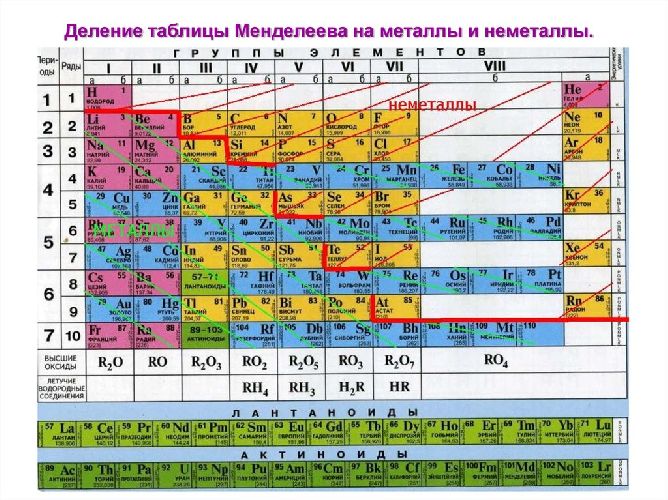
Рис. 1. Список металлов.
Как правило, на внешнем уровне элементов металлов находится небольшое число электронов (1-3), значения электроотрицательности невысокие. К металлам относятся все s-элементы (кроме водорода и гелия), d- и f-элементы, а также p-элементы под чертой бор-астат. Для типичных металлов характерен большой размер атомов, что способствует легкости отдачи валентных электронов. Образующиеся положительные ионы устойчивы, так как имеют завершенную внешнюю электронную оболочку.
Физические и химические свойства
Все металлы, кроме ртути, при нормальных условиях в виде простых веществ находятся в твердом агрегатном состоянии и образуют металлическую кристаллическую решетку.

Рис. 2. Металлы в таблице Д.И. Менделеева.
Таблица «Металлы»
В следующей таблицы представлены группы основных металлов:
| Группа металлов | Металл |
| Щелочные | литий, натрий, калий и т.д. |
| Щелочноземельные | кальций, стронций, барий и т.д. |
| Переходные | уран, титан, железо, платина и т.д. |
| постпереходные | алюминий, свинец, олово и т.д. |
| Тугоплавкие | молибден, вольфрам |
| Цветные | медь, титан, магний и т.д. |
| Благородные | золото, серебро и т.д. |
Металлы пластичны и ковки, особенно если на внешнем электронном уровне атомов по одному электрону: слои атомов перемещаются относительно друг друга без разрушения кристаллической решетки (щелочные металлы, медь, серебро, золото). В атомах непластичных хрупких металлов хрома и марганца – большое число валентных электронов.
Плотность, твердость, температура плавления металлов изменяются в широком диапазоне и зависят от атомной массы, строения атома и геометрии кристаллической решетки. Самый легкий металл – литий (плотность 0,53 г/см 3 ), самый тяжелый – осмий (плотность 22,5 г/см 3 ). Металлы с плотностью больше 5 г/см 3 относят к тяжелым, меньше 5 г/см 3 – к легким металлам.
Самая низкая температура плавления у ртути (-39 градусов по Цельсию), самый тугоплавкий металл – вольфрам (температура плавления 3410 градусов по Цельсию.) Энергия атомизации вольфрама составляет 836 кДж/моль, а температура кипения его 5930 градусов.
Металлы вступают в реакцию как с простыми, так и со сложными веществами. Как типичные восстановители металлы реагируют почти со всеми неметаллами-окислителями (кислород, сера, азот и т. д.):
Также металлы реагируют с такими сложными веществами, как оксиды и гидроксиды, разбавленные растворы кислот, с растворенными в воде щелочами.
В пределах одного и того же периода металлические свойства ослабевают, а неметаллические усиливаются; в пределах одной и той же группы (в главной подгруппе) металлические свойства усиливаются, а неметаллические ослабевают

Рис. 3. Металлы главных подгрупп.
Нахождение металлов и способы их получения
Самый распространенный на земле элемент-металл – алюминий. За ним следуют железо, кальций, натрий.
Некоторые металлы встречаются в природе в самородном состоянии (золото, ртуть, платина), но в основном они находятся в природе в виде оксидов и солей.
Получение металлов происходит с помощью металлургии (получение из руд), пирометаллургии (получение с помощью реакции восстановления при высокой температуре), гидрометаллургии (извлечение из руд в виде растворимых соединений), электрометаллургии (получение металлов электролизом расплавов и растворов их соединений).
Что мы узнали?
Металлы – вещества, которые обладают высокой электро- и теплопроводностью, ковкостью, пластичностью и металлическим блеском. В данной статье по химии 9 класса рассматриваются их физические и химические свойства, формулы класса металлов, а также способы получения.
Читайте также:

