Таблица по щелочным металлам
К щелочным металлам относятся элементы первой группы, главной подгруппы: литий, натрий, калий, рубидий, цезий, франций .
Нахождение в природе
Из щелочных металлов наиболее широко распространены в природе натрий и калий. Но из-за высокой химической активности они встречаются только в виде соединений: Na-2,64% (по массе), K-2,5% (по массе), Li, Rb, Cs - значительно меньше, Fr - искусственно полученный элемент.
Основными источниками лития, натрия, калия являются:
Li
Na
NaCl – поваренная соль (каменная соль), галит
Na 2 SO 4 • 10H 2 O – глауберова соль (мирабилит)
NaNO 3 – чилийская селитра
K
KCl • NaCl – сильвинит
KCl • MgCl 2 • 6H 2 O – карналлит
K 2 O • Al 2 O 3 • 6SiO 2 – полевой шпат (ортоклаз)
Литий, натрий, калий, рубидий в свободном состоянии серебристо-белые металлы, цезий имеет золотисто-желтый цвет. Все металлы очень мягкие и пластичные. Наибольшей твердостью обладает литий, остальные металлы легко режутся ножом и могут быть раскатаны в фольгу.
В кристаллическом состоянии все они имеют объёмно-центрированную кристаллическую решетку с металлическим типом химической связи, что обуславливает их высокую тепло- и электропроводность.
Все щелочные металлы имеют небольшую плотность, самый легкий металл – литий, его плотность составляет всего 0,53 г/см 3 .
Металлы имеют достаточно низкие температуры плавления и кипения, причем с увеличением порядкового номера элемента температура плавления металла понижается.
Все металлы очень активны, поэтому их хранят в запаянных ампулах, под слоем вазелинового масла или керосина.
Некоторые физические свойства щелочных металлов приведены в таблице.
Электронное строение атомов
На внешнем энергетическом уровне атомы щелочных металлов имеют один электрон ns 1 . Поэтому для всех металлов группы IA характерна степень окисления +1.
Этим объясняется сходство свойств всех щелочных металлов.
Для них (сверху вниз по группе) с увеличением порядкового номера атомный радиус увеличивается, способность отдавать валентные электроны увеличивается, и восстановительная активность увеличивается.
Химические свойства
Типичные металлы, очень сильные восстановители. В соединениях проявляют единственную степень окисления +1.
Восстановительная способность увеличивается с ростом атомной массы. Все соединения имеют ионный характер, почти все растворимы в воде.
Гидроксиды ROH – щёлочи, сила их возрастает с увеличением атомной массы металла.
Воспламеняются на воздухе при умеренном нагревании. Продукты сгорания чаще всего пероксиды R 2 O 2 .
С водородом образуют солеобразные гидриды RH.
Восстановительная способность увеличивается в ряду Li–Na–K–Rb–Cs
РЕАКЦИИ С ПРОСТЫМИ ВЕЩЕСТВАМИ
1. Реакция с кислородом:
Для получения оксида из пероксида (надпероксида) щелочного металла:
На воздухе щелочные металлы мгновенно окисляются. Поэтому их хранят под слоем органических растворителей (керосин и др.).
2. В реакциях с другими неметаллами образуются бинарные соединения:
2Li + Cl 2 → 2LiCl -1 (галогениды)
2Na + S → Na 2 S -2 (сульфиды)
2Na + H 2 → 2NaH -1 (гидриды)
6Li + N 2 → 2Li 3 N -3 (нитриды)
2Li + 2C → Li 2 C 2 -1 (карбиды)
РЕАКЦИИ СО СЛОЖНЫМИ ВЕЩЕСТВАМИ
1. Активно взаимодействуют с водой:
2Na + 2H 2 O → 2NaOH + H 2
2Li + 2H 2 O → 2LiOH + H 2
2. Реакция с кислотами - неокислителями (H 2 S, H 3 PO 4 , H 2 SiO 3 и др., исключение – HNO 3 ) :
2Na + 2HCl = 2NaCl + H 2
3. C кислотами-окислителями образуются три продукта-водород не вытесняется:
8Na + 5 H 2 SO 4 (конц.) = 4Na 2 SO 4 + H 2 S↑ + 4H 2 O,
8Na + 10 HNO 3 (конц.) = 8NaNO 3 + N 2 O↑ + 5H 2 O,
8Na + 9 HNO 3 (разб.) = 8NaNO 3 + NH 3 ↑ + 3H 2 O,
8Na + 10 HNO 3 (оч. разб.) = 8NaNO 3 + NH 4 NO 3 + 3H 2 O
4. Качественная реакция на катионы щелочных металлов - окрашивание пламени в следующие цвета:
K + , Rb + и Cs + – фиолетовый
Получение
Т.к. щелочные металлы - это самые сильные восстановители, их можно восстановить из соединений только при электролизе расплавов солей:
Щелочные металлы
Щелочные металлы — элементы главной подгруппы I группы Периодической системы химических элементов Д. И. Менделеева:
литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr.
Данные металлы получили название щелочных, потому что большинство их соединений растворимо в воде. По-славянски «выщелачивать» означает «растворять», это и определило название данной группы металлов. При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щёлочами.
Основная характеристика щелочных металлов: В Периодической системе они следуют сразу за инертными газами, поэтому особенность строения атомов щелочных металлов заключается в том, что они содержат один электрон на новом энергетическом уровне: их электронная конфигурация ns1.
Валентные электроны щелочных металлов могут быть легко удалены, потому что атому энергетически выгодно отдать электрон и приобрести конфигурацию инертного газа.
Поэтому для всех щелочных металлов характерны восстановительные свойства. Это подтверждают низкие значения их потенциалов ионизации (потенциал ионизации атома цезия — один из самых низких) и электроотрицательности (ЭО).
Далее таблица свойств щелочных металлов:
| Атомный номер | Название, символ | Металлический радиус, нм | Ионный радиус, нм | Потенциал ионизации, эВ | ЭО | p, г/см³ | tпл, °C | tкип, °C |
|---|---|---|---|---|---|---|---|---|
| 3 | Литий Li | 0,152 | 0,078 | 5,32 | 0,98 | 0,53 | 181 | 1347 |
| 11 | Натрий Na | 0,190 | 0,098 | 5,14 | 0,93 | 0,97 | 98 | 883 |
| 19 | Калий K | 0,227 | 0,133 | 4,34 | 0,82 | 0,86 | 64 | 774 |
| 37 | Рубидий Rb | 0,248 | 0,149 | 4,18 | 0,82 | 1,53 | 39 | 688 |
| 55 | Цезий Cs | 0,265 | 0,165 | 3,89 | 0,79 | 1,87 | 28 | 678 |
Все металлы этой подгруппы имеют серебристо-белый цвет (кроме серебристо-жёлтого цезия), они очень мягкие, их можно резать скальпелем. Литий, натрий и калий легче воды и плавают на её поверхности, реагируя с ней.
Щелочные металлы встречаются в природе в форме соединений, содержащих однозарядные катионы.
Многие минералы содержат в своём составе металлы главной подгруппы I группы. Например, ортоклаз, или полевой шпат, состоит из алюмюсиликата калия K2[Al2Si6O16], аналогичный минерал, содержащий натрий — альбит — имеет состав Na2[Al2Si6O16]. В морской воде содержится хлорид натрия NaCl, а в почве — соли калия — сильвин KCl, сильвинит NaCl • KCl, карналлит KCl • MgCl2 • 6H2O, полигалит K2SO4 • MgSO4 • CaSO4 • 2H2O.
Химические свойства щелочных металлов
Из-за высокой химической активности щелочных металлов по отношению к воде, кислороду, азоту их хранят под слоем керосина. Чтобы провести реакцию со щелочным металлом, кусочек нужного размера аккуратно отрезают скальпелем под слоем керосина, в атмосфере аргона тщательно очищают поверхность металла от продуктов его взаимодействия с воздухом и только потом помещают образец в реакционный сосуд.
1. Взаимодействие с водой. Важное свойство щелочных металлов — их высокая активность по отношению к воде. Наиболее спокойно (без взрыва) реагирует с водой литий:
При проведении аналогичной реакции натрий горит жёлтым пламенем и происходит небольшой взрыв. Калий ещё более активен: в этом случае взрыв гораздо сильнее, а пламя окрашено в фиолетовый цвет.
2. Взаимодействие с кислородом. Продукты горения щелочных металлов на воздухе имеют разный состав в зависимости от активности металла.
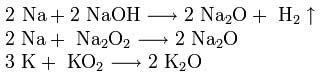
Только литий сгорает на воздухе с образованием оксида стехиометрического состава:
При горении натрия в основном образуется пероксид Na2O2 с небольшой примесью надпероксида NaO2:
В продуктах горения калия, рубидия и цезия содержатся в основном надпероксиды:
Для получения оксидов натрия и калия нагревают смеси гидроксида, пероксида или надпероксида с избытком металла в отсутствие кислорода:
Для кислородных соединений щелочных металлов характерна следующая закономерность: по мере увеличения радиуса катиона щелочного металла возрастает устойчивость кислородных соединений, содержащих пероксид-ион О22-и надпероксид-ион O2-.
Для тяжёлых щелочных металлов характерно образование довольно устойчивых озонидов состава ЭО3. Все кислородные соединения имеют различную окраску, интенсивность которой углубляется в ряду от Li до Cs:
Оксиды щелочных металлов обладают всеми свойствами, присущими основным оксидам: они реагируют с водой, кислотными оксидами и кислотами:
Пероксиды и надпероксиды проявляют свойства сильных окислителей:
Пероксиды и надпероксиды интенсивно взаимодействуют с водой, образуя гидроксиды:
3. Взаимодействие с другими веществами. Щелочные металлы реагируют со многими неметаллами. При нагревании они соединяются с водородом с образованием гидридов, с галогенами, серой, азотом, фосфором, углеродом и кремнием с образованием, соответственно, галогенидов, сульфидов, нитридов, фосфидов, карбидов и силицидов:
При нагревании щелочные металлы способны реагировать с другими металлами, образуя интерметаллиды. Активно (со взрывом) реагируют щелочные металлы с кислотами.
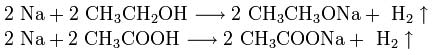
Щелочные металлы растворяются в жидком аммиаке и его производных — аминах и амидах:
При растворении в жидком аммиаке щелочной металл теряет электрон, который сольватируется молекулами аммиака и придаёт раствору голубой цвет. Образующиеся амиды легко разлагаются водой с образованием щёлочи и аммиака:
Щелочные металлы взаимодействуют с органическими веществами спиртами (с образованием алкоголятов) и карбоновыми кислотами (с образованием солей):
4. Качественное определение щелочных металлов. Поскольку потенциалы ионизации щелочных металлов невелики, то при нагревании металла или его соединений в пламени атом ионизируется, окрашивая пламя в определённый цвет:
| Li | Карминно-красный |
| Na | Жёлтый |
| K | Фиолетовый |
| Rb | Беловато-розовый |
| Cs | Фиолетово-красный |
Получение щелочных металлов
1. Для получения щелочных металлов используют в основном электролиз расплавов их галогенидов, чаще всего — хлоридов, образующих природные минералы:
катод: Li+ + e → Li
анод: 2Cl- — 2e → Cl2
2. Иногда для получения щелочных металлов проводят электролиз расплавов их гидроксидов:
катод: Na+ + e → Na
анод: 4OH- — 4e → 2H2O + O2
Поскольку щелочные металлы в электрохимическом ряду напряжений находятся левее водорода, то электролитическое получение их из растворов солей невозможно; в этом случае образуются соответствующие щёлочи и водород.
Соединения щелочных металлов. Гидроксиды
Для получения гидроксидов щелочных металлов в основном используют электролитические методы. Наиболее крупнотоннажным является производство гидроксида натрия электролизом концентрированного водного раствора поваренной соли:
Периодическая система химических элементов Менделеева
Классификация хим. элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона/
198095, г.Санкт-Петербург, ул.Швецова, д.23, лит.Б, пом.7-Н, схема проезда
Щёлочные металлы
Щелочны́е мета́ллы — элементы главной подгруппы I группы Периодической системы химических элементов Д. И. Менделеева: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr. Эти металлы получили название щелочных, потому что большинство их соединений растворимо в воде. По-славянски «выщелачивать» означает «растворять», это и определило название данной группы металлов. При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щелочами.
Содержание
Общая характеристика щелочных металлов
В Периодической системе они следуют сразу за инертными газами, поэтому особенность строения атомов щелочных металлов заключается в том, что они содержат один электрон на новом энергетическом уровне: их электронная конфигурация ns 1 . Очевидно, что валентные электроны щелочных металлов могут быть легко удалены, потому что атому энергетически выгодно отдать электрон и приобрести конфигурацию инертного газа. Поэтому для всех щелочных металлов характерны восстановительные свойства. Это подтверждают низкие значения их потенциалов ионизации (потенциал ионизации атома цезия — один из самых низких) и электроотрицательности (ЭО).
Некоторые свойства щелочных металлов
| Атомный номер | Название, символ | Металлический радиус, нм | Ионный радиус, нм | Потенциал ионизации, эВ | ЭО | p, г/см³ | tпл, °C | tкип, °C |
|---|---|---|---|---|---|---|---|---|
| 3 | Литий Li | 0,152 | 0,078 | 5,32 | 0,98 | 0,53 | 181 | 1347 |
| 11 | Натрий Na | 0,190 | 0,098 | 5,14 | 0,93 | 0,97 | 98 | 883 |
| 19 | Калий K | 0,227 | 0,133 | 4,34 | 0,82 | 0,86 | 64 | 774 |
| 37 | Рубидий Rb | 0,248 | 0,149 | 4,18 | 0,82 | 1,53 | 39 | 688 |
| 55 | Цезий Cs | 0,265 | 0,165 | 3,89 | 0,79 | 1,87 | 28 | 678 |
Все металлы этой подгруппы имеют серебристо-белый цвет (кроме золотисто-жёлтого цезия), они очень мягкие, их можно резать скальпелем. Литий, натрий и калий легче воды и плавают на её поверхности, реагируя с ней.
Щелочные металлы встречаются в природе в форме соединений, содержащих однозарядные катионы. Многие минералы содержат в своём составе металлы главной подгруппы I группы. Например, ортоклаз, или полевой шпат, состоит из алюмюсиликата калия K2[Al2Si6O16], аналогичный минерал, содержащий натрий — альбит — имеет состав Na2[Al2Si6O16]. В морской воде содержится хлорид натрия NaCl, а в почве — соли калия — сильвин KCl, карналлит KCl • MgCl2 • 6H2O, полигалит K2SO4 • MgSO4 • CaSO4 • 2H2O.
Химические свойства щелочных металлов
Из-за высокой химической активности щелочных металлов по отношению к воде, кислороду, азоту их хранят под слоем керосина. Чтобы провести реакцию со щелочным металлом, кусочек нужного размера аккуратно отрезают скальпелем под слоем керосина, в атмосфере аргона тщательно очищают поверхность металла от продуктов его взаимодействия с воздухом и только потом помещают образец в реакционный сосуд.
1. Взаимодействие с водой. Важное свойство щелочных металлов — их высокая активность по отношению к воде. Наиболее спокойно (без взрыва) реагирует с водой литий:
При проведении аналогичной реакции натрий горит жёлтым пламенем и происходит небольшой взрыв. Калий ещё более активен: в этом случае взрыв гораздо сильнее, а пламя окрашено в фиолетовый цвет.
2. Взаимодействие с кислородом. Продукты горения щелочных металлов на воздухе имеют разный состав в зависимости от активности металла.
- Только литий сгорает на воздухе с образованием оксида стехиометрического состава:
- При горении натрия в основном образуется пероксид Na2O2 с небольшой примесью надпероксида NaO2:
- В продуктах горения калия, рубидия и цезия содержатся в основном надпероксиды:
Для получения оксидов натрия и калия нагревают смеси гидроксида, пероксида или надпероксида с избытком металла в отсутствие кислорода:
Для кислородных соединений щелочных металлов характерна следующая закономерность: по мере увеличения радиуса катиона щелочного металла возрастает устойчивость кислородных соединений, содержащих пероксид-ион О2 2- и надпероксид-ион O2 - .
Для тяжёлых щелочных металлов характерно образование довольно устойчивых озонидов состава ЭО3. Все кислородные соединения имеют различную окраску, интенсивность которой углубляется в ряду от Li до Cs:
| Формула кислородного соединения | Цвет |
|---|---|
| Li2O | Белый |
| Na2O | Белый |
| K2O | Желтоватый |
| Rb2O | Жёлтый |
| Cs2O | Оранжевый |
| Na2O2 | Светло- жёлтый |
| KO2 | Оранжевый |
| RbO2 | Тёмно- коричневый |
| CsO2 | Жёлтый |
Оксиды щелочных металлов обладают всеми свойствами, присущими основным оксидам: они реагируют с водой, кислотными оксидами и кислотами:
Пероксиды и надпероксиды проявляют свойства сильных окислителей:
Пероксиды и надпероксиды интенсивно взаимодействуют с водой, образуя гидроксиды:
3. Взаимодействие с другими веществами. Щелочные металлы реагируют со многими неметаллами. При нагревании они соединяются с водородом с образованием гидридов, с галогенами, серой, азотом, фосфором, углеродом и кремнием с образованием, соответственно, галогенидов, сульфидов, нитридов, фосфидов, карбидов и силицидов:
При нагревании щелочные металлы способны реагировать с другими металлами, образуя интерметаллиды. Активно (со взрывом) реагируют щелочные металлы с кислотами.
Щелочные металлы растворяются в жидком аммиаке и его производных — аминах и амидах:
При растворении в жидком аммиаке щелочной металл теряет электрон, который сольватируется молекулами аммиака и придаёт раствору голубой цвет. Образующиеся амиды легко разлагаются водой с образованием щёлочи и аммиака:
Щелочные металлы взаимодействуют с органическими веществами спиртами (с образованием алкоголятов) и карбоновыми кислотами (с образованием солей):
4. Качественное определение щелочных металлов. Поскольку потенциалы ионизации щелочных металлов невелики, то при нагревании металла или его соединений в пламени атом ионизируется, окрашивая пламя в определённый цвет:
Окраска пламени щелочными металлами
и их соединениями
| Щелочной металл | Цвет пламени |
|---|---|
| Li | Карминно-красный |
| Na | Жёлтый |
| K | Фиолетовый |
| Rb | Беловато-розовый |
| Cs | Фиолетово-красный |
Получение щелочных металлов
1. Для получения щелочных металлов используют в основном электролиз расплавов их галогенидов, чаще всего — хлоридов, образующих природные минералы:
катод: Li + + e → Li
2. Иногда для получения щелочных металлов проводят электролиз расплавов их гидроксидов:
катод: Na + + e → Na
Поскольку щелочные металлы в электрохимическом ряду напряжений находятся левее водорода, то электролитическое получение их из растворов солей невозможно; в этом случае образуются соответствующие щёлочи и водород.
Соединения щелочных металлов
Гидроксиды
Для получения гидроксидов щелочных металлов в основном используют электролитические методы. Наиболее крупнотоннажным является производство гидроксида натрия электролизом концентрированного водного раствора поваренной соли:
Прежде щёлочь получали реакцией обмена:
Получаемая таким способом щёлочь была сильно загрязнена содой Na2CO3.
Гидроксиды щелочных металлов — белые гигроскопичные вещества, водные растворы которых являются сильными основаниями. Они участвуют во всех реакциях, характерных для оснований — реагируют с кислотами, кислотными и амфотерными оксидами, амфотерными гидроксидами:
Гидроксиды щелочных металлов при нагревании возгоняются без разложения, за исключением гидроксида лития, который так же, как гидроксиды металлов главной подгруппы II группы, при прокаливании разлагается на оксид и воду:
Гидроксид натрия используется для изготовления мыла, синтетические моющие средства|синтетических моющих средств, искусственного волокна, органических соединений, например фенола.
Карбонаты
Важным продуктом, содержащим щелочной металл, является сода Na2CO3. Основное количество соды во всём мире производят по методу Сольве, предложенному ещё в начале XX века. Суть метода состоит в следующем: водный раствор NaCl, к которому добавлен аммиак, насыщают углекислым газом при температуре 26 — 30 °C. При этом образуется малорастворимый гидрокарбонат натрия, называемый питьевой содой:
Аммиак добавляют для нейтрализации кислотной среды, возникающей при пропускании углекислого газа в раствор, и получения гидрокарбонат-иона HCO3 - , необходимого для осаждения гидрокарбоната натрия. После отделения питьевой соды раствор, содержащий хлорид аммония, нагревают с известью и выделяют аммиак, который возвращают в реакционную зону: Таким образом, при аммиачном способе получения соды единственным отходом является хлорид кальция, остающийся в растворе и имеющий ограниченное применение.
При прокаливании гидрокарбоната натрия получается кальцинированная, или стиральная, сода Na2CO3 и диоксид углерода, используемый в процессе получения гидрокарбоната натрия:
Основной потребитель соды — стекольная промышленность.
В отличие от малорастворимой кислой соли NaHCO3, гидрокарбонат калия KHCO3 хорошо растворим в воде, поэтому карбонат калия, или поташ, K2CO3 получают действием углекислого газа на раствор гидроксида калия:
Поташ используют в производстве стекла и жидкого мыла.
Литий — единственный щелочной металл, для которого не получен гидрокарбонат. Причина этого явления в очень маленьком радиусе иона лития, который не позволяет ему удерживать довольно крупный ион HCO3 - .
Щелочны́е мета́ллы — это элементы 1-й группы периодической таблицы химических элементов (по устаревшей классификации — элементы главной подгруппы I группы) [1] : литий Li, натрий Na, калий K, рубидий Rb, цезий Cs, франций Fr, и унуненний Uue. При растворении щелочных металлов в воде образуются растворимые гидроксиды, называемые щёлочами.
В Периодической системе они следуют сразу за инертными газами, поэтому особенность строения атомов щелочных металлов заключается в том, что они содержат один электрон на внешнем энергетическом уровне: их электронная конфигурация ns 1 . Очевидно, что валентные электроны щелочных металлов могут быть легко удалены, потому что атому энергетически выгодно отдать электрон и приобрести конфигурацию инертного газа. Поэтому для всех щелочных металлов характерны восстановительные свойства. Это подтверждают низкие значения их потенциалов ионизации (потенциал ионизации атома цезия — один из самых низких) и электроотрицательности (ЭО).
| Атомный номер | Название, символ | Металлический радиус, нм | Ионный радиус, нм | Потенциал ионизации, эВ | ЭО | p, г/см³ | tпл, °C | tкип, °C |
|---|---|---|---|---|---|---|---|---|
| 3 | Литий Li | 0,152 | 0,078 | 5,32 | 0,98 | 0,53 | 181 | 1347 |
| 11 | Натрий Na | 0,190 | 0,098 | 5,14 | 0,93 | 0,97 | 98 | 883 |
| 19 | Калий K | 0,227 | 0,133 | 4,34 | 0,82 | 0,86 | 64 | 774 |
| 37 | Рубидий Rb | 0,248 | 0,149 | 4,18 | 0,82 | 1,53 | 39 | 688 |
| 55 | Цезий Cs | 0,265 | 0,165 | 3,89 | 0,79 | 1,87 | 28 | 678 |
| 87 | Франций Fr | ? | 0,18 | ? | 0,7 | 1,87 | 27 | 6778 |
| 119 | Унуненний Uue | ? | ? | ? | ? | ? | ? | ? |
Щелочные металлы встречаются в природе в форме соединений, содержащих однозарядные катионы. Многие минералы содержат в своём составе металлы главной подгруппы I группы. Например, ортоклаз, или полевой шпат, состоит из алюмосиликата калия K2[Al2Si6O16], аналогичный минерал, содержащий натрий — альбит — имеет состав Na2[Al2Si6O16]. В морской воде содержится хлорид натрия NaCl, а в почве — соли калия — сильвин KCl, сильвинит NaCl • KCl, карналлит KCl • MgCl2 • 6H2O, полигалит K2SO4 • MgSO4 • CaSO4 • 2H2O.
Из-за высокой химической активности щелочных металлов по отношению к воде, кислороду, и иногда даже и азоту (Li, Cs) их хранят под слоем керосина. Чтобы провести реакцию со щелочным металлом, кусочек нужного размера аккуратно отрезают скальпелем под слоем керосина, в атмосфере аргона тщательно очищают поверхность металла от продуктов его взаимодействия с воздухом и только потом помещают образец в реакционный сосуд.
Для кислородных соединений щелочных металлов характерна следующая закономерность: по мере увеличения радиуса катиона щелочного металла возрастает устойчивость кислородных соединений, содержащих пероксид-ион О2 2− и надпероксид-ион O2 − .
| Формула кислородного соединения | Цвет |
|---|---|
| Li2O | Белый |
| Na2O | Белый |
| K2O | Желтоватый |
| Rb2O | Жёлтый |
| Cs2O | Оранжевый |
| Na2O2 | Светло- жёлтый |
| KO2 | Оранжевый |
| RbO2 | Тёмно- коричневый |
| CsO2 | Жёлтый |
| Щелочной металл | Цвет пламени |
|---|---|
| Li | Карминно-красный |
| Na | Жёлтый |
| K | Фиолетовый |
| Rb | Бурокрасный |
| Cs | Фиолетово-красный |
3. Щелочной металл может быть восстановлен из соответствующего хлорида или бромида кальцием, магнием, кремнием и др. восстановителями при нагревании под вакуумом до 600-900 °C:
Чтобы реакция пошла в нужную сторону, образующийся свободный щелочной металл (M) должен удаляться путём отгонки. Аналогично возможно восстановление цирконием из хромата. Известен способ получения натрия восстановлением из карбоната углём при 1000 °C в присутствии известняка. [источник не указан 578 дней]
катод:
анод:
Гидроксид натрия используется для изготовления мыла, синтетических моющих средств, искусственного волокна, органических соединений, например фенола.
Аммиак добавляют для нейтрализации кислотной среды, возникающей при пропускании углекислого газа в раствор, и получения гидрокарбонат-иона HCO3 − , необходимого для осаждения гидрокарбоната натрия. После отделения питьевой соды раствор, содержащий хлорид аммония, нагревают с известью и выделяют аммиак, который возвращают в реакционную зону: Таким образом, при аммиачном способе получения соды единственным отходом является хлорид кальция, остающийся в растворе и имеющий ограниченное применение.
Литий — единственный щелочной металл, для которого не получен гидрокарбонат. Причина этого явления в очень маленьком радиусе иона лития, который не позволяет ему удерживать довольно крупный ион HCO3 − .
Щелочной металл
Фотографии




Литература
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Щелочной металл" в других словарях:
щелочной металл — šarminis metalas statusas T sritis fizika atitikmenys: angl. alkali metal vok. Alkalimetall, n rus. щелочной металл, m pranc. métal alcalin, m … Fizikos terminų žodynas
Металл — (Metal) Определение металла, физические и химические свойства металлов Определение металла, физические и химические свойства металлов, применение металлов Содержание Содержание Определение Нахождение в природе Свойства Характерные свойства… … Энциклопедия инвестора
Щелочной элемент — марганцево цинковый гальванический элемент, в котором в качестве катода используется диоксид марганца, анода порошкообразный цинк, а в качестве электролита раствор щёлочи, обычно гидроксида калия. Содержание 1 История изобретения … Википедия
Щелочной топливный элемент — Схема щелочного топливного элемента. 1:Водород 2:Поток электронов 3:Нагрузка 4:Кислород 5:Катод 6:Электролит 7:Анод 8:Вода 9:Гидроксид ионы Щел … Википедия
Никель-металл-гидридный аккумулятор — Никель металл гидридные аккумуляторы Никель металл гидридный аккумулятор (Ni MH) вторичный химический источник тока, в котором анодом является водородный металлогидридный электрод (обычно гибрид никель лантан … Википедия
ГОСТ Р МЭК 61951-2-2007: Аккумуляторы и аккумуляторные батареи, содержащие щелочной и другие некислотные электролиты. Портативные герметичные аккумуляторы. Часть 2. Никель-металл-гидрид — Терминология ГОСТ Р МЭК 61951 2 2007: Аккумуляторы и аккумуляторные батареи, содержащие щелочной и другие некислотные электролиты. Портативные герметичные аккумуляторы. Часть 2. Никель металл гидрид оригинал документа: 3.3.5 герметичный… … Словарь-справочник терминов нормативно-технической документации
ГОСТ Р МЭК 61436-2004: Аккумуляторы и аккумуляторные батареи, содержащие щелочной и другие некислотные электролиты. Аккумуляторы никель-металл-гидридные герметичные — Терминология ГОСТ Р МЭК 61436 2004: Аккумуляторы и аккумуляторные батареи, содержащие щелочной и другие некислотные электролиты. Аккумуляторы никель металл гидридные герметичные оригинал документа: 1.3.1 герметичный никель–металл гидридный… … Словарь-справочник терминов нормативно-технической документации
герметичный никель–металл-гидридный аккумулятор — 1.3.1 герметичный никель–металл гидридный аккумулятор: Аккумулятор, остающийся закрытым и не пропускающим газ или жидкость при работе в режимах заряда и температуре, установленных изготовителем. Аккумулятор должен быть снабжен предохранительным… … Словарь-справочник терминов нормативно-технической документации
никель-металл-гидридный аккумулятор — 3.3.4 никель металл гидридный аккумулятор (nickel metal hydride cell): Аккумулятор, положительный электрод которого содержит гидрат окиси никеля, и отрицательный электрод содержит сплав, абсорбирующий водород. Источник … Словарь-справочник терминов нормативно-технической документации
номинальное напряжение герметичного никель-металл-гидридного аккумулятора — 1.3.3 номинальное напряжение герметичного никель металл гидридного аккумулятора : Напряжение аккумулятора, равное 1,2 В. Источник … Словарь-справочник терминов нормативно-технической документации
Читайте также:

