Связываемая частица в металлической связи
В конце XVIII века Уильям Хиггинс опубликовал научную работу, в которой описал предположение о существовании неких связей между частицами всех веществ. Эта теория стала предвестником теории о валентности, которая на тот момент воспринималась как «соединительная сила» веществ.
Такие представления существовали в мире химии до открытия электрона. С момента возникновения теории о химических связях понятие валентности было вытеснено из научного толкования, а сам термин стал претерпевать значительные изменения.
Теория химических связей смогла более точно объяснить связь частиц тех веществ, с которыми сталкивался человек. Определение химической связи звучит следующим образом:
Химическая связь — это взаимодействие атомов, осуществляемое путем обмена электронами или их перехода от одного атома к другому.
Благодаря стремлению веществ к более стабильным и устойчивым состояниям с минимальным расходом энергии появляются различные химические соединения.
Основными характеристиками химической связи являются:
- прочность;
- длина;
- полярность.
Процесс образования химических связей не может происходить бесследно для вещества. Он всегда сопровождается выделением энергии химической связи.
Большую роль в процессе формирования химической связи играют валентные электроны, находящиеся на внешнем энергетическом уровне (электронном слое) атома. Они вступают во взаимодействие с другими атомами, образуя новые химические соединения.
Способность притягивать электроны — электроотрицательность — играет важную роль при образовании химической связи и определяет ее вид. По правилу октета завершенным считается внешний энергетический уровень, содержащий 8 электронов у большинства веществ и 2 электрона у гелия.
Современная химия различает несколько видов связей:
- металлическая;
- ковалентная;
- ионная;
- водородная;
- ван-дер-ваальсова.
Основные теории и представления
До открытия электрона представления о химической связи заключались в теории валентности — способности атомов образовывать химические связи в определенном количестве, ограниченном числом неспаренных электронов.
Точное и полное понимание теории сложилось к 1852 году, когда свой труд о соединительной силе атомов опубликовал химик Эдуард Франкленд. Он переосмыслил все знания о валентности, существовавшие до него и объединил их в одну теорию, согласно которой появилось учение о валентности.
В 1861 году в теорию внес свой вклад А. М. Бутлеров, который показал четкое различие между изолированным и входящим в состав соединение атомом. Эти знания позволили получить наглядное изображение атома в виде первых молекулярных моделей.
Дальнейшие основные теории химической связи делятся на:
К электронным теориям относятся электронная теория химической связи и Боровская модель.
Электронная теория сформировалась в 1912-16 годах американским физиком и химиком Г. Н. Льюисом. Она стала основой классической теории строения в органической части химических исследований. Согласно этой теории атомы, вступающие в связь при ковалентном соединении, имеют общую электронную плотность, которая делится между ними.
Это мнение шло в противовес господствовавшей тогда теории о положительном и отрицательном заряде атомов, которые несут разные атомы. Также концепция Льюиса включала формулирование правило октета.
Боровская модель была опубликована в 1913 году Нильсом Бором в статье «Системы, содержащие несколько ядер». Согласно модели, электроны атомов образовывают кольцо, которое вращается перпендикулярно оси молекулы. Однако эта система требовала усовершенствования и доработки, а все попытки их осуществления приводили к неудачам.
Квантовые теории химической связи включают в себя теорию валентных связей и теорию молекулярных орбиталей.
В 1927 году В. Гайтлером и Ф. Лондоном была заложена теория валентных связей, основанная на том, что каждая пара атомов в молекуле удерживается при помощи общих электронных пар.
Молекулу как целый объект рассматривает теория молекулярных орбиталей. Согласно ей молекула является сложной системой, и поэтому должна рассматриваться как целое и не разбиваться при исследованиях на более мелкие частицы, иначе они теряют свои свойства. Данная теория описывает свойства отдельных молекул и дает понимание о распределении плотности вероятности обнаружения электрона в заданном пространстве.
Виды химических связей в неорганических, органических и комплексных соединениях
Химические соединения имеют сложную структуру. Одна молекула может иметь сразу несколько видов химической связи.
Химия выделяет 4 основных вида химической связи. Это:
- ковалентная;
- ионная;
- металлическая;
- межмолекулярная.
Ковалентная связь при взаимодействии атомов бывает двух видов: полярная и неполярная. Атомы объединяются по типу обменного механизма или по донорно-акцепторному механизму. В таком соединении важна электроотрицательность атомов.
Электроотрицательность (ЭО) — способность атома в молекуле притягивать электронные пары в свою сторону.
Неполярная ковалентная связь образуется между двумя атомами с одинаковой электроотрицательностью. Обычно это молекулы одного химического элемента, например, хлор C l 2 , азот N 2 , кислород O 2 и другие. Полюс + или – в такой связи отсутствует, а электронная плотность распределяется равномерно.
Полярная ковалентная связь образуется между атомами с разной электроотрицательностью, то есть с атомами разных химических элементов. В таких соединениях полюс + или – смещается к одному из элементов, более электроотрицательному. К таким соединениям относятся йодистый водород H I , вода H 2 O , хлористый водород H C l .
Обменный механизм образования ковалентной связи предполагает, что каждый атом предоставляет по одному неспаренному электрону для создания общей электронной пары, располагающейся между ядрами взаимодействующих атомов. Эта общая электронная пара и является одинарной ковалентной связью.
При донорно-акцепторном механизме один атом становится донором своей неподеленной пары, а второй не отдавая электроны вовсе, лишь предоставляет место для них на своей пустой (свободной или вакантной) орбитали.
Ковалентная связь характерна как для неорганических, так и органических соединений. Образуется преимущественно между атомами неметаллов.
Ионная связь образуется между атомами веществ, электроотрицательность которых сильно отличается (чаще всего между атомами металла и неметалла). При такой связи электрон атома с меньшей ЭО практически полностью переходит к электрону атома с бОльшей ЭО, превращая первый атом в катион, а второй — в анион. Соединения, имеющие ионные связи, как правило, состоят из ионов и являются электролитами.
Ионы — частицы, имеющие заряд, но образующиеся из нейтральных частиц.
По строению ионная связь имеет сходство с ковалентной и даже считается крайней формой полярной ковалентной связи. Примерами веществ с ионной связью являются: соединения оксид натрия N a 2 O , хлорид калия K C l , гидрооксид кальция C a ( O Н ) 2 , серная кислота H 2 S O 4 и многие другие. Ионная связь характерна для соединений металлов с неметаллами.
Атомы металла вместе удерживает металлическая связь. По природе эта связь близка и к ковалентной и к ионной связям, но отличается от нее наличием высокой концентрации в металлах электронов проводимости (электронный газ). Металлическая связь образуется в простых веществах: металлах и их сплавах. Относится к одному из трех основных типов химических связей.
Соединения неметаллов с водородом имеют удивительные свойства, объясняющиеся возникновением межмолекулярных связей. Это заметили химики еще до появления современной теории о химических связях.
Водородная связь образуется между атомом водорода, принадлежащим одной молекуле, и атомом другой молекулы, имеющим большее значение ЭО: например, фтористый водород H F , этанол C 2 H 5 O H , аммиак N H 3 .
Водородные связи могут образовываться как между отдельными молекулами, так и внутри одной из них (внутримолекулярная водородная связь).
Как определить тип, свойства
Каждому веществу свойственен свой тип связи и определенные свойства.
Вид химической связи определяется следующим образом:
- Определение элементов в соединении.
- Определение ЭО.
- Металл и неметалл вступают в ионную связь.
- Два металла вступают в металлическую связь.
- Два неметалла вступают в ковалентную связь.
- Два равных по ЭО элемента вступают в неполярную ковалентную связь.
- Два неравных по ЭО элемента вступают в полярную ковалентную связь.
- Водород и атом с бОльшей ЭО, относящиеся к разным молекулам или группам, образуют особый тип межмолекулярной связи - водородную связь.
Химические связи проходят сравнение по разным количественным характеристикам, среди которых:
- порядок связей или кратность химической связи;
- полярность;
- энергия;
- длина.
Порядок связей включает в себя описание количества электронных пар, которые вступили в связь. Он описывает количество электронов, вступивших в химическую связь.
Полярность связи показывает смещение электронной плотности к атомам — электроотрицательность элемента.
Энергия определяет прочность химической связи, от которой зависит насколько сложно разъединить атомы.
Длина связи определяет расстояние между атомами, связанными химической связью. Она не может быть определена точно, поэтому определяется экспериментально.
1. Типы кристаллических решёток
Большинство твёрдых веществ имеет кристаллическое строение, которое характеризуется строго определённым расположением частиц.
Если соединить частицы условными линиями, то получится пространственный каркас, называемый кристаллической решёткой .
Точки, в которых размещены частицы кристалла, называют узлами решётки. В узлах воображаемой решётки могут находиться атомы, ионы или молекулы.
В зависимости от природы частиц, расположенных в узлах, и характера связи между ними различают четыре типа кристаллических решёток: ионную , металлическую , атомную и молекулярную .
Их образуют вещества с ионной связью. В узлах такой решётки располагаются положительные и отрицательные ионы, связанные между собой электростатическим взаимодействием.
Ионы могут быть простые или сложные. Например, в узлах кристаллической решётки хлорида натрия находятся простые ионы натрия Na + и хлора Cl − , а в узлах решётки сульфата калия чередуются простые ионы калия K + и сложные сульфат-ионы S O 4 2 − .
Связи между ионами в таких кристаллах прочные. Поэтому ионные вещества твёрдые , тугоплавкие , нелетучие . Такие вещества хорошо растворяются в воде .

Металлическими называют решётки, которые состоят из положительных ионов и атомов металла и свободных электронов.
Их образуют вещества с металлической связью. В узлах металлической решётки находятся атомы и ионы (то атомы, то ионы, в которые легко превращаются атомы, отдавая свои внешние электроны в общее пользование).
Температуры плавления металлов могут быть разными (от \(–37\) °С у ртути до двух-трёх тысяч градусов). Но все металлы имеют характерный металлический блеск , ковкость , пластичность , хорошо проводят электрический ток и тепло .

Атомными называют кристаллические решётки, в узлах которых находятся отдельные атомы, соединённые ковалентными связями.
Такой тип решётки имеет алмаз — одно из аллотропных видоизменений углерода. К веществам с атомной кристаллической решёткой относятся графит , кремний , бор и германий , а также сложные вещества, например, карборунд SiC и кремнезём , кварц , горный хрусталь , песок , в состав которых входит оксид кремния(\(IV\)) Si O 2 .
Таким веществам характерны высокая прочность и твёрдость . Так, алмаз является самым твёрдым природным веществом.
У веществ с атомной кристаллической решёткой очень высокие температуры плавления и кипения . Например, температура плавления кремнезёма — \(1728\) °С, а у графита она выше — \(4000\) °С.

Молекулярными называют решётки, в узлах которых находятся молекулы, связанные слабым межмолекулярным взаимодействием.
Несмотря на то, что внутри молекул атомы соединены очень прочными ковалентными связями, между самими молекулами действуют слабые силы межмолекулярного притяжения. Поэтому молекулярные кристаллы имеют небольшую прочность и твёрдость , низкие температуры плавления и кипения .
Такие вещества летучи . Например, кристаллические иод и твёрдый оксид углерода(\(IV\)) («сухой лёд») испаряются, не переходя в жидкое состояние.
Такой тип решётки имеют простые вещества в твёрдом агрегатном состоянии: благородные газы с одноатомными молекулами ( He , Ne , Ar , Kr , Xe , Rn ), а также неметаллы с двух- и многоатомными молекулами ( H 2 , O 2 , N 2 , Cl 2 , I 2 , O 3 , P 4 , S 8 ).
Молекулярную кристаллическую решётку имеют также вещества с ковалентными полярными связями: вода — лёд , иод , твёрдые аммиак , кислоты , оксиды большинства неметаллов . Большинство органических соединений тоже представляют собой молекулярные кристаллы ( нафталин , сахар , глюкоза ).


Попробуем определить, каковы примерно температуры плавления у фторида натрия , фтороводорода и фтора .
У фторида натрия — ионная кристаллическая решётка. Значит, его температура плавления будет высокой. Фтороводород и фтор имеют молекулярные кристаллические решётки. Поэтому их температуры плавления будут невысокими. Молекулы фтороводорода полярные, а фтора — неполярные. Значит, межмолекулярное взаимодействие у фтороводорода будет сильнее, и его температура плавления будет выше по сравнению со фтором.
Экспериментальные данные подтверждают эти предположения: температуры плавления NaF , HF и F 2 составляют соответственно \(995\) °С, \(–83\) °С, \(–220\) °С.
Металлическая связь: механизм образования. Металлическая химическая связь: примеры
Все известные на сегодняшний день химические элементы, расположенные в таблице Менделеева, подразделяются условно на две большие группы: металлы и неметаллы. Для того чтобы они стали не просто элементами, а соединениями, химическими веществами, могли вступать во взаимодействие друг с другом, они должны существовать в виде простых и сложных веществ.
Именно для этого одни электроны стараются принять, а другие - отдать. Восполняя друг друга таким образом, элементы и образуют различные химические молекулы. Но что позволяет им удерживаться вместе? Почему существуют вещества такой прочности, разрушить которую неподвластно даже самым серьезным инструментам? А другие, наоборот, разрушаются от малейшего воздействия. Все это объясняется образованием различных типов химической связи между атомами в молекулах, формированием кристаллической решетки определенного строения.
Виды химических связей в соединениях
Всего можно выделить 4 основных типа химических связей.
- Ковалентная неполярная. Образуется между двумя одинаковыми неметаллами за счет обобществления электронов, формирования общих электронных пар. В образовании ее принимают участие валентные неспаренные частицы. Примеры: галогены, кислород, водород, азот, сера, фосфор.
- Ковалентная полярная. Образуется между двумя разными неметаллами либо между очень слабым по свойствам металлом и слабым по электроотрицательности неметаллом. В основе также общие электронные пары и перетягивание их к себе тем атомом, сродство к электрону которого выше. Примеры: NH3, SiC, P2O5 и прочие.
- Водородная связь. Самая нестойкая и слабая, формируется между сильно электроотрицательным атомом одной молекулы и положительным другой. Чаще всего это происходит при растворении веществ в воде (спирта, аммиака и так далее). Благодаря такой связи могут существовать макромолекулы белков, нуклеиновых кислот, сложных углеводов и так далее.
- Ионная связь. Формируется за счет сил электростатического притяжения разнозаряженных ионов металлов и неметаллов. Чем сильнее различие по данному показателю, тем ярче выражен именно ионный характер взаимодействия. Примеры соединений: бинарные соли, сложные соединения - основания, соли.
- Металлическая связь, механизм образования которой, а также свойства, будут рассмотрены дальше. Формируется в металлах, их сплавах различного рода.
Существует такое понятие, как единство химической связи. В нем как раз и говорится о том, что нельзя каждую химическую связь рассматривать эталонно. Они все лишь условно обозначенные единицы. Ведь в основе всех взаимодействий лежит единый принцип - электронностатическое взаимодействие. Поэтому ионная, металлическая, ковалентная связь и водородная имеют единую химическую природу и являются лишь граничными случаями друг друга.
Металлы и их физические свойства
Металлы находятся в подавляющем большинстве среди всех химических элементов. Это объясняется их особыми свойствами. Значительная часть из них была получена человеком ядерными реакциями в лабораторных условиях, они являются радиоактивными с небольшим периодом полураспада.
Однако большинство - это природные элементы, которые формируют целые горные породы и руды, входят в состав большинства важных соединений. Именно из них люди научились отливать сплавы и изготавливать массу прекрасных и важных изделий. Это такие, как медь, железо, алюминий, серебро, золото, хром, марганец, никель, цинк, свинец и многие другие.
Для всех металлов можно выделить общие физические свойства, которые объясняет схема образования металлической связи. Какие же это свойства?
- Ковкость и пластичность. Известно, что многие металлы можно прокатать даже до состояния фольги (золото, алюминий). Из других получают проволоку, металлические гибкие листы, изделия, способные деформироваться при физическом воздействии, но тут же восстанавливать форму после прекращения его. Именно эти качества металлов и называют ковкостью и пластичностью. Причина этой особенности - металлический тип связи. Ионы и электроны в кристалле скользят относительно друг друга без разрыва, что и позволяет сохранять целостность всей структуры.
- Металлический блеск. Это также объясняет металлическая связь, механизм образования, характеристики ее и особенности. Так, не все частицы способны поглощать или отражать световые волны одинаковой длины. Атомы большинства металлов отражают коротковолновые лучи и приобретают практически одинаковую окраску серебристого, белого, бледно-голубоватого оттенка. Исключениями являются медь и золото, их окраска рыже-красная и желтая соответственно. Они способны отражать более длинноволновое излучение.
- Тепло- и электропроводность. Данные свойства также объясняются строением кристаллической решетки и тем, что в ее образовании реализуется металлический тип связи. За счет "электронного газа", движущегося внутри кристалла, электрический ток и тепло мгновенно и равномерно распределяются между всеми атомами и ионами и проводятся через металл.
- Твердое агрегатное состояние при обычных условиях. Здесь исключением является лишь ртуть. Все остальные металлы - это обязательно прочные, твердые соединения, равно как и их сплавы. Это также результат того, что в металлах присутствует металлическая связь. Механизм образования такого типа связывания частиц полностью подтверждает свойства.
Это основные физические характеристики для металлов, которые объясняет и определяет именно схема образования металлической связи. Актуален такой способ соединения атомов именно для элементов металлов, их сплавов. То есть для них в твердом и жидком состоянии.

Металлический тип химической связи
В чем же ее особенность? Все дело в том, что такая связь формируется не за счет разнозаряженных ионов и их электростатического притяжения и не за счет разности в электроотрицательности и наличия свободных электронных пар. То есть ионная, металлическая, ковалентная связь имеют несколько разную природу и отличительные черты связываемых частиц.
Всем металлам присущи такие характеристики, как:
- малое количество электронов на внешнем энергетическом уровне (кроме некоторых исключений, у которых их может быть 6,7 и 8);
- большой атомный радиус;
- низкая энергия ионизации.
Все это способствует легкому отделению внешних неспаренных электронов от ядра. При этом свободных орбиталей у атома остается очень много. Схема образования металлической связи как раз и будет показывать перекрывание многочисленных орбитальных ячеек разных атомов между собой, которые в результате и формируют общее внутрикристаллическое пространство. В него подаются электроны от каждого атома, которые начинают свободно блуждать по разным частям решетки. Периодически каждый из них присоединяется к иону в узле кристалла и превращает его в атом, затем снова отсоединяется, формируя ион.
Таким образом, металлическая связь - это связь между атомами, ионами и свободными электронами в общем кристалле металла. Электронное облако, свободно перемещающееся внутри структуры, называют "электронным газом". Именно им объясняется большинство физических свойств металлов и их сплавов.
Как конкретно реализует себя металлическая химическая связь? Примеры можно привести разные. Попробуем рассмотреть на кусочке лития. Даже если взять его размером с горошину, атомов там будут тысячи. Вот и представим себе, что каждый из этих тысяч атомов отдает свой валентный единственный электрон в общее кристаллическое пространство. При этом, зная электронное строения данного элемента, можно увидеть количество пустующих орбиталей. У лития их будет 3 (р-орбитали второго энергетического уровня). По три у каждого атома из десятков тысяч - это и есть общее пространство внутри кристалла, в котором "электронный газ" свободно перемещается.

Вещество с металлической связью всегда прочное. Ведь электронный газ не позволяет кристаллу рушиться, а лишь смещает слои и тут же восстанавливает. Оно блестит, обладает определенной плотностью (чаще всего высокой), плавкостью, ковкостью и пластичностью.
Где еще реализуется металлическая связь? Примеры веществ:
- металлы в виде простых структур;
- все сплавы металлов друг с другом;
- все металлы и их сплавы в жидком и твердом состоянии.
Конкретных примеров можно привести просто неимоверное количество, ведь металлов в периодической системе более 80!
Металлическая связь: механизм образования
Если рассматривать его в общем виде, то основные моменты мы уже обозначили выше. Наличие свободных атомных орбиталей и электронов, легко отрывающихся от ядра вследствие малой энергии ионизации, - вот главные условия для формирования данного типа связи. Таким образом, получается, что она реализуется между следующими частицами:
- атомами в узлах кристаллической решетки;
- свободными электронами, которые были у металла валентными;
- ионами в узлах кристаллической решетки.
В итоге - металлическая связь. Механизм образования в общем виде выражается следующей записью: Ме 0 - e - ↔ Ме n+ . Из схемы очевидно, какие частицы присутствуют в кристалле металла.
Сами кристаллы могут иметь разную форму. Это зависит от конкретного вещества, с которым мы имеем дело.
Типы кристаллов металлов
Данная структура металла или его сплава характеризуется очень плотной упаковкой частиц. Ее обеспечивают ионы в узлах кристалла. Сами по себе решетки могут быть разных геометрических форм в пространстве.
- Объемноцентрическая кубическая решетка - щелочные металлы.
- Гексагональная компактная структура - все щелочноземельные, кроме бария.
- Гранецентрическая кубическая - алюминий, медь, цинк, многие переходные металлы.
- Ромбоэдрическая структура - у ртути.
- Тетрагональная - индий.
Чем тяжелее металл и чем ниже он располагается в периодической системе, тем сложнее его упаковка и пространственная организация кристалла. При этом металлическая химическая связь, примеры которой можно привести для каждого существующего металла, является определяющей при построении кристалла. Сплавы имеют очень разнообразные организации в пространстве, некоторые из них до сих пор еще не до конца изучены.

Характеристики связи: ненаправленность
Ковалентная и металлическая связь имеют одну очень ярко выраженную отличительную черту. В отличие от первой, металлическая связь не является направленной. Что это значит? То есть электронное облако внутри кристалла движется совершенно свободно в его пределах в разных направлениях, каждый из электронов способен присоединяться к абсолютно любому иону в узлах структуры. То есть взаимодействие осуществляется по разным направлениям. Отсюда и говорят о том, что металлическая связь - ненаправленная.
Механизм ковалентной связи подразумевает образование общих электронных пар, то есть облаков перекрывания атомов. Причем происходит оно строго по определенной линии, соединяющей их центры. Поэтому говорят о направленности такой связи.
Насыщаемость
Данная характеристика отражает способность атомов к ограниченному или неограниченному взаимодействию с другими. Так, ковалентная и металлическая связь по этому показателю опять же являются противоположностями.
Первая является насыщаемой. Атомы, принимающие участие в ее образовании, имеют строго определенное количество валентных внешних электронов, принимающих непосредственное участие в образовании соединения. Больше, чем есть, у него электронов не будет. Поэтому и количество формируемых связей ограничено валентностью. Отсюда насыщаемость связи. Благодаря данной характеристике большинство соединений имеет постоянный химический состав.
Металлическая и водородная связи, напротив, ненасыщаемые. Это объясняется наличием многочисленных свободных электронов и орбиталей внутри кристалла. Также роль играют ионы в узлах кристаллической решетки, каждый из которых может стать атомом и снова ионом в любой момент времени.

Еще одна характеристика металлической связи - делокализация внутреннего электронного облака. Она проявляется в способности небольшого количества общих электронов связывать между собой множество атомных ядер металлов. То есть плотность как бы делокализуется, распределяется равномерно между всеми звеньями кристалла.
Примеры образования связи в металлах
Рассмотрим несколько конкретных вариантов, которые иллюстрируют, как образуется металлическая связь. Примеры веществ следующие:
Образование металлической связи между атомами цинка: Zn 0 - 2e - ↔ Zn 2+ . Атом цинка имеет четыре энергетических уровня. Свободных орбиталей, исходя из электронного строения, у него 15 - 3 на р-орбитали, 5 на 4 d и 7 на 4f. Электронное строение следующее: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 0 4d 0 4f 0 , всего в атоме 30 электронов. То есть две свободные валентные отрицательные частицы способны перемещаться в пределах 15 просторных и никем не занятых орбиталей. И так у каждого атома. В итоге - огромное общее пространство, состоящее из пустующих орбиталей, и небольшое количество электронов, связывающих всю структуру воедино.
Металлическая связь между атомами алюминия: AL 0 - e - ↔ AL 3+ . Тринадцать электронов атома алюминия располагаются на трех энергетических уровнях, которых им явно хватает с избытком. Электронное строение: 1s 2 2s 2 2p 6 3s 2 3p 1 3d 0 . Свободных орбиталей - 7 штук. Очевидно, что электронное облако будет небольшим по сравнению с общим внутренним свободным пространством в кристалле.

Металлическая связь хрома. Данный элемент особый по своему электронному строению. Ведь для стабилизации системы происходит провал электрона с 4s на 3d орбиталь: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 5 4p 0 4d 0 4f 0 . Всего 24 электрона, из которых валентных получается шесть. Именно они уходят в общее электронное пространство на образование химической связи. Свободных орбиталей 15, то есть все равно намного больше, чем требуется для заполнения. Поэтому хром - также типичный пример металла с соответствующей связью в молекуле.
Одним из самых активных металлов, реагирующих даже с обычной водой с возгоранием, является калий. Чем объясняются такие свойства? Опять же во многом - металлическим типом связи. Электронов у этого элемента всего 19, но вот располагаются они аж на 4 энергетических уровнях. То есть на 30 орбиталях разных подуровней. Электронное строение: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 0 4p 0 4d 0 4f 0 . Всего два валентных электрона, с очень низкой энергией ионизации. Свободно отрываются и уходят в общее электронное пространство. Орбиталей для перемещения на один атом 22 штуки, то есть очень обширное свободное пространство для "электронного газа".
Сходство и различие с другими видами связей
В целом данный вопрос уже рассматривался выше. Можно только обобщить и сделать вывод. Главными отличительными от всех других типов связи чертами именно металлических кристаллов являются:
- несколько видов частиц, принимающих участие в процессе связывания (атомы, ионы или атом-ионы, электроны);
- различное пространственное геометрическое строение кристаллов.
С водородной и ионной связью металлическую объединяет ненасыщаемость и ненаправленность. С ковалентной полярной - сильное электростатическое притяжение между частицами. Отдельно с ионной - тип частиц в узлах кристаллической решетки (ионы). С ковалентной неполярной - атомы в узлах кристалла.
Типы связей в металлах разного агрегатного состояния
Как мы уже отмечали выше, металлическая химическая связь, примеры которой приведены в статье, образуется в двух агрегатных состояниях металлов и их сплавов: твердом и жидком.
Возникает вопрос: какой тип связи в парах металлов? Ответ: ковалентная полярная и неполярная. Как и во всех соединениях, находящихся в виде газа. То есть при длительном нагревании металла и перевода его из твердого состояния в жидкое связи не рвутся и кристаллическая структура сохраняется. Однако когда речь заходит о переводе жидкости в парообразное состояние, кристалл разрушается и металлическая связь преобразуется в ковалентную.
Металлическая связь
Большинство металлов имеют общие свойства, которые отличны от свойств других простых или сложных веществ. Это такие свойства как:
- повышенные температуры плавления,
- значительные электро- и теплопроводность,
- способность отражать свет и
- способность прокатываться в листы
- характерный металлический блеск.
Эти свойства связаны с существованием в металлах металлической связи:
Металлическая связь — это связь между положительно заряженными ионами и атомами металлов и свободно движущимися по кристаллу электронами.
Образование металлической связи
Простое вещество — металл существует в виде кристалла, имеющим металлическую кристаллическую решетку, в узлах которой находятся атомы или ионы металлов.
Валентные атомные орбитали каждого атома металла в кристалле перекрываются сразу с орбиталями нескольких близлежащих соседей, и число этих атомных орбиталей чрезвычайно велико. Поэтому число возникающих молекулярных орбиталей тоже велико.
Мы уже знаем, что число валентных электронов атомов металлов небольшое, к тому же они достаточно слабо связаны с собственными ядрами и могут легко отрываться. Поэтому электроны заполняют всю зону взаимодействующих орбиталей образуя металлическую связь. Т.о. в кристаллической решетке металла перемещение электронов происходит свободно.
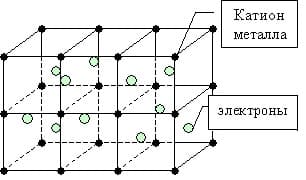
металлическая связь
Такие особенности, как тепло- и электропроводность металлов связано с существованием свободно движущихся электронов в кристаллической решетке.
Особенности металлической связи
Отличие металлической связи от ковалентной
- Несмотря на то, что металлическая связь как и ковалентная связь образована посредством обобществления электронов, однако в металлической связи электроны принадлежат всему множеству ионов/атомов металлов, а в ковалентной только двум атомам неметаллов.
- Важное отличие металлической связи от ковалентной – это то, что здесь не существует направленности связи, т.к. электроны по кристаллу распределены почти равномерно.
- Прочность металлической связи также отличается: ее энергия в 3-4 раза меньше энергии ковалентной связи.
Отличие металлической связи от ионной
В образовании как ионной связи, так и металлической принимают участие ионы — катионы. Однако ионная связь — это связь между катионами и анионами, а в металлической связи анионы отсутствуют, зато имеются электроны, свободно движущиеся между катионами/атомами металлов.
Прочность металлической связи
- Если рассмотреть щелочные металлы, то наиболее активный среди них – цезий, легче всего будет отдавать свои валентные электроны, а труднее всего – рубидий, наименее активный среди щелочных металлов.
Чем легче атом металла переходит в состояние иона, т.е. отдает электроны, тем менее прочна его решетка, вследствие отталкивания положительно заряженных ионов.
В связи с этим металл будет обладать пониженной температурой плавления и становится более мягким.
- Чем больше валентных электронов имеет атом металла, тем более прочна его кристаллическая решетка, и тем выше его температуры кипения и плавления
Ниже приведена зависимость температуры плавления металлов от их положения в периодической таблице и числа валентных электронов.

зависимость температуры плавления металлов от положения в периодической таблице и от числа валентных электронов
Металлическая химическая связь
Вы когда-нибудь задумывались — существует ли в природе отдельный атом металла?
Металл всегда существует в виде кристалла. Естественно, это обусловлено определенным строением и предполагает определенные физические и химические свойства.

Давайте представим, что у нас есть кусок какого-то металла. Например, нам дано железо (Fe). Из чего состоит этот кусок железа?
Он состоит из атомов железа, которые находятся в строго определенном порядке — в узлах кристаллической решетки.
У атома железа, как у любого металла, на последнем электронном слое небольшое число электронов, плюс к этому, большой радиус атома. На этом последнем слое электроны держатся достаточно слабо.
Любой металл способен отдавать электроны, превращаясь в положительно заряженный ион.
На примере железа:
Fe 0 -2e — = Fe 2+
Куда направляются отделившиеся отрицательно заряженные частицы — электроны? Минус всегда притягивается к плюсу. Электроны притягиваются к другому иону (положительно заряженному) железа в кристаллической решетке:
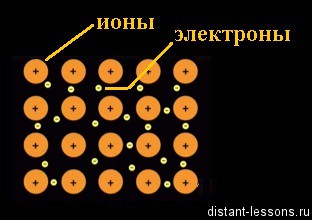
Fe 2+ +2e — = Fe 0
Ион становится нейтральным атомом.
И такой процесс повторяется много раз.
Получается, что свободные электроны железа находятся в постоянном движении по всему объему кристалла, отрываясь и присоединяясь к ионам в узлах решетки. Другое название этого явления — делокализованное электронное облако. Термин «делокализованный» обозначает — свободный, не привязанный.
Это жестко зафиксированные в узлах кристаллической решетки ионы металла и свободно перемещающиеся по всему объему кристалла электроны.
В чем-то металлическая химическая связь похожа на ионную — в ней тоже присутствуют ионы (катионы) , однако, существенное отличие в том, что:
- в ионной связи есть катионы (положительно заряженные частицы) и анионы (отрицательно заряженные ионы);
- в металлической химической связи есть катионы и электроны .
Кое в чем металлическая химическая связь похожа и на ковалентную — в ней тоже есть общие электроны, но:
- в ковалентной химической связи электроны принадлежат двум элементам (локализованы между ними);
- в металлической — они принадлежат абсолютно всем ионам.
Металлическая химическая связь— связь между положительными ионами в кристаллах металлов, осуществляемая за счет притяжения электронов, свободно перемещающихся по кристаллу.
Добиться состояния одной молекулы металла можно только при очень высоких температурах — когда металл перейдет в газообразное состояние.
Читайте также:
