Свойство металла обусловленное особенностями металлической связи
Металловедение – это наука, которая изучает свойства и внутреннее строение металлов и сплавов в их взаимосвязи.
Все свойства металлов делятся на следующие группы:
- Механические, к которым относятся вязкость, прочность и твердость.
- Физические, к которым относятся тепловые, магнитные, объемные и электрические свойства.
- Химические, к которым относится сопротивление действию агрессивной среды.
- Технологические, к которым относятся прокаливаемость, жидкотекучесть, штампуемость и обрабатываемость режущим инструментом.
Историю развития металловедения можно разделить на три периода. Первый период продолжался до двадцатых годов двадцатого века. В данный период были заложены основы металловедения, как самостоятельной науки и созданы общие представления о металлах и сплавах. Делалось это на основе исследований их строения невооруженным глазом и при помощи специального металлографического микроскопа. Второй период продолжался до пятидесятых годов двадцатого века. На данном этапе удалось создать представление о расположении атомов в кристаллах металлов, а также процессах, которые происходят в них. Делалось это при помощи рентгеноструктурного анализа и разнообразны лабораторных исследований. Тогда выяснилось, что все свойства металлов определяются дефектами строения, а не идеальным расположением атомов в кристаллах металлов. Третий период развития металловедения продолжается с пятидесятых годов прошлого века. Этот период связан с появлением ядерного излучения и его совместного использования с электронной микроскопией и современными методами исследования, что обеспечило возможность всестороннего и глубокого изучения структуры реальных металлов. Появилась возможность изменять строение расположение атомов, тем самым создавая дефекты строения и изучения их взаимодействия, от которого во многом зависят свойства металлов. Теперь металловедение могло не только объяснять свойства и строение металлов, но и предвидеть их и изменять таком направлении, которое необходимо для эксплуатации и производства.
Современное металловедение обобщает и использует опыт промышленных и научных лабораторий на основе достижений физики и физической химии. Это способствовало созданию нескольких теорий, которые позволили разработать новые процессы, применяемые в современных машиностроении и металлургии.
Свойства металлов
Общность свойств металлов обусловлена типом связи между их атомами. Валентные электроны металла, в отличии от электронов неметаллов, плохо связаны с ядром атома. Поэтому атомы металлов легко теряют валентные электроны и превращаются в положительно заряженные ионы. Свободные электроны образуют электронный газ, который беспрепятственно перемещается между ионами. Электростатическое притяжение между отрицательно заряженными электронным газом и положительно заряженными ионами является металлическим типом связи.
Ион – это частица с электрическим зарядом.
У металлической связи нет направленного характера. Электроны, которые образовали электронный газ никак не связаны с отдельными атомами - в одинаковой мере принадлежат всем атомам. Благодаря этому они могут перемещаться внутри атомам, но не нарушая межатомную связь. Особенностями металлической связи обусловлены свойства металлов. Например, хорошая электропроводность объясняется возможностью ускорения свободных электронов под действием электрического поля, а высокая теплопроводность определяется участием свободных электронов в процессе передачи тепла. Причиной способности металлов к пластической деформации связана с ненаправленным характером связи, результат приложения внешних сил - взаимное относительное смещение атомов металла, а не разрыв связей между ними. При новом расположении характер связи остается таким же, как и до итого. Металлический блеск является результатом взаимодействия электромагнитных световых волн с освободившимися электронами.
Готовые работы на аналогичную тему
Металлические сплавы
Металлические сплавы – это сложные вещества, которые образовались в результате взаимодействия двух и более металлов или металлов с некоторыми неметаллами.
Химические элементы, которые входят в состав сплава называются компонентами. Компоненты, который количественно преобладает в сплаве - основной компонент, а те, что вводятся в его состав с целью придания необходимых свойств - легирующие. Сплавы классифицируются по следующим основаниям:
- Количеству компонентов - двойные, тройные и т. д.
- Основному компоненту - алюминиевые, титановые, медные, магниевые и т. д.
- Применению - конструкционные, жаропрочные, инструментальные, пружинные, антифрикционные, шарикоподшипниковые и т. д.
- Температуре плавления - тугоплавкие и легкоплавкие.
- Плотности - легкие и тяжелые.
- Технологии изготовления изделий и полуфабрикатов - спеченные, литейные, деформируемые, композиционные, гранулированные и т. п.
Нужны еще материалы по теме статьи?
Воспользуйся новым поиском!
Найди больше статей и в один клик создай свой список литературы по ГОСТу
Автор этой статьи Дата последнего обновления статьи: 28.04.2022
Эксперт по предмету «Материаловедение» , преподавательский стаж — 5 лет
Автор24 - это сообщество учителей и преподавателей, к которым можно обратиться за помощью с выполнением учебных работ.
Металлическая связь. Свойства металлической связи
Металлическая связь — химическая связь, обусловленная наличием относительно свободных электронов. Характерна как для чистых металлов, так и их сплавов и интерметаллических соединений.
Механизм металлической связи
Во всех узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа движутся валентные электроны, отцепившиеся от атомов при образовании ионов. Эти электроны играют роль цемента, удерживая вместе положительные ионы; в противном случае решётка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть. Силы связи не локализованы и не направлены.
Поэтому в большинстве случаев проявляются высокие координационные числа (например, 12 или 8). Когда два атома металла сближаются, орбитали их внешних оболочек перекрываются, образуя молекулярные орбитали. Если подходит третий атом, его орбиталь перекрывается с орбиталями первых двух атомов, что дает еще одну молекулярную орбиталь. Когда атомов много, возникает огромное число трехмерных молекулярных орбиталей, простирающихся во всех направлениях. Вследствие многократного перекрывания орбиталей валентные электроны каждого атома испытывают влияние многих атомов.
Характерные кристаллические решётки
Большинство металлов образует одну из следующих высокосимметричных решёток с плотной упаковкой атомов: кубическую объемно центрированную, кубическую гранецентрированную и гексагональную.
В кубической объемно центрированной решётке (ОЦК) атомы расположены в вершинах куба и один атом в центре объёма куба. Кубическую объемно центрированную решётку имеют металлы: Pb, K, Na, Li, β-Ti, β-Zr, Ta, W, V, α-Fe, Cr, Nb, Ba и др.
В кубической гранецентрированной решётке (ГЦК) атомы расположены в вершинах куба и в центре каждой грани. Решётку такого типа имеют металлы: α-Ca, Ce, α-Sr, Pb, Ni, Ag, Au, Pd, Pt,Rh, γ-Fe, Cu, α-Co и др.
В гексагональной решётке атомы расположены в вершинах и центре шестигранных оснований призмы, а три атома — в средней плоскости призмы. Такую упаковку атомов имеют металлы: Mg, α-Ti, Cd, Re, Os, Ru, Zn, β-Co, Be, β-Ca и др.
Другие свойства
Свободно движущиеся электроны обусловливают высокую электро- и теплопроводность. Вещества, обладающие металлической связью, часто сочетают прочность с пластичностью, так как при смещении атомов друг относительно друга не происходит разрыв связей. Также важным свойством является металлическая ароматичность.
Металлы хорошо проводят тепло и электричество, они достаточно прочны, их можно деформировать без разрушения. Некоторые металлы ковкие (их можно ковать), некоторые тягучие (из них можно вытягивать проволоку). Эти уникальные свойства объясняются особым типом химической связи, соединяющей атомы металлов между собой – металлической связью.
Металлы в твердом состоянии существуют в виде кристаллов из положительных ионов, как бы “плавающих” в море свободно движущихся между ними электронов.
Металлическая связь объясняет свойства металлов, в частности, их прочность. Под действием деформирующей силы решетка металла может изменять свою форму, не давая трещин, в отличие от ионных кристаллов.
Высокая теплопроводность металлов объясняется тем, что если нагреть кусок металла с одной стороны, то кинетическая энергия электронов увеличится. Это увеличение энергии распространится в “ электронном море” по всему образцу с большой скоростью.
Становится понятной и электрическая проводимость металлов. Если к концам металлического образца приложить разность потенциалов, то облако делокализованных электронов будет сдвигаться в направлении положительного потенциала: этот поток электронов, движущихся в одном направлении, и представляет собой всем знакомый электрический ток.
Общие свойства металлов. Металлическая связь. Тепло- и электропроводность. Физико-механические и химические свойства металлов.
Общие свойства металлов. Физико-механические и химические свойства металлов.
Объясняются особым строением кристаллической решетки - наличием свободных электронов ("электронного газа").
- Пластичность - способность изменять форму при ударе, вытягиваться в проволоку, прокатываться в тонкие листы. В ряду Au,Ag,Cu,Sn,Pb,Zn,Fe уменьшается.
- Блеск, обычно серый цвет и непрозрачность. Это связано со взаимодействием свободных электронов с падающими на металл квантами света.
- Электропроводность.Объясняется направленным движением свободных электронов от отрицательного полюса к положительному под влиянием небольшой разности потенциалов. В ряду Ag,Cu,Al,Fe уменьшается. При нагревании электропроводность уменьшается, т.к. с повышением температуры усиливаются колебания атомов и ионов в узлах кристаллической решетки, что затрудняет направленное движение "электронного газа".
- Теплопроводность. Закономерность та же. Обусловлена высокой подвижностью свободных электронов и колебательным движением атомов, благодаря чему происходит быстрое выравнивание температуры по массе металла. Наибольшая теплопроводность - у висмута и ртути.
- Твердость. Самый твердый – хром (режет стекло); самые мягкие – щелочные металлы – калий, натрий, рубидий и цезий – режутся ножом.
- Плотность. Она тем меньше, чем меньше атомная масса металла и чем больше радиус его атома (самый легкий - литий (r=0,53 г/см3); самый тяжелый – осмий (r=22,6 г/см3).
- Температуры плавления и кипения. Самый легкоплавкий металл – ртуть (т.пл. = -390C), самый тугоплавкий металл – вольфрам (t0пл. = 33900C).
Металлы с t0пл. выше 10000C считаются тугоплавкими, ниже – низкоплавкими.
Общие химические свойства металлов
Сильные восстановители: Me0 – ne Men+
I. Реакции с неметаллами
С водородом (реагируют только щелочные и щелочноземельные металлы):
II. Реакции с кислотами
Металлы, стоящие в электрохимическом ряду напряжений до H восстанавливают кислоты-неокислители до водорода:
Mg + 2HCl MgCl2 + H2
2Al+ 6HCl 2AlCl3 + 3H2
6Na + 2H3PO4 2Na3PO4 + 3H2
Восстановление металлами кислот-окислителей смотри в разделах: "окислительно-восстановительные реакции", "серная кислота", "азотная кислота".
III. Взаимодействие с водой
Активные (щелочные и щелочноземельные металлы) образуют растворимое основание и водород:
2Na0 + 2H2O 2NaOH + H2
Ca0 + 2H2O Ca(OH)2 + H2
Металлы средней активности окисляются водой при нагревании до оксида:
Zn0 + H2O ZnO + H2
Неактивные (Au, Ag, Pt) - не реагируют.
Вытеснение более активными металлами менее активных металлов из растворов их солей:
Fe+ CuSO4 Cu + FeSO4
Металлическая связь— связь между положительными ионами в кристаллах металлов, осуществляемая за счет притяжения электронов, свободно перемещающихся по кристаллу. В соответствии с положением в периодической системе атомы металлов имеют небольшое число валентных электронов. Эти электроны достаточно слабо связаны со своими ядрами и могут легко отрываться от них. В результате в кристаллической решетке металла появляются положительно заряженные ионы и свободные электроны. Поэтому в кристаллической решетке металлов существует большая свобода перемещения электронов: одни из атомов будут терять свои электроны, а образующиеся ионы могут принимать эти электроны из «электронного газа». Как следствие, металл представляет собой ряд положительных ионов, локализованных в определенных положениях кристаллической решетки, и большое количество электронов, сравнительно свободно перемещающихся в поле положительных центров. В этом состоит важное отличие металлических связей от ковалентных, которые имеют строгую направленность в пространстве.
Металлическая связь отличается от ковалентной также и по прочности: ее энергия в 3-4 раза меньше энергии ковалентной связи.
Энергия связи — энергия, необходимая для разрыва химической связи во всех молекулах, составляющих один моль вещества. Энергии ковалентных и ионных связей обычно велики и составляют величины порядка 100-800 кДж/моль.
Теплопроводность Способность тела передавать теплоту от более нагретых его частей менее нагретым Ag, Cu, Au, Al, W, Fe
В ряду наблюдается уменьшение теплопроводности
Электропроводность Свойство вещества проводить электрический ток (обусловлено наличием в нем свободных электронов) Ag, Cu, Au, Al, W, Fe
В ряду наблюдается уменьшение электропроводности.
При нагревании электропроводность уменьшается, так как усиливается колебательное движение атомов и ионов в узлах решетки и затрудняется движение электронов -
Металлическая связь
Большинство металлов имеют общие свойства, которые отличны от свойств других простых или сложных веществ. Это такие свойства как:
- повышенные температуры плавления,
- значительные электро- и теплопроводность,
- способность отражать свет и
- способность прокатываться в листы
- характерный металлический блеск.
Эти свойства связаны с существованием в металлах металлической связи:
Металлическая связь — это связь между положительно заряженными ионами и атомами металлов и свободно движущимися по кристаллу электронами.
Образование металлической связи
Простое вещество — металл существует в виде кристалла, имеющим металлическую кристаллическую решетку, в узлах которой находятся атомы или ионы металлов.
Валентные атомные орбитали каждого атома металла в кристалле перекрываются сразу с орбиталями нескольких близлежащих соседей, и число этих атомных орбиталей чрезвычайно велико. Поэтому число возникающих молекулярных орбиталей тоже велико.
Мы уже знаем, что число валентных электронов атомов металлов небольшое, к тому же они достаточно слабо связаны с собственными ядрами и могут легко отрываться. Поэтому электроны заполняют всю зону взаимодействующих орбиталей образуя металлическую связь. Т.о. в кристаллической решетке металла перемещение электронов происходит свободно.
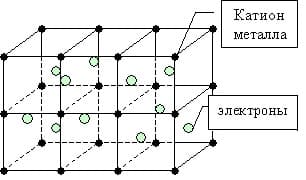
металлическая связь
Такие особенности, как тепло- и электропроводность металлов связано с существованием свободно движущихся электронов в кристаллической решетке.
Особенности металлической связи
Отличие металлической связи от ковалентной
- Несмотря на то, что металлическая связь как и ковалентная связь образована посредством обобществления электронов, однако в металлической связи электроны принадлежат всему множеству ионов/атомов металлов, а в ковалентной только двум атомам неметаллов.
- Важное отличие металлической связи от ковалентной – это то, что здесь не существует направленности связи, т.к. электроны по кристаллу распределены почти равномерно.
- Прочность металлической связи также отличается: ее энергия в 3-4 раза меньше энергии ковалентной связи.
Отличие металлической связи от ионной
В образовании как ионной связи, так и металлической принимают участие ионы — катионы. Однако ионная связь — это связь между катионами и анионами, а в металлической связи анионы отсутствуют, зато имеются электроны, свободно движущиеся между катионами/атомами металлов.
Прочность металлической связи
- Если рассмотреть щелочные металлы, то наиболее активный среди них – цезий, легче всего будет отдавать свои валентные электроны, а труднее всего – рубидий, наименее активный среди щелочных металлов.
Чем легче атом металла переходит в состояние иона, т.е. отдает электроны, тем менее прочна его решетка, вследствие отталкивания положительно заряженных ионов.
В связи с этим металл будет обладать пониженной температурой плавления и становится более мягким.
- Чем больше валентных электронов имеет атом металла, тем более прочна его кристаллическая решетка, и тем выше его температуры кипения и плавления
Ниже приведена зависимость температуры плавления металлов от их положения в периодической таблице и числа валентных электронов.

зависимость температуры плавления металлов от положения в периодической таблице и от числа валентных электронов
Металлическая химическая связь - характеристика, способы образования и свойства
Металлическая химическая связь характерна для металлов и их сплавов в кристаллическом состоянии. Образуется за счет обобществления валентных электронов. Для этого типа строения вещества не характерно образование направленных структурированных связей.
Следует отличать различные типы связи элементов кристаллов - металлическую, ионную и водородную, свойственную кристаллам льда.
Схема образования металлической связи на примерах
Механизм создания металлической связи предусматривает отрыв частично свободных электронов от атома с образованием катионов с положительным зарядом, формирующих “остов” кристаллической решетки и электронного облака. При этом металлический кристалл не приобретает положительного или отрицательного заряда.
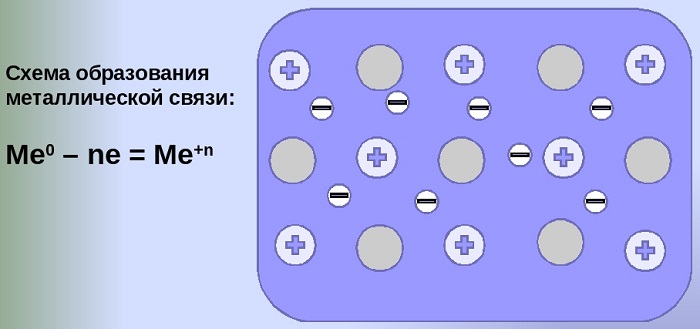
Общий случай формирования связывания металлических атомов в химии, соответствующий данному выше определению:
здесь n - число электронов, участвующих в образовании связи, как правило, от 1 до 3.
В левой части уравнения - атом металла, отдающий электроны, в правой - образовавшийся в результате ион.
Формула показывает, что в кристалле постоянно происходит присоединение и отдача электронов.
Схемы формирования связи на примере атомов различной валентности:
- K - e⁻ ⇆ K;
- Cu - 2e⁻ ⇆ Cu;
- Al - 3e⁻ ⇆ Al.
Отделяющиеся от атома электроны перемещаются на свободные валентные орбитали, которые обобществляются и позволяют всем электронам перемещаться в пределах кристалла. Отделение электронов выгодно атому с точки зрения энергетического баланса, так как позволяет сформировать электронно-стабильную оболочку.
Характерные кристаллические решетки
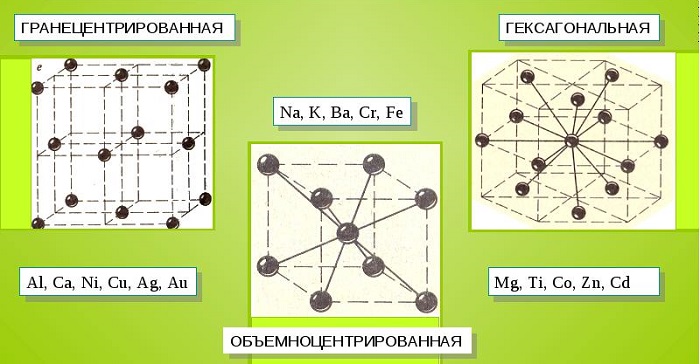
Металлические кристаллы подразделяются на 3 основных типа:
- Объемно-центрированную кубическую решетку, в которой, помимо размещения атомов в четырех вершинах куба, один из них размещается в центре объемной фигуры. Такой тип организации твердого вещества характерен для ряда металлов, включая K, Na и Li, вольфрам, хром, ниобий и др.
- Гранецентрированная кубическая решетка характеризуется расположением атомов в центре граней. Всего в ячейке задействовано 10 атомов, 4 в вершинах и 6 на гранях. Такая решетка встречается у меди, драгметаллов (серебра и золота) и металлов платиновой группы: Pd, Pt.
- Гексагональное строение решетки предполагает размещение атомов в углах и внутри 6-гранной призмы. Ячейка состоит из 15 атомов и свойственна магнию, кальцию, осмию, бериллию и ряду других металлических элементов.
Общими свойствами всех решеток являются высокая симметрия и плотная упаковка составляющих их атомов. Некоторые элементы периодической таблицы формируют уникальную структуру, например, элементарная ячейка In имеет тетрагональное строение.
Для сплавов, являющихся химическими соединениями, также характерно образование кристаллов перечисленных видов, при этом атомы каждого металла занимают определенное место в структуре.
Например, в сплаве никеля и алюминия атомы Al размещаются по углам, а атом Ni - в центре ОЦК ячейки. Свойства сплава и его структура влияют на класс прочности изделия, изготовленного из этого материала.
Физические свойства металлической связи
Физические характеристики металлических кристаллов обусловлены способностью обобществленных электронов свободно перемещаться внутри кристалла.

Характеристики, отличающие подобные вещества:
хорошая электропроводность, благодаря наличию условно свободного электронного облака;
высокая проводимость тепла;
низкая реакционная способность или инертность;
пластичность - большинство металлов можно гнуть и ковать.
Высокий уровень организации вещества обусловливает металлический блеск. Следует иметь в виду, что повышение прочности при пластической деформации и легировании приводит к образованию частично ковалентной связи.
При деформации могут возникать области повышенной прочности и низкими пластическими свойствами, похожие на вещества с ковалентной связью (например, алмаз).
Сходства и отличия металлической химической связи от ионной
Помимо рассматриваемой, металлы могут образовывать другие виды связи, включая простую ионную.
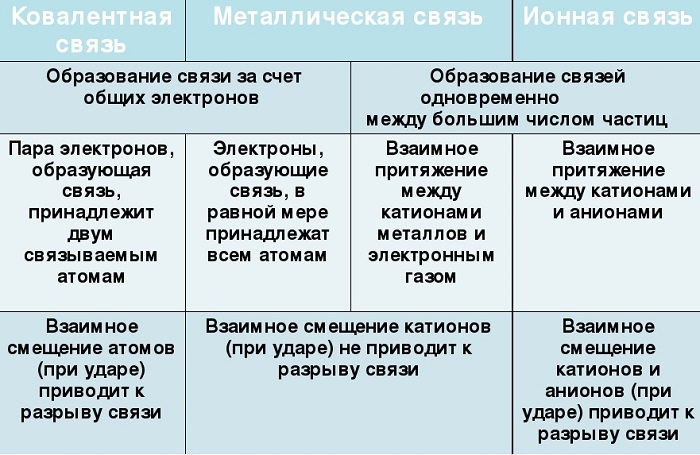
Их общие черты:
участие металлов, при этом металлическая связь формируется исключительно атомами металла, а ионная образуется между металлическим и неметаллическим элементами;
металл высвобождает электроны и становится катионом;
соединения могут существовать в кристаллической форме.
Кристаллы с ионным характером соединения отличают следующие параметры:
- В узлах размещаются как положительно, так и отрицательно заряженные ионы. Каркас металлической решетки формируют исключительно катионы.
- Узлы удерживаются за счет электростатического взаимодействия.
- При низких температурах кристаллические вещества, образованные за счет ионного взаимодействия, проявляют свойства диэлектриков (не проводят ток).
- Переход электронов с атома металла происходит на орбиты атома неметалла.
Характерный пример кристалла с ионной связью - поваренная соль, решетка которой сформирована из ионов Na⁺ и Cl⁻. Такие кристаллические вещества не обладают пластичностью и блеском.
Читайте также:
