Свойства нитридов металлов химические
Соединения азота с металлами чаще всего являются тугоплавкими и устойчивыми при высоких температурах веществами, например, эльбор. Нитридные покрытия придают изделиям твёрдость, коррозионную стойкость; находят применение в энергетике, космической технике.
Содержание
Строение
В зависимости от типа химической связи между атомами нитриды подразделяются на ионные, ковалентные и металлоподобные (ионно-ковалентно-металлические). Атомы азота в нитридах могут принимать электроны менее электроотрицательного элемента, при этом образуя стабильную электронную конфигурацию s 2 p 6 )или отдавать электрон партнеру с образованием устойчивой конфигурации sp 3 ). В первом случае нитриды характеризуются наличием ионной связи, во втором химическая связь является типично металлической. В обоих случаях присутствует также некоторая доля ковалентной составляющей. В соединениях азота с бором и кремнием преобладает ковалентный характер химической связи.
Ионная связь наблюдается а нитридах металлов I и II групп Периодической системы. Состав этих нитридов отвечает обычным валентным соотношениям. Эти нитриды подвергаются гидролизу с выделением аммиака, обладают высоким электрическим сопротивлением, у них наблюдаются полупроводниковые свойства).
Ковалентными нитридами являются нитриды бора, кремния, алюминия, галлия, индия. Ковалентные нитриды являются диэлектриками и полупроводниками с широкой запрещенной зоной.
Переходные металлы образуют нитриды с преимущественной металлической связью. Эти вещества обладают значительной твёрдостью и хрупкостью, высокой электропроводностью, высокими температурами плавления, большой энтальпией образования.
Получение
Нитриды ионного типа получаются при взаимодействии металлов с азотом при температурах 700—1200 °C. Другие нитриды можно получить взаимодействием металла с азотом или аммиаком или восстановлением оксидов, хлоридов металла углеродом в присутствии азота или аммиака при высоких температурах. Нитриды образуются также в плазме в дуговых, высокочастотных и сверхвысокочастотных плазмотронах. В последнем случае нитриды образуются как ультрадисперсные порошки с размером частиц 10-100 нм.
Химические свойства
Нитриды ионного типа легко разлагаются водой и кислотами, проявляя основные свойства:
Нагревание нитридов элементов V, VI и VIII групп приводит к их разложению с выделением азота, низших нитридов и твердых растворов азота в металлах. Нитриды бора, кремния, алюминия, индия, галлия и переходных металлов IV группы при нагревании в вакууме не разлагаются.
Окисление нитридов кислородом приводит к образованию оксидов металлов и азота. Взаимодействие нитридов с углеродом приводит к карбидам и карбонитридам.
Применение
Тугоплавкие нитриды применяют в качестве огнеупорных и температуростойких материалов, твёрдые - в производстве твердосплавного и абразивного инструмента, как изностостойкие, жаропрочные и жаростойкие материалы.
Ссылки
- Найти и оформить в виде сносок ссылки на авторитетные источники, подтверждающие написанное.
- Добавить иллюстрации.
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Нитриды" в других словарях:
НИТРИДЫ — хим. соединения азота главным образом с металлами и некоторыми неметаллами, напр. Н. кремния Si3N4, Н. бора BN, образующиеся при высоких температурах. Н. обладают важными для техники свойствами: высокие огнеупорность, термостойкость,… … Большая политехническая энциклопедия
Нитриды — [nitrides] химические соединения азота с металлами и некоторыми неметаллами. Обладают высокой твердостью, хрупкостью, тугоплавкостью, жаропрочностью. Нитриды служат для создания жаропрочных сплавов, применяемых в технике высоких температур, для… … Энциклопедический словарь по металлургии
НИТРИДЫ — соед. азота с металлами и более электроположительными, чем N, неметаллами. По типу хим. связи Н. делят на ионные, ковалентные и металлоподобные (ион но ковалентно металлические). Атомы азота в Н. могут принимать электроны партнера (образуется… … Химическая энциклопедия
нитриды — химические соединения азота с более электроположительными элементами. Нитриды алюминия, бора, кремния, вольфрама, титана (AlN, BN, Si3N4, W2N, TiN) и многие другие тугоплавкие, химически стойкие кристаллические вещества. Компоненты жаропрочных… … Энциклопедический словарь
нитриды — (нитр(о). гр. eidos вид) соединения азота с другими элементами, тугоплавкие, устойчивые при высоких температурах вещества, напр, боразон; нитридные покрытия придают изделиям твердость, коррозионную стойкость; н. примен. в энергетике,… … Словарь иностранных слов русского языка
Нитриды — соединения азота с более электроположительными элементами, главным образом с металлами. По строению и свойствам Н. подразделяются на три группы: 1) солеобразные Н. металлов I и II групп периодической системы Менделеева, легко… … Большая советская энциклопедия
НИТРИДЫ — химические соединения азота с металлами и некоторыми неметаллами. Обладают высокой твердостью, хрупкостью, тугоплавкостью, жаропрочностью. Нитриды служат для создания жаропрочных сплавов, применяемых в технике высоких температур, для абразивных… … Металлургический словарь
Нитриды рения — Нитриды рения неорганические соединения металла рения и азота, серые кристаллы. Получение Действием аммиака при 300 350°С на перренат аммония или хлорид рения(III) образуются нитриды рения переменного состава от Re2N и до Re3N. Физические… … Википедия
Нитриды кобальта — Нитриды кобальта неорганические соединения металла кобальта и азота, чёрные или серые кристаллы. Свойства нитридов кобальта Состав Мол. масса Свойства Получение Co4N 249,74 чёрно серые кубические кристаллы Co3N 190,81 серые гексагональные… … Википедия
Нитриды никеля — Нитриды никеля неорганические соединения металла никеля и азота, парамагнитные чёрные кристаллы. Свойства нитридов никеля Состав Мол. масса Свойства Получение Ni4N 248,78 ферромагнитные кристаллы, превращается в Ni3N при нагревании до 190°С … Википедия
НИТРИДЫ
НИТРИДЫ, соед. азота с металлами и более электроположительными, чем N, неметаллами. По типу хим. связи нитриды делят на ионные, ковалентные и металлоподобные (ион-но-ковалентно-металлические). Атомы азота в нитридах могут принимать электроны партнера (образуется стабильная электронная конфигурация s 2 p 6 )или отдавать электрон партнеру (стабильная конфигурация sp 3 ). В первом случае соед. обладают четко выраженной ионной связью, во втором-типично металлич., причем в обоих случаях им сопутствует определенная доля ковалентной составляющей. Ковалентная связь является основной в соединениях азота с бором и кремнием.
Н итриды с преим. ионной связью образуют металлы I и II гр. периодич. системы (табл. 1), атомы к-рых имеют внеш. s-электроны. Эти нитриды имеют составы, отвечающие обычным валентным соотношениям, что обусловливает их ионный характер (они подвергаются гидролизу с выделением NH 3 , обладают высоким электрич. сопротивлением, проявляют полупроводниковые св-ва).
К ковалентным нитридам относят бора нитрид, кремния нитрид, а также алюминия нитрид, нитриды галлия (см. Галлий)и индия (InN, кристаллич. решетка гексагональная, т. пл. 1200°С, DH 0 обp —17,2 кДж/моль). Ковалентные нитриды-диэлектрики; полупроводники с широкой запрещенной зоной.
Табл.1.- СВОЙСТВА ИОННЫХ НИТРИДОВ

Н итриды с преим. металлической связью образуют переходные металлы. Эти соед. характеризуются широкими областями гомогенности, высокой электрич. проводимостью и ее положительным температурным коэф., высокими т-рами плавления, твердостью, высокой энтальпией образования (табл. 2).
Табл. 2.-СВОЙСТВА МЕТАЛЛОПОДОБНЫХ НИТРИДОВ
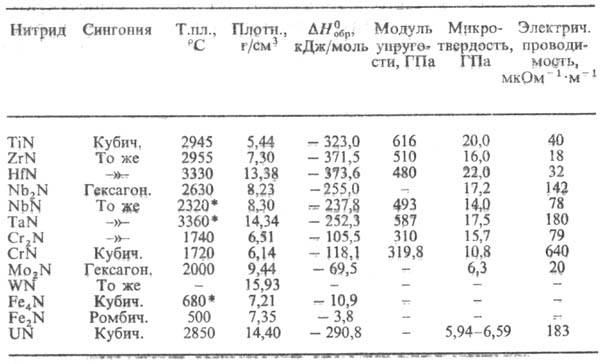
Мех. св-ва нитридов зависят от прочности хим. связи, степени ее ковалентности, а также от структуры (величины зерен, состояния границ зерен, степени дефектности кристаллич. решетки). Большинство нитридов очень твердые и хрупкие в-ва, их пластич. деформация возможна только при высоких т-рах и напряжениях.
При нагр. на воздухе и в среде О 2 нитриды разрушаются с образованием оксидов и выделением в осн. N 2 . Нитриды бора, Si, Al, In, Ga и переходных металлов IV гр. устойчивы при нагр. в вакууме, нитриды элементов V, VI и VIII гр. разлагаются с выделением N 2 и последоват. образованием низших нитридов и твердых р-ров азота в металлах. С углеродом нитриды взаимод. с образованием карбидов, а также твердых р-ров нитридов и карбидов-к а р б о н и т р и д о в. Нитриды металлов I и II гр. легко гидролизуются, разлагаются минер. к-тами и р-рами щелочей. нитриды переходных металлов, Al, In, Ga, а также В и Si устойчивы к действию большинства к-т и щелочей, не взаимод. с водой.
Получают нитриды, из элементов при высоких т-рах в атмосфере N 2 или NH 3 , а также восстановлением оксидов и гало-генидов металлов в присут. азота. Синтез из элементов может осуществляться Э режиме горения, т. к. в результате р-ции выделяется большое кол-во тепла, либо в плазме в дуговых, высокочастотных и сверхвысокочастотныя плаз-мотронах. В результате быстрого охлаждения из парогазо-вой смеси плазменным методом получают ультрадисперсные порошки нитридов с размером частиц 10-100 нм.
Восстановление оксидов в присут. азота с образованием нитридов происходит по схеме:
Чаще всего восстановителем является углерод. Однако при восстановлении оксидов карбидообразующих металлов конечный продукт р-ции может представлять собой не чистый нитрид, а карбонитрид. Нитриды получают также восстановлением газообразных галогенидов металлов аммиаком или смесью N 2 и Н 2 по р-циям типа:
Эти р-ции проходят обычно при т-рах выше 800 °С. Осаждение нитридов из газовой фазы используют обычно для получения покрытий- Получают нитриды также термич. разложением аммиакатов галогенидов металлов.
Компактные изделия из порошков нитридов получают спеканием предварительно спрессованных порошков, горячим прессованием, реакц. спеканием. Спекание заготовок, спрессованных из порошков нитридов, может осуществляться в среде N 2 , азотсодержащих восстановит. газов или в вакууме. Горячим прессованием получают изделия с меньшей остаточной пористостью, чем при спекании. Однако применяемые при горячем прессовании графитовые прессформы служат источником загрязнения нитридов углеродом. Реакц. спекание совмещение процессов образования нитридов и их спекания - интенсифицирует уплотнение изделий по сравнению с обычным спеканием предварительно спрессованных заготовок из порошков заранее полученных нитридов. Уд. объем образующейся фазы нитрида больше уд. объема исходного металла, что приводит к снижению пористости.
Области применения нитридов весьма разнообразны. Наиб. развито использование огнеупорных св-в нек-рых ковалентных нитридов-BN, SiN, AlN, а также их сложных соед. и разл. материалов на их основе. Нитриды используют для футеровки, изготовления огнеупорных тиглей, муфелей, чехлов термопар, крепления транзисторов, цоколей электронных ламп, устройств ядерной техники, высокотемпературной смазки, в произ-ве твердосплавного и абразивного инструмента и др. Металлоподобные нитриды переходных металлов - компоненты твердых сплавов, их используют при произ-ве огнеупорных тиглей, лодочек для испарения Аl, в качестве износостойких покрытий на твердосплавном режущем инструменте, для поверхностного упрочнения деталей машин и механизмов. Нитриды входят в состав жаропрочных и жаростойких композиц. материалов, в т.ч. керметов.
Лит.: Самсонов Г. В., Нитриды, К., 1969; Тот Л., Карбиды и нитриды переходных металлов, пер. с англ., М., 1974; Самсонов Г. В., Винницкий И. М., Тугоплавкие соединения. Справочник, 2 изд., М., 1976; Бол-гap А. С., Литвиненко В.Ф., Термодинамические свойства нитридов, К., 1980; Свойства, получение и применение тугоплавких соединений. Справочник, под ред. Т. Я. Косолаповой, М., 1986. Ю. В. Левинский.
Глава 4. Свойства соединений азота в отрицательных степенях окисления: нитриды, гидразин, гидроксиламин
1) Нитриды - соединения азота с менее электроотрицательными элементами, например, с металлами и с рядом неметаллов.
Известны несколько методов получения нитридов.
1) Метод синтеза из простых веществ. При высоких температурах азот окисляет
многие металлы и неметаллы, образуя нитриды, в которых проявляет степень
Из ковалентных нитридов наибольшее значение имеет нитрид водорода H3N
(аммиак), получаемый в промышленности синтезом из простых веществ:
Основная масса производимого аммиака используется для получения азотной кислоты.
2) Метод восстановления из оксидов в присутствии азота. В качестве восстановителя в этих процессах используют не только углерод, но и металлы или их гидриды:
3) Метод термической диссоциации. Этот метод осуществляется с применением соединений, содержащих одновременно и металл и азот, например аминохлоридов:
Таким способом получают нитриды AlN, VN, NbN, Ta3N5, CrN, U3N, Fe2 N.
4) Метод осаждения нитридов из газовой фазы. Примером этого метода может служить взаимодействие хлоридов и оксихлоридов металлов с аммиаком. Эти реакции происходят обычно при температурах порядка 800oC
Химические свойства нитридов
Свойства нитридов более или менее закономерно изменяются по периодам и группам периодической системы. Например, в малых периодах наблюдается переход от основных нитридов к кислотным:
основные амфотерный кислотные
Нитриды s-элементов первой и второй групп, например Na3N, Mn3N2, являются кристаллическими веществами. Химически они довольно активны.
Например, легко разлагаются водой, образуя щелочь и аммиак:
Кислотные нитриды, напримерCl3N, гидролизуются с образованием кислот и аммиака:
Основные нитриды взаимодействуют с кислотами:
При этом кислотные нитриды склонны к взаимодействию со щелочами:
Амфотерные нитриды, в частности AlN, могут реагировать как с кислотами, так и со щелочами:
Основные и кислотные нитриды вступают в реакции комплексообразования с образованием смешанных нитридов, например Li5TiN3 , Li5GeN3 и другие
Нитриды щелочных металлов – малоустойчивые соединения. При обычной температуре с кислородом воздуха они не взаимодействуют. При температурах плавления начинают разлагаться на элементы.
Все ковалентные нитриды довольно устойчивы. Особенно устойчивы нитриды алюминия, бора и кремния, которые начинают слабо разлагаться на элементы только при температурах 1000-1200оC. Они обладают высокой стойкостью против окисления, против действия расплавленных металлов, горячих кислот, различных агрессивных газов.
Металлоподобные нитриды обладают высокой химической стойкостью, особенно против действия холодных и кипящих кислот, многих расплавленных металлов, а также против окисления на воздухе. В растворах щелочей металлоподобные нитриды менее устойчивы. Они быстро разлагаются при сплавлении со щелочами и солями щелочных металлов.
Гидразин
Гидразин (NH2NH2) – это сильно гигроскопическая жидкость, обладающая заметной способностью поглощать из воздуха углекислоту и кислород. Замерзает гидразин при температуре плюс 1,5°, кипит при температуре 113,5° (давление 760 мм рт. ст.). Удельный вес вещества колеблется в зависимости от его агрегатного состояния и температуры окружающей среды. При температуре минус 5° плотность твердого гидразина составляет 1,146, жидкого при температуре 0°-1,0253, а при температуре +15°-1,0114. По мере дальнейшего возрастания температуры удельный вес соединения уменьшается. Гидразин хорошо растворяется в воде, спиртах, аммиаке, аминах. Он нерастворим в углеводородах и их галоидопроизводных. Водные растворы обладают основными свойствами. Гидразин является сильным восстановителем. Благодаря этому он термодинамически неустойчив и легко разлагается под влиянием катализаторов, при нагревании до высоких температур, при действии излучений. На воздухе горит синим пламенем. При этом выделяется значительное количество энергии.
В промышленности гидразин получают по методу Рашига, первая стадия которого состоит в действии хлора на аммиак, в результате чего образуется непрочный хлорамин:
Хлорамин далее взаимодействует с избытком аммиака в щелочной среде по уравнению
Химические свойства гидразина определяются, во-первых, тем, что его молекула состоит из двух аминогрупп, обладающих слабо основными свойствами. В соответствии с этим гидразин как слабое основание может реагировать как с одной, так и с двумя молекулами одноосновной кислоты, например соляной:
Его реакция с серной кислотой приводит к гидразин-сульфату( N2H6SO4) который, как всякая соль, является твердым веществом, хорошо растворимым в воде. Гидразин-сульфат под названием "Сигразин" нашел применение в медицине при лечении больных раком. Онкологические больные обычно испытывают сильное истощение, быструю потерю веса и аппетита. Эти явления вызываются нарушениями углеводного обмена.
Другая особенность гидразина - его сильнейшие восстановительные свойства, что вызвано как присутствием в его молекуле непрочной связи азот-азот, так и аномальной степенью окисления атомов азота (-2). В качестве примера восстановительных свойств гидразина можно привести его реакцию с перманганатом калия, которую можно использовать для аналитического определения гидразина, как и реакции с некоторыми другими окислителями:
Гидразин сгорает на воздухе, причем эта реакция сильно экзотермична и приводит к образованию газообразных продуктов:
Гидроксиламин
В молекуле гидроксиламина атом азота имеет непоселенную пару электронов. Поэтому, подобно аммиаку и гидразину, он способен к реакциям присоединения с образованием связен по донорно-акцепторному способу. Гидроксиламин хорошо растворяется в воде, а с кислотами дает соли, например хлорид гидроксиламмония . Степень окислениости азота в гидроксила мине равна -1. Поэтому он проявляет как восстановительные, так и окислительные свойства. Однако более характерна восстановительная способность гидроксиламина. В частности, он применяется как восстановитель (главным образом в виде солей) в лабораторной практике.
В водном растворе диссоциирует по основному типу, являясь слабым основанием:
Может также диссоциировать и по кислотному типу
Подобно NH3, гидроксиламин реагирует с кислотами, образуя соли гидроксиламиния:
На воздухе соединение является нестабильным:
но при давлении в 3 кПа (2,25 мм рт.ст.) плавится при 32 °С и кипит при 57 °С без разложения.
На воздухе легко окисляется кислородом воздуха:
Гидроксиламин проявляет свойства восстановителя, при действии на него окислителей выделяются N2 или N2O:
В некоторых реакциях NH2OH проявляются окислительные свойства, при этом он восстанавливается до NH3 или NH4 +
В лаборатории получают разложением в вакууме солей гидроксиламина: (NH3OH)3PO4 или [Mg(NH2OH)6](ClO4)2.
Спиртовой раствор гидроксиламина можно получить действием этанола на NH3OHCl.
В промышленности соли гидроксиламина получают восстановлением NO водородом в присутствии платинового катализатора или гидрированием азотной кислоты, а также действием на азотную кислоту атомарным водородом:
соед. азота с металлами и более электроположительными, чем N, неметаллами. По типу хим. связи Н. делят на ионные, ковалентные и металлоподобные (ион-но-ковалентно-металлические). Атомы азота в Н. могут принимать электроны партнера (образуется стабильная электронная конфигурация s 2 p 6 )или отдавать электрон партнеру (стабильная конфигурация sp 3 ). В первом случае соед. обладают четко выраженной ионной связью, во втором-типично металлич., причем в обоих случаях им сопутствует определенная доля ковалентной составляющей. Ковалентная связь является основной в соединениях азота с бором и кремнием.
Н. с преим. ионной связью образуют металлы I и II гр. периодич. системы (табл. 1), атомы к-рых имеют внеш. s- электроны. Эти Н. имеют составы, отвечающие обычным валентным соотношениям, что обусловливает их ионный характер (они подвергаются гидролизу с выделением NH 3 , обладают высоким электрич. сопротивлением, проявляют полупроводниковые св-ва).
К ковалентным Н. относят бора нитрид, кремния нитрид, а также алюминия нитрид, Н. галлия (см. Галлий )и индия (InN, кристаллич. решетка гексагональная, т. пл. 1200°С, DH 0 обp Ч17,2 кДж/моль). Ковалентные Н.-диэлектрики; полупроводники с широкой запрещенной зоной.
Табл.1.- СВОЙСТВА ИОННЫХ НИТРИДОВ

Н. с преим. металлической связью образуют переходные металлы. Эти соед. характеризуются широкими областями гомогенности, высокой электрич. проводимостью и ее положительным температурным коэф., высокими т-рами плавления, твердостью, высокой энтальпией образования (табл. 2).
Табл. 2.-СВОЙСТВА МЕТАЛЛОПОДОБНЫХ НИТРИДОВ
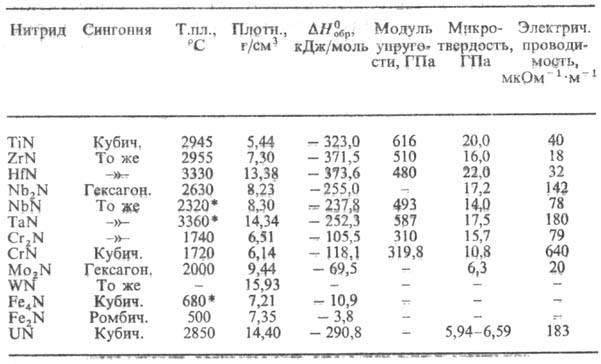
Мех. св-ва Н. зависят от прочности хим. связи, степени ее ковалентности, а также от структуры (величины зерен, состояния границ зерен, степени дефектности кристаллич. решетки). Большинство Н. очень твердые и хрупкие в-ва, их пластич. деформация возможна только при высоких т-рах и напряжениях.
При нагр. на воздухе и в среде О 2 Н. разрушаются с образованием оксидов и выделением в осн. N 2 . H. бора, Si, Al, In, Ga и переходных металлов IV гр. устойчивы при нагр. в вакууме, Н. элементов V, VI и VIII гр. разлагаются с выделением N 2 и последоват. образованием низших нитридов и твердых р-ров азота в металлах. С углеродом Н. взаимод. с образованием карбидов, а также твердых р-ров Н. и карбидов-к а р б о н и т р и д о в. Н. металлов I и II гр. легко гидролизуются, разлагаются минер. к-тами и р-рами щелочей. Н. переходных металлов, Al, In, Ga, а также В и Si устойчивы к действию большинства к-т и щелочей, не взаимод. с водой.
Получают H,из элементов при высоких т-рах в атмосфере N 2 или NH 3 , а также восстановлением оксидов и гало-генидов металлов в присут. азота. Синтез из элементов может осуществляться Э режиме горения, т. к. в результате р-ции выделяется большое кол-во тепла, либо в плазме в дуговых, высокочастотных и сверхвысокочастотныя плаз-мотронах. В результате быстрого охлаждения из парогазо-вой смеси плазменным методом получают ультрадисперсные порошки Н. с размером частиц 10-100 нм.
М'-металл-восстановитель, Х-неметаллич. восстановитель (углерод, кремний, бор и т. д.).
Чаще всего восстановителем является углерод. Однако при восстановлении оксидов карбидообразующих металлов конечный продукт р-ции может представлять собой не чистый Н., а карбонитрид. Н. получают также восстановлением газообразных галогенидов металлов аммиаком или смесью N 2 и Н 2 по р-циям типа:
Эти р-ции проходят обычно при т-рах выше 800 °С. Осаждение Н. из газовой фазы используют обычно для получения покрытий- Получают Н. также термич. разложением аммиакатов галогенидов металлов.
Компактные изделия из порошков Н. получают спеканием предварительно спрессованных порошков, горячим прессованием, реакц. спеканием. Спекание заготовок, спрессованных из порошков Н., может осуществляться в среде N 2 , азотсодержащих восстановит. газов или в вакууме. Горячим прессованием получают изделия с меньшей остаточной пористостью, чем при спекании. Однако применяемые при горячем прессовании графитовые прессформы служат источником загрязнения Н. углеродом. Реакц. спекание совмещение процессов образования Н. и их спекания - интенсифицирует уплотнение изделий по сравнению с обычным спеканием предварительно спрессованных заготовок из порошков заранее полученных Н. Уд. объем образующейся фазы Н. больше уд. объема исходного металла, что приводит к снижению пористости.
Области применения Н. весьма разнообразны. Наиб. развито использование огнеупорных св-в нек-рых ковалентных H.-BN, SiN, AlN, а также их сложных соед. и разл. материалов на их основе. Н. используют для футеровки, изготовления огнеупорных тиглей, муфелей, чехлов термопар, крепления транзисторов, цоколей электронных ламп, устройств ядерной техники, высокотемпературной смазки, в произ-ве твердосплавного и абразивного инструмента и др. Металлоподобные Н. переходных металлов - компоненты твердых сплавов, их используют при произ-ве огнеупорных тиглей, лодочек для испарения Аl, в качестве износостойких покрытий на твердосплавном режущем инструменте, для поверхностного упрочнения деталей машин и механизмов. Н. входят в состав жаропрочных и жаростойких композиц. материалов, в т. ч. керметов.
См. также Плутония нитрид, Титана нитрид, Урана нитриды.
Лит.: Самсонов Г. В., Нитриды, К., 1969; Тот Л., Карбиды и нитриды переходных металлов, пер. с англ., М., 1974; Самсонов Г. В., Винницкий И. М., Тугоплавкие соединения. Справочник, 2 изд., М., 1976; Бол-гap А. С., Литвиненко В. Ф., Термодинамические свойства нитридов, К., 1980; Свойства, получение и применение тугоплавких соединений. Справочник, под ред. Т. Я. Косолаповой, М., 1986. Ю. В. Левинский.
Химическая энциклопедия. — М.: Советская энциклопедия . Под ред. И. Л. Кнунянца . 1988 .
Аммиак: получение и свойства
В молекуле аммиака NH3 атом азота соединен тремя одинарными ковалентными полярными связями с атомами водорода:

Геометрическая форма молекулы аммиака — правильная треугольная пирамида. Валентный угол H-N-H составляет 107,3 о :

У атома азота в аммиаке на внешнем энергетическом уровне остается одна неподеленная электронная пара. Эта электронная пара оказывает значительное влиение на свойства аммиака, а также на его структуру. Электронная структура аммиака — тетраэдр , с атомом азота в центре:

Аммиак – бесцветный газ с резким характерным запахом. Ядовит. Весит меньше воздуха. Связь N-H — сильно полярная, поэтому между молекулами аммиака в жидкой фазе возникают водородные связи. При этом аммиак очень хорошо растворим в воде, т.к. молекулы аммиака образуют водородные связи с молекулами воды.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например , аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например , гидролиз нитрида кальция:
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непровзаимодействовавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Химические свойства аммиака
1. В водном растворе аммиак проявляет основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион аммония. Реакция может протекать и в водном растворе, и в газовой фазе:

Таким образом, среда водного раствора аммиака – щелочная. Однако аммиак – слабое основание . При 20 градусах один объем воды поглощает до 700 объемов аммиака.
Видеоопыт растворения аммиака в воде можно посмотреть здесь.
2. Как основание, аммиак взаимодействует с кислотами в растворе и в газовой фазе с образованием солей аммония.
Например , аммиак реагирует с серной кислотой с образованием либо кислой соли – гидросульфата аммония (при избытке кислоты), либо средней соли – сульфата аммония (при избытке аммиака):
Еще один пример : аммиак взаимодействует с водным раствором углекислого газа с образованием карбонатов или гидрокарбонатов аммония:
Видеоопыт взаимодействия аммиака с концентрированными кислотами – азотной, серной и и соляной можно посмотреть здесь.
В газовой фазе аммиак реагирует с летучим хлороводородом. При этом образуется густой белый дым – это выделяется хлорид аммония.
NH3 + HCl → NH4Cl
Видеоопыт взаимодействия аммиака с хлороводородом в газовой фазе (дым без огня) можно посмотреть здесь.
3. В качестве основания, водный раствор аммиака реагирует с растворами солей тяжелых металлов , образуя нерастворимые гидроксиды.
Например , водный раствор аммиака реагирует с сульфатом железа (II) с образованием сульфата аммония и гидроксида железа (II):
4. Соли и гидроксиды меди, никеля, серебра растворяются в избытке аммиака, образуя комплексные соединения – аминокомплексы.
Например , хлорид меди (II) реагирует с избытком аммиака с образованием хлорида тетрамминомеди (II):
Гидроксид меди (II) растворяется в избытке аммиака:
5. Аммиак горит на воздухе , образуя азот и воду:
Если реакцию проводить в присутствии катализатора (Pt), то азот окисляется до NO:
6. За счет атомов водорода в степени окисления +1 аммиак может выступать в роли окислителя , например в реакциях с щелочными, щелочноземельными металлами, магнием и алюминием . С металлами реагирует только жидкий аммиак.
Например , жидкий аммиак реагирует с натрием с образованием амида натрия:
Также возможно образование Na2NH, Na3N.
При взаимодействии аммиака с алюминием образуется нитрид алюминия:
2NH3 + 2Al → 2AlN + 3H2
7. За счет азота в степени окисления -3 аммиак проявляет восстановительные свойства. Может взаимодействовать с сильными окислителями — хлором, бромом, пероксидом водорода, пероксидами и оксидами некоторых металлов. При этом азот окисляется, как правило, до простого вещества.
Например , аммиак окисляется хлором до молекулярного азота:
Пероксид водорода также окисляет аммиак до азота:
Оксиды металлов , которые в электрохимическом ряду напряжений металлов расположены справа — сильные окислители. Поэтому они также окисляют аммиак до азота.
Например , оксид меди (II) окисляет аммиак:
2NH3 + 3CuO → 3Cu + N2 + 3H2O
Читайте также:
