Сложные вещества состоящие из ионов металла и кислотного остатка
Основания -Сложные вещества состоящие из ионов металлов и связанных с ним гидроксид ионов . Например Са (ОН) 2
Кислоты - это сложные вещества, молекулы которых состоят из атомов водород и кислотных остатков. Например Н2SO4
Оксиды - сложные вещества, состоящие из 2 элементов один из которых кислород со степенью окисления -2
Пример - Н2О, Nа2О
Щелочи растворенные в воде основания начинаются С 1А-2А группы
Например НаОН
Соли - это сложные вещества, состоящие из ионов металла и кислотного остатка
Например СаCl2
4 Нравится Комментировать Пожаловаться
Валерия Гусева Ученик (109) 8 часов назад
Вот тебе такой совет от меня. Найди в YouTube плейлист "8 класс химия полный курс ( от Вурдихана Вурдиханова) и найди эту тему. Он реально очень хорошо объясняет, я считаю. Да и видео достаточно короткие, но очень информативные. Сама пользуюсь время от времени.
1 Нравится Комментировать Пожаловаться
Елена Дмитриева Гуру (4863) 7 часов назад
А в учебниках про это не пишут?
Нравится Комментировать Пожаловаться
Роман Попов Ученик (109) 6 часов назад
чяго чяго*
Нравится Комментировать Пожаловаться
Лиолле Романова Ученик (164) 34 минуты назад
кислоты - это сложные вещества, состоящие из атомов водорода (стоящих на первом месте) и кислотного остатка. Пример: HNO3
Основания (гидроксиды) - это сложные вещества, состоящие из атомов металлов (стоящих на первом месте) и гидроксогруппы ОН. пример: NaOH
Оксиды - это сложные вещества, состоящие из двух видов атомов, одним из которых является кислород. Пример : H2O, Al2O3
Щелочи- растворимые в воде основания. Пример: KOH
Нравится Комментировать Пожаловаться
Введите текст ответа
ФотоВидеоИсточник:
Символов: 3800
Ответить
Нажимая на кнопку, вы принимаете условия пользовательского соглашения
ПОХОЖИЕ ВОПРОСЫ
что лишнее : оксид, соль, щелочь, кислота? Почему? Почему?
Юрий Назаров в «Образование», 6 лет назад• 3 ответа
Как реагируют Щелочи с кислотными оксидами? Напишите, если не.
Наталья Сенопальникова в «Домашние задания», 1 год назад• 1 ответ
1) Оксид, который реагирует с соляной кислотой, но не.
Александраsahsa Попова в «Образование», 4 года назад• 1 ответ
характерные химические свойства карбонатов: реакции с солями.
Ekaterina в «Образование», 3 года назад• 1 ответ
помогите найти химические свойства солей оксидов кислот и щелочи.
efs dsfdf в «Естественные науки», 2 года назад• 3 ответа

Основания -Сложные вещества состоящие из ионов металлов и связанных с ним гидроксид ионов . Например Са (ОН) 2
Кислоты - это сложные вещества, молекулы которых состоят из атомов водород и кислотных остатков. Например Н2SO4
Оксиды - сложные вещества, состоящие из 2 элементов один из которых кислород со степенью окисления -2
Пример - Н2О, Nа2О
Щелочи растворенные в воде основания начинаются С 1А-2А группы
Например НаОН
Соли - это сложные вещества, состоящие из ионов металла и кислотного остатка
Например СаCl2
Вот тебе такой совет от меня. Найди в YouTube плейлист "8 класс химия полный курс ( от Вурдихана Вурдиханова) и найди эту тему. Он реально очень хорошо объясняет, я считаю. Да и видео достаточно короткие, но очень информативные. Сама пользуюсь время от времени.
кислоты - это сложные вещества, состоящие из атомов водорода (стоящих на первом месте) и кислотного остатка. Пример: HNO3
Основания (гидроксиды) - это сложные вещества, состоящие из атомов металлов (стоящих на первом месте) и гидроксогруппы ОН. пример: NaOH
Оксиды - это сложные вещества, состоящие из двух видов атомов, одним из которых является кислород. Пример : H2O, Al2O3
Щелочи- растворимые в воде основания. Пример: KOH
Сложные вещества состоящие из ионов металла и кислотного остатка
`"KNO"_2` - нитрит калия
`"KClO"_4` - перхлорат калия
Способы получения средних солей
Соли тесно связаны со всеми остальными классами неорганических соединений и могут быть получены практически из любого класса. Большинство способов получения солей было разобрано выше.
Способы получения кислых и основных солей
Кислые соли могут быть получены либо неполной нейтрализацией кислот, либо действием избытка кислот на средние соли, щелочи, оксиды или соли:
`"NaOH" + "H"_2"SO"_4 -> "NaHSO"_4 + "H"_2"O"`;
`"Na"_2"SO"_4 + "H"_2"SO"_4 -> 2"NaHSO"_4`;
`"NaCl" + "H"_2"SO"_4 -> "NaHSO"_4 + "HCl"`;
`"CaCO"_3 + "CO"_2 + "H"_2"O" -> "Ca(HCO"_3)_2`.
Основные соли часто получаются при осторожном добавлении небольших количеств щелочей к растворам средних солей металлов, имеющих малорастворимые основания, или при действии солей слабых кислот на средние соли:
`"AlCl"_3 + 2"NaOH" -> "Al(OH)"_2"Cl" + 2"NaCl"`;
В общем виде способы получения кислых или основных солей из средних солей представим в виде следующей схемы:
Химические свойства солей
Многие соли устойчивы при нагревании. Однако соли аммония, а также некоторые соли малоактивных металлов, слабых кислот и кислот, в которых элементы проявляют высшие или низшие степени окисления, при нагревании разлагаются (также см. получение оксидов).
Взаимодействие растворов или расплавов солей менее активных металлов с более активными металлами:
`"Cu" + 2"AgNO"_3 -> 2"Ag"darr + "Cu(NO"_3)_2`.
Взаимодействие соли с кислотой, в результате которого образуется нерастворимое или летучее вещество:
`"AgNO"_3 + "HBr" → "AgBr"↓ + "HNO"_3`;
`"FeS" + 2"HCl" → "H"_2"S"↑ + "FeCl"_2`.
Взаимодействие раствора соли со щелочью, в результате которого образуется нерастворимое вещество:
`"CuCl"_2 + "KOH" → "Cu(OH)"_2 ↓+ 2"KCl"`;
`"Na"_2"CO"_3 + "Ca(OH)"_2 → "CaCO"_3↓ + 2"NaOH"`.
Взаимодействие растворов солей друг с другом, в результате которого образуется нерастворимое вещество:
`"Na"_2"CO"_3 + "Ba(NO"_3)_2 → "BaCO"_3 ↓+ 2"NaNO"_3`.
`2"FeCl"_2 + "Cl"_2 → 2"FeCl"_3`;
`2"NaNO"_2 + "O"_2 → 2"NaNO"_3`;
`"Na"_2"SO"_3 + "H"_2"O" + "Cl"_2 → "Na"_2"SO"_4 + 2"HCl"`.
Гидролиз некоторых солей:
При нагревании многие кислые соли разлагаются:
называется связь между веществами разных классов соединений, основанная на их взаимных превращениях и отражающая единство их происхождения.
Генетическая связь может быть отражена в генетических рядах.
Генетический ряд состоит из веществ, которые образованы одним химическим элементом, принадлежат к разным классам соединений и связаны взаимными превращениями.
В приведённой ниже таблице обобщены рассмотренные выше химические свойства важнейших классов неорганических соединений.
Химические свойства солей

Впервые школьники знакомятся с химическими свойствами солей в 8 классе, и для понимания дальнейшего материала без этой темы никуда. Наша статья поможет освежить знания перед контрольной или экзаменом: вспомним, какие бывают соли и как они образуются, рассмотрим типичные реакции с ними.
О чем эта статья:
Соли — это сложные вещества, в состав которых входят катионы металла и анионы кислотного остатка. Иногда в состав солей входят водород или гидроксид-ион.
Классификация и номенклатура солей
Так как соли — это продукт полного или частичного замещения металлом атома водорода в кислоте, по составу их можно классифицировать следующим образом.
Кислые соли
Образованы неполным замещением атомов водорода на металл в кислоте.
В наименованиях кислых солей указывают количество водорода приставками «гидро-» или «дигидро-», название кислотного остатка и название металла. Если металл имеет переменную валентность, то в скобках указывают валентность.
Примеры кислых солей и их наименования:
LiHCO3 — гидрокарбонат лития,
NaHSO4 — гидросульфат натрия,
NaH2PO4 — дигидрофосфат натрия.
Средние соли
Образованы полным замещением атомов водорода в кислоте на металл.
Наименования средних солей складываются из названий кислотного остатка и металла. При необходимости указывают валентность.
Примеры средних солей с названиями:
CuSO4 — сульфат меди (II),
CaCl2 — хлорид кальция.
Основные соли
Продукт неполного замещения гидроксогрупп на кислотный остаток.
В наименованиях основных солей указывают количество гидроксид-ионов приставкой «гидроксо-» или «дигидроксо-», название кислотного остатка и название металла с указанием валентности.
Пример: Mg(OH)Cl — гидроксохлорид магния.
Двойные соли
В состав входят два разных металла и один кислотный остаток.
Наименование складывается из названия аниона кислотного остатка и названий металлов с указанием валентности (если металл имеет переменную валентность).
Примеры двойных солей и их наименования:
KNaSO4 — сульфат калия-натрия,
Смешанные соли
Содержат один металл и два разных кислотных остатка.
Наименования смешанных солей складываются из названия кислотных остатков (по усложнению) и названия металла с указанием валентности (при необходимости).
Примеры смешанных солей с наименованиями:
CaClOCl — хлорид-гиполхорит кальция,
PbFCl — фторид-хлорид свинца (II).
Комплексные соли
Образованы комплексным катионом или анионом, связанным с несколькими лигандами.
Называют комплексные соли по схеме: координационное число + лиганд с окончанием «-о» + комплексообразователь с окончанием «-ат» и указанием валентности + внешняя сфера, простой ион в родительном падеже.
Пример: K[Al(OH)4] — тетрагидроксоалюминат калия.
Гидратные соли
В состав входит молекула кристаллизационной воды.
Число молекул воды указывают численной приставкой к слову «гидрат» и добавляют название соли.
Пример: СuSO4∙5H2O — пентагидрат сульфата меди (II).
Получение солей
Получение средних солей
Средние соли можно образовать в ходе следующих реакций:
Так получают только соли бескислородных кислот.
Металл, стоящий левее H2 в ряду активности, с раствором кислоты:
Mg + 2HCl = MgCl2 + H2
Металл с раствором соли менее активного металла:
Основный оксид + кислотный оксид:
Основный оксид и кислота:
Основание с кислотным оксидом:
Основание с кислотой (реакция нейтрализации):
Взаимодействие соли с кислотой:
Взаимодействие возможно, если одним из продуктов реакции будет нерастворимая соль, вода или газ.
Реакция раствора основания с раствором соли:
Взаимодействие растворов двух солей с образованием новых солей:
Получение кислых солей
Кислые соли образуются при взаимодействии:
Кислот с металлами:
Кислот с оксидами металлов:
Гидроксидов металлов с кислотами:
Кислот с солями:
Аммиака с кислотами:
Получение кислых солей возможно, если кислота в избытке.
Также кислые соли образуются в ходе реакции основания с избытком кислотного оксида:
Получение основных солей
Взаимодействие кислоты с избытком основания:
Добавление (по каплям) небольших количеств щелочей к растворам средних солей металлов:
Взаимодействие солей слабых кислот со средними солями:
Получение комплексных солей
Реакции солей с лигандами:
Получение двойных солей
Двойные соли получают совместной кристаллизацией двух солей:
Химические свойства средних солей
Растворимые соли являются электролитами, следовательно, могут распадаться на ионы. Средние соли диссоциируют сразу:
Нитраты разлагаются в зависимости от активности металла соли:
| Металл | Левее Mg, кроме Li | От Mg до Cu | Правее Cu |
| Продукты | MeNO3 + O2 | MexOy + NO2 + O2 | Me + NO2 + O2 |
| Пример | 2NaNO3 = 2NaNO2 + O2 | 2Cu(NO3)2 = 2CuO + 4NO2 + O2 | 2AgNO3= 2Ag + 2NO2 + O2 |
Соли аммония разлагаются с выделением азота или оксида азота (I), если в составе анион, проявляет окислительные свойства. В остальных случаях разложение солей аммония сопровождается выделением аммиака:
Взаимодействие солей с металлами:
Более активные металлы вытесняют менее активные металлы из растворов солей.
Некоторые соли подвержены гидролизу:
Обменные реакции соли и кислоты, соли с основаниями и взаимодействие солей с солями:
Окислительно-восстановительные реакции, обусловленные свойствами катиона или аниона:
Химические свойства кислых солей
Диссоциация. Кислые соли диссоциируют ступенчато:
Термическое разложение с образованием средней соли:
Взаимодействие солей со щелочью. В результате образуется средняя соль:
Химические свойства основных солей
Реакции солей с кислотами — образование средней соли:
Диссоциация — так же как и кислые соли, основные соли диссоциируют ступенчато.
Химические свойства комплексных солей
Избыток сильной кислоты приводит к разрушению комплекса и образованию двух средних солей и воды:
Недостаток сильной кислоты приводит к образованию средней соли активного металла, амфотерного гидроксида и воды:
Взаимодействие слабой кислоты с солью образует кислую соль активного металла, амфотерный гидроксид и воду:
При действии углекислого или сернистого газа получаются кислая соль активного металла и амфотерный гидроксид:
Реакция солей, образованных сильными кислотами с катионами Fe3+, Al3+ и Cr3+, приводит к взаимному усилению гидролиза. Продукты реакции — два амфотерных гидроксида и соль активного металла:
Разлагаются при нагревании:
Вопросы для самопроверки
С чем взаимодействуют средние соли?
Назовите типичные реакции солей.
Из предложенного списка солей выберите те, которые не реагируют с цинком: нитрит калия, бромид железа, карбонат цезия, сульфат меди.
Простые и сложные вещества

Из этой статьи вы узнаете, какие вещества называются простыми, а какие сложными, в чем их различия и особенности строения.
Прежде чем переходить к понятиям простых и сложных веществ и к их строению, давайте вспомним, что такое химический элемент.
Химический элемент — это группа атомов с одинаковым зарядом ядра, который обусловливает его (элемента) химические свойства.
В зависимости от того, как соединяются друг с другом химические элементы, выделяют два типа веществ: простые и сложные.
Что такое простые вещества
Простые вещества — это вещества, образованные атомами только одного типа химического элемента. Например: H2, Na, P, Al.
Простые вещества делятся на два типа: металлы и неметаллы.
Металлы
Имеют общие между собой физические свойства. Обладают металлическим блеском, высокой тепло- и электропроводностью, твердые (за исключением ртути), пластичные и ковкие.
К простым веществам — металлам относятся: Na, Ca, Fe и т. д.
Почти все металлы имеют немолекулярное строение, т. е. состоят из атомов или ионов.
Неметаллы
Среди неметаллов выделить общие физические свойства практически невозможно. Они могут находиться в разных агрегатных состояниях, обладать различным цветом и т. д.
К простым веществам — неметаллам относятся: P, C, F2 и т. д.
Большинство неметаллов имеют молекулярное строение, т. е. состоят из молекул. При этом молекулы могут быть:
одноатомные: He, Si, Ar и другие;
двухатомные: F2, O2, H2, N2, Cl2, Br2, I2. Эти простые вещества всегда пишутся с индексом 2, их необходимо запомнить;
трехатомные — например, молекула озона O3;
и другие многоатомные.
Некоторые неметаллы имеют немолекулярное (атомное) строение: красный фосфор, кремний, алмаз и графит.
Металлы и неметаллы сильно отличаются друг от друга физическими и химическими свойствами.
При этом запоминать, к какому типу относится то или иное вещество, не нужно, достаточно посмотреть в таблицу Менделеева:
Проведите диагональ от 5-го до 85-го номера химических элементов.
Все химические элементы, находящиеся ниже и левее проведенной диагонали, образуют простые вещества — металлы (кроме водорода).
Выше диагонали химические элементы, находящиеся в главных подгруппах, образуют простые вещества — неметаллы, а в побочных — металлы.
Например, фосфор (порядковый номер — 15) расположен в таблице Менделеева выше диагонали и в главной подгруппе V группы. Значит, простое вещество фосфор — неметалл.
В большинстве случаев названия химического элемента и простого вещества совпадают. Поэтому необходимо научиться различать характеристики простого вещества и химического элемента.
Характеристика химического элемента
Характеристика простого вещества
Расположение в периодической системе (атомный номер, номер группы или периода)
Относительная атомная масса
Строение атома (число электронов, протонов или нейтронов, количество заполненных энергетических уровней)
Распространенность в природе
Содержание в соединении (например, в растительных белках или аминокислотах)
Значения электроотрицательности, сродства к электрону, энергии ионизации
Как правило, когда мы характеризуем простое вещество, то говорим о его физических или химических свойствах:
Влияние на живой организм
Температуры кипения и плавления
Взаимодействие с другими веществами
Содержание в каких-либо смесях веществ (например, газов)
Аллотропия
Аллотропия — это возможность образования химическим элементом нескольких простых веществ, которые отличаются друг от друга строением и свойствами.
Образующиеся простые вещества называют аллотропными модификациями.
Аллотропия характерна для следующих химических элементов:
углерод (алмаз, графит, графен, углеродные нанотрубки, фуллерен и другие);
фосфор (красный, белый и черный);
кислород (кислород и озон);
кремний (аморфный и кристаллический);
Рассмотрим две аллотропные модификации углерода:


The image 1 is a derivative of "Crystal" by manfredxy on Envato Elements.
The image 2 is a derivative of "Rough Graphite rock" by vvoennyy on Envato Elements.
Алмаз — бесцветное прозрачное вещество. Является одним из самых твердых веществ. Не проводит электрический ток.
Графит представляет собой вещество серо-черного цвета, обладает металлическим блеском. Имеет высокую тепло- и электропроводность.
Что такое сложные вещества
Сложные вещества — это вещества, образованные атомами нескольких химических элементов.
Например, молекула HNO3 состоит из одного атома водорода, одного атома азота и трех атомов кислорода.
К сложным веществам в химии относятся две большие группы веществ: неорганические и органические.
Неорганические вещества
Неорганические вещества делятся на 4 вида:
Оксиды — вещества, молекулы которых состоят из двух химических элементов, один из которых — кислород в степени окисления −2.
Основания — вещества, молекулы которых состоят из катиона металла и гидроксильной группы (—OH).
Кислоты — вещества, молекулы которых состоят из катиона водорода (H+), способного замещаться атомом металла, и кислотного остатка.
Соли — вещества, состоящие из катиона металла и кислотного остатка.
Кратко о классификации веществ можно узнать из схемы:
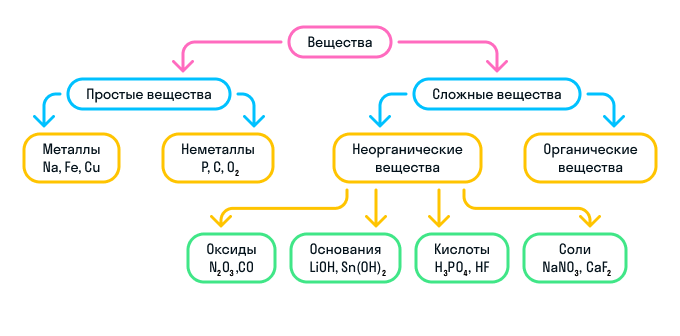
Номенклатура неорганических веществ
Названия простых веществ чаще всего совпадают с названием химического элемента, а для сложных веществ существует два вида номенклатуры: тривиальная и систематическая.
В тривиальной номенклатуре вещества названы в соответствии с их особенностями, например специфическим запахом или окраской.
В систематической номенклатуре название зависит от вида неорганического вещества.
Оксиды
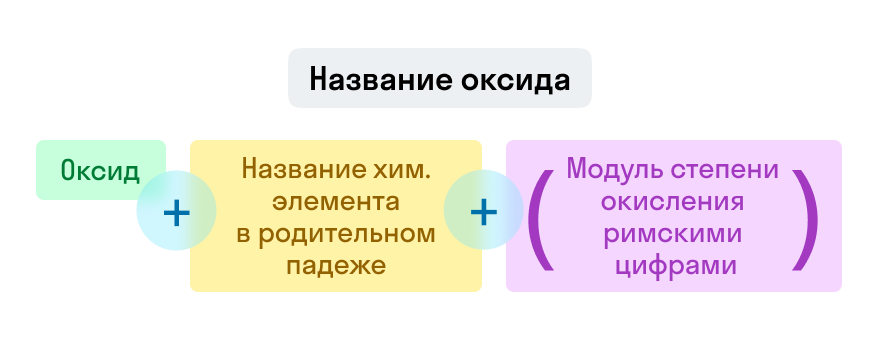
Примеры названий оксидов:
Fe2O3 — оксид железа (III). Читается: феррум два о три;
Na2O — оксид натрия. Читается: натрий два о.
Основания
Примеры названий гидроксидов:
Fe(OH)3 — гидроксид железа (III). Читается: феррум о аш трижды;
NaOH — гидроксид натрия. Читается: натрий о аш.
Соли
Примеры названий солей:
KNO3 — нитрат калия. Читается: калий эн о три;
AlCl3 — хлорид алюминия. Читается: алюминий хлор три.
Кислоты
Названия кислот, кислотных остатков и их формулы необходимо выучить, они приведены в таблице ниже.
Читайте также:
