Схема электронного строения атома наиболее активного металла это
Презентация на тему: " Строение атома Тесты. 1 Какую электронную конфигурацию имеет атом наиболее активного металла? 1) 1s 2 2s 2 2p 1 2) 1s 2 2s 2 2p 6 3s 1 3) 1s 2 2s 2 4)" — Транскрипт:
1 Строение атома Тесты
2 1 Какую электронную конфигурацию имеет атом наиболее активного металла? 1) 1s 2 2s 2 2p 1 2) 1s 2 2s 2 2p 6 3s 1 3) 1s 2 2s 2 4) 1s 2 2s 2 2p 6 3s 2 3p 1
3 2 Химический элемент, формула высшего оксида которого R 2 O 7, имеет электронную конфигурацию атома 1) 1s 2 2s 2 2p 6 3s 1 2) 1s 2 2s 2 2p 6 3s 2 3p 5 3) 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 4) 1s 2 2s 1
4 3 В ряду Na – Mg – Al - Si 1) увеличивается число энергетических уровней в атомах 2) усиливаются металлические свойства элементов 3)уменьшается высшая степень окисления элементов 4) ослабевают металлические свойства элементов
5 4 В ряду химических элементов азот – кислород – фтор возрастает 1) валентность по водороду 2) число энергетических уровней 3) число внешних электронов 4) число неспаренных электронов
6 5 Какой элемент имеет более выраженые неметаллические свойства, чем кремний? 1) углерод 2) германий 3) алюминий 4) бор
7 6 Верны ли следующие суждения об элементах VА группы? А. Атомы азота имеют вакантные 2d- орбитали. Б. Формула высшего оксида элементов VА группы R 2 O 5. 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
8 7 Наибольшее число нейтронов содержит – ся в ядре атома 1) 12 С 2) 32 S 3) 7 Li 4) 9 Be
9 8 Верны ли суждения о соединениях неметаллов? А. Кислотные свойства водородных соединений в периодах усиливаются. Б. Кислотные свойства гидроксидов в периодах ослабевают. 1) верно только А 3) верны оба суждения 2) верно только Б 4) оба суждения неверны
10 9 Сумма протонов, нейтронов и электронов в атоме 40 Са равна 1) 40 2) 60 3) 30 4) 50
11 10 Наибольший радиус имеет атом 1) олова 2) кремния 3) свинца 4) углерода
12 11 Верны ли суждения о свойствах соединений элемента, электронная конфигурация атома которого 1s 2 2s 2 2p 6 3s 2 3p 4 ? А.Этот элемент образует гидроксид с ярко выражены - ними кислотними свойствами. Б. Степень окисления этого элемента в высшем гидроксиде равна +4 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны
13 Что общего в атомах 7 N и 6 С? 1) массовое число 2) число протонов 3) число нейтронов 4) заряд ядра
14 Что общего в атомах 6 С и 6 С? 1) массовое число 2) число протонов 3) число нейтронов 4) радиоактивные свойства
15 14 Выберите атом, в котором больше всего электронов: 1) 1 H 2) 40 Ar 3) 41 Ar 4) 39 K
16 15 Атом неона(Nе), катион натрия(Nа + ) и анион фтора(F - ) имеют: 1) одинаковое число протонов 2) одинаковое число нейтронов 3) одинаковое число электронов 4) одинаковое число нуклонов
17 16 Укажите, какая формула описывает элек– тронную оболочку катиона натрия Na +. 1) 1s 2 2s 2 2p 6 2) 1s 2 2s 2 2p 7 3) 1s 2 2s 2 2p 6 3s 1 4) 1s 2 2s 2 2p 6 3s 2
18 17 Отметьте, какой из приведённых рисунков показывает валентные электроны атома кремния в основном состоянии
19 18 Установите соответствие: А) s 1. Б) p 2. В) d 3. Г) любая 4.
20 19 Установите соответствие: А) d- подуровень Б) f- подуровень В) p-подуровень Г) s-подуровень
21 20 Укажите символ химического элемента, электронная формула которого соответ – соответствует формуле иона S 2-.
22 Ответы 1) 2 8) 1 2) 2 9) 2 3) 4 10) 3 4) 3 11) 1 5) 1 12) 1 6) 2 13) 2 7) 2 14) 4
23 Ответы 15) 3 16) 1 17) 2 18) А3, Б2, В4, Г1 19) А3, Б4, В2, Г1 20) Ar (аргон) 1s 2 2s 2 2p 6 3s 2 3p 6. S 2- ( сера – ион) 1s 2 2s 2 2p 6 3s 2 3p 6 S (сера – атом) 1s 2 2s 2 2p 6 3s 2 3p 4
Строение атома. Строение электронных оболочек атомов первых 20 элементов Периодической системы Д.И. Менделеева

Атом — электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов. В центре атома находится положительно заряженное ядро. Оно занимает ничтожную часть пространства внутри атома, в нём сосредоточены весь положительный заряд и почти вся масса атома.
Ядро состоит из элементарных частиц — протона и нейтрона; вокруг атомного ядра по замкнутым орбиталям движутся электроны.
Протон (р) — элементарная частица с относительной массой 1,00728 атомной единицы массы и зарядом +1 условную единицу. Число протонов в атомном ядре равно порядковому номеру элемента в Периодической системе Д.И. Менделеева.
Нейтрон (n) — элементарная нейтральная частица с относительной массой 1,00866 атомной единицы массы (а. е. м.).
Число нейтронов в ядре N определяют по формуле:
где А — массовое число, Z — заряд ядра, равный числу протонов (порядковому номеру).
Обычно параметры ядра атома записывают следующим образом: слева внизу от символа элемента ставят заряд ядра, а вверху — массовое число, например:
Эта запись показывает, что заряд ядра (следовательно, и число протонов) для атома фосфора равен 15, массовое число равно 31, а число нейтронов равно 31 – 15 = 16. Так как массы протона и нейтрона очень мало отличаются друг от друга, то массовое число приблизительно равно относительной атомной массе ядра.
Электрон ( е – ) — элементарная частица с массой 0,00055 а. е. м. и условным зарядом –1. Число электронов в атоме равно заряду ядра атома (порядковому номеру элемента в Периодической системе Д.И. Менделеева).
Электроны движутся вокруг ядра по строго определённым орбиталям, образуя так называемое электронное облако.
Область пространства вокруг атомного ядра, где наиболее (90 и более %) вероятно нахождение электрона, определяет форму электронного облака.
Электронное облако s-электрона имеет сферическую форму; на s-энергетическом подуровне может максимально находиться два электрона.
Электронное облако p-электрона имеет гантелеобразную форму; на трёх p-орбиталях максимально может находиться шесть электронов.
Орбитали изображают в виде квадрата, сверху или снизу которого пишут значения главного и побочного квантовых чисел, описывающих данную орбиталь. Такую запись называют графической электронной формулой, например:
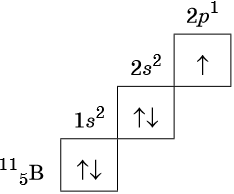
В этой формуле стрелками обозначают электрон, а направление стрелки соответствует направлению спина — собственного магнитного момента электрона. Электроны с противоположными спинами ↑↓ называют спаренными.
Электронные конфигурации атомов элементов можно представить в виде электронных формул, в которых указывают символы подуровня, коэффициент перед символом подуровня показывает его принадлежность к данному уровню, а степень у символа — число электронов данного подуровня.
В таблице 1 приведено строение электронных оболочек атомов первых 20 элементов Периодической системы химических элементов Д.И. Менделеева.
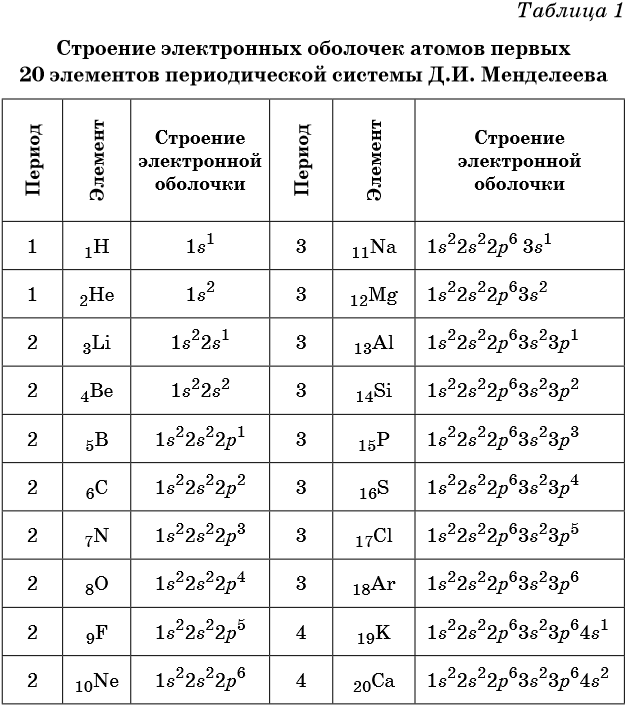
Химические элементы, в атомах которых s-подуровень внешнего уровня пополняется одним или двумя электронами, называют s-элементами. Химические элементы, в атомах которых заполняется p-подуровень (от одного до шести электронов), называют p-элементами.
Число электронных слоёв в атоме химического элемента равно номеру периода.
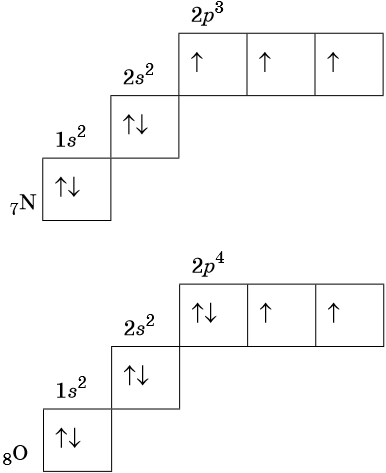
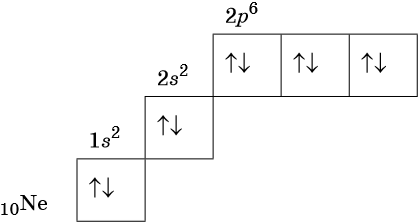
В соответствии с правилом Хунда электроны располагаются на однотипных орбиталях одного энергетического уровня таким образом, чтобы суммарный спин был максимален. Следовательно, при заполнении энергетического подуровня каждый электрон прежде всего занимает отдельную ячейку, а только после этого начинается их спаривание. Например, у атома азота все p-электроны будут находиться в отдельных ячейках, а у кислорода начнётся их спаривание, которое полностью закончится у неона.
Изотопами называют атомы одного и того же элемента, содержащие в своих ядрах одинаковое число протонов, но различное число нейтронов.
Изотопы известны для всех элементов. Поэтому атомные массы элементов в периодической системе являются средним значением из массовых чисел природных смесей изотопов и отличаются от целочисленных значений. Таким образом, атомная масса природной смеси изотопов не может служить главной характеристикой атома, а следовательно, и элемента. Такой характеристикой атома является заряд ядра, определяющий число электронов в электронной оболочке атома и её строение.
Рассмотрим несколько типовых заданий по этому разделу.
Пример 1. Атом какого элемента имеет электронную конфигурацию 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 ?
На внешнем энергетическом уровне у данного элемента находится один 4s-электрон. Следовательно, этот химический элемент находится в четвёртом периоде первой группе главной подгруппе. Этот элемент — калий.
К этому ответу можно прийти по-другому. Сложив общее количество всех электронов, получим 19. Общее число электронов равно порядковому номеру элемента. Под номером 19 в периодической системе находится калий.
Пример 2. Химическому элементу соответствует высший оксид RO2. Электронной конфигурации внешнего энергетического уровня атома этого элемента соответствует электронная формула:
- ns 2 np 4
- ns 2 np 2
- ns 2 np 3
- ns 2 np 6
По формуле высшего оксида (смотрите на формулы высших оксидов в Периодической системе) устанавливаем, что этот химический элемент находится в четвёртой группе главной подгруппы. У этих элементов на внешнем энергетическом уровне находятся четыре электрона — два s и два p. Следовательно, правильный ответ 2.
Тренировочные задания
1. Общее число s-электронов в атоме кальция равно
2. Число спаренных p-электронов в атоме азота равно
3. Число неспаренных s-электронов в атоме азота равно
4. Число электронов на внешнем энергетическом уровне атома аргона равно
5. Число протонов, нейтронов и электронов в атоме 9 4Be равно
1) 9, 4, 5
2) 4, 5, 4
3) 4, 4, 5
4) 9, 5, 9
6. Распределение электронов по электронным слоям 2; 8; 4 — соответствует атому, расположенному в(во)
1) 3-м периоде, IА группе
2) 2-м периоде, IVА группе
3) 3-м периоде, IVА группе
4) 3-м периоде, VА группе
7. Химическому элементу, расположенному в 3-м периоде VA группе соответствует схема электронного строения атома
1) 2, 8, 6
2) 2, 6, 4
3) 2, 8, 5
4) 2, 8, 2
8. Химический элемент с электронной конфигурацией 1s 2 2s 2 2p 4 образует летучее водородное соединение, формула которого
9. Число электронных слоёв в атоме химического элемента равно
1) его порядковому номеру
2) номеру группы
3) числу нейтронов в ядре
4) номеру периода
10. Число внешних электронов в атомах химических элементов главных подгрупп равно
1) порядковому номеру элемента
2) номеру группы
3) числу нейтронов в ядре
4) номеру периода
11. Два электрона находятся во внешнем электронном слое атомов каждого из химических элементов в ряду
1) He, Be, Ba
2) Mg, Si, O
3) C, Mg, Ca
4) Ba, Sr, B
12. Химический элемент, электронная формула которого 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 , образует оксид состава
13. Число электронных слоев и число p-электронов в атоме серы равно
1) 2, 6
2) 3, 4
3) 3, 16
4) 3, 10
14. Электронная конфигурация ns 2 np 4 соответствует атому
1) хлора
2) серы
3) магния
4) кремния
15. Валентные электроны атома натрия в основном состоянии находятся на энергетическом подуровне
1) 2s
2) 2p
3) 3s
4) 3p
16. Атомы азота и фосфора имеют
1) одинаковое число нейтронов
2) одинаковое число протонов
3) одинаковую конфигурацию внешнего электронного слоя
4) одинаковое число электронов
17. Одинаковое число валентных электронов имеют атомы кальция и
1) калия
2) алюминия
3) бериллия
4) бора
18. Атомы углерода и фтора имеют
1) одинаковое число нейтронов
2) одинаковое число протонов
3) одинаковое число электронных слоёв
4) одинаковое число электронов
19. У атома углерода в основном состоянии число неспаренных электронов равно
20. В атоме кислорода в основном состоянии число спаренных электронов равно
Урок 1. Схема строения атомов
В уроке 1 «Схема строения атомов» из курса «Химия для чайников» рассмотрим основы строение атома и состав атомного ядра; выясним, что такое атомная единица массы, порядковый номер атома и атомная масса элемента. Обязательно просмотрите основные понятия и определения к разделу «Атомы, молекулы и ионы», чтобы лучше воспринимать суть изложенного материала в данной главе.

Основы строения атома
Пока не будем говорить, кто и когда узнал о существовании атома, а сразу перейдем к основам его строения: Атом — это мельчайшая частица вещества, которая состоит из ядра (заряд «+»), окруженного электронами (заряд «–»).
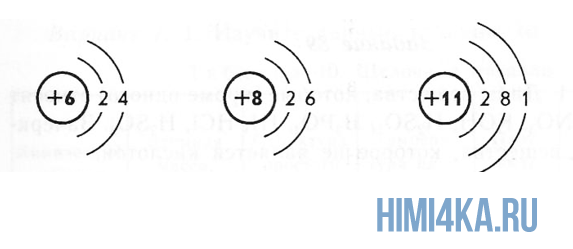
Электроны расположены на электронных оболочках атома: чем больше заряд ядра, тем больше электронов и электронных оболочек. Сам атом заряда не имеет, так как он является электрически нейтральным: заряд ядра (+) равен сумме зарядов электронов (-), вращающихся вокруг ядра.
Состав ядра атома
Ядро атома состоит из нуклонов. Нуклоны в ядре — это протоны и нейтроны. Массы протона и нейтрона почти одинаковые. Заряд ядра атома обозначается знаком «+» и зависит исключительно от количества протонов, ведь протоны — это носители положительного заряда, а нейтроны заряда не имеют никогда. Почти вся масса атома сконцентрирована в ядре, поэтому оно супер-тяжелое по отношению к остальному содержимому атома, однако, очень маленькое по сравнению с общим размером атома.
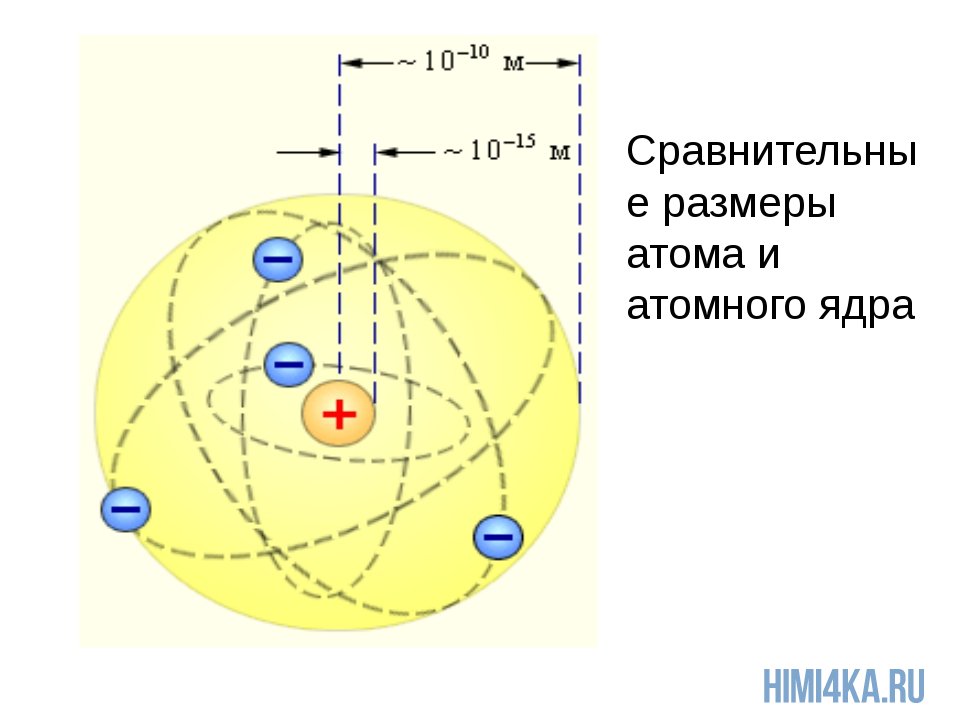
Чтобы вы понимали насколько оно мало, приведу пример: если атом увеличить до размеров Земли, то ядро атома будет в диаметре всего 60 метров. Надеюсь, что теперь у вас возникло некоторое представление об основах строения атома и составе атомного ядра.
Атомная единица массы
Весы, которые могли бы взвесить атом, электрон или нуклон, пока еще не изобрели. Поэтому химики выражают массу частиц не в граммах, а в атомных единицах массы (а.е.м.). 1 атомная единица массы равна 1/12 массы атома углерода, ядро которого состоит из 6 протонов и 6 нейтронов. Получается, что масса 1 протона ~ 1 нейтрона ~ 1 а.е.м. Возникает вопрос, почему мы не считали 6 электронов, однако ответ будет простым: масса электрона ничтожно мала , поэтому в данном случае с ней даже не считаются.

Перевод граммов в атомные единицы массы выглядит так: 1 гр = 6,022×10 23 а.е.м и наоборот 1 а.е.м. = 1,66×10 -24 г. Число 6,022×10 23 носит название — число Авогадро N (позже мы рассмотрим способ ее вычисления). Ниже изображена сравнительная таблица зарядов и масс элементарных частиц:
| Название | Заряд, Кл | Масса, гр | Масса, а.е.м. |
| Протон | +1,6·10 -19 | 1,67·10 -24 | 1,00728 |
| Нейтрон | 0 | 1,67·10 -24 | 1,00866 |
| Электрон | -1,6·10 -19 | 9,10·10 -28 | 0,00055 |
Порядковый номер атома и атомная масса элемента
Переходим к двум фундаментальным понятиям. Порядковый (атомный) номер Z — это число протонов в ядре и оно же обозначает число электронов, потому как атом должен быть электрически нейтральным. Атомная масса элемента (относительная атомная масса, атомный вес) — это масса всех субатомных частиц (протонов, нейтронов, электронов) в атоме, выражается в а.е.м. Относительная атомная масса элемента один в один то же самое, что и атомная, но является безразмерной величиной и показывает, во сколько раз масса рассматриваемого атома превышает массу 1/12 части атома углерода. Порядковые номера и атомные массы химических элементов отмечены в таблице Менделеева.
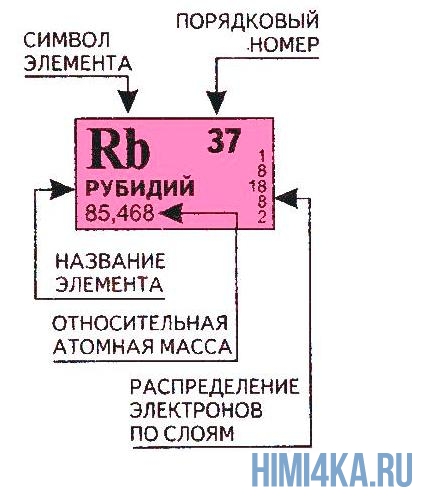
Все атомы в природе с одинаковым порядковым номером в химическом отношении ведут себя практически одинаково и, поэтому их можно считать как атом одного и того же химического элемента. Каждый элемент обозначается одно- или двухбуквенным символом, заимствованный в большинстве случаев из греческого или латинского названия. Например, символ углерода — C, натрия — Na, азота — N и т.д. В качестве символа натрия Na, взяты две первые буквы его латинского названия натриум, чтобы отличить его от азота N (латинское название нитроген). В таблице Менделеева приведен алфавитный перечень элементов и их символов, их порядковый номер и атомные массы.
Надеюсь урок 1 «Схема строения атомов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Строение атома

Атом – наименьшая частица вещества. Его изучение началось еще в Древней Греции, когда к строению атома было приковано внимание не только ученых, но и философов. Каково же электронное строение атома, и какие основные сведения известны об этой частице?
Уже древнегреческие ученые догадывались о существовании мельчайших химически частиц, из которых состоит любой предмет и организм. И если в XVII-XVIII вв. химики были уверены, что атом неделимая элементарная частица, то на рубеже XIX-XX вв., опытным путем удалось доказать, что атом не является неделимым.
Атом, будучи микроскопической частицей вещества, состоит из ядра и электронов. Ядро в 10000 раз меньше атома, однако практически вся его масса сосредоточена именно в ядре. Главной характеристикой атомного ядра, является то, что он имеет положительный заряд и состоит из протонов и нейтронов. Протоны заряжены положительно, а нейтроны не имеют заряда (они нейтральны).
Связаны они друг с другом с помощью сильного ядерного взаимодействия. Масса протона примерно равна массе нейтрона, но при этом в 1840 раз больше массы электрона. Протоны и нейтроны имеют в химии общее название – нуклоны. Сам атом является электронейтральным.
Атом любого элемента можно обозначить электронной формулой и электронно графической формулой:
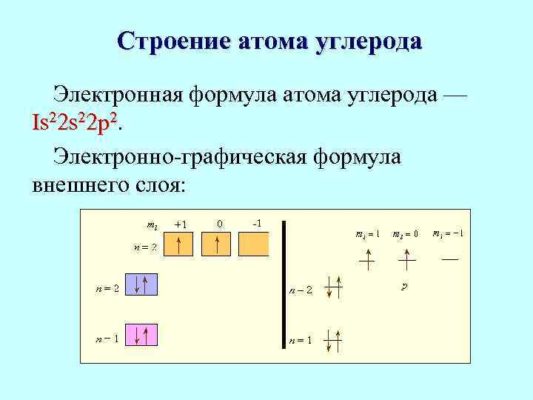
Рис. 1. Электронно-графическая формула атома.
Единственным химическим элементом из периодической системы, в ядре которого не содержатся нейтроны, является легкий водород (протий).
Электрон является отрицательно заряженной частицей. Электронная оболочка состоит из движущихся вокруг ядра электронов. Электроны имеют свойства притягиваться к ядру, а между друг друг на них оказывает влияние кулоновское взаимодействие. Чтобы преодолеть притяжения ядра, электроны должны получать энергию от внешнего источника. Чем дальше электрон находится от ядра, тем меньше энергии для этого необходимо.
Модели атомов
На протяжении долго времени ученые стремились познать природу атома. На раннем этапе большой вклад внес древнегреческий философ Демокрит. Хотя сейчас его теория и кажется нам банальной и слишком простой, в тот период, когда представления об элементарных частицах только начинало зарождаться, его теория о кусочках материи воспринималась совершенно серьезно. Демокрит считал, что свойства любого вещества зависят от формы, массы и других характеристик атомов. Так, например, у огня, полагал он, острые атомы – поэтому огонь обжигает; у воды атомы гладкие, поэтому она способна течь; у твердых предметов, по его представлению, атомы были шереховатые.
Демокрит считал, что из атомов состоит абсолютно все, даже душа человека.
В 1904 году Дж. Дж. Томсон предложил свою модель атома. Основные положения теории сводились к тому, что атом представлялся положительно заряженным телом, внутри которого находились электроны с отрицательным зарядом. Позже эта теория была опровергнута Э. Резерфордом.

Рис. 2. Модель атома Томсона.
Также в 1904 году японским физиком Х. Нагаока была предложена ранняя планетарная модель атома по аналогии с планетой Сатурн. Электроны по этой теории объединены в кольца и вращаются вокруг положительно заряженного ядра. Эта теория оказалась ошибочной.
В 1911 году Э. Резерфорд, проделав ряд опытов, сделал выводы, что атом по своему строению похож на планетную систему. Ведь электроны, словно планеты, движутся по орбитам вокруг тяжелого положительно заряженного ядра. Однако это описание противоречило классической электродинамике. Тогда датский физик Нильс Бор в 1913 году ввел постулаты, суть которых заключалась в том, что электрон, находясь в некоторых специальных состояниях, не излучает энергию. Таким образом, постулаты бора показали, что для атомов классическая механика неприменима. Планетарная модель, описанная Резерфордом и дополненная Бором, получила название – планетарная модель Бора-Резерфорда.

Рис. 3. Планетарная модель Бора-Резерфорда.
Дальнейшее изучение атома привело к созданию такого раздела, как квантовая механика, с помощью которого объяснялись многие научные факты. Современные представления об атоме развились из планетарной модели Бора-Резерфорда.
Что мы узнали?
В данной статье по химии (8 класс) рассказывается кратко и понятно о строении атома. На протяжении многих веков ученые разных стран изучали мельчайшие частицы вещества. Появлялись разные теории, модели и разные формулы строения атома. Современные представления об атоме основываются на модели Бора-Резерфорда, по которой атом состоит из ядра и электронного облака, в котором электроны движутся вокруг ядра.
Строение электронных оболочек атомов

Атом – мельчайшая частица вещества, состоящая из ядра и электронов. Строение электронных оболочек атомов определяется положением элемента в Периодической системе химических элементов Д. И. Менделеева.
Электрон и электронная оболочка атома
Атом, который в целом является нейтральным, состоит из положительно заряженного ядра и отрицательно заряженной электронной оболочки (электронное облако), при этом, суммарные положительные и отрицательные заряды равны по абсолютной величине. При вычислении относительной атомной массы массу электронов не учитывают, так как она ничтожно мала и в 1840 раз меньше массы протона или нейтрона.
Рис. 1. Атом.
Электрон – совершенно уникальная частица, которая имеет двойственную природу: он имеет одновременно свойства волны и частицы. Они непрерывно движутся вокруг ядра.
Пространство вокруг ядра, где вероятность нахождения электрона наиболее вероятна, называют электронной орбиталью, или электронным облаком. Это пространство имеет определенную форму, которая обозначается буквами s-, p-, d-, и f-. S-электронная орбиталь имеет шаровидную форму, p-орбиталь имеет форму гантели или объемной восьмерки, формы d- и f-орбиталей значительно сложнее.
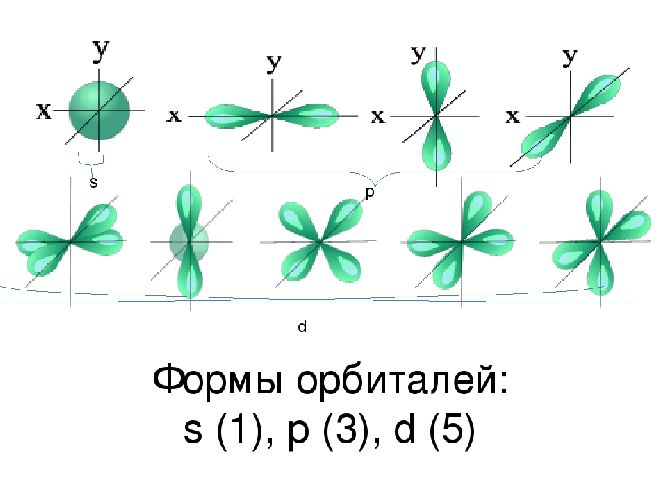
Рис. 2. Формы электронных орбиталей.
Вокруг ядра электроны расположены на электронных слоях. Каждый слой характеризуется расстоянием от ядра и энергией, поэтому электронные слои часто называют электронными энергетическими уровнями. Чем ближе уровень к ядру, тем меньше энергия электронов в нем. Один элемент отличается от другого числом протонов в ядре атома и соответственно числом электронов. Следовательно, число электронов в электронной оболочке нейтрального атома равно числу протонов, содержащимся в ядре этого атома. Каждый следующий элемент имеет в ядре на один протон больше, а в электронной оболочке – на один электрон больше.
Вновь вступающий электрон занимает орбиталь с наименьшей энергией. Однако максимальное число электронов на уровне определяется формулой:
где N – максимальное число электронов, а n – номер энергетического уровня.
На первом уровне может быть только 2 электрона, на втором – 8 электронов, на третьем – 18 электронов, а на четвертом уровне – 32 электрона. На внешнем уровне атома не может находится больше 8 электронов: как только число электронов достигает 8, начинает заполняться следующий, более далекий от ядра уровень.
Каждый элемент стоит в определенном периоде. Период – это горизонтальная совокупность элементов, расположенных в порядке возрастания заряда ядер их атомов, которая начинается щелочным металлом, а заканчивается инертным газом. Первые три периода в таблице – малые, а следующие, начиная с четвертого периода – большие, состоят из двух рядов. Номер периода, в котором находится элемент имеет физический смысл. Он означает, сколько электронных энергетических уровней имеется в атоме любого элемента данного периода. Так, элемент хлор Cl находится в 3 периоде, то есть его электронная оболочка имеет три электронных слоя. Хлор стоит в VII группе таблицы, причем в главной подгруппе. Главной подгруппой называется столбец внутри каждой группы, который начинается с 1 или 2 периода.
Таким образом, состояние электронных оболочек атома хлора таково: порядковый номер элемента хлора – 17, что означает, что атом имеет в ядре 17 протонов, а в электронной оболочке – 17 электронов. На 1 уровне может быть только 2 электрона, на 3 уровне – 7 электронов, так как хлор находится в главной подруппе VII группы. Тогда на 2 уровне находится:17-2-7=8 электронов.
Рис. 3. Схема строения электронной оболочки атома.
Тема «Строение электронных оболочек атомов» по химии (8 класс) кратко объясняет строение атома, свойства и расположение электронов. Также она дает представление о распределении электронов по уровням в периодической системе Д. И. Менделеева.
Читайте также:
