Серная кислота как окислитель взаимодействие с металлами и неметаллами
Кислоты можно классифицировать исходя из разных критериев:
1) Наличие атомов кислорода в кислоте
| Кислородсодержащие | Бескислородные |
| H3PO4,HNO3,HNO2,H2SO4,H3PO4,H2CO3,H2CO3, HClO4 все органические кислоты (HCOOH, CH3COOH и т.д.) | HF, HCl, HBr, HI, H2S |
2) Основность кислоты
Основностью кислоты называют число «подвижных» атомов водорода в ее молекуле, способных при диссоциации отщепляться от молекулы кислоты в виде катионов водорода H + , а также замещаться на атомы металла:
3) Летучесть
Кислоты обладают различной способностью улетучиваться из водных растворов.
4) Растворимость
| Растворимые | Нерастворимые |
| HF, HCl, HBr, HI, H2S, H2SO3, H2SO4, HNO3, HNO2, H3PO4, H2CO3, CH3COOH, HCOOH | H2SiO3, высшие карбоновые кислоты |
5) Устойчивость
| Устойчивые | Неустойчивые |
| H2SO4, H3PO4, HCl, HBr, HF | H2CO3, H2SO3 |
6) Способность к диссоциации
хорошо диссоциирующие (сильные)
7) Окисляющие свойства
(проявляют окислительные свойства за счет катионов водорода H + )
(проявляют окислительные свойства за счет кислотообразующего элемента)
практически все кислоты кроме HNO3 и H2SO4 (конц.)
Химические свойства кислот
1. Способность к диссоциации
Кислоты диссоциируют в водных растворах на катионы водорода и кислотные остатки. Как уже было сказано, кислоты делятся на хорошо диссоциирующие (сильные) и малодиссоциирующие (слабые). При записи уравнения диссоциации сильных одноосновных кислот используется либо одна направленная вправо стрелка (), либо знак равенства (=), что показывает фактически необратимость такой диссоциации. Например, уравнение диссоциации сильной соляной кислоты может быть записано двояко:
либо в таком виде: HCl = H + + Cl —
либо в таком: HCl → H + + Cl —
По сути направление стрелки говорит нам о том, что обратный процесс объединения катионов водорода с кислотными остатками (ассоциация) у сильных кислот практически не протекает.
В случае, если мы захотим написать уравнение диссоциации слабой одноосновной кислоты, мы должны использовать в уравнении вместо знака две стрелки . Такой знак отражает обратимость диссоциации слабых кислот — в их случае сильно выражен обратный процесс объединения катионов водорода с кислотными остатками:
Многоосновные кислоты диссоциируют ступенчато, т.е. катионы водорода от их молекул отрываются не одновременно, а по очереди. По этой причине диссоциация таких кислот выражается не одним, а несколькими уравнениями, количество которых равно основности кислоты. Например, диссоциация трехосновной фосфорной кислоты протекает в три ступени с поочередным отрывом катионов H + :
Следует отметить, что каждая следующая ступень диссоциации протекает в меньшей степени, чем предыдущая. То есть, молекулы H3PO4 диссоциируют лучше (в большей степени), чем ионы H2PO4 — , которые, в свою очередь, диссоциируют лучше, чем ионы HPO4 2- . Связано такое явление с увеличением заряда кислотных остатков, вследствие чего возрастает прочность связи между ними и положительными ионами H + .
Из многоосновных кислот исключением является серная кислота. Поскольку данная кислота хорошо диссоциирует по обоим ступеням, допустимо записывать уравнение ее диссоциации в одну стадию:
2. Взаимодействие кислот с металлами
Седьмым пунктом в классификации кислот мы указали их окислительные свойства. Было указано, что кислоты бывают слабыми окислителями и сильными окислителями. Подавляющее большинство кислот (практически все кроме H2SO4(конц.) и HNO3) являются слабыми окислителями, так как могут проявлять свою окисляющую способность только за счет катионов водорода. Такие кислоты могут окислить из металлов только те, которые находятся в ряду активности левее водорода, при этом в качестве продуктов образуется соль соответствующего металла и водород. Например:
Что касается кислот-сильных окислителей, т.е. H2SO4 (конц.) и HNO3, то список металлов, на которые они действуют, намного шире, и в него входят как все металлы до водорода в ряду активности, так и практически все после. То есть концентрированная серная кислота и азотная кислота любой концентрации, например, будут окислять даже такие малоактивные металлы, как медь, ртуть, серебро. Более подробно взаимодействие азотной кислоты и серной концентрированной с металлами, а также некоторыми другими веществами из-за их специфичности будет рассмотрено отдельно в конце данной главы.
3. Взаимодействие кислот с основными и амфотерными оксидами
Кислоты реагируют с основными и амфотерными оксидами. Кремниевая кислота, поскольку является нерастворимой, в реакцию с малоактивными основными оксидами и амфотерными оксидами не вступает:
4. Взаимодействие кислот с основаниями и амфотерными гидроксидами
HCl + NaOH H2O + NaCl
5. Взаимодействие кислот с солями
Данная реакция протекает в случае, если образуется осадок, газ либо существенно более слабая кислота, чем та, которая вступает в реакцию. Например:
HCOONa + HCl HCOOH + NaCl
6. Специфические окислительные свойства азотной и концентрированной серной кислот
Как уже было сказано выше, азотная кислота в любой концентрации, а также серная кислота исключительно в концентрированном состоянии являются очень сильными окислителями. В частности, в отличие от остальных кислот они окисляют не только металлы, которые находятся до водорода в ряду активности, но и практически все металлы после него (кроме платины и золота).
Так, например, они способны окислить медь, серебро и ртуть. Следует однако твердо усвоить тот факт, что ряд металлов (Fe, Cr, Al) несмотря на то, что являются довольно активными (находятся до водорода), тем не менее, не реагируют с концентрированной HNO3 и концентрированной H2SO4 без нагревания по причине явления пассивации — на поверхности таких металлов образуется защитная пленка из твердых продуктов окисления, которая не позволяет молекулами концентрированной серной и концентрированной азотной кислот проникать вглубь металла для протекания реакции. Однако, при сильном нагревании реакция все таки протекает.
В случае взаимодействия с металлами обязательными продуктами всегда являются соль соответствующего метала и используемой кислоты, а также вода. Также всегда выделяется третий продукт, формула которого зависит от многих факторов, в частности, таких, как активность металлов, а также концентрация кислот и температура проведения реакций.
Высокая окислительная способность концентрированной серной и концентрированной азотной кислот позволяет им реагировать не только практическим со всеми металлами ряда активности, но даже со многими твердыми неметаллами, в частности, с фосфором, серой, углеродом. Ниже в таблице наглядно представлены продукты взаимодействия серной и азотной кислот с металлами и неметаллами в зависимости от концентрации:
7. Восстановительные свойства бескислородных кислот
Все бескислородные кислоты (кроме HF) могут проявлять восстановительные свойства за счет химического элемента, входящего в состав аниона, при действии различных окислителей. Так, например, все галогеноводородные кислоты (кроме HF) окисляются диоксидом марганца, перманганатом калия, дихроматом калия. При этом галогенид-ионы окисляются до свободных галогенов:
Среди всех галогеноводородных кислот наибольшей восстановительной активностью обладает иодоводородная кислота. В отличие от других галогеноводородных кислот ее могут окислить даже оксид и соли трехвалентного железа.
Высокой восстановительной активностью обладает также и сероводородная кислота H2S. Ее может окислить даже такой окислитель, как диоксид серы:
кислот-окислителей
Концентрированная серная кислота – бесцветная тяжелая маслянистая нелетучая жидкость. Не имеет запаха и тянет сказать: «без вкуса», но вкус у нее все же есть, пробовать не советую.
Разбавленная серная кислота ничем особым непримечательна. Свойства как и у других кислот. За исключением того, что она не реагирует со свинцом, так как образующийся сульфат свинца нерастворим. Нерастворимое вещество покрывает кусочек металла и «защищает его от реакции»
А вот концентрированная серная кислота – сильный окислитель (за счет атома серы в высшей степени окисления).
Раз сера – окислитель, то она будет восстанавливаться:
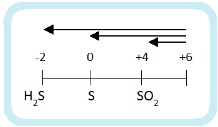
Глубина восстановления серы зависит от активности восстановителя:
- сильные восстановители восстанавливают серную кислоту до H2S,
- слабые — до SO2,
- восстановители средней активности – до S.
На практике образуются несколько продуктов в разных пропорциях. Преобладание того или иного продукта зависит от множества факторов: от вышеупомянутой активности восстановителя, температуры, концентрации кислоты (95%, 90%. 85%, 80%, 75% – это все концентрированная кислота). Но в реалиях школьной программы все схематично и пишем один единственный продукт.
1. Взаимодействие металлов в концентрированной серной кислотой.
Концентрированная серная кислота реагирует с металлами, даже стоящими после водорода. Но кроме платины и золота – эти металлы слишком малоактивны.
Схема этих реакций:

- Активные металлы восстанавливают серную кислоту до H2S:
- Металлы средней активности восстанавливают серную кислоту до S:
- Малоактивные металлы восстанавливают серную кислоту до SO2:
Некоторые металлы (конкретно нужно запомнить — Fe, Al, Cr) при контакте с концентрированной серной кислотой покрываются защитной пленкой – и реакция не идет. Поэтому серную кислоту без всякой опасности перевозят в железных цистернах. Это явление называют пассивацией.
То, что железо, алюминий и хром пассивируются не означает, что реакция невозможна. Просто нужно нагреть – при нагревании от защитной пленки не остаётся и следа:

2. Взаимодействие неметаллов с концентрированной серной кислотой.
Не все неметаллы реагируют с концентрированной серной кислотой: лишь те, что проявляют восстановительные свойства. Поэтому кислород, азот и галогены не вступают в эти реакции.
Мы рассмотрим взаимодействие с фосфором, углеродом, бором, серой. Неметаллы – не такие активные восстановители как типичные металлы – поэтому серная кислота восстанавливается до SO2.
Неметалл окисляется до высшей степени окисления: образуется оксид. Поскольку оксид неметалла – кислотный, то он тут же в момент получения реагирует с водой и образуется кислота:
Угольная кислота не образуется – получается углекислый газ:
Концентрированная серная кислота окисляет серу:

3. Взаимодействие концентрированной серной кислоты с галогенидами.
Галогениды металлов – это соли галогеноводородов (HF, HCl, HBr, HI). Галогеноводороды – летучие кислоты, а HF еще к тому же и слабая.
Поэтому серная кислота их вытесняет из солей:
Соли нужно брать твердые, не раствор. Тогда галогеноводороды будут вытесняться в виде газов.
А к фториду можно и в раствор прилить кислоты, так как фтороводородная кислота – слабая, она вытеснится. Только останется в растворе, вот и вся разница.
С хлоридами и фторидами происходит простая реакция обмена, без изменения степеней окисления.
Галоген окисляется до простого вещества. Сера восстанавливается:

А вот бромиды и иодиды – восстановители. После вытеснения галогеноводорода он тут же окисляется. Поэтому реакции концентрированной серной кислоты с бромидами и иодидами протекают с изменением степеней окисления.
Бромоводород и иодоводород окисляются так же, как и их соли:
Азотная кислота — окислитель.
Производство.
Сырье для производства азотной кислоты – аммиак. Три последовательные реакции окисления:
1. Каталитическое окисление аммиака:
Реакция экзотермическая, необратимая.
2. Окисление NO до NO2:
Реакция экзотермическая, обратимая.
3. Поглощение NO2 водой и одновременно его окисление:
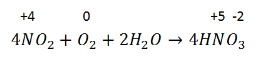
Реакция экзотермическая, обратимая – по этой же схеме азотная кислота разлагается при хранении. Поэтому с течением времени прозрачная изначально азотная кислота буреет. Бурый цвет кислоте придает, образующийся при разложении NO2.
Если растворять NO2 в воде без доступа кислорода, то азот диспропорционирует:
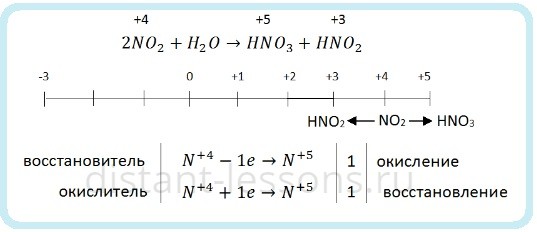
Поэтому оксид азота (IV) NO2 мы относим к кислотным. Хоть у него и нет соответствующей кислоты, при растворении его в воде образуются HNO3 и HNO2.
Азотная кислота – жидкость с резким запахом. Свежая азотная кислота бесцветная. При хранении она разлагается и за счет бурого NO2 приобретает желтоватый цвет.
Важно знать, что азотная кислота летучая, легкокипящая, поэтому и имеет запах. А раз она летучая, то ее можно вытеснить из соли нелетучей кислотой, например, концентрированной серной:
Важно, чтобы нитрат был твердым, а серная кислота концентрированная – меньше воды. Чтобы азотная кислота испарялась, испаряется – значит покидает реакционную смесь, значит реакция идет до конца.
Химические свойства.
Свойства азотной кислоты в целом повторяют свойства концентрированной серной. Но с одной поправкой, в отличие от серной, азотная кислота и концентрированная, и разбавленная проявляет сильные окислительные свойства.
1. Взаимодействие с металлами.
До чего может восстанавливаться азот? Вспомним диаграмму степеней окисления азота:

Получиться может любой из этих продуктов. А на практике – несколько сразу. Мы рассмотрим упрощенный вариант: берем только преобладающий продукт и только два фактора, влияющие на глубину восстановления:
- Активность металла – чем активнее, тем глубже идет восстановление.
- Концентрация кислоты – разбавленная кислота восстанавливается глубже.
Еще больше упрощая берем только четыре продукта: NH4NO3, N2O, NO, NO2.
Наиболее глубокое восстановление дает разбавленная кислота и активный металл – NH4NO3.
Соответственно при взаимодействии концентрированной кислоты и малоактивного металла образуется NO2. Самое неглубокое восстановление.
Теперь нужно определить в каком случае будет N2O, а в каком NO. Фактор активности металла – решающий. С активным металлом и концентрированной кислотой будет N2O. А с малоактивным металлом и разбавленной кислотой образуется NO.
8Na + 10HNO3 конц → 8NaNO3 + N 2 O ↑ + 5H2O

Концентрированная азотная кислота пассивирует Fe, Cr, Al, как и концентрированная серная.
Чтобы провести реакцию нужно нагреть:
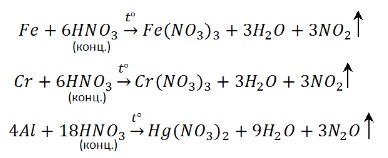
С разбавленной кислотой эти металлы реагируют и без нагревания:
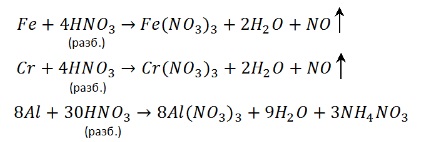
2. Взаимодействие с неметаллами (C, P, B, S).
Неметаллы окисляются до высших кислот. Реагирует и концентрированная, и разбавленная азотная кислота. Неметаллы – не очень хорошие восстановители, поэтому кислота восстанавливается как в реакции с малоактивными металлами (образуются N2O и NO2).

В отличие от серной кислоты, очень концентрированная азотная кислота (безводная) окисляет при нагревании иод до иодноватой кислоты (HIO3):
3. Взаимодействие с галогенидами.
Эти реакции могут запутать, хотя ничего сложного в них нет. Вам нужно просто понять логику каждой из них.
На что следует опираться:
- Реакции могут быть либо окислительно-восстановительными, либо обменными.
- Помним, что фториды (F–) и хлориды (Cl–) – восстановители плохие, если быть точнее, то никакие. А бромиды (Br–) и иодиды (I–) – хорошие восстановители.
- HF – слабая кислота, HCl, HBr, HI – сильные.
Фториды металлов – это соли слабых кислот, поэтому сильная азотная кислота вытесняет фтороводород. И не важно концентрированная или разбавленная – это простая реакция обмена/p>
Фтороводород не реагирует с азотной кислотой. Реакция обмена невозможна и окислительно-восстановительная тоже: фторид – слабый восстановитель.
Хлориды металлов и хлороводород не реагируют с азотной кислотой. Хлорид ион – слабый восстановитель – не возможна ОВР. Хлориды металлов не реагируют, потому что соляная кислота – сильная (предыдущая плавиковая – слабая, если помните).
Бромиды и иодиды вступают с азотной кислотой в окислительно-восстановительное взаимодействие. Сами окисляются до простых веществ. Азотная кислота восстанавливается до NO2 если концентрированная, разбавленная – до NO, то есть так, как будто взаимодействует с малоактивным металлом.
Окислительные свойства серной кислоты
ОВР в статье специально выделены цветом. Обратите на них особое внимание. Эти уравнения могут попасться в ЕГЭ.
Разбавленная серная ведет себя, как и остальные кислоты, окислительные свои возможности прячет:
Zn + H2SO4 → ZnSO4 + H2↑
Автор статьи — Саид Лутфуллин
И еще, что надо помнить про разбавленную серную кислоту : она не реагирует со свинцом . Кусок свинца, брошенный в разбавленную H2SO4 покрывается слоем нерастворимого (см. таблицу растворимости) сульфата свинца и реакция моментально прекращается.
Концентрированная серная кислота – тяжелая маслянистая жидкость, не летучая, не имеет вкуса и запаха
За счет серы в степени окисления +6(высшей) серная кислота приобретает сильные окислительные свойства.
Правило для задания 24 (по-старому А24) при приготовлении растворов серной кислоты никогда нельзя в нее лить воду. Концентрированую серную кислоту нужно тонкой струйкой вливать в воду, постоянно помешивая.
Взаимодействие концентрированной серной кислоты с металлами
Эти реакции строго стандартизированны и идут по схеме:
H2SO4(конц.) + металл → сульфат металла + H2O + продукт восстановленной серы.
Есть два нюанса:
1) Алюминий, железо и хром с H2SO4 (конц) в нормальных условиях не реагируют, из-за пассивации. Нужно нагреть.
2) С платиной и золотом H2SO4 (конц) не реагирует вообще.
Сера в концентрированной серной кислоте – окислитель
- значит, сама будет восстанавливаться;
- то, до какой степени окисления будет восстанавливаться сера, зависит от металла.
Рассмотрим диаграмму степеней окисления серы:

- До -2 серу могут восстановить только очень активные металлы — в ряду напряжений до алюминия включительно.
Реакции будут идти вот так:
- при взаимодействии H2SO4 (конц) с металлами в ряду напряжений после алюминия, но до железа, то есть с металлами со средней активностью сера восстанавливается до 0:
- все остальные металлы, начиная с железа в ряду напряжений (включая те, что после водорода, кроме золота и платины, конечно), могут восстановить серу только до +4. Так как это малоактивные металлы:
(обратите внимание, что железо окисляется до +3, до максимально возможной, высшей степени окисления, так как оно имеет дело с сильным окислителем)

Конечно, все относительно. Глубина восстановления будет зависеть от многих факторов: концентрации кислоты (90%, 80%, 60%), температуры и т.д. Поэтому совсем уж точно предсказать продукты нельзя. Приведенная выше таблица тоже имеет свой процент приблизительности, но пользоваться ей можно. Еще необходимо помнить, что в ЕГЭ, когда продукт восстановленной серы не указан, и металл не отличается особой активностью, то, скорее всего, составители имеют в виду SO 2. Нужно смотреть по ситуации и искать зацепки в условиях.
SO 2 – это вообще частый продукт ОВР с участием конц. серной кислоты.
H2SO4 (конц) окисляет некоторые неметаллы (которые проявляют восстановительные свойства), как правило, до максимальной — высшей степени окисления (образуется оксид этого неметалла). Сера при этом тоже восстанавливается до SO 2:
Свежеобразованный оксид фосфора ( V ) реагирует с водой, получается ортофосфорная кислота. Поэтому реакцию записывают сразу:
То же самое с бором, он превращается в ортоборную кислоту:
Очень интересны взаимодействие серы со степенью окисления +6 (в серной кислоте) с «другой» серой (находящейся в другом соединении). В рамках ЕГЭ рассматривается взаимодействиеH2SO4 (конц) с серой (простым веществом) и сероводородом.
Начнем с взаимодействия серы (простого вещества) с концентрированной серной кислотой. В простом веществе степень окисления 0, в кислоте +6. В этой ОВР сера +6 будет окислять серу 0. Посмотрим на диаграмму степеней окисления серы:

Сера 0 будет окисляться, а сера +6 будет восстанавливаться, то есть понижать степень окисления. Будет выделяться сернистый газ:
Но в случае с сероводородом:

Образуется и сера (простое вещество), и сернистый газ:
Этот принцип часто может помочь в определении продукта ОВР, где окислитель и восстановитель – один и тот же элемент, в разных степенях окисления. Окислитель и восстановитель «идут навстречу друг другу» по диаграмме степеней окисления.
H2SO4 (конц) , так или иначе, взаимодействует с галогенидами. Только вот тут надо понимать, что фтор и хлор – «сами с усами» и с фторидами и хлоридами ОВР не протекает, проходит обычный ионно-обменный процесс, в ходе которого образуется газообразный галогеноводород:
А вот галогены в составе бромидов и иодидов (как и в составе соответствующих галогеноводородов) окисляются ей до свободных галогенов. Только вот сера восстанавливается по-разному: иодид является более cильным восстановителем, чем бромид. Поэтому иодид восстанавливает серу до сероводорода, а бромид до сернистого газа:
Хлороводород и фтороводород (как и их соли) устойчивы к окисляющему действию H2SO4 (конц).
И наконец, последнее: для концентрированной серной кислоты это уникально, больше никто так не может. Она обладает водоотнимающим свойством .
Это позволяет использовать концентрированную серную кислоту самым разным образом:
Во-первых, осушение веществ. Концентрированная серная кислота забирает воду от вещества и оно «становится сухим».
Во-вторых, катализатор в реакциях, в которых отщепляется вода (например, дегидратация и этерификация):
Серная кислота
Серная кислота H2SO4 – это сильная кислота, двухосновная, прочная и нелетучая. При обычных условиях серная кислота – тяжелая маслянистая жидкость, хорошо растворимая в воде.
Растворение серной кислоты в воде сопровождается выделением значительного количества кислоты. Поэтому по правилам безопасности в лаборатории при смешивании серной кислоты и воды мы добавляем серную кислоту в воду небольшими порциями при постоянном перемешивании.

Валентность серы в серной кислоте равна VI.
Способы получения
1. Серную кислоту в промышленности производят из серы, сульфидов металлов, сероводорода и др. Один из вариантов — производство серной кислоты из пирита FeS2.
Основные стадии получения серной кислоты :
- Сжигание или обжиг серосодержащего сырья в кислороде с получением сернистого газа.
- Очистка полученного газа от примесей.
- Окисление сернистого газа в серный ангидрид.
- Взаимодействие серного ангидрида с водой.


Рассмотрим основные аппараты, используемые при производстве серной кислоты из пирита (контактный метод):
В контактном аппарате производится окисление сернистого газа до серного ангидрида. Процесс является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO3):
- температура: оптимальной температурой для протекания прямой реакции с максимальным выходом SO3 является температура 400-500 о С. Для того чтобы увеличить скорость реакции при столь низкой температуре в реакцию вводят катализатор – оксид ванадия (V) V2O5.
- давление: прямая реакция протекает с уменьшением объемов газов. Для смещения равновесия вправо процесс проводят при повышенном давлении.
Однако, если для поглощения оксида серы использовать воду, то образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты. Для того, чтобы не образовывался сернокислотный туман, используют 98%-ную концентрированную серную кислоту. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2SO4·nSO3.
Общие научные принципы химического производства:
- Непрерывность.
- Противоток
- Катализ
- Увеличение площади соприкосновения реагирующих веществ.
- Теплообмен
- Рациональное использование сырья
Химические свойства
Серная кислота – это сильная двухосновная кислота .
1. Серная кислота практически полностью диссоциирует в разбавленном в растворе по первой ступени:
По второй ступени серная кислота диссоциирует частично, ведет себя, как кислота средней силы:
HSO4 – ⇄ H + + SO4 2–
2. Серная кислота реагирует с основными оксидами, основаниями, амфотерными оксидами и амфотерными гидроксидами.
Например , серная кислота взаимодействует с оксидом магния:
Еще пример : при взаимодействии серной кислоты с гидроксидом калия образуются сульфаты или гидросульфаты:
Серная кислота взаимодействует с амфотерным гидроксидом алюминия:
3. Серная кислота вытесняет более слабые из солей в растворе (карбонаты, сульфиды и др.). Также серная кислота вытесняет летучие кислоты из их солей (кроме солей HBr и HI).
Например , серная кислота взаимодействует с гидрокарбонатом натрия:
Или с силикатом натрия:
Концентрированная серная кислота реагирует с твердым нитратом натрия. При этом менее летучая серная кислота вытесняет азотную кислоту:
Аналогично – концентрированная серная кислота вытесняет хлороводород из твердых хлоридов, например , хлорида натрия:
4. Т акже серная кислота вступает в обменные реакции с солями.
Например , серная кислота взаимодействует с хлоридом бария:
5. Разбавленная серная кислота взаимодействует с металлами, которые расположены в ряду активности металлов до водорода. При этом образуются соль и водород.
Например , серная кислота реагирует с железом. При этом образуется сульфат железа (II):
Серная кислота взаимодействует с аммиаком с образованием солей аммония:
Концентрированная серная кислота является сильным окислителем . При этом она обычно восстанавливается до сернистого газа SO2. С активными металлами может восстанавливаться до серы S, или сероводорода Н2S.
Железо Fe, алюминий Al, хром Cr пассивируются концентрированной серной кислотой на холоде. При нагревании реакция возможна.
При взаимодействии с неактивными металлами концентрированная серная кислота восстанавливается до сернистого газа:
При взаимодействии с щелочноземельными металлами и магнием концентрированная серная кислота восстанавливается до серы:
При взаимодействии с щелочными металлами и цинком концентрированная серная кислота восстанавливается до сероводорода:
6. Качественная реакция на сульфат-ионы – взаимодействие с растворимыми солями бария. При этом образуется белый кристаллический осадок сульфата бария:
BaCl2 + Na2SO4 → BaSO4 ↓ + 2NaCl
Видеоопыт взаимодействия хлорида бария и сульфата натрия в растворе (качественная реакция на сульфат-ион) можно посмотреть здесь.
7. Окислительные свойства концентрированной серной кислоты проявляются и при взаимодействии с неметаллами.
Например , концентрированная серная кислота окисляет фосфор, углерод, серу. При этом серная кислота восстанавливается до оксида серы (IV):
Уже при комнатной температуре концентрированная серная кислота окисляет галогеноводороды и сероводород:
4.Взаимодействие металлов с концентрированной серной кислотой.
В концентрированной серной кислоте окислителем является не катион водорода, а более сильный окислитель – сульфат-ион, который в разбавленной серной кислоте не проявляет себя как окислитель из-за сильной гидратации, и, как следствие – малоподвижности.
Н2SO4 (конц.) окисляет все металлы в ряду стандартных электродных потенциалов до серебра включительно.
Этим процессам восстановления серной кислоты соответствуют следующие ионно-электронные равновесные полуреакции:
SO4 2- + 8H + +6e ↔ S + 4H2O E o = +0,36B
Пользоваться данными значениями ОВПОТ некорректно, т.к. концентрация серной кислоты значительно превышает 1моль/л
Cхематично реакции окисления металлов в конц. Н2SO4 можно записать в виде:
H2S и S выделяются в случае активных металлов до цинка включительно (Е о ме Е о Zn).
SO2 выделяется при взаимодействии металлов, стоящие в таблице СЭП, ниже цинка (Е о ме Е о Zn).
Необходимо помнить, что при изменении условий реакция для одного и того же металла можно получить разные продукты, так что предложенная схема является до некоторой степени условной. Например, при длительном нагревании взаимодействие алюминия с конц. серной кислотой может идти до образования не только серы, но и сероводорода:
Со щелочными металлами серная кислота конц. и разб. взаимодействует одинаково по реакции: Na + Н2SO4 (разб.,конц.) = Na2SO4 + Н2О + H2S
Существуют особенности взаимодействия свинца с серной кислотой - образуется кислая растворимая соль – гидросульфат свинца:
К каждой реакции необходимо составить уравнения ионно-электронного баланса и расставить коэффициенты. Концентрированная серная кислота - сильный окислитель, и окисляет металлы, стоящие в таблице СЭПОТ до серебра включительно
Следует иметь в виду, что металлы, проявляющие разные степени окисления, в случае кислот, в которых окислителем является катион водорода, окисляются до низших степеней окисления, а в конц. Н2SO4 – до высших. Например, железо:
Вторая реакция идет только при нагревании. В холодной конц. Н2SO4 железо, а также алюминий, хром, марганец - пассивируются. Реакцию пассивации можно написать следующим образом:
Взаимодействие концентрированной серной с неметаллами-восстановителями.
Под понятием «неметаллы-восстановители» подразумевают не только атомы неметаллов, но и их ионы, например галогенид-ионы, которые в разной степени проявляют восстановительные свойства. В зависимости от силы восстановителя (значения ОВПОТ системы) серная кислота может восстанавливаться до диоксида серы или сероводорода (в случае такого сильного восстановителя, как ион иода).
HCl + Н2SO4 реакция не идет, т.к. хлорид-ион –слабый восстановитель
Читайте также:
