Щелочные металлы получают электролизом растворов солей
Металлургия — это наука о промышленных способах получения металлов. Различают черную и цветную металлургию.
Черная металлургия — это производство железа и его сплавов (сталь, чугун и др.).
Цветная металлургия — производство остальных металлов и их сплавов.
Широкое применение находят сплавы металлов. Наиболее распространенные сплавы железа — чугун и сталь.
Чугун — это сплав железа, в котором содержится 2-4 масс. % углерода, а также кремний, марганец и небольшие количества серы и фосфора.
Сталь — это сплав железа, в котором содержится 0,3-2 масс. % углерода и небольшие примеси других элементов.
Легированные стали — это сплавы железа с хромом, никелем, марганцем, кобальтом, ванадием, титаном и другими металлами. Добавление металлов придает стали дополнительные свойства. Так, добавление хрома придает сплаву прочность, а добавление никеля придает стали пластичность.
Основные стадии металлургических процессов:
- Обогащение природной руды (очистка, удаление примесей)
- Получение металла или его сплава.
- Механическая обработка металла
1. Нахождение металлов в природе
Большинство металлов встречаются в природе в виде соединений. Наиболее распространенный металл в земной коре — алюминий. Затем железо, кальций, натрий и другие металлы.
2. Получение активных металлов
Активные металлы (щелочные и щелочноземельные) классическими «химическими» методами получить из соединений нельзя. Такие металлы в виде ионов — очень слабые окислители, а в простом виде — очень сильные восстановители, поэтому их очень сложно восстановить из катионов в простые вещества. Чем активнее металл, тем сложнее его получить в чистом виде — ведь он стремится прореагировать с другими веществами.
Получить такие металлы можно, как правило, электролизом расплавов солей, либо вытеснением из солей другими металлами в жестких условиях.
Натрий в промышленности получают электролизом расплава хлорида натрия с добавками хлорида кальция:
2NaCl = 2Na + Cl2
Калий получают пропусканием паров натрия через расплав хлорида калия при 800°С:
KCl + Na = K↑ + NaCl
Литий можно получить электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
2LiCl = 2Li + Cl2
Цезий можно получить нагреванием смеси хлорида цезия и специально подготовленного кальция:
Са + 2CsCl = 2Cs + CaCl2
Магний получают электролизом расплавленного карналлита или хлорида магния с добавками хлорида натрия при 720–750°С:
Кальций получают электролизом расплавленного хлорида кальция с добавками фторида кальция:
Барий получают из оксида восстановлением алюминием в вакууме при 1200 °C:
4BaO+ 2Al = 3Ba + Ba(AlO2)2
Алюминий получают электролизом раствора оксида алюминия Al2O3 в криолите Na3AlF6:
3. Получение малоактивных и неактивных металлов
Металлы малоактивные и неактивные восстанавливают из оксидов углем, оксидом углерода (II) СО или более активным металлом. Сульфиды металлов сначала обжигают.
3.1. Обжиг сульфидов
При обжиге сульфидов металлов образуются оксиды:
2ZnS + 3O2 → 2ZnO + 2SO2
Металлы получают дальнейшим восстановлением оксидов.
3.2. Восстановление металлов углем
Чистые металлы можно получить восстановлением из оксидов углем. При этом до металлов восстанавливаются только оксиды металлов, расположенных в ряду электрохимической активности после алюминия.
Например , железо получают восстановлением из оксида углем:
2Fe2O3 + 6C → 2Fe + 6CO
ZnO + C → Zn + CO
Оксиды металлов, расположенных в ряду электрохимической активности до алюминия, реагируют с углем с образованием карбидов металлов:
CaO + 3C → CaC2 + CO
3.3. Восстановление металлов угарным газом
Оксид углерода (II) реагирует с оксидами металлов, расположенных в ряду электрохимической активности после алюминия.
Например , железо можно получить восстановлением из оксида с помощью угарного газа:
3.4. Восстановление металлов более активными металлами
Более активные металлы вытесняют из оксидов менее активные. Активность металлов можно примерно оценить по электрохимическому ряду металлов:
Восстановление металлов из оксидов другими металлами — распространенный способ получения металлов. Часто для восстановления металлов применяют алюминий и магний. А вот щелочные металлы для этого не очень подходят – они слишком химически активны, что создает сложности при работе с ними.
Алюмотермия – это восстановление металлов из оксидов алюминием.
Например : алюминий восстанавливает оксид меди (II) из оксида:
3CuO + 2Al = Al2O3 + 3Cu
Магниетермия – это восстановление металлов из оксидов магнием.
CuO + Mg = Cu + MgO
Железо можно вытеснить из оксида с помощью алюминия:
При алюмотермии образуется очень чистый, свободный от примесей углерода металл.
Активные металлы вытесняют менее активные из растворов их солей.
Например , при добавлении меди (Cu) в раствор соли менее активного металла – серебра (AgNO3) произойдет химическая реакция:
2AgNO3 + Cu = Cu(NO3)2 + 2Ag
Медь покроется белыми кристаллами серебра.
При добавлении железа (Fe) в раствор соли меди (CuSO4) на железном гвозде появился розовый налет металлической меди:
CuSO4 + Fe = FeSO4 + Cu
При добавлении цинка в раствор нитрата свинца (II) на цинке образуется слой металлического свинца:
3.5. Восстановление металлов из оксидов водородом
Водород восстанавливает из оксидов только металлы, расположенные в ряду активности правее алюминия. Как правило, взаимодействие оксидов металлов с водородом протекает в жестких условиях – под давлением или при нагревании.
CuO + H2 = Cu + H2O
4. Производство чугуна
Чугун получают из железной руды в доменных печах.
Печь последовательно загружают сверху шихтой, флюсами, коксом, затем снова рудой, коксом и т.д.

1- загрузочное устройство, 2 — колошник, 3 — шахта, 4 — распар, 5 — горн, 6 — регенератор
Доменная печь имеет форму двух усеченных конусов, соединенных основаниями. Верхняя часть доменной печи — колошник, средняя — шахта, а нижняя часть — распар.
В нижней части печи находится горн. Внизу горна скапливается чугун и шлак и отверстия, через которые чугун и шлак покидают горн: чугун через нижнее, а шлак через верхнее.
Наверху печи расположено автоматическое загрузочное устройство. Оно состоит из двух воронок, соединенных друг с другом. Руда и кокс сначала поступают в верхнюю воронку, а затем в нижнюю.
Из нижней воронки руда и кокс поступают в печь. во время загрузки руды и кокса печь остается закрытой, поэтому газы не попадают в атмосферу, а попадают в регенераторы. В регенераторах печной газ сгорает.
Шихта — это железная руда, смешанная с флюсами.
Снизу в печь вдувают нагретый воздух, обогащенный кислородом, кокс сгорает:
Образующийся углекислый газ поднимается вверх и окисляет кокс до оксида углерода (II):
CO2 + С = 2CO
Оксид углерода (II) (угарный газ) — это основной восстановитель железа из оксидов в данных процессах. Последовательность восстановления железа из оксида железа (III):
Последовательность восстановления оксида железа (III):
FeO + CO → Fe + CO2
Суммарное уравнение протекающих процессов:
При этом протекает также частичное восстановление примесей оксидов других элементов (кремния, марганца и др.). Эти вещества растворяются в жидком железе.
Чтобы удалить из железной руды тугоплавкие примеси (оксид кремния (IV) и др.). Для их удаления используют флюсы и плавни (как правило, известняк CaCO3 или доломит CaCO3·MgCO3). Флюсы разлагаются при нагревании:
и образуют с тугоплавкими примесями легкоплавкие вещества (шлаки), которые легко можно удалить из реакционной смеси:
Электролиз
Электролиз (греч. elektron - янтарь + lysis — разложение) - химическая реакция, происходящая при прохождении постоянного тока через электролит. Это разложение веществ на их составные части под действием электрического тока.
Процесс электролиза заключается в перемещении катионов (положительно заряженных ионов) к катоду (заряжен отрицательно), и отрицательно заряженных ионов (анионов) к аноду (заряжен положительно).
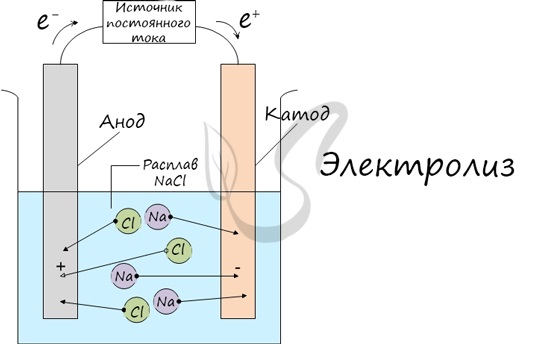
Итак, анионы и катионы устремляются соответственно к аноду и катоду. Здесь и происходит химическая реакция. Чтобы успешно решать задания по этой теме и писать реакции, необходимо разделять процессы на катоде и аноде. Именно так и будет построена эта статья.
Катод
К катоду притягиваются катионы - положительно заряженные ионы: Na + , K + , Cu 2+ , Fe 3+ , Ag + и т.д.
Чтобы установить, какая реакция идет на катоде, прежде всего, нужно определиться с активностью металла: его положением в электрохимическом ряду напряжений металлов.
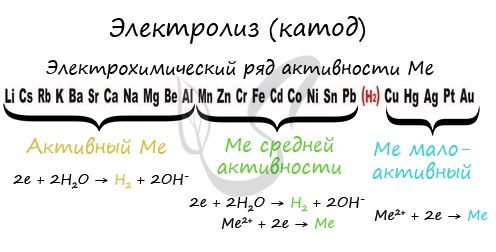
Если на катоде появился активный металл (Li, Na, K) то вместо него восстанавливаются молекулы воды, из которых выделяется водород. Если металл средней активности (Cr, Fe, Cd) - на катоде выделяется и водород, и сам металл. Малоактивные металлы выделяются на катоде в чистом виде (Cu, Ag).
Замечу, что границей между металлами активными и средней активности в ряду напряжений считается алюминий. При электролизе на катоде металлы до алюминия (включительно!) не восстанавливаются, вместо них восстанавливаются молекулы воды - выделяется водород.
В случае, если на катод поступают ионы водорода - H + (например при электролизе кислот HCl, H2SO4) восстанавливается водород из молекул кислоты: 2H + - 2e = H2
К аноду притягиваются анионы - отрицательно заряженные ионы: SO4 2- , PO4 3- , Cl - , Br - , I - , F - , S 2- , CH3COO - .

При электролизе кислородсодержащих анионов: SO4 2- , PO4 3- - на аноде окисляются не анионы, а молекулы воды, из которых выделяется кислород.
Бескислородные анионы окисляются и выделяют соответствующие галогены. Сульфид-ион при оксилении окислении серу. Исключением является фтор - если он попадает анод, то разряжается молекула воды и выделяется кислород. Фтор - самый электроотрицательный элемент, поэтому и является исключением.
Анионы органических кислот окисляются особым образом: радикал, примыкающий к карбоксильной группе, удваивается, а сама карбоксильная группа (COO) превращается в углекислый газ - CO2.
Примеры решения
В процессе тренировки вам могут попадаться металлы, которые пропущены в ряду активности. На этапе обучения вы можете пользоваться расширенным рядом активности металлов.
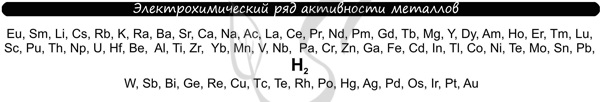
Теперь вы точно будете знать, что выделяется на катоде ;-)
Итак, потренируемся. Выясним, что образуется на катоде и аноде при электролизе растворов AgCl, Cu(NO3)2, AlBr3, NaF, FeI2, CH3COOLi.

Иногда в заданиях требуется записать реакцию электролиза. Сообщаю: если вы понимаете, что образуется на катоде, а что на аноде, то написать реакцию не составляет никакого труда. Возьмем, например, электролиз NaCl и запишем реакцию:
NaCl + H2O → H2 + Cl2 + NaOH (обычно в продуктах оставляют именно запись "NaOH", не подвергая его дальнейшему электролизу)
Натрий - активный металл, поэтому на катоде выделяется водород. Анион не содержит кислорода, выделяется галоген - хлор. Мы пишем уравнение, так что не можем заставить натрий испариться бесследно :) Натрий вступает в реакцию с водой, образуется NaOH.
Запишем реакцию электролиза для CuSO4:
Медь относится к малоактивным металлам, поэтому сама в чистом виде выделяется на катоде. Анион кислородсодержащий, поэтому в реакции выделяется кислород. Сульфат-ион никуда не исчезает, он соединяется с водородом воды и превращается в серую кислоту.
Электролиз расплавов
Все, что мы обсуждали до этого момента, касалось электролиза растворов, где растворителем является вода.
Перед промышленной химией стоит важная задача - получить металлы (вещества) в чистом виде. Малоактивные металлы (Ag, Cu) можно легко получать методом электролиза растворов.
Но как быть с активными металлами: Na, K, Li? Ведь при электролизе их растворов они не выделяются на катоде в чистом виде, вместо них восстанавливаются молекулы воды и выделяется водород. Тут нам как раз пригодятся расплавы, которые не содержат воды.
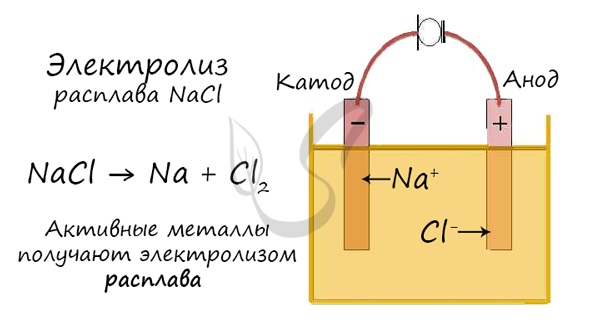
В безводных расплавах реакции записываются еще проще: вещества распадаются на составные части:
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Щелочные металлы
К щелочным металлам относят химические элементы: одновалентные металлы, составляющие Ia группу: литий, натрий, калий, рубидий, цезий и франций.
Эти металлы очень активны, быстро окисляются на воздухе и бурно реагируют с водой. Их хранят под слоем керосина из-за их сильной реакционной способности.

Общая характеристика
От Li к Fr (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств, реакционной способности. Уменьшается электроотрицательность, энергия ионизации, сродство к электрону.

- Li - 2s 1
- Na - 3s 1
- K - 4s 1
- Rb - 5s 1
- Cs - 6s 1
- Fr - 7s 1
Природные соединения
- NaCl - галит (каменная соль)
- KCl - сильвин
- NaCl*KCl - сильвинит

Получение
Получить такие активные металлы электролизом водного раствора - невозможно. Для их получения применяют электролиз расплавов при высоких температурах (естественно - безводных):
NaCl → Na + Cl2↑ (электролиз расплава каменной соли)
Химические свойства
Одной из особенностей щелочных металлов является их реакция с кислородом. Литий в такой реакции преимущественно образует оксид, натрий - пероксид, калий, рубидий и цезий - супероксиды.
K + O2 → KO2 (супероксид калия)
Помните, что металлы никогда не принимают отрицательных степеней окисления. Щелочные металлы одновалентны, и проявляют постоянную степень окисления +1 в различных соединениях: гидриды, галогениды (фториды, хлориды, бромиды и йодиды), нитриды, сульфиды и т.д.
Li + H2 → LiH (в гидридах водород -1)
Na + F2 → NaF (в фторидах фтор -1)
Na + S → Na2S (в сульфидах сера -2)
K + N2 → K3N (в нитридах азот -3)
Щелочные металлы бурно взаимодействуют с водой, при этом часто происходит воспламенение, а иногда - взрыв.
Na + H2O → NaOH + H2↑ (воду можно представить в виде HOH - натрий вытесняет водород)
Иногда в задачах может проскользнуть фраза такого плана: ". в ходе реакции выделился металл, окрашивающий пламя горелки в желтый цвет". Тут вы сразу должны догадаться: речь, скорее всего, про натрий.
Щелочные металлы по-разному окрашивают пламя. Литий окрашивает в алый цвет, натрий - в желтый, калий - в фиолетовый, рубидий - синевато-красный, цезий - синий.

Оксиды щелочных металлов
Имеют общую формулу R2O, например: Na2O, K2O.
Получение оксидов щелочных металлов возможно в ходе реакции с кислородом. Для лития все совсем несложно:
В подобных реакциях у натрия и калия получается соответственно пероксид и супероксид, что приводит к затруднениям. Как из пероксида, так и из супероксида, при желании можно получить оксид:
По свойствам эти оксиды являются основными. Они хорошо реагируют c водой, кислотными оксидами и кислотами:
Li2O + H2O → LiOH (осн. оксид + вода = основание - реакция идет, только если основание растворимо)
Na2O + SO2 → Na2SO3 (обратите внимание - мы сохраняем СО серы +4)
Гидроксиды щелочных металлов
Относятся к щелочам - растворимым основаниям. Наиболее известные представители: NaOH - едкий натр, KOH - едкое кали.
Гидроксиды щелочных металлов получаются в ходе электролиза водных растворов их солей, в реакциях обмена, в реакции щелочных металлов и их оксидов с водой:
KCl + H2O → (электролиз!) KOH + H2 + Cl2 (на катоде выделяется водород, на аноде - хлор)

Проявляют основные свойства. Хорошо реагируют с кислотами, кислотными оксидами и солями, если в ходе реакции выпадает осадок, выделяется газ или образуется слабый электролит (вода).
LiOH + H2SO4 → LiHSO4 + H2O (соотношение 1:1, кислота в избытке - получается кислая соль)
2LiOH + H2SO4 → Li2SO4 + 2H2O (соотношение 2:1, основание в избытке - получается средняя соль)
KOH + SO2 → KHSO3 (соотношение 1:1 - получается кислая соль)
2KOH + SO2 → K2SO3 + H2O (соотношение 2:1 - получается средняя соль)
С амфотерными гидроксидами реакции протекают с образованием комплексных солей (в водном растворе) или с образованием окиселов - смешанных оксидов (при высоких температурах - прокаливании).
NaOH + Al(OH)3 → Na[Al(OH)4] (в водном растворе образуются комплексные соли)
NaOH + Al(OH)3 → NaAlO2 + H2O (при прокаливании образуется окисел - смесь двух оксидов: Al2O3 и Na2O, вода испаряется)
Реакции щелочей с галогенами заслуживают особого внимания. Без нагревания они идут по одной схеме, а при нагревании эта схема меняется:
NaOH + Cl2 → NaClO + NaCl + H2O (без нагревания хлор переходит в СО +1 и -1)
NaOH + Cl2 → NaClO3 + NaCl + H2O (с нагреванием хлор переходит в СО +5 и -1)
В реакциях щелочей с йодом образуется исключительно иодат, так как гипоиодит неустойчив даже при комнатной температуре, не говоря о нагревании. С серой реакция протекает схожим образом:
NaOH + I2 → NaIO3 + NaI + H2O (с нагреванием)

NaOH + S → Na2S + Na2SO3 + H2O (сера переходит в СО -2 и +4)
Уникальным является также взаимодействие щелочей с кислотным оксидом NO2, который соответствует сразу двум кислотам - и азотной, и азотистой.
Щелочные металлы. Химия щелочных металлов и их соединений

Щелочные металлы расположены в главной подгруппе первой группы периодической системы химических элементов Д.И. Менделеева (или просто в 1 группе в длиннопериодной форме ПСХЭ). Это литий Li, натрий Na, калий K, цезий Cs, рубидий Rb и франций Fr.
Электронное строение щелочных металлов и основные свойства
Электронная конфигурация внешнего энергетического уровня щелочных металлов: ns 1 , на внешнем энергетическом уровне находится 1 s-электрон. Следовательно, типичная степень окисления щелочных металлов в соединениях +1.
Рассмотрим некоторые закономерности изменения свойств щелочных металлов.
В ряду Li-Na-K-Rb-Cs-Fr, в соответствии с Периодическим законом, увеличивается атомный радиус , усиливаются металлические свойства , ослабевают неметаллические свойства , уменьшается электроотрица-тельность .

Физические свойства
Все щелочные металлы — вещества мягкие, серебристого цвета. Свежесрезанная поверхность их обладает характерным блеском.

Кристаллическая решетка щелочных металлов в твёрдом состоянии — металлическая. Следовательно, щелочные металлы обладают высокой тепло- и электропроводимостью. Кипят и плавятся при низких температурах. Они имеют также небольшую плотность.

Нахождение в природе
Как правило, щелочные металлы в природе присутствуют в виде минеральных солей: хлоридов, бромидов, йодидов, карбонатов, нитратов и др. Основные минералы , в которых присутствуют щелочные металлы:
Поваренная соль, каменная соль, галит — NaCl — хлорид натрия

Сильвин KCl — хлорид калия

Сильвинит NaCl · KCl

Глауберова соль Na2SO4⋅10Н2О – декагидрат сульфата натрия

Едкое кали KOH — гидроксид калия
Поташ K2CO3 – карбонат калия
Поллуцит — алюмосиликат сложного состава с высоким содержанием цезия:

Способы получения
Литий получают в промышленности электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
2LiCl = 2Li + Cl2
Натрий получают электролизом расплава хлорида натрия с добавками хлорида кальция:
2NaCl (расплав) → 2Na + Cl2
Электролитом обычно служит смесь NaCl с NaF и КСl (что позволяет проводить процесс при 610–650°С).
Калий получают также электролизом расплавов солей или расплава гидроксида калия. Также распространены методы термохимического восстановления: восстановление калия из расплавов хлоридов или гидроксидов. В качестве восстановителей используют пары натрия, карбид кальция, алюминий, кремний:
KCl + Na = K↑ + NaCl
KOH + Na = K↑ + NaOH
Са + 2CsCl → 2Cs + CaCl2
В промышленности используют преимущественно физико-химические методы выделения чистого цезия: многократную ректификацию в вакууме.
Качественные реакции
Качественная реакция на щелочные металлы — окрашивание пламени солями щелочных металлов .

Цвет пламени:
Li — карминно-красный
Na — жѐлтый
K — фиолетовый
Rb — буро-красный
Cs — фиолетово-красный
Химические свойства
1. Щелочные металлы — сильные восстановители . Поэтому они реагируют почти со всеми неметаллами .
1.1. Щелочные металлы легко реагируют с галогенами с образованием галогенидов:
2K + I2 = 2KI
1.2. Щелочные металлы реагируют с серой с образованием сульфидов:
2Na + S = Na2S
1.3. Щелочные металлы активно реагируют с фосфором и водородом (очень активно). При этом образуются бинарные соединения — фосфиды и гидриды:
3K + P = K3P
2Na + H2 = 2NaH
1.4. С азотом литий реагирует при комнатной температуре с образованием нитрида:
Остальные щелочные металлы реагируют с азотом при нагревании.
1.5. Щелочные металлы реагируют с углеродом с образованием карбидов, преимущественно ацетиленидов:
1.6. При взаимодействии с кислородом каждый щелочной металл проявляет свою индивидуальность: при горении на воздухе литий образует оксид, натрий – преимущественно пероксид, калий и остальные металлы – надпероксид.
Цезий самовозгорается на воздухе, поэтому его хранят в запаянных ампулах. Видеоопыт самовозгорания цезия на воздухе можно посмотреть здесь.
2. Щелочные металлы активно взаимодействуют со сложными веществами:
2.1. Щелочные металлы бурно (со взрывом) реагируют с водой . Взаимодействие щелочных металлов с водой приводит к образованию щелочи и водорода. Литий реагирует бурно, но без взрыва.
Например , калий реагирует с водой очень бурно:
2K 0 + H2 + O = 2 K + OH + H2 0

Видеоопыт: взаимодействие щелочных металлов с водой можно посмотреть здесь.
2.2. Щелочные металлы взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой) со взрывом. При этом образуются соль и водород.
Например , натрий бурно реагирует с соляной кислотой :
2Na + 2HCl = 2NaCl + H2↑
2.3. При взаимодействии щелочных металлов с концентрированной серной кислотой выделяется сероводород.
Например , при взаимодействии натрия с концентрированной серной кислотой образуется сульфат натрия, сероводород и вода:
2.4. Щелочные металлы реагируют с азотной кислотой. При взаимодействии с концентрированной азотной кислотой образуется оксид азота (I):
С разбавленной азотной кислотой образуется молекулярный азот:
При взаимодействии щелочных металлов с очень разбавленной азотной кислотой образуется нитрат аммония:
2.5. Щелочные металлы могут реагировать даже с веществами, которые проявляют очень слабые кислотные свойства . Например, с аммиаком, ацетиленом (и прочими терминальными алкинами), спиртами , фенолом и органическими кислотами .
Например , при взаимодействии лития с аммиаком образуются амиды и водород:
Ацетилен с натрием образует ацетиленид натрия и также водород:
Н ─ C ≡ С ─ Н + 2Na → Na ─ C≡C ─ Na + H2
Фенол с натрием реагирует с образованием фенолята натрия и водорода:
Метанол с натрием образуют метилат натрия и водород:
Уксусная кислота с литием образует ацетат лития и водород:
2СH3COOH + 2Li → 2CH3COOLi + H2↑
Щелочные металлы реагируют с галогеналканами (реакция Вюрца).
Например , хлорметан с натрием образует этан и хлорид натрия:
2.6. В расплаве щелочные металлы могут взаимодействовать с некоторыми солями . Обратите внимание! В растворе щелочные металлы будут взаимодействовать с водой, а не с солями других металлов.
Например , натрий взаимодействует в расплаве с хлоридом алюминия :
3Na + AlCl3 → 3NaCl + Al
Оксиды щелочных металлов
Оксиды щелочных металлов (кроме лития) можно получить только к освенными методами : взаимодействием натрия с окислителями в расплаве:
1. О ксид натрия можно получить взаимодействием натрия с нитратом натрия в расплаве:
2. Взаимодействием натрия с пероксидом натрия :
3. Взаимодействием натрия с расплавом щелочи :
2Na + 2NaOН → 2Na2O + Н2↑
4. Оксид лития можно получить разложением гидроксида лития :
2LiOН → Li2O + Н2O
Химические свойства
Оксиды щелочных металлов — типичные основные оксиды . Вступают в реакции с кислотными и амфотерными оксидами, кислотами, водой.
1. Оксиды щелочных металлов взаимодействуют с кислотными и амфотерными оксидами :
Например , оксид натрия взаимодействует с оксидом фосфора (V):
Оксид натрия взаимодействует с амфотерным оксидом алюминия:
2. Оксиды щелочных металлов взаимодействуют с кислотами с образованием средних и кислых солей (с многоосновными кислотами).
Например , оксид калия взаимодействует с соляной кислотой с образованием хлорида калия и воды:
K2O + 2HCl → 2KCl + H2O
3. Оксиды щелочных металлов активно взаимодействуют с водой с образованием щелочей.
Например , оксид лития взаимодействует с водой с образованием гидроксида лития:
Li2O + H2O → 2LiOH
4. Оксиды щелочных металлов окисляются кислородом (кроме оксида лития): оксид натрия — до пероксида, оксиды калия, рубидия и цезия – до надпероксида.
Пероксиды щелочных металлов
Свойства пероксидов очень похожи на свойства оксидов. Однако пероксиды щелочных металлов, в отличие от оксидов, содержат атомы кислорода со степенью окисления -1. Поэтому они могут могут проявлять как окислительные , так и восстановительные свойства.
1. Пероксиды щелочных металлов взаимодействуют с водой . При этом на холоде протекает обменная реакция, образуются щелочь и пероксид водорода:
При нагревании пероксиды диспропорционируют в воде, образуются щелочь и кислород:
2. Пероксиды диспропорционируют при взаимодействии с кислотными оксидами .
Например , пероксид натрия реагирует с углекислым газом с образованием карбоната натрия и кислорода:
3. При взаимодействии с минеральными кислотами на холоде пероксиды вступают в обменную реакцию. При этом образуются соль и перекись водорода:
При нагревании пероксиды, опять-таки, диспропорционируют:
4. Пероксиды щелочных металлов разлагаются при нагревании, с образованием оксида и кислорода:
5. При взаимодействии с восстановителями пероксиды проявляют окислительные свойства.
Например , пероксид натрия с угарным газом реагирует с образованием карбоната натрия:
Пероксид натрия с сернистым газом также вступает в ОВР с образованием сульфата натрия:
6. При взаимодействии с сильными окислителями пероксиды проявляют свойства восстановителей и окисляются, как правило, до молекулярного кислорода.
Например , при взаимодействии с подкисленным раствором перманганата калия пероксид натрия образует соль и молекулярный кислород:
Гидроксиды щелочных металлов (щелочи)
1. Щелочи получают электролизом растворов хлоридов щелочных метал-лов:
2NaCl + 2H2O → 2NaOH + H2 + Cl2
2. При взаимодействии щелочных металлов, их оксидов, пероксидов, гидридов и некоторых других бинарных соединений с водой также образуются щелочи.
Например , натрий, оксид натрия, гидрид натрия и пероксид натрия при растворении в воде образуют щелочи:
2Na + 2H2O → 2NaOH + H2
Na2O + H2O → 2NaOH
2NaH + 2H2O → 2NaOH + H2
3. Некоторые соли щелочных металлов (карбонаты, сульфаты и др.) при взаимодействии с гидроксидами кальция и бария также образуют щелочи.
Например , карбонат калия с гидроксидом кальция образует карбонат кальция и гидроксид калия:
1. Гидроксиды щелочных металлов реагируют со всеми кислотами (и сильными, и слабыми, и растворимыми, и нерастворимыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Например , гидроксид калия с фосфорной кислотой реагирует с образованием фосфатов, гидрофосфатов или дигидрофосфатов:
2. Гидроксиды щелочных металлов реагируют с кислотными оксидами . При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Например , гидроксид натрия с углекислым газом реагирует с образованием карбонатов или гидрокарбонатов:
Необычно ведет себя оксид азота (IV) при взаимодействии с щелочами. Дело в том, что этому оксиду соответствуют две кислоты — азотная (HNO3) и азотистая (HNO2). «Своей» одной кислоты у него нет. Поэтому при взаимодействии оксида азота (IV) с щелочами образуются две соли- нитрит и нитрат:
А вот в присутствии окислителя, например, молекулярного кислорода, образуется только одна соль — нитрат, т.к. азот +4 только повышает степень окисления:
3. Гидроксиды щелочных металлов реагируют с амфотерными оксидами и гидроксидами . При этом в расплаве образуются средние соли, а в растворе комплексные соли.
Например , гидроксид натрия с оксидом алюминия реагирует в расплаве с образованием алюминатов:
в растворе образуется комплексная соль — тетрагидроксоалюминат:
Еще пример : гидроксид натрия с гидроксидом алюминия в расплаве образут также комплексную соль:
4. Щелочи также взаимодействуют с кислыми солями. При этом образуются средние соли, или менее кислые соли.
Например : гидроксид калия реагирует с гидрокарбонатом калия с образованием карбоната калия:
5. Щелочи взаимодействуют с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода).
При этом кремний окисляется щелочами до силиката и водорода:
Фтор окисляет щелочи. При этом выделяется молекулярный кислород:
Другие галогены, сера и фосфор — диспропорционируют в щелочах:
Сера взаимодействует с щелочами только при нагревании:
6. Щелочи взаимодействуют с амфотерными металлами , кроме железа и хрома . При этом в расплаве образуются соль и водород:
В растворе образуются комплексная соль и водород:
2NaOH + 2Al + 6Н2О = 2Na[Al(OH)4] + 3Н2
7. Гидроксиды щелочных металлов вступают в обменные реакции с растворимыми солями .
С щелочами взаимодействуют соли тяжелых металлов.
Например , хлорид меди (II) реагирует с гидроксидом натрия с образованием хлорида натрия и осадка гидроксида меди (II):
2NaOH + CuCl2 = Cu(OH)2↓+ 2NaCl
Также с щелочами взаимодействуют соли аммония.
Например , при взаимодействии хлорида аммония и гидроксида натрия образуются хлорид натрия, аммиак и вода:
NH4Cl + NaOH = NH3 + H2O + NaCl
8. Гидроксиды всех щелочных металлов плавятся без разложения , гидроксид лития разлагается при нагревании до температуры 600°С:
2LiOH → Li2O + H2O
9. Все гидроксиды щелочных металлов проявляют свойства сильных оснований . В воде практически нацело диссоциируют , образуя щелочную среду и меняя окраску индикаторов.
NaOH ↔ Na + + OH —
10. Гидроксиды щелочных металлов в расплаве подвергаются электролизу . При этом на катоде восстанавливаются сами металлы, а на аноде выделяется молекулярный кислород:
4NaOH → 4Na + O2 + 2H2O
Соли щелочных металлов
Нитраты и нитриты щелочных металлов
Нитраты щелочных металлов при нагревании разлагаются на нитриты и кислород. Исключение — нитрат лития. Он разлагается на оксид лития, оксид азота (IV) и кислород.
Например , нитрат натрия разлагается при нагревании на нитрит натрия и молекулярный кислород:
Нитраты щелочных металлов в реакциях могут выступать в качестве окислителей.
Нитриты щелочных металлов могут быть окислителями или восстановителями.
В щелочной среде нитраты и нитриты — очень мощные окислители.
Например , нитрат натрия с цинком в щелочной среде восстанавливается до аммиака:
Сильные окислители окисляют нитриты до нитратов.
Например , перманганат калия в кислой среде окисляет нитрит натрия до нитрата натрия:
Электролиз
Химические реакции, сопровождающиеся переносом электронов (окислительно-восстановительные реакции) делятся на два типа: реакции, протекающие самопроизвольно и реакции, протекающие при прохождении тока через раствор или расплав электролита.
Раствор или расплав электролита помещают в специальную емкость — электролитическую ванну .
Электрический ток — это упорядоченное движение заряженных частиц — ионов, электронов и др. под действием внешнего электрического поля. Электрическое поле в растворе или расплаве электролита создают электроды .
Электроды — это, как правило, стержни из материала, проводящего электрический ток. Их помещают в раствор или расплав электролита, и подключают к электрической цепи с источником питания.
При этом отрицательно заряженный электрод катод — притягивает положительно заряженные ионы — катионы . Положительно заряженный электрод ( анод ) притягивает отрицательно заряженные частицы ( анионы ). Катод выступает в качестве восстановителя, а анод — в качестве окислителя.

Различают электролиз с активными и инертными электродами. Активные (растворимые) электроды подвергаются химическим превращениям в процессе электролиза. Обычно их изготавливают из меди, никеля и других металлов. Инертные (нерастворимые) электроды химическим превращениям не подвергаются. Их изготавливают из неактивных металлов, например, платины , или графита .
Электролиз растворов
Различают электролиз раствора или расплава химического вещества. В растворе присутствует дополнительное химическое вещество — вода, которая может принимать участие в окислительно-восстановительных реакциях.
Катодные процессы
В растворе солей катод притягивает катионы металлов. Катионы металлов могут выступать в качестве окислителей. Окислительные способности ионов металлов различаются. Для оценки окислительно-восстановительных способностей металлов применяют электро-химический ряд напряжений :

Каждый металл характеризуется значением электрохимического потен-циала. Чем меньше потенциал , тем больше восстановительные свойства металла и тем меньше окислительные свойства соответствующего иона этого металла. Разным ионам соответствуют разные значения этого потенциала. Электрохимический потенциал — относительная величина. Электрохимический потенциал водорода принят равным нулю.
Также около катода находятся молекулы воды Н2О. В составе воды есть окислитель — ион H + .
При электролизе растворов солей на катоде наблюдаются следующие закономерности:
1. Если металл в соли — активный ( до Al 3+ включительно в ряду напряжений ), то вместо металла на катоде восстанавливается (разряжается) водород , т.к. потенциал водорода намного больше. Протекает процесс восстановления молекулярного водорода из воды, при этом образуются ионы OH — , среда возле катода — щелочная:
2H2O +2ē → H2 + 2OH —
Например , при электролизе раствора хлорида натрия на катоде будет вос-станавливаться только водород из воды.
2. Если металл в соли – средней активности (между Al 3+ и Н + ) , то на катоде восстанавливается (разряжается) и металл , и водород , так как потенциал таких металлов сравним с потенциалом водорода:
Me n+ + nē → Me 0
2 H + 2O +2ē → H2 0 + 2OH —
Например , при электролизе раствора сульфата железа (II) на катоде будет восстанавливаться (разряжаться) и железо, и водород:
Fe 2+ + 2ē → Fe 0
3. Если металл в соли — неактивный (после водорода в ряду стандартных электрохимических металлов) , то ион такого металла является более сильным окислителем, чем ион водорода, и на катоде восстанавливается только металл:
Например, при электролизе раствора сульфата меди (II) на катоде будет восстанавливаться медь:
Cu 2+ + 2ē → Cu 0
4. Если на катод попадают катионы водорода H + , то они и восстанавливаются до молекулярного водорода:
2H + + 2ē → H2 0
Анодные процессы
Положительно заряженный анод притягивает анионы и молекулы воды. Анод – окислитель. В качестве восстановителей выступаю либо анионы кислотных остаток, либо молекулы воды (за счет кислорода в степени окисления -2: H 2 O -2 ).
При электролизе растворов солей на аноде наблюдаются следующие закономерности:
1. Если на анод попадает бескислородный кислотный остаток , то он окисляется до свободного состояния (до степени окисления 0):
неМе n- – nē = неМе 0
Например : при электролизе раствора хлорида натрия на аноде окисляют-ся хлорид-ионы:
2Cl — – 2ē = Cl2 0
Действительно, если вспомнить Периодический закон: при увеличении электроотрицательности неметалла его восстановительные свойства уменьшаются. А кислород – второй по величине электроотрицательности элемент. Таким образом, проще окислить практически любой неметалл, а не кислород. Правда, есть одно исключение . Наверное, вы уже догадались. Конечно же, это фтор. Ведь электроотрицательность фтора больше, чем у кислорода. Таким образом, при электролизе растворов фторидов окисляться будут именно молекулы воды, а не фторид-ионы :
2H2 O -2 – 4ē → O2 0 + 4H +
2. Если на анод попадает кислородсодержащий кислотный остаток, либо фторид-ион , то окислению подвергается вода с выделением молекулярно-го кислорода:
3. Если на анод попадает гидроксид-ион, то он окисляется и происходит выделение молекулярного кислорода:
4 O -2 H – – 4ē → O2 0 + 2H2O
4. При электролизе растворов солей карбоновых кислот окислению под-вергается атом углерода карбоксильной группы, выделяется углекислый газ и соответствующий алкан.
Например , при электролизе растворов ацетатов выделяется углекислый газ и этан:
2 CH3 C +3 OO – –2ē → 2 C +4 O2+ CH3-CH3
Суммарные процессы электролиза
Рассмотрим электролиз растворов различных солей.
Например , электролиз раствора сульфата меди. На катоде восстанавливаются ионы меди:
Катод (–): Cu 2+ + 2ē → Cu 0
На аноде окисляются молекулы воды:
Анод (+): 2H2 O -2 – 4ē → O2 + 4H +
Сульфат-ионы в процессе не участвуют. Мы их запишем в итоговом уравнении с ионами водорода в виде серной кислоты:
2 Cu 2+ SO4 + 2H2 O -2 → 2 Cu 0 + 2H2SO4 + O2 0
Электролиз раствора хлорида натрия выглядит так:
На катоде восстанавливается водород:
Катод (–): 2 H + 2O +2ē → H2 0 + 2OH –
На аноде окисляются хлорид-ионы:
Анод (+): 2 Cl – – 2ē → Cl2 0
Ионы натрия в процессе электролиза не участвуют. Мы записываем их с гидроксид-анионами в суммарном уравнении электролиза раствора хлорида натрия :
2 H + 2O +2Na Cl – → H2 0 + 2NaOH + Cl2 0
Следующий пример : электролиз водного раствора карбоната калия.
На катоде восстанавливается водород из воды:
На аноде окисляются молекулы воды до молекулярного кислорода:
Анод (+): 2H2 O -2 – 4ē → O2 0 + 4H +
Таким образом, при электролизе раствора карбоната калия ионы калия и карбонат-ионы в процессе не участвуют. Происходит электролиз воды:
2 H2 + O -2 → 2 H2 0 + O2 0
Еще один пример : электролиз водного раствора хлорида меди (II).
На катоде восстанавливается медь:
На аноде окисляются хлорид-ионы до молекулярного хлора:
Таким образом, при электролизе раствора карбоната калия происходит электролиз воды:
Cu 2+ Cl2 – → Cu 0 + Cl2 0
Еще несколько примеров: электролиз раствора гидроксида натрия.
На аноде окисляются гидроксид-ионы до молекулярного кислорода:
Анод (+): 4 O -2 H – – 4ē → O2 0 + 2H2O
Таким образом, при электролизе раствора гидроксида натрия происходит разложение воды, катионы натрия в процессе не участвуют:
Электролиз расплавов
При электролизе расплава на аноде окисляются анионы кислотных остатков, а на катоде восстанавливаются катионы металлов. Молекул воды в системе нет.
Например: электролиз расплава хлорида натрия. На катоде восстанавливаются катионы натрия:
Катод (–): Na + + ē → Na 0
На аноде окисляются анионы хлора:
Суммарное уравнение электролиза расплава хлорида натрия:
2 Na + Cl – → 2 Na 0 + Cl2 0

Еще один пример: электролиз расплава гидроксида натрия. На катоде восстанавливаются катионы натрия:
На аноде окисляются гидроксид-ионы:
Анод (+): 4 OH – – 4ē → O2 0 + 2H2O
Суммарное уравнение электролиза расплава гидроксида натрия:
4 Na + OH – → 4 Na 0 + O2 0 + 2H2O
Многие металлы получают в промышленности электролизом расплавов.
Например , алюминий получают электролизом раствора оксида алюминия в расплаве криолита. Криолит – Na3[AlF6] плавится при более низкой температуре (1100 о С), чем оксид алюминия (2050 о С). А оксид алюминия отлично растворяется в расплавленном криолите.
В растворе криолите оксид алюминия диссоциирует на ионы:
На катоде восстанавливаются катионы алюминия:
Катод (–): Al 3+ + 3ē → Al 0
На аноде окисляются алюминат-ионы:
Анод (+): 4Al O 3 3 – – 12ē → 2Al2O3 + 3 O2 0
Общее уравнение электролиза раствора оксида алюминия в расплаве криолита:
2 Al 2 О 3 = 4 Al 0 + 3 О 2 0

В промышленности при электролизе оксида алюминия в качестве электродов используют графитовые стержни. При этом электроды частично окисляются (сгорают) в выделяющемся кислороде:
C 0 + О2 0 = C +4 O2 -2
Электролиз с растворимыми электродами
Если материал электродов выполнен из того же металла, который присутствует в растворе в виде соли, или из более активного металла, то на аноде разряжаются не молекулы воды или анионы, а окисляются частицы самого металла в составе электрода.
Например , рассмотрим электролиз раствора сульфата меди (II) с медными электродами.
На катоде разряжаются ионы меди из раствора:
На аноде окисляются частицы меди из электрода :
Анод (+): Cu 0 – 2ē → Cu 2+
Читайте также:
