Щелочные металлы краткий конспект
Урок №47. Щелочные металлы. Положение щелочных металлов в периодической системе и строение атомов. Нахождение в природе. Физические и химические свойства. Применение щелочных металлов и их соединений.
ЩЕЛОЧНЫЕ МЕТАЛЛЫ
К щелочным металлам относятся элементы первой группы, главной подгруппы: литий, натрий, калий, рубидий, цезий, франций.
Нахождение в природе
Na-2,64% (по массе), K-2,5% (по массе), Li, Rb, Cs - значительно меньше, Fr- искусственно полученный элемент
NaCl – поваренная соль (каменная соль), галит
Na2SO4 • 10H2O – глауберова соль (мирабилит)
NaNO3 – чилийская селитра
KCl • NaCl – сильвинит
KCl • MgCl2 • 6H2O – карналлит
Свойства щелочных металлов
С увеличением порядкового номера атомный радиус увеличивается, способность отдавать валентные электроны увеличивается и восстановительная активность увеличивается:
Физические свойства
Низкие температуры плавления, малые значения плотностей, мягкие, режутся ножом.
Химические свойства
Типичные металлы, очень сильные восстановители. В соединениях проявляют единственную степень окисления +1. Восстановительная способность увеличивается с ростом атомной массы. Все соединения имеют ионный характер, почти все растворимы в воде. Гидроксиды R–OH – щёлочи, сила их возрастает с увеличением атомной массы металла.
Воспламеняются на воздухе при умеренном нагревании. С водородом образуют солеобразные гидриды. Продукты сгорания чаще всего пероксиды.
Восстановительная способность увеличивается в ряду Li–Na–K–Rb–Cs
2. Реакция с кислотами:
2Na + 2HCl → 2NaCl + H2
3. Реакция с кислородом:
K + O2 → KO2 (надпероксид калия)
На воздухе щелочные металлы мгновенно окисляются. Поэтому их хранят под слоем органических растворителей (керосин и др.).
4. В реакциях с другими неметаллами образуются бинарные соединения:
2Li + Cl2 → 2LiCl (галогениды)
2Na + S → Na2S (сульфиды)
2Na + H2 → 2NaH (гидриды)
5. Качественная реакция на катионы щелочных металлов - окрашивание пламени в следующие цвета:
K + , Rb + и Cs + – фиолетовый
Т.к. щелочные металлы - это самые сильные восстановители, их можно восстановить из соединений только при электролизе расплавов солей:
2NaCl=2Na+Cl2
Применение щелочных металлов
Литий - подшипниковые сплавы, катализатор
Натрий - газоразрядные лампы, теплоноситель в ядерных реакторах
Рубидий - научно-исследовательские работы
Оксиды, пероксиды и надпероксиды щелочных металлов
Получение
Окислением металла получается только оксид лития
(в остальных случаях получаются пероксиды или надпероксиды).
Все оксиды (кроме Li2O) получают при нагревании смеси пероксида (или надпероксида) с избытком металла:
Химические свойства
Типичные основные оксиды.
Реагируют с водой, кислотными оксидами и кислотами:
Пероксид натрия Na2O2
1. Сильный окислитель :
2. Разлагается водой:
Надпероксид калия KO2
1. Сильный окислитель:
Гидроксиды щелочных металлов – ROH
Белые, кристаллические вещества, гигроскопичны; хорошо растворимы в воде (с выделением тепла). В водных растворах нацело диссоциированы.
NaOH-едкий натр, каустическая сода, KOH-едкое кали
1. Электролиз растворов хлоридов:
2 NaCl + 2 H 2 O → 2 NaOH + H 2 + Cl 2
2. Обменные реакции между солью и основанием:
3. Взаимодействие металлов или их основных оксидов (или пероксидов и надпероксидов) с водой:
1. R–OH – сильные основания (щелочи) реагируют с кислотными оксидами и кислотами:
NaOH + HCl → NaCl + H2O ОПЫТ
2. Взаимодействуют с солями, если в продуктах образуется нерастворимое основание: 3NaOH + FeCl3 → Fe(OH)3↓+ 3NaCl
Типично ионные соединения, как правило - хорошо растворимы в воде, кроме некоторых солей лития.
Курс повышения квалификации
Химия окружающей среды

Педагогические основы деятельности учителя общеобразовательного учреждения в условиях ФГОС
Авторская разработка онлайн-курса

«Домашнее обучение. Лайфхаки для родителей»
Краткое описание документа:
Щелочные металлы. Положение щелочных металлов в периодической системе и строение атомов. Нахождение в природе. Физические и химические свойства. Применение щелочных металлов и их соединений.
ЩЕЛОЧНЫЕ МЕТАЛЛЫ
Нахождение в природе
Li
Na
K
Свойства щелочных металлов
Физические свойства
Химические свойства
2. Реакция с кислотами:
3. Реакция с кислородом:
4. В реакциях с другими неметаллами образуются бинарные соединения:
5. Качественная реакция на катионы щелочных металлов - окрашивание пламени в следующие цвета:
Щелочные металлы краткий конспект
Ключевые слова конспекта: щелочноземельные металлы, элементы IIA-группы, земли, получение щелочноземельных металлов.
ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ IIA ГРУППЫ
К щёлочноземельным металлам относят кальций Са, стронций Sr, барий Ва, радий Ra – металлы IIА-группы. Название «щёлочноземельные» обусловлено тем, что гидроксиды этих металлов относятся к щелочам – растворимым в воде основаниям, а оксиды этих металлов с древних времён называли землями. Бериллий и магний к щёлочноземельным металлам не относятся.
Важнейшие параметры элементов IIA группы приведены в таблице:
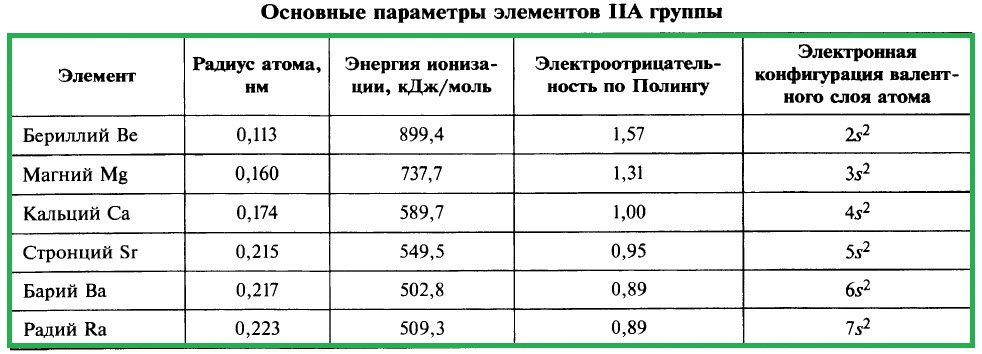
Электронная конфигурация валентного слоя атомов щёлочноземельных металлов в стационарном состоянии ns 2 . Щёлочноземельные металлы являются s-элементами. Во всех своих соединениях они имеют степень окисления +2.
Высшие оксиды щёлочноземельных металлов имеют состав МеО и проявляют основный характер. Высшие гидроксиды этих элементов Ме(ОН)2 являются типичными основаниями, их относят к щелочам, хотя их растворимость намного ниже, чем гидроксидов щелочных металлов. Водородные соединения щёлочноземельных металлов представляют собой твёрдые гидриды состава МеH2.
ЩЁЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ – ПРОСТЫЕ ВЕЩЕСТВА
При обычных условиях щёлочноземельные металлы – твёрдые вещества, имеют металлический блеск на свежем срезе (быстро покрываются желтоватой плёнкой на воздухе), лёгкие (кроме радия), при этом более твёрдые, чем щелочные металлы. Кальций не режется ножом, он довольно твёрдый, стронций и барий мягче. Барий похож по твёрдости на свинец, но в отличие от него при разрезании крошится на отдельные кристаллы.
При внесении щёлочноземельных металлов или их соединений в бесцветное пламя появляется его характерная окраска:
Щёлочноземельные металлы являются активными восстановителями. Реакции с галогенами протекают легко даже при обычных условиях: При сгорании щёлочноземельных металлов на воздухе или в кислороде образуются оксиды:При нагревании на воздухе или в кислороде кальций загорается, пламя при этом имеет красноватый цвет.
Щёлочноземельные металлы взаимодействуют с серой при нагревании. Образуются сульфиды: При нагревании щёлочноземельные металлы реагируют с азотом с образованием нитридов (Са – при температуре красного каления): При нагревании щёлочноземельные металлы взаимодействуют с водородом с образованием твёрдых гидридов: Щёлочноземельные металлы легко взаимодействуют с водой с образованием щёлочи и водорода:Кальций с холодной водой реагирует сравнительно медленно, но с горячей водой реакция идёт бурно.
Щёлочноземельные металлы активно взаимодействуют с растворами солей, но происходит, как и в случае щелочных металлов, не замещение металла, входящего в состав соли, а реакция щёлочноземельных металлов с водой раствора.
Кальций и стронций получают электролизом расплавов хлоридов:Конспект урока по химии «Щелочноземельные металлы. Элементы IIA-группы». Выберите дальнейшее действие:

Щелочные металлы. Элементы IA-группы
Ключевые слова конспекта: щелочные металлы, элементы IA-группы, литий, натрий, цезий, калий, рубидий, надпероксиды, пероксид натрия, щелочи, получение и применение щелочных металлов.
Щелочными металлами называют элементы IA-группы Периодической системы. Групповое название «щелочные» обусловлено тем, что растворимые в воде гидроксиды натрия и калия известны с древних времён, их называли щелочами. Важнейшие параметры этих элементов приведены в таблице.

Вы видите, как меняются свойства элементов в подгруппе: от лития к цезию радиусы атомов увеличиваются, значения энергии ионизации и электроотрицательности уменьшаются, металлические свойства усиливаются.
Электронная конфигурация валентного электронного слоя атомов щелочных металлов ns 1 , где n – номер валентного энергетического уровня. Щелочные металлы являются s-элементами.
В соединениях щелочных металлов преобладает ионный характер связи. В своих соединениях щелочные металлы могут быть только одновалентны. Во всех своих соединениях щелочные металлы имеют степень окисления +1.
Высшими оксидами являются соединения состава Ме2O, они имеют ярко выраженный основный характер. Высшие гидроксиды щелочных металлов МеОН – типичные основания, щёлочи. Водородные соединения щелочных металлов – твёрдые гидриды состава МеН.
ЩЕЛОЧНЫЕ МЕТАЛЛЫ – ПРОСТЫЕ ВЕЩЕСТВА
Щелочные металлы – вещества немолекулярного строения, их кристаллическая решётка металлическая.
При обычных условиях щелочные металлы – твёрдые вещества, имеют металлический блеск на свежем срезе (быстро тускнеют вследствие окисления), лёгкие (литий – самый лёгкий металл, его плотность составляет 0,53 г/см 3 ), легкоплавкие, мягкие (легко режутся ножом).
При внесении щелочных металлов или их соединений в бесцветное пламя оно приобретает характерную окраску:
Элемент
Окраска пламени
Rb
Cs
К
Щелочные металлы являются активными восстановителями. В атмосфере хлора и фтора они воспламеняются при обычных условиях.
Взаимодействие щелочных металлов с жидким бромом сопровождается взрывом.
Нагретые щелочные металлы легко сгорают на воздухе или в кислороде, но только при сгорании лития образуется оксид: При сгорании натрия обычно образуется пероксид (Na2O2):Пероксид натрия Na2O2 – кристаллы светло-жёлтого цвета – можно рассматривать как соль пероксида водорода H2O2.
При сгорании остальных щелочных металлов образуются надпероксиды (например, КO2). Получить оксиды Na2О, К2O, Rb2O, Cs2O можно восстановлением пероксидов и надпероксидов щелочными металлами, например, по реакции: КO2 + 3К = 2К2O
Щелочные металлы взаимодействуют с серой при нагревании.
Литий – единственный металл, который реагирует с азотом с образованием нитрида уже при комнатной температуре:Остальные щелочные металлы с азотом не реагируют (натрий реагирует с азотом при 100 °С, при электрическом разряде).
При нагревании щелочные металлы взаимодействуют с водородом с образованием твёрдых гидридов:
Щелочные металлы активно взаимодействуют с водой с образованием щёлочи и водорода. При этом кусочек лития или натрия с шипением «бегает» по поверхности воды, при взаимодействии калия происходит возгорание выделяющегося водорода (бледно-фиолетовое пламя), рубидий и цезий взаимодействуют со взрывом:
Щелочные металлы активно реагируют с разбавленными кислотами с образованием соли и водорода, но при этом параллельно протекают реакции щелочного металла с водой и образовавшейся щёлочи с кислотой.

Иначе протекают реакции с концентрированными растворами кислот или с самими кислотами – сильными окислителями, например с азотной и серной. В этих реакциях происходит восстановление азота в высшей степени окисления (в HNO3) или серы в высшей степени окисления (в H2SO4). Образуется соль, продукт восстановления азота или серы и вода:
Щелочные металлы активно взаимодействуют с растворами солей, но при этом происходит не замещение металла, входящего в состав соли, щелочным металлом, а прежде всего взаимодействие щелочного металла с водой раствора.
Натрий получают электролизом расплава поваренной соли (с добавками СаCl2 для понижения температуры плавления смеси):Щелочные металлы находят широкое применение в промышленности и в технике:
- литий – в литий-ионных аккумуляторах, в термоядерной энергетике для получения изотопа водорода – трития, а также в качестве теплоносителя в ядерных реакторах;
- натрий используют как теплоноситель в ядерных реакторах, для синтеза некоторых органических соединений (например, как катализатор в синтезе каучука, как активный восстановитель в других реакциях, часто в сплаве с калием), в металлотермии (натрийтермия);
- цезий легко теряет электроны даже под действием света, поэтому он применяется в фотоэлементах.
Наиболее распространёнными соединениями щелочных металлов являются (приведены исторические названия):
NaOH – едкий натр (каустическая сода),
NaCl – поваренная соль,
NaNO3 – чилийская селитра,
Na2SO4 • 10H2O – глауберова соль,
Na2CO3 • 10H2O – сода кристаллическая,
КОН – едкое кали,
КCl – хлорид калия, входит в состав калийной соли (NaCl • КCl + КCl),
KNO3 – индийская селитра,
К2СO3 – поташ.
Конспект урока по химии «Щелочные металлы. Элементы IA-группы». Выберите дальнейшее действие:
Конспект по химии на тему "Щелочные металлы"
2. Изучить физические и химические свойства щелочных металлов.
3. Научиться применять полученные знания для решения практических задач
«Настоящий конец образования дает только сама жизнь и самодеятельность каждого» (Д.И. Менделеев).
В познавательной сфере:
Научиться давать характеристику щелочным металлам на основании их положения в ПСХЭ. Научиться давать характеристику физическим и химическим свойствам щелочных металлов.
В ценностно-ориентационной сфере:
Знать о роли соединений щелочных металлов в организме человека, их применении в народном хозяйстве
1). Умение грамотно обращаться с веществами;
2). Формирование основ экологической культуры, здорового образа жизни.
1). Умение управлять своей познавательной деятельностью;
2). Формирование навыков самоконтроля и самооценки;
3). Воспитание чувства гордости за достижения российской промышленности.
1). Определение понятий
2). Умение структурировать знания
3). Умение выделять существенные признаки объекта
4). Умение находить причинно-следственные связи
5). Умение сравнивать изучаемые факты, логично излагать мысли и делать выводы
1). Умение выслушивать разные мнения и суждения
2). Умение работать в группе.
3). Умение составить аргументированный ответ, в том числе в письменной форме.
Щелочные металлы как элементы и как простые вещества, едкий натр. Едкое кали, щелочи, поташ, глауберова соль.
Ресурсы: учебник, тексты, презентация, фильм о работе завода химконцентратов, схемы, реактивы (сухие щелочи), спиртовка, проволока, спички.
Межпредметные связи: биология, география, технология.
Виды работ: работа с информацией, лабораторный опыт. Работа по презентации.
1 этап. Повторение по теме «Коррозия металлов»
Учитель раздает дифференцированные задания на карточках.
Учащиеся выполняют задания. Устно делятся результатами. Сдают выполненные задания на проверку учителю
Познавательные: 1). Умение структурировать материал. 2). Умение выделять существенные признаки объекта 3). Умение ставить цели и задачи 4). Умение анализировать условия достижения цели 5). Умение прогнозировать ситуацию
Регулятивные: регуляция познавательной деятельности
Коммуникативные: умение выслушивать собеседника, отстаивать свое мнение.
а). работа с информацией
б). актуализация знаний
1).Учитель предлагает учащимся составить 7 вопросов, дающих односложный ответ и догадаться, о каком веществе идет речь (используется прием да-нет)
Учитель подсказывает. что речь идет о целой группе веществ.
Сообщается тема урока – Щелочные металлы. Учитель вместе с учащимися формулирует цели и задачи урока – На основе уже имеющихся знаний о металлах сформировать знания о физических и химических свойствах щелочных металлов.
2).Учитель предлагает учащимся работу по презентации. На слайде презентации находится задание с выбором правильного ответа.
Учащиеся подбирают вопросы и делают вывод о том, что речь идет об элементах первой группы главной подгруппы Периодической системы.
Учащиеся выбирают правильные ответы. Металлы серебро, медь, золото не взаимодействуют с водой даже при нагревании, У атомов металлов на внешнем уровне 1-3 электрона, металлы проводят электрический ток. Дают устные ответы
1). Определение понятий;
2). Умение выделять существенные признаки объекта;
3). Умение устанавливать причинно-следственные связи
1). Умение управлять своей познавательной деятельностью
2). Умение ставить цели и задачи
1).Умение выслушивать собеседника.
2). Умение давать аргументированный ответ;
3). Умение задавать вопрос, слушать и быть услышанным.
2 мин – высказывания
2 мин – формулировка
2 мин – подбор и
3 этап. Осмысление содержания. Первичное применение знаний.
Учитель проводит лабораторный эксперимент. Задает учащимся вопрос: «Соединение какого металла внесено в пламя спиртовки?»
Учитель с помощью презентации знакомит учащихся с химическими свойствами щелочных металлов. Задаются вопросы:
1). Что образуется в результате взаимодействия щелочных металлов с водой?
2). Что представляет собой кислота? Что же произойдет, прежде чем щелочные металлы вступят в реакцию с кислотой?
3). Учитель обращает внимание на широкое применение щелочных металлов, а также на значение их для жизнедеятельности организма. Предлагает работу с учебником. Подробно останавливается на использовании лития
4).. Рассказывает о производстве лития на Новосибирском заводе химконцентратов. Предлагается фильм о работе завода.
5). По результатам просмотренной презентации и фильму предлагаются следующие вопросы:
А. С работой какого завода вы познакомились сегодня?
Б. Как связана тема урока с продукцией, выпускаемой данным предприятием?
В. Какие виды продукции выпускает этот завод?
В.Когда был основан завод?
Г. Чем продукция этого завода отличается от аналогичной продукции других заводов? Почему это так важно?
С помощью презентации учащиеся изучают физические свойства щелочных металлов. Проводится лабораторный эксперимент. Учащиеся наблюдают за результатами эксперимента. Отвечают на вопрос.
Учащиеся изучают химические свойства щелочных металлов. Отвечают на вопросы.
1). В результате взаимодействия щелочных металлов с водой образуется щелочь. Учащиеся записывают подтверждающие уравнения реакций. Делают вывод о том, что именно благодаря этому свойству щелочные металлы получили такое название.
2). Кислоты – это растворы, а значит присутствует вода. В этом случае щелочные металлы будут реагировать прежде всего с водой. Учащиеся составляют подтверждающие уравнения реакций (работа в паре).
Учащиеся работают с учебником, знакомятся с ролью щелочных металлов для жизнедеятельности организма. Организуется работа в группах. Каждая группа делает краткий отчет по изученному материалу.
Учащиеся при помощи презентации и фильма знакомятся с работой завода химконцентратов.
1. Щелочные металлы: общая характеристика, строение; свойства и получение простых веществ
Щелочными металлами называются химические элементы-металлы \(IA\) группы Периодической системы Д. И. Менделеева: литий \(Li\), натрий \(Na\), калий \(K\), рубидий \(Rb\), цезий \(Cs\) и франций \(Fr\).
Электронное строение атомов. На внешнем энергетическом уровне атомы щелочных металлов имеют один электрон ns 1 . Поэтому для всех металлов группы \(IA\) характерна степень окисления \(+1\).
- увеличение радиуса атомов;
- усиление восстановительных, металлических свойств.
Нахождение в природе. Из щелочных металлов наиболее широко распространены в природе натрий и калий. Но из-за высокой химической активности они встречаются только в виде соединений.
- каменная соль (хлорид натрия \(NaCl\)),
- глауберова соль, или мирабилит — декагидрат сульфата натрия Na 2 SO 4 \(·\) 10 H 2 O ,
- сильвин — хлорид калия \(KCl\),
- сильвинит — двойной хлорид калия-натрия \(KCl\) \(·\)\(NaCl\) и др.
Соединения лития, рубидия и цезия в природе встречаются значительно реже, поэтому их относят к числу редких и рассеянных.
Физические свойства простых веществ. В твёрдом агрегатном состоянии атомы связаны металлической связью. Наличие металлической связи обусловливает общие физические свойства простых веществ-металлов: металлический блеск, ковкость, пластичность, высокую тепло- и электропроводность.
В свободном виде простые вещества, образованные элементами \(IA\) группы — это легкоплавкие металлы серебристо-белого (литий, натрий, калий, рубидий) или золотисто-жёлтого (цезий) цвета, обладающие высокой мягкостью и пластичностью.


Наиболее твёрдым является литий, остальные щелочные металлы легко режутся ножом и могут быть раскатаны в фольгу.
Только у натрия плотность немного больше единицы ρ = 1,01 г / см 3 , у всех остальных металлов плотность меньше единицы.
Химические свойства. Щелочные металлы обладают высокой химической активностью, реагируя с кислородом и другими неметаллами.
Поэтому хранят щелочные металлы под слоем керосина или в запаянных ампулах. Они являются сильными восстановителями.
Взаимодействие натрия с водой протекает с выделением большого количества теплоты (т. е. реакция является экзотермической). Кусочек натрия, попав в воду, начинает быстро двигаться по её поверхности. Под действием выделяющейся теплоты он расплавляется, превращаясь в каплю, которая, взаимодействуя с водой, быстро уменьшается в размерах. Если задержать её, прижав стеклянной палочкой к стенке сосуда, капля воспламенится и сгорит ярко-жёлтым пламенем.
Получение. Металлический натрий в промышленности получают главным образом электролизом расплава хлорида натрия с инертными (графитовыми) электродами.
Читайте также:
