Щелочноземельные металлы 9 класс конспект
Цель урока: изучить соединения магния и щелочноземельных металлов, знать их формулы и их применение.
Задачи урока:
1. Сформировать знания о строении атома и свойствах щелочноземельных металлов;
2. Совершенствовать экспериментальные умения и навыков учащихся.
1. Сформировать навыки анализа и сопоставления известных химических фактов.
2. Совершенствовать умения логически мыслить.
3. Развить умения обобщать и делать правильные выводы из изученного материала.
4. Продолжить развитие умений переносить знания в новые ситуации и устанавливать межпредметные связи.
1. Продолжить развитие наблюдательности и умения делать выводы на основе наблюдаемого интереса к предмету и представлений.
2. Выработка положительной мотивации учения, чувства ответственности и уверенности в себе.
| Вложение | Размер |
|---|---|
| 9_klass_otkrytyy_urok_po_khimii.docx | 19.97 КБ |
| soedineniya_shchelochnozemelnykh_metallov.pptx | 2.62 МБ |
Подтяните оценки и знания с репетитором Учи.ру
За лето ребенок растерял знания и нахватал плохих оценок? Не беда! Опытные педагоги помогут вспомнить забытое и лучше понять школьную программу. Переходите на сайт и записывайтесь на бесплатный вводный урок с репетитором.
Вводный урок бесплатно, онлайн, 30 минут
Предварительный просмотр:
Открытый урок по теме:
Соединения магния и щелочноземельных металлов и их применение
- Сформировать знания о строении атома и свойствах щелочноземельных металлов;
- Совершенствовать экспериментальные умения и навыков учащихся.
- Сформировать навыки анализа и сопоставления известных химических фактов.
- Совершенствовать умения логически мыслить.
- Развить умения обобщать и делать правильные выводы из изученного материала.
- Продолжить развитие умений переносить знания в новые ситуации и устанавливать межпредметные связи.
- Продолжить развитие наблюдательности и умения делать выводы на основе наблюдаемого интереса к предмету и представлений.
- Выработка положительной мотивации учения, чувства ответственности и уверенности в себе.
Оборудование и реактивы: коллекция известняков, гидроксид кальция, вода, фенолфталеин, штатив с пробирками, фильтр, воронка, химический стакан.
Устная проверка знаний: (у доски)
- строение атома элементов 2а группы
- химические свойства на примере кальция
- упражнение 5 стр. 67
-работа по карточкам
- групповая опережающая работа с коллекцией известняков
- групповая опережающая работа ( лабораторный опыт)
-остальные работают, выполняя задание по компьютеру(найти соответствие формулы и названия вещества)
Карточки собрать. У всех на столах таблицы ( приложение 3)
В природе щелочноземельные металлы и магний так же как и щелочные металлы находятся только в виде соединений, вследствие своей высокой химической активности.
Я попросила 2 группы ребят провести исследования. Что они исследовали, какие результаты у них получились, мы сейчас и узнаем.
Попутно заполняется таблица
1 группа: ( Приложение 2)
Выданное нам вещество называется оксид кальция или негашеная известь. Оно твердое, белого цвета. В воде растворяется плохо. При растворении образовался гидроксид кальция, который по-другому называется гашеной известью.
Затем мы разделили раствор гидроксида кальция на 2 части.
В 1 часть добавили несколько капель фенолфталеина, он изменил свою окраску на малиновый цвет. Из этого следует, что в растворе есть гидроксогруппа и раствор является щелочью.
2 часть раствора мы профильтровали. Из учебника мы узнали, что прозрачный раствор гидроксида кальция называется известковая вода, а то что осталось на фильтровальной бумаге – известковое молоко.
СaO – в производстве строительных материалов
Сa(OH) 2 – в сахарной промышленности для очистки свекольного сока
Наибольшее распространение имеют соли щелочноземельных металлов
2 группа учащихся коллекцию минералов и сейчас они расскажут , какие минералы кальция они узнали, где они применяются. Продолжается работа с заполнением таблицы.
2 группа ( Приложение 2)
Изучив коллекцию минералов и работая с учебником, мы выяснили, какие соединения образует кальций и где эти соединения применяются.
Сначала мы увидели мел. Его мы используем в школе, а так же его добавляют в зубную пасту, при производстве бумаги, резины, для побелки
Потом мы рассмотрели известняк. Он бывает ракушечный и плотный. Используется для получения цемента, стекла, гашеной и негашеной извести. Известковой щебенкой укрепляют дороги
Мрамор мы увидели: белый, серый, красный. Мрамор используется для изготовления скульптур, в архитектуре, для облицовки.
Мел, мрамор, известняк имеют формулу СаСО 3
Гипс СаSO 4 × 10 H 2 O используется в строительстве, медицине.
Заполняем таблицу до конца
Ионы кальция играют роль в работе сердца, процессах свертываемости крови, для работы НС.
Суточная потребность кальция- 1,5 г. Кальций входит в состав сыра, петрушки, творога, салата.
4.Закрепление : показываю карточку с формулой, ребята дают название и где применяется данное соединение.
5. Итог урока: Что мы сегодня узнали на уроке?
Мы узнали формулы магния и щелочноземельных металлов, названия и их применение.
Щелочноземельные металлы (9-й класс)
Тип урока: изучение нового материала.
Вид урока: комбинированный урок
Обучающие: формирование знаний учащихся о щелочноземельных элементах как типичных металлах, понятия о взаимосвязи строения атомов со свойствами (физическими и химическими).
Развивающие: развитие умений исследовательской деятельности, умения добывать информацию из различных источников, сравнивать, обобщать, делать выводы.
Воспитывающие: воспитание устойчивого интереса к предмету, воспитание таких нравственных качеств как аккуратность, дисциплина, самостоятельность, ответственное отношение к порученному делу.
Методы: проблемные, поисковые, лабораторная работа, самостоятельная работа учащихся.
Оснащение: компьютер, таблица по технике безопасности, диск “Виртуальная лаборатория по химии”, презентация.
Ход урока
1. Организационный момент.
2. Вводное слово учителя.
Мы изучаем раздел, металлы, и вы знаете, что металлы имеют большое значение в жизни современного человека. На предыдущих уроках мы познакомились с элементами I группы главной подгруппы – щелочными металлами. Сегодня приступаем к изучению металлов II группы главной подгруппы - щелочноземельных металлов. Для того чтобы усвоить материал урока, нам необходимо вспомнить наиболее важные вопросы, которые рассматривали на предыдущих уроках.
3. Актуализация знаний.
- Где находятся щелочные металлы в периодической системе Д.И. Менделеева?
- В периодической системе щелочные металлы расположены в I группе главной подгруппе, на внешнем уровне 1 электрон, который щелочные металлы легко отдают, поэтому во всех соединениях они проявляют степень окисления +1. С увеличением размеров атомов от лития к францию энергия ионизации атомов уменьшается и, как правило, возрастает их химическая активность.
- Физические свойства щелочных металлов?
- Все щелочные металлы серебристо-белого цвета с незначительными оттенками, лёгкие, мягкие и легкоплавкие. Их твёрдость и температура плавления закономерно снижаются от лития к цезию.
- Знания Химических свойств щелочных металлов проверим в виде небольшой проверочной работы по вариантам:
- Iвариант: Напишите уравнения реакции взаимодействия натрия с кислородом, хлором, водородом, водой. Укажите окислитель и восстановитель.
- I I вариант: Напишите уравнения реакции взаимодействия лития с кислородом, хлором, водородом, водой. Укажите окислитель и восстановитель.
- I I I вариант: Напишите уравнения реакции взаимодействия калия с кислородом, хлором, водородом, водой. Укажите окислитель и восстановитель.
Учитель: Тема нашего урока “Щелочноземельные металлы”
Задачи урока: Дать общую характеристику щелочноземельным металлам.
Рассмотреть их электронное строение, сравнить физические и химические свойства.
Узнать о важнейших соединениях этих металлов.
Определить области применения этих соединений.
- Наш план урока написан на доске, будем работать соответственно плана, просмотрим презентацию.
- Положение металлов в периодической системе Д.И. Менделеева.
- Строение атома щелочных металлов.
- Физические свойства.
- Химические свойства.
- Применение щелочноземельных металлов.
Исходя, из полученных ранее знаний ответим на следующие вопросы: Для ответа воспользуемся периодической системой химических элементов Д.И. Менделеева .
1. Перечислите щелочноземельные металлы
- Это магний, кальций, стронций, барий, радий.
2. Почему данные металлы назвали щелочноземельными?
Происхождение этого названия связано с тем, что их гидроксиды являются щелочами, а оксиды по тугоплавкости сходны с оксидами алюминия и железа, носившими ранее общее название "земли"
3. Расположение щелочноземельные металлы в ПСХЭ Д.И. Менделеева.
- II группа главная подгруппа. У металлов II группы главной подгруппы на внешнем энергетическом уровне содержится по 2 электрона, находящихся на меньшем удалении от ядра, чем у щелочных металлов. Поэтому их восстановительные свойства хотя и велики, но все же менее, чем у элементов I группы. Усиление восстановительных свойств также наблюдается при переходе от Mg к Ba, что связано с увеличением радиусов их атомов, во всех соединениях проявляют степень окисления +2.
Учитель: Физические свойства щелочноземельных металлов?
- Металлы II группы главной подгруппы - это серебристо-белые вещества, хорошо проводящие тепло и электрический ток. Плотность их возрастает от Be к Ba, а температура плавления, наоборот, уменьшается. Они значительно тверже щелочных металлов. Все, кроме бериллия, обладают способностью окрашивать пламя в разные цвета.
Проблема: В каком виде щелочноземельные металлы встречаются в природе?
Почему в природе щелочноземельные металлы в основном существуют в виде соединений?
Ответ: В природе щелочноземельные металлы находятся в виде соединений, потому что обладают высокой химической активностью, которая в свою очередь, зависит от особенностей электронного строения атомов (наличие двух неспаренных электронов на внешнем энергетическом уровне)
Физкультминутка – отдых глазам.
- Зная общие физические свойства, активность металлов, предположите химические свойства щелочноземельных металлов. С какими веществами взаимодействуют щелочные металлы?
- Щелочноземельные металлы взаимодействуют как с простыми веществами, и сложными. Активно взаимодействуют почти со всеми неметаллами ( с галогенами, водородом, образуя гидриды). Из сложных веществ с водой – образуя растворимые в воде основания – щелочи и с кислотами.
- А теперь на опытах убедимся, в правильности наших предположениях о химических свойствах щелочноземельных металлов.
4. Лабораторная работа по виртуальной лаборатории.
Цель: провести реакции, подтверждающие химические свойства щелочноземельных металлов.
Повторяем правила техники безопасности для работы со щелочноземельными металлами.
Урок химии "Соединения щелочноземельных металлов" (9-й класс)
Единственный путь, ведущий к знанию, – это деятельность.
ХОД УРОКА
1. Игровая пятиминутка (для активизации мыслительной деятельности учащихся).
- Этот металл используют для металлотермии – восстановления редких металлов из их руд.
- Сульфат данного элемента, известный под названием горькой, или английской, соли, используется в медицине в качестве слабительного средства.
- Морская соль имеет горький вкус из-за наличия в ней катионов данного металла.
- Сжигание данного металла сопровождается ослепительной вспышкой, поэтому его раньше применяли при фотографировании.
- В его атоме на внешнем уровне два электрона, все электроны размещены на трёх энергетических уровнях.
- Вследствие высокой химической активности этот металл не пригоден для изготовления изделий.
- В организме взрослого человека содержится более 1 кг данного элемента в виде фосфата.
- Этот металл был впервые получен Г. Дэви в 1808 г.
- Соединения этого элемента широко используется, например, в строительстве. Мел, мрамор, известняк- это его карбонат.
- В его атоме на внешнем уровне два электрона, все электроны размещены на четырёх энергетических уровнях.
3. Проверка знаний и умений учащихся.
| 1. Кальций отличается по физическим свойствам от щелочных металлов. | а) Цветом; б) Плотностью; в) Твёрдостью; г) Температурой плавления. |
| 2. С кальцием реагирует. | а) CI2, P, Si; б) C, CI2,S; в) O2, H2, Fe. |
| 3. Водород можно получить при взаимодействии кальция с. | а) HCI б) CO2; в) H2O г) NaOH; д) H2SO4. |
| 4. У кальция электроны распределены по энергетическим уровням. | а) 2,8.8,3; б) 2,8,8,1; в) 2,8,8,2. |
| 5. Кальций проявляет свойства. | а) Окислительные; б) Восстановительные; в) Окислительные и восстановительные. |
Докажите это, составив уравнения соответствующих реакций (самостоятельная работа 5 минут).
Письменная работа проверяется на доске.
4. Изучение нового материала
Цель: обобщить и систематизировать знания о свойствах оксидов и гидроксидов металлов главной подгруппы II группы.
Учитель. Известно, что металлам соответствуют основные оксиды.
- Докажите, что оксид кальция – основный оксид, составив уравнения соответствующих реакций.
Самостоятельная работа (5 минут).
САМОПРОВЕРКА (на доске появляется слайд).
CaO + H2O = Ca(OH)2
CaO + CO2 = CaCO3
CaO + H2SO4 = CaSO4 + H2O
CaO – негашёная известь.
Учитель. Известно, что металлу соответствует основный оксид и основание.
Докажите, что гидроксид кальция – основание. Составьте уравнения соответствующих реакций.
Самостоятельная работа (5 минут)
Самопроверка (слайд на доске)
Ca(OH )2 + CO2 = CaCO 3 + H2O
Ca(OH)2 + H2SO4 = CaSO4 + 2H2O
Ca(OH)2 + CuSO4 = Cu(OH) 2 + CaSO4
Ca(OH)2 – гашёная известь.
Учитель. В каком же виде встречаются щелочноземельные металлы в природе?
Презентация “Соединения щелочноземельных металлов в природе”. (Составляет ученик к уроку заранее).
5. Кодированный диктант.
- Оксиды проявляют основные свойства, кроме бериллия. (1)
- Все оксиды главной подгруппы II группы активны в реакции с водой. (0)
- Оксиды кальция в технике называют негашёной известью. (1)
- Для обнаружения углекислого газа используют раствор гидроксида кальция – известковую воду. (1)
- Карбонат бария – основная часть минералов: мела, мрамора, известняка.(0)
Учащиеся проводят взаимопроверку работ.
- У меня вызвало затруднение на уроке .
- Мне удалось .
- Я узнал(а), что .
Щелочноземельные металлы 9 класс конспект
Ключевые слова конспекта: щелочноземельные металлы, элементы IIA-группы, земли, получение щелочноземельных металлов.
ХАРАКТЕРИСТИКА ЭЛЕМЕНТОВ IIA ГРУППЫ
К щёлочноземельным металлам относят кальций Са, стронций Sr, барий Ва, радий Ra – металлы IIА-группы. Название «щёлочноземельные» обусловлено тем, что гидроксиды этих металлов относятся к щелочам – растворимым в воде основаниям, а оксиды этих металлов с древних времён называли землями. Бериллий и магний к щёлочноземельным металлам не относятся.
Важнейшие параметры элементов IIA группы приведены в таблице:
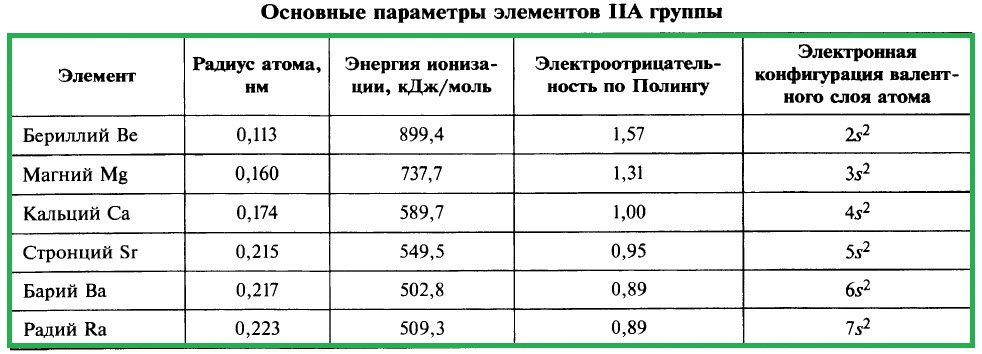
Электронная конфигурация валентного слоя атомов щёлочноземельных металлов в стационарном состоянии ns 2 . Щёлочноземельные металлы являются s-элементами. Во всех своих соединениях они имеют степень окисления +2.
Высшие оксиды щёлочноземельных металлов имеют состав МеО и проявляют основный характер. Высшие гидроксиды этих элементов Ме(ОН)2 являются типичными основаниями, их относят к щелочам, хотя их растворимость намного ниже, чем гидроксидов щелочных металлов. Водородные соединения щёлочноземельных металлов представляют собой твёрдые гидриды состава МеH2.
ЩЁЛОЧНОЗЕМЕЛЬНЫЕ МЕТАЛЛЫ – ПРОСТЫЕ ВЕЩЕСТВА
При обычных условиях щёлочноземельные металлы – твёрдые вещества, имеют металлический блеск на свежем срезе (быстро покрываются желтоватой плёнкой на воздухе), лёгкие (кроме радия), при этом более твёрдые, чем щелочные металлы. Кальций не режется ножом, он довольно твёрдый, стронций и барий мягче. Барий похож по твёрдости на свинец, но в отличие от него при разрезании крошится на отдельные кристаллы.
При внесении щёлочноземельных металлов или их соединений в бесцветное пламя появляется его характерная окраска:
Щёлочноземельные металлы являются активными восстановителями. Реакции с галогенами протекают легко даже при обычных условиях: При сгорании щёлочноземельных металлов на воздухе или в кислороде образуются оксиды:При нагревании на воздухе или в кислороде кальций загорается, пламя при этом имеет красноватый цвет.
Щёлочноземельные металлы взаимодействуют с серой при нагревании. Образуются сульфиды: При нагревании щёлочноземельные металлы реагируют с азотом с образованием нитридов (Са – при температуре красного каления): При нагревании щёлочноземельные металлы взаимодействуют с водородом с образованием твёрдых гидридов: Щёлочноземельные металлы легко взаимодействуют с водой с образованием щёлочи и водорода:Кальций с холодной водой реагирует сравнительно медленно, но с горячей водой реакция идёт бурно.
Щёлочноземельные металлы активно взаимодействуют с растворами солей, но происходит, как и в случае щелочных металлов, не замещение металла, входящего в состав соли, а реакция щёлочноземельных металлов с водой раствора.
Кальций и стронций получают электролизом расплавов хлоридов:Конспект урока по химии «Щелочноземельные металлы. Элементы IIA-группы». Выберите дальнейшее действие:
Конспект урока по химии в 9 классе по теме : «Бериллий, магний и щелочноземельные металлы».
Цель урока: дать общую характеристику металлов главной подгруппы II группы; рассмотреть основные физические и химические свойства, важнейшие соединения и области их применения.
Обучающие: Сформировать знания учащихся о металлах главной подгруппы II группы, свойствах и значением важнейших из них.
Развивающие : развитие у учащихся познавательных способностей, умения логически рассуждать, обобщать и делать выводы из полученных знаний
Воспитывающие : формирование навыков коллективной работы в сочетании с индивидуальной, повышение творческой активности учащихся
Тип урока: комбинированный
Фронтальный опрос
Запись темы урока
Рассказ учителя
Запись в тетрадь
Самостоятельное выполнение задания учениками
I. Орг. момент.
II. Проверка д/з.
Ученикам раздаются карточки
Фамилия и Имя______________________________________
Саша прочитал текст учебника «Щелочные металлы» и сказал: «Калий и натрий широко распространены в природе, поэтому эти металлы не надо получать в промышленности.» Катя ответила: «Ты не прав, наоборот из-за того, что они химически активны, эти металлы получают только в промышленности.» Кто из них прав? Почему?
1.Назовите особенности химических свойств лития. Чем он отличается от других ЩМ?
Только литий при сгорании на воздухе образует оксид, все остальные ЩМ образуют пероксиды
2.Что общего в строении атомов ЩМ?
Общим является одинаковое строение внешнего электронного слоя, у всех ЩМ на последнем уровне находится один электрон. ЩМ проявляют постоянную с. о. +1
3. Каковы физические свойства щелочных металлов ?
Все щелочные металлы обладают металлическим блеском, тепло- и электропроводностью, плавятся при низких температурах, легки и пластичны. Щелочные металлы легко режутся ножом. Все они (за исключением желтоватого цезия) серебристо-белые. Хранят их под слоем керосина или парафина.
4.Опишите основные химические свойства ЩМ.
реагируют с неметаллами, водой, с кислотами — со взрывом), с водой образуют щелочи. От лития к калию в озрастают радиусы атомов, повышается химическая активность:
4 Li + O 2 —» 2 Li 2 O (оксид)
2 Na + O 2 —> Na 2 O 2 (пероксид)
K + O 2 -> К O 2 (надпероксид)
Увеличиваются атомная масса, плотность; уменьшаются температура плавления, твердость
Рассмотрим химические свойства ЩМ на примере натрия:
2Na + С l 2 = 2Na С l
2Na + S = 2Na 2 S
2 Na + H 2 O = 2 Na OH + H 2
5. Назовите важнейшие природные соединения ЩМ.
NaCl — каменная соль, NaCl • КС1 — сильвинит, Na 2 S О4 • 10Н2О - глауберова соль, NaN О3 - селитра, КС1 • MgCl 2 • 6Н2О — карналлит.
III. Содержание урока.
Тема нашего урока : «Бериллий, магний и щелочноземельные металлы»
1.Строение и физические свойства атомов . Бериллий Ве, магний М g и щелочноземельные металлы кальций Са, стронций Sr, барий Ва и радий Ra — элементы главной подгруппы II группы Периодической системы. Атомы этих элементов содержат на внешнем энергетическом уровне два электрона, которые они отдают при химических взаимодействиях, и поэтому являются сильнейшими восстановителями. Во всех соединениях они имеют степень окисления +2. С ростом порядкового номера сверху вниз в подгруппе восстановительные свойства элементов усиливаются, что связано с увеличением радиусов их атомов.
Радий — радиоактивный элемент, содержание его в природе невелико.
Бериллий, магний и щелочноземельные металлы — простые вещества. Легкие серебристо-белые металлы, стронций имеет золотистый оттенок. Он значительно тверже щелочных металлов, барий же по мягкости напоминает свинец.
2. Химические свойства . На воздухе при обычной температуре поверхность бериллия и магния покрывается защитной оксидной пленкой. Щелочноземельные металлы взаимодействуют с кислородом воздуха более активно, поэтому их хранят под слоем керосина или в запаянных сосудах, как и щелочные металлы.
а) При нагревании на воздухе все рассматриваемые металлы энергично сгорают с образованием оксидов:
2 Ca + O 2 = 2 CaO
Реакция сжигания магния сопровождается ослепительной вспышкой, раньше она применялась при фотографировании объектов в темных помещениях. В настоящее время используют электрическую вспышку.
б ) Реакция с неметаллами. Бериллий, магний и все щелочноземельные металлы взаимодействуют при нагревании с неметаллами — хлором, серой, азотом и т. д., образуя соответственно хлориды, сульфиды, нитриды:
Са + S = CaS сульфид
в) Реакция с водой . Из всех металлов главной подгруппы II группы только бериллий практически не взаимодействует с водой (препятствует защитная пленка на его поверхности), магний реагирует с ней медленно, остальные металлы бурно взаимодействуют с водой при обычных условиях:
Подобно алюминию магний и кальций способны восстанавливать редкие металлы — ниобий, тантал, молибден, вольфрам, титан и др. — из их оксидов
Mg + TiO = Ti + MgO
Магний и кальций применяют для производства редких металлов и легких сплавов. Например, магний входит в состав дюралюминия, а кальций — один из компонентов свинцовых сплавов, необходимых для изготовления подшипников и оболочек кабелей.
Внимание. Выполните задание. Сейчас вы составите опорный конспект по химическим свойствам ЩЗМ. Задание выполняется в паре.
Металлы II гр А подгруппы
гидроксиды(основания, кроме ВеО)
3.Соединения металлов II группы
Me ( O Н)2
Ме(кислотный остаток)
MeO Основные оксиды
Ве(ОН)3 амфотерный гидроксид
Соединения бериллия, магния и щелочноземельных металлов. В природе щелочноземельные металлы, как и щелочные металлы, находятся только в форме соединений вследствие своей высокой химической активности.
Оксиды МО — твердые белые тугоплавкие вещества, устойчивые к воздействию высоких температур.
Проявляют основные свойства, кроме оксида бериллия, имеющего амфотерный характер.
Оксид магния малоактивен в реакции с водой, все остальные оксиды очень бурно взаимодействуют с ней:
Оксиды получают обжигом карбонатов: МСО3 = МО + СО2
В технике оксид кальция СаО называют негашеной известью, а МgО — жженой магнезией. Оба этих оксида используют в производстве строительных материалов.
Гидроксиды щелочноземельных металлов относятся к щелочам. Их растворимость в воде растет от Са(ОН)2 к Ва(ОН)2. Эти гидроксиды получают взаимодействием соответствующего оксида с водой.
Реакция оксида кальция с водой сопровождается выделением большого количества теплоты и называется гашением извести, а образующийся Са(ОН)2 — гашеной известью:
Прозрачный раствор гидроксида кальция называется известковой водой, а белая взвесь Са(ОН)2 в воде — известковым молоком. Гашеная известь широко используется в строительстве. Известковое молоко применяют в сахарной промышленности для очистки свекловичного сока.
Соли бериллия, магния и щелочноземельных металлов получают взаимодействием их с кислотами. Галогениды (фториды, хлориды, бромиды и иодиды) этих металлов — белые кристаллические вещества, большинство из них растворимо в воде.
Из сульфатов хорошо растворимы в воде только сульфаты бериллия и магния. Растворимость сульфатов уменьшается от ВеSO4 к ВaSO4. Карбонаты этих металлов малорастворимы или совсем нерастворимы в воде.
Сульфиды щелочноземельных металлов, содержащие в малых количествах примеси тяжелых металлов, после предварительного освещения начинают светиться различным цветом — красным, оранжевым, голубым, зеленым. Они входят в состав специальных светящихся красок, которые называют фосфорами. Их используют для изготовления светящихся дорожных знаков, циферблатов и т. п.
Рассмотрим наиболее важные соединения элементов главной подгруппы II группы периодической системы.
СаСО3 — карбонат кальция — одно из самых распространенных на Земле соединений. Вам хорошо известны такие содержащие его минералы, как мел, мрамор, известняк.
Самый важный из этих минералов — известняк, без которого не обходится ни одно строительство. Во-первых, он сам является прекрасным строительным камнем (вспомните знаменитые одесские катакомбы — бывшие каменоломни, в которых добывали камень для строительства города), во-вторых, это сырье для получения других материалов: цемента, гашеной и негашеной извести, стекла и др.
Известковой щебенкой укрепляют дороги, а порошком — уменьшают кислотность почв.
Природный мел представляет собой остатки раковин древних животных .Один из примеров его использования вы хорошо знаете — это школьные мелки, зубные пасты. Мел применяют в производстве бумаги и резины, а также для побелки.
Мрамор — это минерал скульпторов, архитекторов и облицовщиков. Из него создавал свои прекрасные творения Микеланджело ), стены всемирно известного индийского мавзолея-Тадж-Махал выложены из мрамора, им же облицованы многие станции московского метро.
МgС O 3 — карбонат магния, необходим в производстве стекла, цемента, кирпича, а также в металлургии для перевода пустой породы, т. е. не содержащей соединения металла, в шлак.
СаSО4 — сульфат кальция, встречается в природе в виде минерала гипса СаSO4 • 2Н2О, представляющего собой кристаллогидрат. Используется в строительстве, в медицине для наложения неподвижных гипсовых повязок, для получения слепков.
Для этого применяют полуводный гипс 2СаSО4 • Н2О — алебастр, который при взаимодействии с водой образует двуводный гипс:
Эта реакция идет с выделением теплоты.
Сульфат магния, известный под названием горькая, или английская, соль, используемый в медицине в качестве слабительного средства. Содержится в морской воде и придает ей горький вкус.
ВаSО4 — сульфат бария благодаря нерастворимости и способности задерживать рентгеновские лучи применяется в рентгенодиагностике («баритовая каша») при заболеваниях желудочно-кишечного тракта.
Кальций имеет важное значение для живых организмов, это материал для постройки костных скелетов. Он играет существенную роль и в самих процессах жизнедеятельности: ионы кальция регулируют работу сердца, участвуют в процессах свертывания крови.
На долю кальция приходится более 1,5% от массы тела человека, 98% кальция содержится в костях скелета. Однако кальций не только делает наши кости крепче, но и способствует работе нервной системы. При недостатке кальция руки теряют способность удерживать предметы, мышцы начинают судорожно сокращаться, кровь перестает свертываться, нервная система приходит в негодность, а сердечная мышца отказывается нормально работать.
Магний также является необходимым биоэлементом, играя роль стимулятора обмена веществ, содержится в печени, костях, крови, нервной ткани и мозге. Магния в человеческом организме намного меньше, чем кальция, — всего около 40 г. Однако ему отведена очень важная роль: ионы магния «сшивают» молекулы белка в клубочки, обеспечивая тем самым присущую для живых организмов структуру этих молекул. Магний входит в состав хлорофилла, а следовательно, участвует в процессах фотосинтеза. Без хлорофилла не было бы жизни, а без магния — хлорофилла, ведь в нем содержится 2% этого элемента.
Открытие магния и кальция . Магний был впервые получен Г. Дэви в 1808 г. из белой магнезии — минерала, найденного близ греческого города Магнезия. По названию минерала и дали название простому веществу и химическому элементу.
Полученный Г. Дэви металл был загрязнен примесями, а чистый магний получил француз А. Бюсси в 1829 г.
Кальций был впервые получен также Г. Дэви в 1808 г., название элемента происходит от лат. слова кальс, что означает «известь, мягкий камень».
Генетический ряд кальция
Ca – 1 CaO – 2 Ca ( OH )2 – CaCO 3
Домашнее задание
П рочитайте § 15 о значении соединений щелочноземельных металлов и выпишите сведения в виде таблицы:
Читайте также:
