Самым активным металлом среди элементов na mg al si является
Помогите пожалуйста
ТЕСТ №1 по теме «Металлы» Вариант1
1. К какому типу элементов относятся щелочные и щелочноземельные металлы?
А) р –элементам Б) s -элементам
В) d-элементам Г) f -элементам
2. Атом какого элемента имеет электронную конфигурацию 1s22s22p63s23p64s1 ?
А) К Б) Са В) Ва Г) Na
3.Какой металл р - семейства наиболее активен?
А) алюминий Б) индий
В) таллий Г) галлий
4. В какой группе все три металла можно получить алюмотермией из оксидов?
А) Na, Cu, Cr Б) Sn, Cu, Fe
В) Na, Cr, Pb Г) Mg, Zn, Ni
5. В какой группе ПС химических элементов находятся самые активные металлы?
А) VΙΙ группа, побочная подгруппа
Б) Ι группа, главная подгруппа
В ΙΙ группа, главная подгруппа
Г) V группа, побочная подгруппа
6. Верны ли следующие суждения об элементах ΙΙА группы
А) Металлические свойства элементов ΙΙА группы усиливаются сверху вниз
Б) Увеличивается число электронов на последнем энергетическом уровне
1. оба - верно 2. оба - неверно
3. верно только А 4. верно только. Б
7.Оцените справедливость суждений о металлах
А) В периодах с увеличением зарядов атомных ядер происходит ослабление основных свойств гидроксидов элементов
Б) В главных подгруппах с увеличением заряда атомных ядер происходит усиление притяжения валентных электронов к ядру
1. верно только А 2. верно только Б
3. оба – верно 4. оба - неверно
8. Основные свойства наиболее сильно выражены
А) NaOH Б) Mg(OH)2 В) Al(OH)3 Г) Si(OH)4
9. Наиболее энергично взаимодействуют с водой
А) Al Б) Mg В) Са Г) К
10. В ряду Na−Mg−Al элементы расположены в порядке увеличения
А) атомного радиуса
В) металлических свойств
Г) числа энергетических уровней
11. Металл Ме образует оксид состава Ме2О3. В невозбужденном состоянии атом Ме имеет конфигурацию валентного слоя:
12. Какому химическому элементу соответствует распределение электронов по энергетическим уровням: 2, 8, 18, 8, 2
А) Ca Б) Мg В) Sr Г)Fe.
13.Тип связи в простом веществе натрия:
Б) ковалентная неполярная
Г) ковалентная полярная
14. Наиболее ярко выраженные металлические свойства
А) Mg Б) K В) Al Г) Ca
15. Какую электронную конфигурацию имеет атом наиболее
А) 1s22s22p11 Б) 1s22s22p63s1
В) 1s22s2 Г) 1s22s22p63s23p1
16. Алюмотермия - это
А) восстановление алюминия водородом из его оксида
Б) восстановление металлов из оксидов алюминием
В) шлифовка алюминиевых изделий
Г) получение алюминиевых сплавов
ТЕСТ №2 по теме «Металлы» вариант2
1. Какому металлу соответствует электронная формула
2. При взаимодействии железа с разбавленной H2SO4 образуется
Б) Fe2(SO4)3 и SO2
3.Какой металл не вытеснит водород из разбавленной H2SO4?
А) Fe Б) Cr В) Cu Г) Zn
4.В порядке уменьшения восстановительных свойств металлы расположены в ряду:
А) Al, Zn, Fe Б) Al, Na, K
В) Fe, Zn, Mg Г) Fe, Zn, Al
5.Оксиды CrO и CrO3 -
Б) основные и кислотные
Г) кислотные и основные
6.К какому типу элементов относится железо?
7. На d- подуровне максимально может находиться:
А) 2е Б) 6е В)10е Г) 18е
8. Металлический хром может взаимодействовать с:
А) H2О Б) HCl (разб.)
В) HNO3(конц.) Г) NaOH(конц.)
9. Для металлов не характерно следующее физическое свойство:
Б) металлический блеск
10.Установите соответствии между металлом и способом его получения
А) Na 1. алюмотермия
Б) Fe 2. восстановление углеродом
В) Cr 3. электролиз расплавов солей
11. С точки зрения типа кристаллической решетки «лишнее» простое вещество среди данных
А) алмаз В) железо
Б) хром Г) кобальт
12.Электронная формула иона Fe+2
13. Свойства оксидов металлов побочных подгрупп с уменьшением степени окисления металла изменяются в следующем порядке
Кто-то может рассказать мне о металлических свойствах элементов? Вот попалось задания, а я такого не помню.
Закономерности, связанные с металлическими и неметаллическими свойствами элементов.
1. При перемещении СПРАВА НАЛЕВО вдоль периода МЕТАЛЛИЧЕСКИЕ свойства р-элементов УСИЛИВАЮТСЯ. В обратном направлении - возрастают неметаллические.
Это объясняется тем, что правее находятся элементы, электронные оболочки которых ближе к октету. Элементы в правой части периода менее склонны отдавать свои электроны для образования металлической связи и вообще в химических реакциях.
Например, углерод - более выраженный неметалл, чем его сосед по периоду бор, а азот обладает еще более яркими неметаллическими свойствами, чем углерод.
Слева направо в периоде также увеличивается и заряд ядра. Следовательно, увеличивается притяжение к ядру валентных электронов и затрудняется их отдача.
Наоборот, s-элементы в левой части таблицы имеют мало электронов на внешней оболочке и меньший заряд ядра, что способствует образованию именно металлической связи. За понятным исключением водорода и гелия (их оболочки близки к завершению или завершены!) , все s-элементы являются металлами; p-элементы могут быть как металлами, так и неметаллами, в зависимости от того - в левой или правой части таблицы они находятся.
У d- и f-элементов, как мы знаем, есть "резервные" электроны из "предпоследних" оболочек, которые усложняют простую картину, характерную для s- и p-элементов. В целом d- и f-элементы гораздо охотнее проявляют металлические свойства.
Подавляющее число элементов является металлами и только 22 элемента относят к неметаллам: H, B, C, Si, N, P, As, O, S, Se, Te, а также все галогены и инертные газы.
Некоторые элементы в связи с тем, что они могут проявлять лишь слабые металлические свойства, относят к полуметаллам.
Что такое полуметаллы? Если выбрать из Периодической таблицы p-элементы и записать их в отдельный "блок" (это сделано в “длинной” форме таблицы) , то обнаружится закономерность, Левая нижняя часть блока содержит типичные металлы, правая верхняя - типичные неметаллы. Элементы, занимающие места на границе между металлами и неметаллами, называются полуметаллами.
. Полуметаллы расположены примерно вдоль диагонали, проходящей по p-элементам от левого верхнего к правому нижнему углу Периодической таблицы
Полуметаллы имеют ковалентную кристаллическую решетку при наличии металлической проводимости (электропроводности) . Валентных электронов у них либо недостаточно для образования полноценной "октетной" ковалентной связи (как в боре) , либо они не удерживаются достаточно прочно (как в тeллуре или полонии) из-за больших размеров атома. Поэтому связь в ковалентных кристаллах этих элементов имеет частично металлический характер.
Некоторые полуметаллы (кремний, германий) являются полупроводниками. Полупроводниковые свойства этих элементов объясняются многими сложными причинами, но одна из них - существенно меньшая (хотя и не нулевая) электропроводность, объясняемая слабой металлической связью. Роль полупроводников в электронной технике чрезвычайно важна.

2. При перемещении СВЕРХУ ВНИЗ вдоль групп УСИЛИВАЮТСЯ МЕТАЛЛИЧЕСКИЕ свойства элементов. Это связано с тем, что ниже в группах расположены элементы, имеющие уже довольно много заполненных электронных оболочек. Их внешние оболочки находятся дальше от ядра. Они отделены от ядра более толстой "шубой" из нижних электронных оболочек и электроны внешних уровней удерживаются слабее.
св-ва:
1.металлический блеск
2. ковкие
3.пластичные
4.высокая тепло- и электропроводность
5.твердые вещества (искл. Ртуть)
6. металлическая кристаллическая решетка и металлическая связь
Тест по теме: Периодический закон и периодическая система химических элементов Д.И. Менделеева
тест по химии (9 класс)
К каждому из 10 заданий даны 4 варианта ответа, из которых только один правильный.
| Вложение | Размер |
|---|---|
| svoystva_pshe.docx | 22.97 КБ |
Подтяните оценки и знания с репетитором Учи.ру
За лето ребенок растерял знания и нахватал плохих оценок? Не беда! Опытные педагоги помогут вспомнить забытое и лучше понять школьную программу. Переходите на сайт и записывайтесь на бесплатный вводный урок с репетитором.
Вводный урок бесплатно, онлайн, 30 минут
Предварительный просмотр:
Периодический закон и периодическая система химических элементов Д.И. Менделеева
- Изменение свойств элементов от металлических к неметаллическим происходит в ряду:
1) P – S - Cl 2) C – B – Be 3) Mg – Al – Si 4) Li – Na – K
- Наиболее сильные металлические свойства проявляет:
- Al 2) Ca 3) Rb 4) Na
- Наиболее сильные неметаллические свойства проявляет:
- I 2) C 3) Cl 4) S
- От основных к кислотным меняются свойства оксидов в ряду:
1) CaO – SiO 2 – Al 2 O 3 2) Li 2 O – CO 2 – N 2 O 5
3) SO 2 – P 2 O 5 – MgO 4) SO 3 – N 2 O 5 – K 2 O
- В ряду элементов С – N – O неметаллические свойства
- Уменьшаются;
- Увеличиваются;
- Не изменяются;
- Сначала уменьшаются, а затем увеличиваются
- Радиус атома в ряду Cl – S – P
4)Сначала уменьшается, а затем увеличивается
- В ряду NaOH – Al(OH) 3 – H 3 PO 4 свойства гидроксидов изменяются от
- Кислотных к основным 2) Кислотных к амфотерным
3)Основных к кислотным 4)Амфотерных к основным
- В ряду химических элементов Si – Mg – K
- Увеличивается атомный радиус и уменьшаются металлические свойства
- Уменьшается атомный радиус и усиливаются металлические свойства
- Уменьшается атомный радиус и ослабевают металлические свойства
- Увеличивается атомный радиус и увеличиваются металлические свойства
- Кислотным является высший оксид каждого из химических элементов, имеющих порядковые номера:
- 6 и 13 2) 15 и 20 3) 7 и 16 4) 19 и 5
- Верны ли следующие суждения?
А. В периоде слева направо усиливается радиус атома и увеличивается заряд.
В. Металлические свойства элементов не зависят от числа электронов на внешнем слое.
1) Верно только А 2) Верно только В
3) оба суждения верны 4) оба суждения неверны
- Изменение свойств элементов от неметаллических к металлическим происходит в ряду:
- N – P – As 2) Si – Al – Mg 3) F – Cl – Br 4) Al – Si – P
- Наиболее сильные металлические свойства проявляет:
- Ba 2) Be 3) Li 4) Cs
- Наиболее сильные неметаллические свойства проявляет:
- P 2) O 3) N 4) Se
- От кислотных к основным меняются свойства оксидов в ряду:
1) K 2 O – SiO 2 – SO 3 2) CaO – MgO - BeO
3) CO 2 – N 2 O 5 – SO 2 4) N 2 O 5 – P 2 O 5 – Al 2 O 3
- В ряду элементов B – Al – Ga металлические свойства
- Не изменяются;
- Увеличиваются;
- Уменьшаются;
- Сначала уменьшаются, а затем увеличиваются.
- Радиус атома в ряду Сa – Mg – Be
- Увеличивается;
- Уменьшается;
- Не изменяется;
- Сначала увеличивается, а затем уменьшается.
- В ряду Mg(OH) 2 – Al(OH) 3 – H 2 SO 4 свойства гидроксидов изменяются от
- Амфотерных к кислотным;
- Основных к кислотным;
- Кислотных к основным;
- Основных к амфотерным.
- В ряду химических элементов Cl – Br – I
- Увеличивается атомный радиус и увеличиваются неметаллические свойства;
- Уменьшается атомный радиус и уменьшаются неметаллические свойства;
- Увеличивается атомный радиус и уменьшаются неметаллические свойства;
- Увеличивается атомный радиус и увеличиваются неметаллические свойства.
- Основным является высший оксид каждого из химических элементов, имеющих порядковые номера:
- 3 и 9 2) 11 и 37 3) 12 и 16 4) 20 и 14
- Верны ли следующие суждения?
А. В группе сверху вниз увеличиваются неметаллические свойства и увеличивается радиус атома.
В. По периоду слева направо увеличиваются металлические свойства и увеличивается электроотрицательность.
Активные металлы

Металлы, легко вступающие в реакции, называются активными металлами. К ним относятся щелочные, щелочноземельные металлы и алюминий.

Положение в таблице Менделеева
Металлические свойства элементов ослабевают слева направо в периодической таблице Менделеева. Поэтому наиболее активными считаются элементы I и II групп.

Рис. 1. Активные металлы в таблице Менделеева.
Все металлы являются восстановителями и легко расстаются с электронами на внешнем энергетическом уровне. У активных металлов всего один-два валентных электрона. При этом металлические свойства усиливаются сверху вниз с возрастанием количества энергетических уровней, т.к. чем дальше электрон находится от ядра атома, тем легче ему отделиться.
Наиболее активными считаются щелочные металлы:
- литий;
- натрий;
- калий;
- рубидий;
- цезий;
- франций.
К щелочноземельным металлам относятся:
- бериллий;
- магний;
- кальций;
- стронций;
- барий;
- радий.
Узнать степень активности металла можно по электрохимическому ряду напряжений металлов. Чем левее от водорода расположен элемент, тем более он активен. Металлы, стоящие справа от водорода, малоактивны и могут взаимодействовать только с концентрированными кислотами.

Рис. 2. Электрохимический ряд напряжений металлов.
К списку активных металлов в химии также относят алюминий, расположенный в III группе и стоящий левее водорода. Однако алюминий находится на границе активных и среднеактивных металлов и не реагирует с некоторыми веществами при обычных условиях.
Алюминий
Алюминий представляет собой серебристо-белого цвета. Основные физические свойства алюминия – легкость, высокая тепло- и электропроводность. В свободном состоянии при пребывании на воздухе алюминий покрывается прочной пленкой оксида Al2O3, которая делает его устойчивым к действию концентрированных кислот.
Алюминий относится к металлам p-семейства. Электронная конфигурация внешнего энергетического уровня – 3s
. В своих соединениях алюминий проявляет степень окисления равную «+3».
Алюминий получают электролизом расплава оксида этого элемента:
Однако из-за небольшого выхода продукта, чаще используют способ получения алюминия электролизом смеси Na3 и Al2O3. Реакция протекает при нагревании до 960С и в присутствии катализаторов – фторидов (AlF3, CaF2 и др.), при этом на выделение алюминия происходит на катоде, а на аноде выделяется кислород.
Алюминий способен взаимодействовать с водой после удаления с его поверхности оксидной пленки (1), взаимодействовать с простыми веществами (кислородом, галогенами, азотом, серой, углеродом) (2-6), кислотами (7) и основаниями (8):
Положение активных металлов в таблице Менделеева
К активным металлам относятся три группы элементов:
- щелочные металлы;
- щелочноземельные металлы;
- алюминий.
Щелочные металлы находятся в первой группе таблицы Менделеева, то есть занимают в ней крайнее левое положение. В частности щелочными металлами являются:
- литий (Li);
- натрий (Na);
- калий (K);
- рубидий (Rb);
- цезий (Cs);
- франций (Fr).
Щелочноземельные металлы находятся во второй группе, то есть правее щелочных металлов. К ним относятся:
- бериллий (Be);
- магний (Mg);
- кальций (Ca);
- стронций (Sr);
- барий (Ba);
- радий (Ra).

Активные металлы в таблице Менделеева
В целом активные металлы отличаются тем, что имеют один или два валентных электрона, поэтому они легко отдают эти электроны в ходе химических реакций, выступая в качестве восстановителей. Степень активности металла можно оценить по его расположению в электрохимическом ряде активности металлов. Чем левее там находится металл, тем сильнее выражены его восстановительные свойства. Крайнее левое положение в ряде занимает литий. В вот крайне правое положение в ряду занимает золото, именно поэтому оно почти не окисляется кислотами.

Электрохимический ряд напряжений металлов
Алюминий – это так называемый постпереходный металл, по своим свойствам он находится где-то между активными и среднеактивными металлами. Разные ученые придерживаются различного мнения о том, стоит ли считать алюминий активным металлом.
Активные металлы не встречаются в природе в чистом виде, так как они быстро вступают в химические реакции с другими элементами. Чаще всего в природе они присутствуют в виде оксидов. Например, даже если алюминий получен в чистом виде, то на воздухе он быстро покрывается оксидной пленкой.
Свойства
Активные металлы отличаются мягкостью (можно разрезать ножом), лёгкостью, невысокой температурой плавления.
Основные химические свойства металлов представлены в таблице.
Реакция
Уравнение
Исключение
Щелочные металлы самовозгораются на воздухе, взаимодействуя с кислородом
Литий реагирует с кислородом только при высокой температуре
Щелочноземельные металлы и алюминий на воздухе образуют оксидные плёнки, а при нагревании самовозгораются
Реагируют с простыми веществами, образуя соли
Алюминий не вступает в реакцию с водородом
Бурно реагируют с водой, образуя щёлочи и водород
Реакция с литием протекает медленно. Алюминий реагирует с водой только после удаления оксидной плёнки
Реагируют с кислотами, образуя соли
Взаимодействуют с растворами солей, сначала реагируя с водой, а затем с солью
Активные металлы легко вступают в реакции, поэтому в природе находятся только в составе смесей – минералов, горных пород.

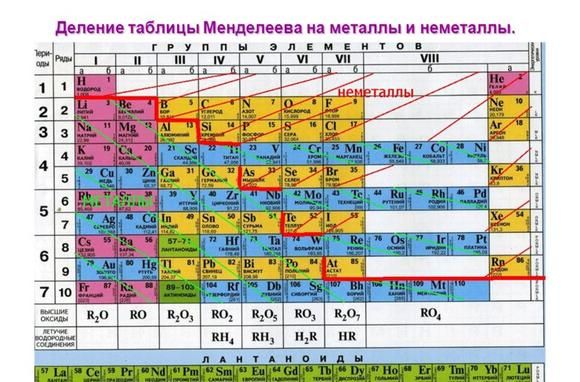
Рис. 1. Активные металлы в таблице Менделеева.

Рис. 2. Электрохимический ряд напряжений металлов.

Рис. 3. Минералы и чистые металлы.
Что мы узнали?
К активным металлам относятся элементы I и II групп – щелочные и щелочноземельные металлы, а также алюминий. Их активность обусловлена строением атома – немногочисленные электроны легко отделяются от внешнего энергетического уровня. Это мягкие лёгкие металлы, быстро вступающие в реакцию с простыми и сложными веществами, образуя оксиды, гидроксиды, соли. Алюминий находится ближе к водороду и для его реакции с веществами требуются дополнительные условия – высокие температуры, разрушение оксидной плёнки.
Читайте также:
