Реакция металлов с органическими веществами
ОРГАНИЧЕСКИЕ МЕТАЛЛЫ – общепринятое образное название соединений, не содержащих атомов металлов и, в то же время, обладающих электропроводимостью металлического типа. Металлическая (или электронная) проводимость осуществляется за счет перемещения электронов, в отличие от растворов электролитов, где перемещаются ионы.
Органические металлы получают на основе соединений, содержащих чередующиеся простые и двойные связи, а также атомы, содержащие неподеленные электронные пары (S, N). Именно такое сочетание компонентов позволяет в некоторых случаях получить молекулы с подвижной объединенной оболочкой из р-электронов.
Соединение, состоящее из двух серусодержащих циклов, соединенных двойной связью (тиофульвален), легко образует комплекс с элементарным хлором:
Поскольку хлор необычайно склонен дополнять свою электронную оболочку до 8 электронов, он забирает электрон (отмечен красным цветом) у тиофульвалена, при этом хлор становится анионом, а тиофульвален катионом: По существу, это процесс внутримолекулярного окисления – восстановления.
Тиофульвален имеет единую, легко подвижную электронную оболочку, поэтому электрон уходит не с конкретного атома, а со всей молекулы целиком. Кроме того, в исходном тиофульвалене все электроны были спарены, удаление одного электрона приводит к тому, что в молекуле появляется электрон без пары (отмечен синим цветом). Органическую молекулу, содержащую неспаренный электрон, называют радикалом, и такой электрон обозначают точкой. В итоге, молекула тиофульвалена становится и катионом и радикалом одновременно, общепринятое название «катион-радикал», который обозначают точкой (неспаренный электрон) и знаком «плюс» (катион):
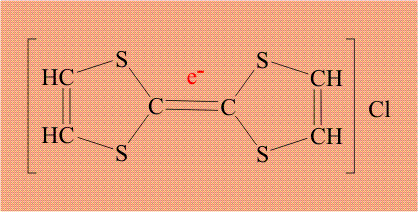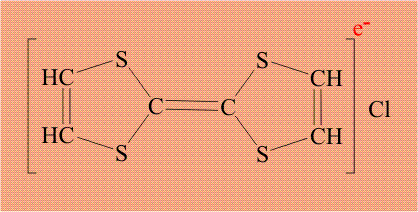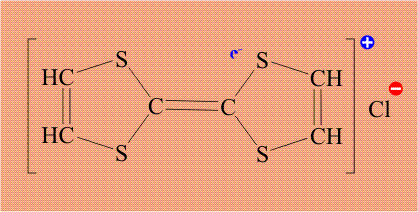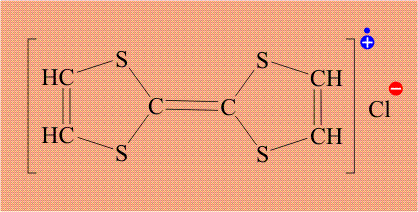
Возникший неспаренный электрон также принадлежит не конкретному атому, а всей молекуле целиком, то есть, он делокализован и потому может легко перемещаться. Именно эти электроны, находящиеся в массе вещества, обеспечивает электропроводимость, таким образом, задача атома хлора – создать неспаренный электрон у тиофульвалена. Проводимость в полученном комплексе довольно необычна.
Все металлы обладают так называемой трехмерной проводимостью: если взять кубик из железа и прикладывать электроды к любым парам противоположных граней, то проводимость будет наблюдаться всегда, ток может идти в любом направлении (кубики условно показаны полупрозрачными):
В кристалле молекулы тиофульвалена располагаются параллельно друг другу, образуя пакеты. Проводимость наблюдается только вдоль этих пакетов, в другом направлении ток не проходит, такую проводимость называют одномерной:
В настоящее время известно несколько десятков комплексов подобного типа, у некоторых из них проводимость почти такая, как у железа, а отдельные представители при понижении температуры способны переходить в сверхпроводящее состояние. В перспективе намечено использовать органические металлы в качестве неметаллических проводников в электронике, а также в роли электродов в химических источниках тока.
Жуховицкий В.Б., Хидекель М.Л., Дюмаев К.М. – журнал «Успехи химии», 1985, т. 54, выпуск. 2
Левицкий М.М. – Эстетическая химия. В журнале «Химия. Методика преподавания в школе», 2003, №5
Химические свойства металлов

Свойства металлов начинают изучать на уроках химии в 8–9 классе. В этом материале мы подробно разберем химические свойства этой группы элементов, а в конце статьи вы найдете удобную таблицу-шпаргалку для запоминания.
О чем эта статья:
8 класс, 9 класс, ЕГЭ/ОГЭ
Металлы — это химические элементы, атомы которых способны отдавать электроны с внешнего энергетического уровня, превращаясь в положительные ионы (катионы) и проявляя восстановительные свойства.
В окислительно-восстановительных реакциях металлы способны только отдавать электроны, являясь сильными восстановителями. В роли окислителей выступают простые вещества — неметаллы (кислород, фосфор) и сложные вещества (кислоты, соли и т. д.).
Металлы в природе встречаются в виде простых веществ и соединений. Активность металла в химических реакциях определяют, используя электрохимический ряд, который предложил русский ученый Н. Н. Бекетов. По химической активности выделяют три группы металлов.
Ряд активности металлов
Металлы средней активности
Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий
натрий образует пероксид
калий, рубидий и цезий — надпероксид
Остальные металлы с кислородом образуют оксиды:
2Zn + O2 = 2ZnO (при нагревании)
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
С галогенами металлы образуют галогениды:
Медный порошок реагирует с хлором и бромом (в эфире):
При взаимодействии с водородом образуются гидриды:
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
Реакции с фосфором протекают до образования фосфидов (при нагревании):
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется H2. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.


Металлы IА группы:
Металлы IIА группы
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Вопросы для самоконтроля
С чем реагируют неактивные металлы?
С чем связаны восстановительные свойства металлов?
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + NH4NO3 + Н2O
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Таблица «Химические свойства металлов»
Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb
Cu, Hg, Ag, Pt, Au
Восстановительная способность металлов в свободном состоянии
Возрастает справа налево
Взаимодействие металлов с кислородом
Быстро окисляются при обычной температуре
Медленно окисляются при обычной температуре или при нагревании
Взаимодействие с водой
Выделяется водород и образуется гидроксид
При нагревании выделяется водород и образуются оксиды
Водород из воды не вытесняют
Взаимодействие с кислотами
Вытесняют водород из разбавленных кислот (кроме HNO3)
Не вытесняют водород из разбавленных кислот
Реагируют с концентрированными азотной и серной кислотами
С кислотами не реагируют, растворяются в царской водке
Взаимодействие с солями
Не могут вытеснять металлы из солей
Более активные металлы (кроме щелочных и щелочноземельных) вытесняют менее активные из их солей
Взаимодействие с оксидами
Для металлов (при высокой температуре) характерно восстановление неметаллов или менее активных металлов из их оксидов
Качественные реакции

Как отличить одно сложное вещество от другого, если они внешне выглядят одинаково? Для этого есть качественные реакции, которые также называют аналитическими. Они сопровождаются каким-либо внешним эффектом, по которому и опознают состав вещества. В этом материале мы рассмотрим качественные реакции органических и неорганических соединений.
Что такое качественная реакция
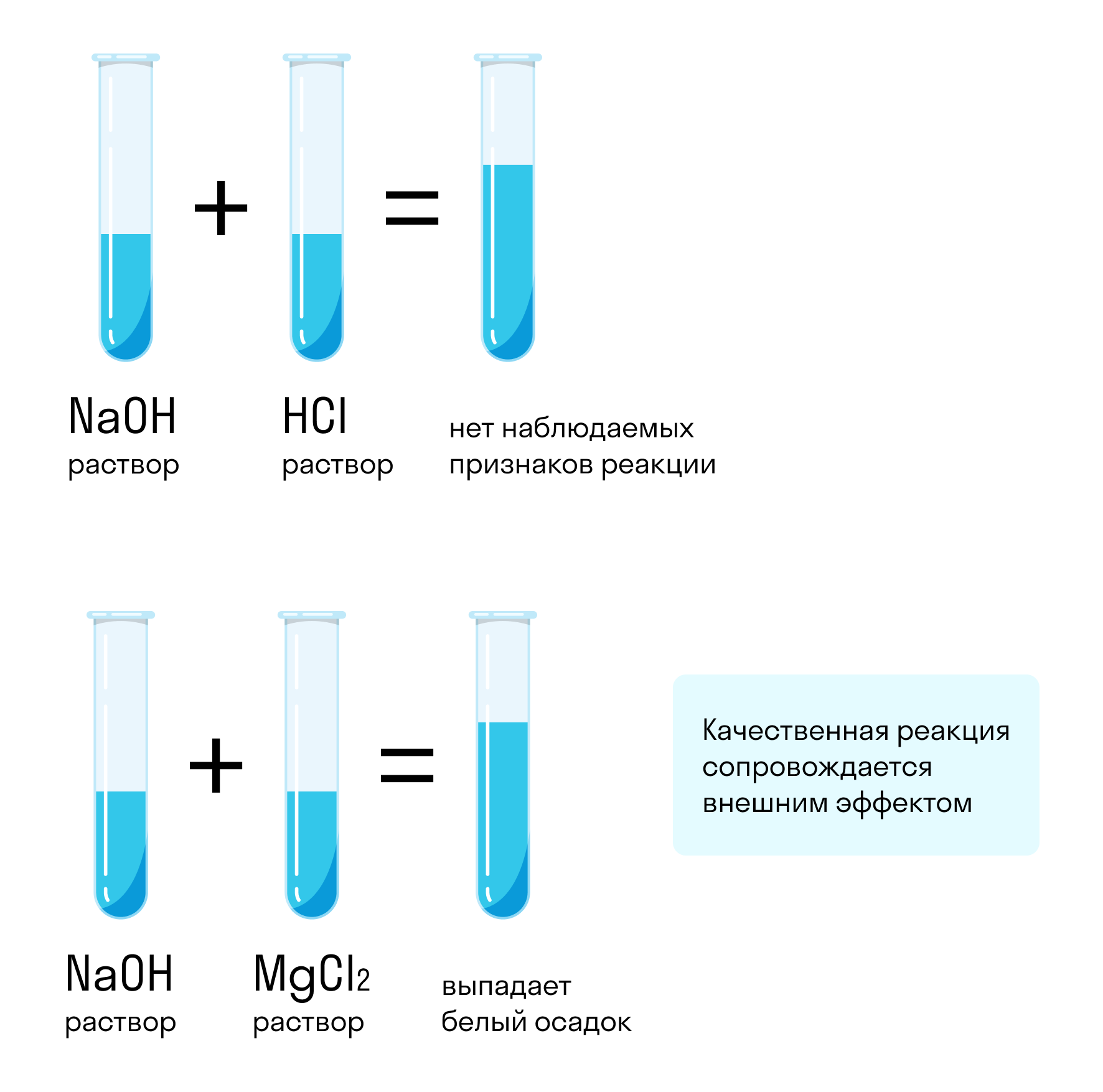
Предположим, у нас есть две пробирки — с водой и с гидроксидом натрия (каустической содой). Можно ли отличить один раствор от другого? Можно, если подобрать правильный реагент, с которым один раствор будет реагировать, а другой нет, или на который эти вещества будут реагировать по-разному.
Для таких целей подойдут не все реагенты. Например, если смешать гидроксид натрия с соляной кислотой, реакция произойдет: NaOH + HCl = NaCl + H2O. Но внешне она никак не проявится — два прозрачных раствора образуют такой же прозрачный третий. Такой реагент не подходит.
Если же смешать гидроксид натрия с хлоридом магния, результат химической реакции будет заметен невооруженным глазом. Характерным признаком станет образование белого осадка: 2NaOH + MgCl2 = Mg(OH)2 + 2NaCl. При смешивании хлорида магния с водой белый осадок не образуется. Значит, этот реагент позволяет отличить один раствор от другого.
Качественными называются реакции, позволяющие идентифицировать в исследуемом объекте определенные атомы, молекулы, функциональные группы и т. д. Идентификация происходит по внешним проявлениям, которые сопровождают реакцию: выделение газа, изменение цвета раствора, образование осадка, появление специфического запаха и др.
Качественные реакции — это простой и быстрый способ узнать качественный состав раствора или другого сложного вещества.
Качественный анализ
Определение состава того или иного вещества с помощью качественной реакции называют качественным анализом. В химии он часто используется перед количественным анализом, а также для того, чтобы понять, как можно разделить смесь.
Исследуемые объекты могут представлять собой твердые, жидкие или газообразные вещества, и в зависимости от этого качественный анализ проводится разными методами:
сухим способом — например, если внести пробу вещества в пламя горелки и отследить, как изменился цвет пламени;
мокрым способом — путем преобразования вещества в раствор.
Русский химик Ф. М. Флавицкий также предложил сухой метод растирания твердого исследуемого объекта с реактивом. Если реакция будет качественной, появятся характерные признаки: изменение цвета смеси, выделение газа и т. д.
Правила растворимости химических соединений
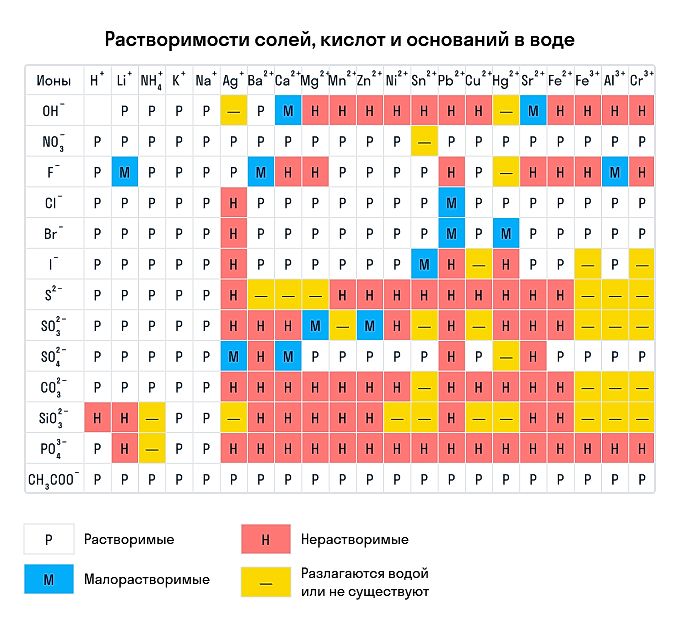
Сухим способом обычно проводят анализ в полевых условиях, а в лабораториях чаще использую растворы. Поэтому для изучения качественных реакций в химии (неорганической и органической) желательно знать правила растворимости сложных веществ. Наизусть учить, конечно, их не стоит — можно воспользоваться таблицей растворимости, которая приведена ниже.
Растворимы:
абсолютно все нитраты;
большинство солей аммония, натрия, калия (но есть исключения, например — гексанитритокобальтат (III) калия K3[Co(NO2)6]);
соли йодидной, хлороводородной и бромоводородной кислоты (но галогениды свинца (II), ртути (I) и серебра обладают умеренной растворимостью);
почти все сульфаты, кроме BaSO4, SrSO4, PbSO4 (при этом CaSO4 и Ag2SO4 умеренно растворимы).
Нерастворимы:
любые сульфиды, кроме сульфидов щелочных и щелочноземельных металлов, а также (NH4)2S;
любые гидроксиды, кроме гидроксидов щелочных металлов (умеренной растворимостью отличаются Sr(OH)2, Ca(OH)2, Ba(OH)2);
Качественные реакции органических веществ
В органической химии качественные реакции позволяют за считанные минуты определить класс соединения — узнать, относится ли исследуемый объект к спиртам, углеводам, альдегидам и т. д. По внешним эффектам судят о присутствии функциональных групп органических соединений в смеси или в растворе.
Белковые соединения при горении издают запах жженой шерсти. При добавлении концентрированной азотной кислоты они окрашивают раствор в ярко-желтый цвет, также характерно образование желтого осадка (ксантопротеиновая реакция). А если соединить в растворе белки со свежеосажденным гидроксидом меди (II), получится сине-фиолетовая смесь.
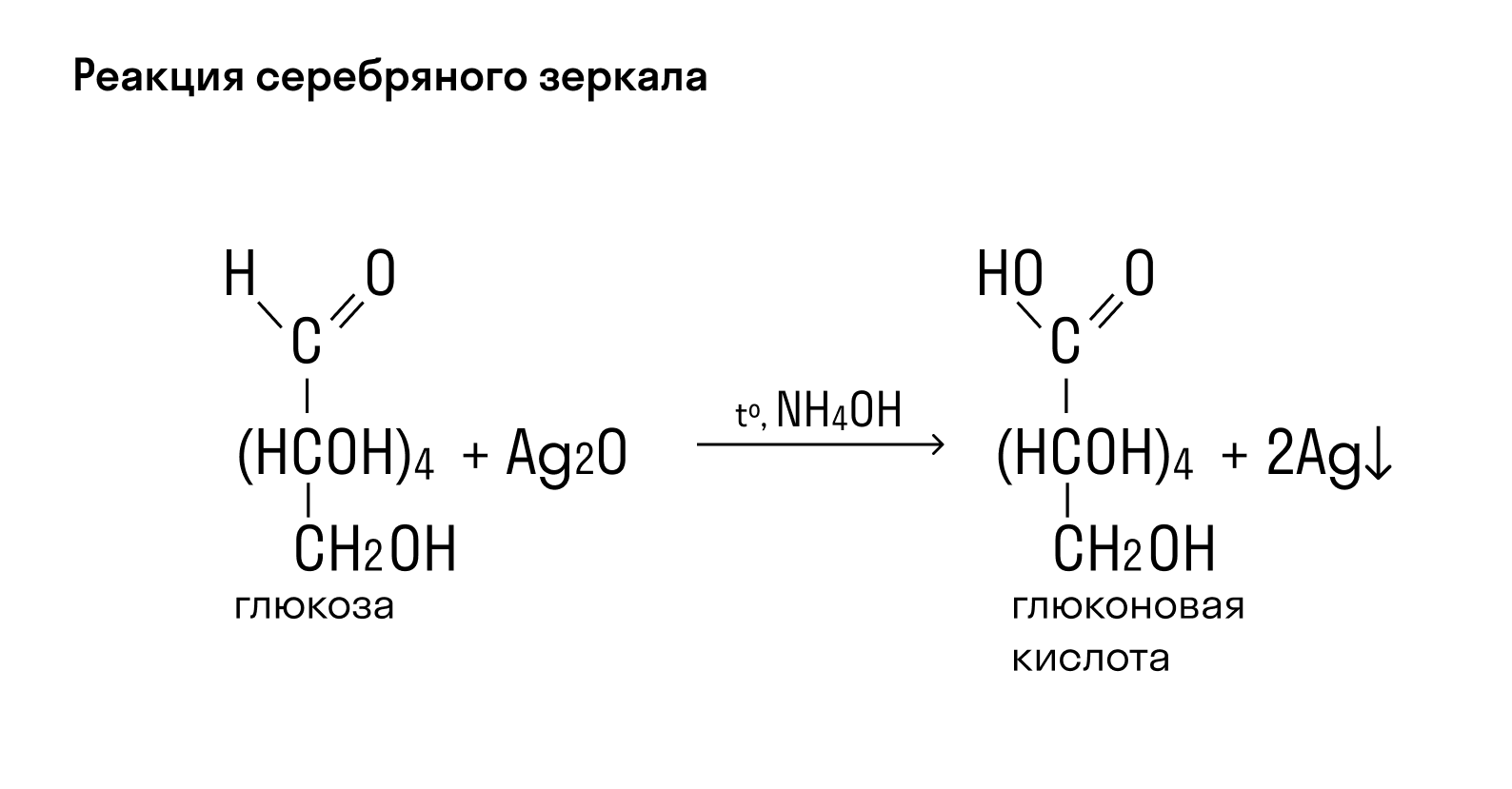
Глюкоза благодаря содержанию альдегидной группы в реакции с аммиачным раствором оксида серебра образует на стенках пробирки «серебряное зеркало». Вместе со свежеосажденным гидроксидом меди (II) она окрашивает раствор в синий цвет, а если данный раствор нагреть — происходит образование красно-оранжевого осадка.
СН2ОН — (СНОН)4 — СОН + Ag2O = СН2ОН — (СНОН)4 — СООН + 2Ag↓ — реакция «серебряного зеркала».
HOСН2 — (СНOH)4 — СН = O + 2Cu(OH)2 ⇒ HOСН2 — (СНOH)4 — СOOH + Cu2O + 2H2O — реакция глюкозы с гидроксидом меди (II).
Фенол с бромной водой образует белый осадок. Также он вступает в качественную реакцию с раствором соли трехвалентного железа — окрашивает его в фиолетовый цвет.
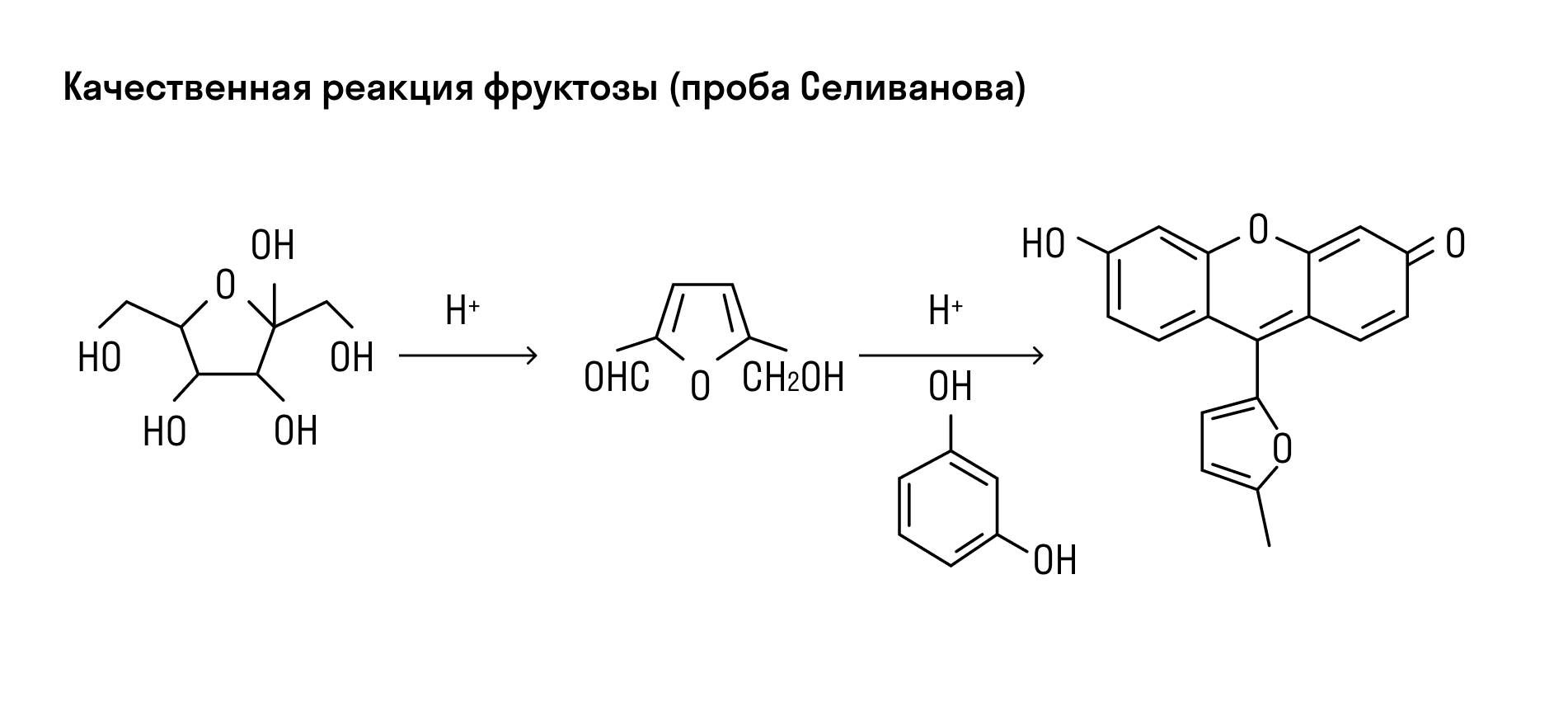
Углеводы с содержанием крахмала можно узнать по синему цвету раствора при добавлении йода. После нагревания такой раствор теряет цвет, но при охлаждении снова становится синим. Фруктозу можно идентифицировать по реакции с резорцином в растворе c соляной кислотой — смесь приобретает вишневый цвет (проба Селиванова).
Все качественные реакции с органическими соединениями в рамках статьи описать невозможно, но в таблице ниже указаны самые важные из них.
Химические свойства кислот
От производства лекарств до приготовления пищи — кислоты помогают человеку во многих областях жизни. В этом материале мы рассмотрим типичные свойства и реакции кислот с другими химическими веществами.
Кислоты — это сложные химические вещества, состоящие из одного или нескольких атомов водорода, способных замещаться атомами металла, и кислотных остатков.
Кислоты проявляют ряд общих химических свойств: диссоциацию и разложение, взаимодействуют с металлами, основаниями, солями, основными и амфотерными оксидами.
Для ряда кислот характерны специфические свойства. Все кислоты имеют определенную окраску в индикаторах.
Рассмотрим подробнее общие свойства кислот.
Диссоциация
Кислоты — это электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка. Диссоциация кислот происходит ступенчато. По способности к диссоциации кислоты разделяют на две группы:
Хорошо диссоциирующие (сильные): H2SO4, HCl, HBr, HNO3, HClO4, HI.
Разложение
В результате реакций разложения кислородсодержащих кислот образуются кислотный оксид и вода. Бескислородные кислоты образуют простые вещества. Для разложения некоторых кислот необходимо нагревание или излучение (HCl, HNO3, H3PO4) другие же разлагаются самопроизвольно в момент образования (H2CO3, H2SO3, HNO2).
Взаимодействие кислот с металлами
Металл может вытеснять водород из кислоты только в том случае, если металл стоит левее водорода в ряду активности металлов. Продукты реакции — соль и водород.

Высокая окислительная способность серной и азотной кислот позволяет им вступать в реакции с металлами. Продукты реакции будут зависеть от активности металла и от концентрации кислот.
Таблица: химические свойства кислот-окислителей
На холоду — пассивация
Реакция не проходит
Взаимодействие кислот с основаниями
Кислоты реагируют с основаниями и амфотерными гидроксидами, в результате образуются соль и вода. Взаимодействие кислот с основаниями называют реакцией нейтрализации.
NaOH + HCl = NaCl + H2O
Взаимодействие кислот с солями
Сильные кислоты вытесняют слабые из растворов их солей, при этом образуются новая соль и новая кислота. Условие протекания реакции кислот с солями — одним из продуктов реакции должны быть нерастворимая соль или слабая кислота, вода, газ.
Взаимодействие кислот с основными и амфотерными оксидами
Кислоты вступают в реакцию с основными и амфотерными оксидами (последние ведут себя как основные оксиды). В результате реакции образуется соль и вода.
Восстановительные свойства бескислородных кислот
Бескислородные кислоты (кроме HF) проявляют восстановительные свойства за счет химического элемента, который входит в состав аниона, при действии на них различных окислителей.
Например, в качестве окислителей для всех галогеноводородных кислот выступают диоксид марганца MnO2, перманганат калия KMnO4, дихромат калия K2Cr2O7.
Результат этих реакций — образование свободных галогенов.
Из галогеноводородных кислот наибольшая восстановительная активность — у йодоводородной. Ее могут окислять оксид железа (III) и соль трехвалентного железа.
Высокая восстановительная активность характерна для сероводородной кислоты, она может быть окислена диоксидом серы.
Способность окрашивать индикаторы
Индикаторы кислот — это специальные вещества, при помощи которых определяют наличие кислот в растворе.

С чем реагируют кислоты?
При каких условиях кислоты взаимодействуют с солями? Приведите пример.
Составьте уравнения реакций и назовите продукты реакций:
Разбавленный раствор серной кислоты реагирует с: медью, хлоридом меди, сульфатом меди, цинком?
МЕТАЛЛООРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
МЕТАЛЛООРГАНИЧЕСКИЕ СОЕДИНЕНИЯ, химические соединения, в которых углеродные атомы или органические группы связаны непосредственно с атомами металлов. Металлоорганические соединения играют важную роль в химии, во-первых, поскольку удобны для синтеза других соединений, во-вторых, потому что структуры некоторых из них привели химиков к новым полезным концепциям химической связи и, в-третьих, благодаря тому, что участвуют как нестойкие промежуточные соединения (интермедиаты) в каталитических реакциях.
Первое металлоорганическое соединение, диэтилцинк (C2H5)2 Zn, выделено в 1847 английским химиком Э.Франклендом, который пытался удалить атом иода из этилиодида C2H5I посредством реакции с цинком. В действительности реакция протекала по уравнению
и Франкленд получил бесцветную жидкость, диэтилцинк, которая самовоспламенялась при контакте с воздухом и бурно реагировала с водой. (Большинство металлоорганических соединений чрезвычайно реакционноспособны и обычно возгораются на воздухе.) Примерно в то же время в Копенгагене датский химик В.Цейзе также случайно получил соль K[PtCl3C2H4] (соль Цейзе), содержащую, как стало известно позднее, этилен, связанный с платиной.
Эти вещества являются представителями двух главных классов металлоорганических соединений: тех, у которых связи металла с углеродом (M–C) локализованы, и тех, где они делокализованы (в случае переходных металлов). В соединениях первого класса, образуемых всеми металлами, органические группы объединены простыми связями, например, M–CH3 или M–C6H5. Существуют также соединения типов M=CR2 и MєCR, с двойными и тройными металл-углеродными связями, – это карбеновые и карбиновые соединения соответственно.
Другой большой класс металлоорганических соединений – p-комплексы. Их называют так потому, что в химическом связывании с d-орбиталями переходных металлов участвуют p-электроны и p-орбитали ненасыщенных органических соединений с C=C-, CєC-, C=N- и т.п. связями (см. также ХИМИЯ ОРГАНИЧЕСКАЯ; МОЛЕКУЛ СТРОЕНИЕ). p-Комплексы включают все соединения, где органическая группа с кратными углерод-углеродными связями присоединена к переходному металлу.
p-Комплексы.
У этилена связь направлена перпендикулярно оси связи C=C (а); циклические олефины могут быть связаны по схеме б; ароматические кольца – нейтральные, как в бензоле C6H6, или заряженные, как у циклопентадиенил-аниона C5H5 – , - могут быть связаны по схеме в. Первое и наиболее известное из таких «сандвичевых» соединений - ферроцен (C5H5)2Fe - имеет структуру типа в. Ацетилены могут быть связаны с двумя атомами металлов по схеме г. Известны тысячи p-комплексов, многие из них - со сложными структурами.
СИНТЕЗ И ПРИМЕНЕНИЕ
Синтез.
Металлоорганические соединения щелочных металлов и магния широко используются как реагенты в органическом синтезе. Их можно приготовить в виде эфирных растворов по реакциям типа (1) и (2):
Смешанные магнийорганические соединения типа RMgX, где X = Cl, Br или I, известны под названием «реактивы Гриньяра» по имени французского химика В.Гриньяра, разработавшего условия их применения для органического синтеза (впервые их получил в 1899 Ф.Барбье – учитель Гриньяра). Реактивы Гриньяра вступают в многочисленные реакции и могут быть использованы, в частности, для синтеза других металлоорганических соединений, например:
Литийорганические соединения типа RLi широко применяются в фармацевтической промышленности для получения разнообразных органических соединений. Примером может служить синтез P(CH3)3:
Алюминийорганические соединения можно получить по реакции типа:
Применение.
Относительно немногие металлоорганические соединения используются как таковые; это, в основном, - кремнийорганические соединения (см. также КРЕМНИЙОРГАНИЧЕСКИЕ ПОЛИМЕРЫ) и тетраэтилсвинец Pb(C2H5)4, применявшийся как антидетонатор для бензина (см. также НЕФТЬ И ГАЗ). Оловоорганические соединения используются в красках, препятствующих биологическому обрастанию судов и подводных сооружений, и как катализаторы в производстве некоторых пластмасс. Ртутьорганические соединения применялись в сельском хозяйстве в качестве фунгицидов, но их использование запрещено во многих странах по экологическим соображениям, т.к. ртутьорганические соединения превращаются микроорганизмами в водорастворимый и токсичный ион метилртути CH3Hg + (послуживший причиной экологического бедствия в Минамате в Японии). В природе важную роль играет витамин B12, кобальторганическое соединение, дефицит которого в организме приводит к анемии; его действие, по-видимому, заключается в переносе органических групп путем образования Co–C-связей (см. также ПЛАСТМАССЫ; ВИТАМИНЫ).
Катализ.
В промышленности большое значение имеют каталитические реакции, в которых металлоорганические соединения возникают в виде нестойких интермедиатов. Эти реакции могут протекать гомогенно в растворах или гетерогенно, с участием металлоорганических частиц на таких носителях, как оксид алюминия, силикагель или уголь (см. также КАТАЛИЗ). Ниже приводятся примеры катализируемых металлами реакций, имеющих важное промышленное значение.
Полимеризация олефинов.
Полимеризация этилена и пропилена протекает с участием каталитической смеси алкилалюминия и хлорида титана. Катализаторы этого типа называются катализаторами Циглера – Натта, так как процесс был разработан К.Циглером (ФРГ) и Д.Натта (Италия), которые получили в 1963 Нобелевскую премию за эту работу. Бутадиен и сходные непредельные соединения могут быть заполимеризованы в каучук в присутствии алкиллития или алкилнатрия.
Соединения молибдена и вольфрама катализируют родственную реакцию, называемую реакцией метатезиса (диспропорционирования) олефинов:
Гидрирование кратных связей.
Эта важная реакция может быть гетерогенной или гомогенной. Гомогенная реакция с катализатором Уилкинсона RhCl[P(C6H5)3]3 применяется в фармацевтической промышленности; используя оптически активные фосфиновые лиганды, можно осуществить экономичный асимметрический синтез таких лекарственных средств, как L-ДОФА (L-3,4-дигидроксифенилаланин).
Родственная реакция, называемая гидросилилированием, состоит в присоединении триалкилсилана к олефину:
Реакции оксида углерода
CO. Промышленный синтез на основе оксида углерода(II) проводят с участием кобальторганических или родийорганических промежуточных соединений, в которых ацильная группа связана с металлом, R–CO–M. Реакция состоит в превращении M–R в M–COR путем «внедрения» оксида углерода по связи углерод – металл. Соединение M–R в некоторых случаях можно получить по реакции гидрида металла с олефином, например:
Важное место в промышленном синтезе занимают реакция гидроксиформилирования (оксо-синтез):
продуктами которой являются альдегиды или спирты, и процесс Монсанто – превращение метанола в уксусную кислоту с участием иодида родия:
В этих процессах металлоорганические соединения возникают на поверхности катализатора как интермедиаты.
Реакции окисления.
Многие реакции окисления органических соединений катализируются металлами, как, например, вакер-процесс – превращение этилена в ацетальдегид при помощи медно-палладиевого катализатора:
Интермедиатом в этом процессе служит этиленовый p-комплекс, сходный с солью Цейзе.
Коттон Ф., Уилкинсон Дж. Основы неорганической химии. М., 1979
Металлоорганическая химия переходных металлов. Основы и применения. М., 1989
Читайте также:
