Простым веществом металлом является
Химические вещества можно разделить на две группы: простые и сложные.
Простые вещества состоят из атомов одного элемента (О2, P4).
Сложные вещества состоят из атомов двух и более элементов (CaO, H3PO4).
Простые вещества можно разделить на металлы и неметаллы.
Металлы – это простые вещества, в которых атомы соединены между собой металлической химической связью. Металлы стремятся отдавать электроны и характеризуются металлическими свойствами (металлический блеск, высокая электро- и теплопроводность, пластичность и др.).
Неметаллы – это простые вещества, в которых атомы соединены ковалентными (или межмолекулярными) связями. Неметаллы стремятся принимать или притягивать электроны. Неметаллические свойства – это способность принимать или притягивать электроны.
Все элементы в Периодической системе химических элементов (ПСХЭ) расположены либо в главной подгруппе, либо в побочной. В различных формах короткопериодной ПСХЭ главные и побочные подгруппы расположены по-разному. Есть простой способ, который позволит вам быстро и надежно определять, к какой подгруппе относится элемент. Дело в том, что все элементы второго периода расположены в главной подгруппе. Те элементы, которые расположены в ячейке точно под элементами второго периода (справа или слева), относятся к главной подгруппе. Остальные — к побочной.
Например , в таблице Менделеева, которая используется на ЕГЭ по химии, элемент номер 31, галлий, расположен в ячейке справа, точно под соответствующим ему элементом второго периода, бором. Следовательно, галлий относится к главной подгруппе. А вот скандий, элемент номер 21, расположен в ячейке слева. Следовательно, скандий относится к побочной подгруппе.
Неметаллы расположены в главных подгруппах, в правом верхнем угле ПСХЭ. К металлам относятся все элементы побочных подгрупп и элементы главных подгрупп, расположенные в левой нижней части ПСХЭ. Разделяют металлы и неметаллы обычно, проводя условную линию от бериллия до астата. На рисунке показано точное разделение на металлы и неметаллы. Закрашены цветом неметаллы.

Основные классы сложных веществ — это оксиды, гидроксиды, соли.

Оксиды — это сложные вещества, которые состоят из атомов двух элементов, один из которых кислород, имеющий степень окисления -2.
В зависимости от второго элемента оксиды проявляют разные химические свойства. Некоторым оксидам соответствуют гидроксиды (солеобразующие оксиды), а некоторым нет (несолеобразующие).
Солеобразующие оксиды делят на основные, амфотерные и кислотные.
Основные оксиды — это оксиды, которые проявляют характерные основные свойства. К ним относят оксиды, образованные атомами металлов со степенью окисления +1 и +2 . Например, оксид лития Li2O, оксид железа (II) FeO.
Амфотерные оксиды — это оксиды, которые проявляют и основные, и кислотные свойства. Это оксиды металлов со степенью окисления +3 и +4 , а также четыре оксида со степенью окисления +2: ZnO, PbO, SnO и BeO .
Несолеобразующие оксиды не проявляют характерных основных или кислотных свойств, им не соответствуют гидроксиды. К несолеобразующим относят четыре оксида: CO, NO, N2O и SiO .
Встречаются и оксиды, похожие на соли, т.е. солеобразные (двойные).
Двойные оксиды — это некоторые оксиды, образованные элементом с разными степенями окисления. Например , магнетит (магнитный железняк) FeO·Fe2O3.
Алгоритм определения типа оксида: сначала определяем, какой элемент образует оксид – металл или неметалл . Если это металл, то определяем степень окисления, затем определяем тип оксида. Если это неметалл, то оксид кислотный (если это не исключение).
Гидроксиды — это сложные вещества, в составе которых есть группа Э-O-H. К гидроксидам относятся основания, амфотерные гидроксиды, и кислородсодержащие кислоты.
Солеобразующим оксидам соответствуют гидроксиды:
основному оксиду соответствует гидроксид основание ,
кислотному оксиду соответствует гидроксид кислота ,
амфотерному оксиду соответствует амфотерный гидроксид .
Например , оксид хрома (II) CrO — основный, ему соответствует гидроксид основание. Формулу гидроксида легко получить, просто добавив к металлу гидроксидную группу OH: Cr(OH)2.
Оксид хрома (VI) — кислотный, ему соответствует гидроксид кислота H2CrO4, и кислотный остаток хромат-ион CrO4 2- .
Если все индексы кратны 2, то мы делим все индексы на 2.
Например : N2O5 + H2O → H2N2O6, делим на 2, получаем HNO3. Так получаем мета-формулу кислоты. Если мы добавим еще одну молекулу воды, то получим орто-формулу кислоты.
Например : оксид P2O5, мета-форма: HPO3. Добавляем воду, орто-форма: H3PO4. Орто-форма устойчива у фосфора и мышьяка.
Оксид хрома (III) — Cr2O3 — амфотерный, ему соответствует амфотерный гидроксид, который может выступать и как основание, и как кислота: Cr(OH)3 = HCrO2, кислотный остаток хромит: CrO2 — .
Взаимосвязь оксидов и гидроксидов:
Основания (основные гидроксиды) — это сложные вещества, которые при диссоциации в водных растворах в качестве анионов (отрицательных ионов) образуют только гидроксид-ионы OH — .
Основания можно разделить на растворимые в воде ( щелочи ), нерастворимые в воде, и разлагающиеся в воде .

К разлагающимся в воде (неустойчивым) основаниям относят гидроксид аммония, гидроксид серебра (I), гидроксид меди (I). В водном растворе такие соединения практически необратимо распадаются:
2AgOH → Ag2O + H2O
2CuOH → Cu2O + H2O
Основания с одной группой ОН – однокислотные (например, NaOH ) , с двумя – двухкислотные (Ca(OH)2) и с тремя – трехкислотные (Fe(OH)3) .

Кислоты – это сложные вещества, которые при диссоциации в водных растворах образуют в качестве катионов только ионы гидроксония H3O + (H + ). Кислоты состоят из водорода H + и кислотного остатка.
По числу атомов водорода, которые можно заместить на металлы: одноосновные (HNO3), двухосновные (H2SO4), трехосновные (H3PO4) и т.д.

По содержанию атомов кислорода кислоты бывают бескислородные ( например , соляная кислота HCl) и кислородсодержащие ( например , серная кислота H2SO4).

Кислоты также можно разделить на сильные и слабые.
Сильные кислоты. К ним относятся:
- Бескислородные кислоты: HCl, HBr, HI . Остальные бескислородные кислоты, как правило, слабые.
- Некоторые высшие кислородсодержащие кислоты: H2SO4, HNO3, HClO4 и др.
Слабые кислоты . К ним относятся:
Определить, сильная кислота перед вами, или слабая, позволяет простой прием. Мы вычитаем из числа атомов O в кислоте число атомов H. Если получаем число 2 или 3, то кислота сильная. Если 1 или 0 — то кислота слабая.
Например : HClO: 1-1 = 0, следовательно, кислота слабая.
Соли – сложные вещества, состоящие из катиона металла (или металлоподобных катионов, например, иона аммония NH4 + ) и аниона кислотного остатка. Также солями называют вещества, которые могут быть получены при взаимодействии кислот и оснований с выделением воды.
Если рассматривать соли, как продукты взаимодействия кислоты и основания, то соли делят на средние , кислые и основные .
Средние соли – продукты полного замещения катионов водорода в кислоте на катионы металла ( например , Na2CO3, K3PO4).
Кислые соли – продукты неполного замещения катионов водорода в кислоте на катионы металлов ( например , NaHCO3, K2HPO4).
Основные соли – продукты неполного замещения гидроксогрупп основания на анионы кислотных остатков кислоты ( например , малахит (CuOH)2CO3).
По числу катионов и анионов соли разделяют на:
Простые соли – состоящие из катиона одного типа и аниона одного типа ( например , хлорид кальция CaCl2).
Двойные соли – это соли, состоящие из двух или более разных катионов и аниона одного типа ( например , алюмокалиевые квасцы – KAl(SO4)2).
Смешанные соли – это соли, состоящие из катиона одного типа и двух или более анионов разного типа ( например , хлорид-гипохлорит кальция Ca(OCl)Cl).
По структурным особенностям выделяют также гидратные соли и комплексные соли.
Гидратные соли (кристаллогидраты) – это такие соли, в состав которых входят молекулы кристаллизационной воды ( например , декагидрат сульфата натрия Na2SO4·10 H2O).
Комплексные соли – это соли, содержащие комплексный катион или комплексный анион (K3[Fe(CN)6], [Cu(NH3)4]Cl2).

Помимо основных классов неорганических соединений, существуют и другие.
Например , бинарные соединения элементов с водородом.
Водородные соединения – это сложные вещества, состоящие из двух элементов, один из которых водород. Водород образует солеобразные гидриды и летучие водородные соединения.
Солеобразные гидриды ЭНх – это соединения металлов IA, IIA групп и алюминия с водородом. Степень окисления водорода равна -1. Например , гидрид натрия NaH.
Летучие водородные соединения НхЭ – это соединения неметаллов с водородом, в которых степень окисления водорода равна +1. Например , аммиак NH3, фосфин PH3.

Тренировочный тест «Классификация неорганических веществ» 10 вопросов, при каждом прохождении новые.
Простые и сложные вещества

Из этой статьи вы узнаете, какие вещества называются простыми, а какие сложными, в чем их различия и особенности строения.
О чем эта статья:
Прежде чем переходить к понятиям простых и сложных веществ и к их строению, давайте вспомним, что такое химический элемент.
Химический элемент — это группа атомов с одинаковым зарядом ядра, который обусловливает его (элемента) химические свойства.
В зависимости от того, как соединяются друг с другом химические элементы, выделяют два типа веществ: простые и сложные.
Что такое простые вещества
Простые вещества — это вещества, образованные атомами только одного типа химического элемента. Например: H2, Na, P, Al.
Простые вещества делятся на два типа: металлы и неметаллы.
Металлы
Имеют общие между собой физические свойства. Обладают металлическим блеском, высокой тепло- и электропроводностью, твердые (за исключением ртути), пластичные и ковкие.
К простым веществам — металлам относятся: Na, Ca, Fe и т. д.
Почти все металлы имеют немолекулярное строение, т. е. состоят из атомов или ионов.
Неметаллы
Среди неметаллов выделить общие физические свойства практически невозможно. Они могут находиться в разных агрегатных состояниях, обладать различным цветом и т. д.
К простым веществам — неметаллам относятся: P, C, F2 и т. д.
Большинство неметаллов имеют молекулярное строение, т. е. состоят из молекул. При этом молекулы могут быть:
одноатомные: He, Si, Ar и другие;
двухатомные: F2, O2, H2, N2, Cl2, Br2, I2. Эти простые вещества всегда пишутся с индексом 2, их необходимо запомнить;
трехатомные — например, молекула озона O3;
и другие многоатомные.
Некоторые неметаллы имеют немолекулярное (атомное) строение: красный фосфор, кремний, алмаз и графит.
Металлы и неметаллы сильно отличаются друг от друга физическими и химическими свойствами.
При этом запоминать, к какому типу относится то или иное вещество, не нужно, достаточно посмотреть в таблицу Менделеева:
Проведите диагональ от 5-го до 85-го номера химических элементов.
Все химические элементы, находящиеся ниже и левее проведенной диагонали, образуют простые вещества — металлы (кроме водорода).
Выше диагонали химические элементы, находящиеся в главных подгруппах, образуют простые вещества — неметаллы, а в побочных — металлы.
Например, фосфор (порядковый номер — 15) расположен в таблице Менделеева выше диагонали и в главной подгруппе V группы. Значит, простое вещество фосфор — неметалл.
В большинстве случаев названия химического элемента и простого вещества совпадают. Поэтому необходимо научиться различать характеристики простого вещества и химического элемента.
Характеристика химического элемента
Характеристика простого вещества
Расположение в периодической системе (атомный номер, номер группы или периода)
Относительная атомная масса
Строение атома (число электронов, протонов или нейтронов, количество заполненных энергетических уровней)
Распространенность в природе
Содержание в соединении (например, в растительных белках или аминокислотах)
Значения электроотрицательности, сродства к электрону, энергии ионизации
Как правило, когда мы характеризуем простое вещество, то говорим о его физических или химических свойствах:
Влияние на живой организм
Температуры кипения и плавления
Взаимодействие с другими веществами
Содержание в каких-либо смесях веществ (например, газов)
Аллотропия
Аллотропия — это возможность образования химическим элементом нескольких простых веществ, которые отличаются друг от друга строением и свойствами.
Образующиеся простые вещества называют аллотропными модификациями.
Аллотропия характерна для следующих химических элементов:
углерод (алмаз, графит, графен, углеродные нанотрубки, фуллерен и другие);
фосфор (красный, белый и черный);
кислород (кислород и озон);
кремний (аморфный и кристаллический);
Рассмотрим две аллотропные модификации углерода:


The image 1 is a derivative of "Crystal" by manfredxy on Envato Elements.
The image 2 is a derivative of "Rough Graphite rock" by vvoennyy on Envato Elements.
Алмаз — бесцветное прозрачное вещество. Является одним из самых твердых веществ. Не проводит электрический ток.
Графит представляет собой вещество серо-черного цвета, обладает металлическим блеском. Имеет высокую тепло- и электропроводность.
Что такое сложные вещества
Сложные вещества — это вещества, образованные атомами нескольких химических элементов.
Например, молекула HNO3 состоит из одного атома водорода, одного атома азота и трех атомов кислорода.
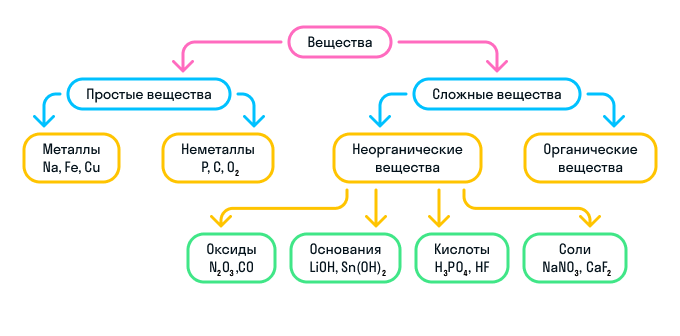
К сложным веществам в химии относятся две большие группы веществ: неорганические и органические.
Неорганические вещества
Неорганические вещества делятся на 4 вида:
Оксиды — вещества, молекулы которых состоят из двух химических элементов, один из которых — кислород в степени окисления −2.
Основания — вещества, молекулы которых состоят из катиона металла и гидроксильной группы (—OH).
Кислоты — вещества, молекулы которых состоят из катиона водорода (H+), способного замещаться атомом металла, и кислотного остатка.
Соли — вещества, состоящие из катиона металла и кислотного остатка.
Кратко о классификации веществ можно узнать из схемы:
Номенклатура неорганических веществ
Названия простых веществ чаще всего совпадают с названием химического элемента, а для сложных веществ существует два вида номенклатуры: тривиальная и систематическая.
В тривиальной номенклатуре вещества названы в соответствии с их особенностями, например специфическим запахом или окраской.
В систематической номенклатуре название зависит от вида неорганического вещества.
Оксиды
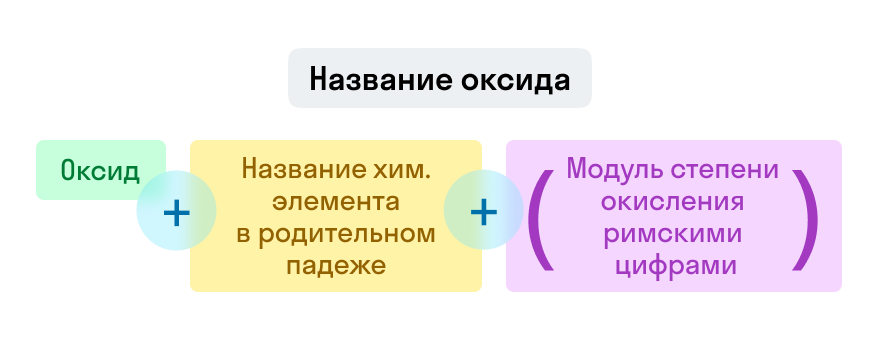
Примеры названий оксидов:
Fe2O3 — оксид железа (III). Читается: феррум два о три;
Na2O — оксид натрия. Читается: натрий два о.
Основания
Примеры названий гидроксидов:
Fe(OH)3 — гидроксид железа (III). Читается: феррум о аш трижды;
NaOH — гидроксид натрия. Читается: натрий о аш.
Соли
Примеры названий солей:
KNO3 — нитрат калия. Читается: калий эн о три;
AlCl3 — хлорид алюминия. Читается: алюминий хлор три.
Кислоты
Названия кислот, кислотных остатков и их формулы необходимо выучить, они приведены в таблице ниже.
Химические свойства металлов

Свойства металлов начинают изучать на уроках химии в 8–9 классе. В этом материале мы подробно разберем химические свойства этой группы элементов, а в конце статьи вы найдете удобную таблицу-шпаргалку для запоминания.
8 класс, 9 класс, ЕГЭ/ОГЭ
Металлы — это химические элементы, атомы которых способны отдавать электроны с внешнего энергетического уровня, превращаясь в положительные ионы (катионы) и проявляя восстановительные свойства.
В окислительно-восстановительных реакциях металлы способны только отдавать электроны, являясь сильными восстановителями. В роли окислителей выступают простые вещества — неметаллы (кислород, фосфор) и сложные вещества (кислоты, соли и т. д.).
Металлы в природе встречаются в виде простых веществ и соединений. Активность металла в химических реакциях определяют, используя электрохимический ряд, который предложил русский ученый Н. Н. Бекетов. По химической активности выделяют три группы металлов.
Ряд активности металлов
Металлы средней активности
Общие химические свойства металлов
Взаимодействие с неметаллами
Щелочные металлы сравнительно легко реагируют с кислородом, но каждый металл проявляет свою индивидуальность:
оксид образует только литий
натрий образует пероксид
калий, рубидий и цезий — надпероксид
Остальные металлы с кислородом образуют оксиды:
2Zn + O2 = 2ZnO (при нагревании)
Металлы, которые в ряду активности расположены левее водорода, при контакте с кислородом воздуха образуют ржавчину. Например, так делает железо:
С галогенами металлы образуют галогениды:
Медный порошок реагирует с хлором и бромом (в эфире):
При взаимодействии с водородом образуются гидриды:
Взаимодействие с серой приводит к образованию сульфидов (реакции протекают при нагревании):
Реакции с фосфором протекают до образования фосфидов (при нагревании):
Основной продукт взаимодействия металла с углеродом — карбид (реакции протекают при нагревании).
Из щелочноземельных металлов с углеродом карбиды образуют литий и натрий:
Калий, рубидий и цезий карбиды не образуют, могут образовывать соединения включения с графитом:
С азотом из металлов IA группы легко реагирует только литий. Реакция протекает при комнатной температуре с образованием нитрида лития:
Взаимодействие с водой
Все металлы I A и IIA группы реагируют с водой, в результате образуются растворимые основания и выделяется H2. Литий реагирует спокойно, держась на поверхности воды, натрий часто воспламеняется, а калий, рубидий и цезий реагируют со взрывом:
Металлы средней активности реагируют с водой только при условии, что металл нагрет до высоких температур. Результат данной реакции — образование оксида.
Неактивные металлы с водой не взаимодействуют.
Взаимодействие с кислотами
Если металл расположен в ряду активности левее водорода, то происходит вытеснение водорода из разбавленных кислот. Данное правило работает в том случае, если в реакции с кислотой образуется растворимая соль.
2Na + 2HCl = 2NaCl + H2
При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.


Металлы IА группы:
Металлы IIА группы
Такие металлы, как железо, хром, никель, кобальт на холоде не взаимодействуют с серной кислотой, но при нагревании реакция возможна.
Взаимодействие с солями
Металлы способны вытеснять из растворов солей другие металлы, стоящие в ряду напряжений правее, и могут быть вытеснены металлами, расположенными левее:
Zn + CuSO4 = ZnSO4 + Cu
На металлы IА и IIА группы это правило не распространяется, так как они реагируют с водой.
Реакция между металлом и солью менее активного металла возможна в том случае, если соли — как вступающие в реакцию, так и образующиеся в результате — растворимы в воде.
Взаимодействие с аммиаком
Щелочные металлы реагируют с аммиаком с образованием амида натрия:
Взаимодействие с органическими веществами
Металлы IА группы реагируют со спиртами и фенолами, которые проявляют в данном случае кислотные свойства:
Также они могут вступать в реакции с галогеналканами, галогенпроизводными аренов и другими органическими веществами.
Взаимодействие металлов с оксидами
Для металлов при высокой температуре характерно восстановление неметаллов или менее активных металлов из их оксидов.
3Са + Cr2O3 = 3СаО + 2Cr (кальциетермия)
Вопросы для самоконтроля
С чем реагируют неактивные металлы?
С чем связаны восстановительные свойства металлов?
Верно ли утверждение, что щелочные и щелочноземельные металлы легко реагируют с водой, образуя щелочи?
Методом электронного баланса расставьте коэффициенты в уравнении реакции по схеме:
Mg + HNO3 → Mg(NO3)2 + NH4NO3 + Н2O
Как металлы реагируют с кислотами?
Подведем итоги
От активности металлов зависит их химические свойства. Простые вещества — металлы в окислительно-восстановительных реакциях являются восстановителями. По положению металла в электрохимическом ряду можно судить о том, насколько активно он способен вступать в химические реакции (т. е. насколько сильно у металла проявляются восстановительные свойства).
Напоследок поделимся таблицей, которая поможет запомнить, с чем реагируют металлы, и подготовиться к контрольной работе по химии.
Таблица «Химические свойства металлов»
Mg, Al, Mn, Zn, Cr, Fe, Ni, Sn, Pb
Cu, Hg, Ag, Pt, Au
Восстановительная способность металлов в свободном состоянии
Возрастает справа налево
Взаимодействие металлов с кислородом
Быстро окисляются при обычной температуре
Медленно окисляются при обычной температуре или при нагревании
Взаимодействие с водой
Выделяется водород и образуется гидроксид
При нагревании выделяется водород и образуются оксиды
Водород из воды не вытесняют
Взаимодействие с кислотами
Вытесняют водород из разбавленных кислот (кроме HNO3)
Не вытесняют водород из разбавленных кислот
Реагируют с концентрированными азотной и серной кислотами
С кислотами не реагируют, растворяются в царской водке
Взаимодействие с солями
Не могут вытеснять металлы из солей
Более активные металлы (кроме щелочных и щелочноземельных) вытесняют менее активные из их солей
Взаимодействие с оксидами
Для металлов (при высокой температуре) характерно восстановление неметаллов или менее активных металлов из их оксидов
Простые вещества

Простые вещества — вещества, состоящие исключительно из атомов одного химического элемента (из гомоядерных молекул) [1] [2] , в отличие от сложных веществ. Являются формой существования химических элементов в свободном виде [1] [3] ; или, иначе говоря, элементы, не связанные химически ни с каким другим элементом, образуют простые вещества [3] . Известно свыше 400 разновидностей простых веществ [2] .
В зависимости от типа химической связи между атомами простые вещества могут быть металлами (Na, Mg, Al, Bi и др.) и неметаллами (H2, N2, Br2, Si и др.) [2] .
Содержание
Аллотропные модификации
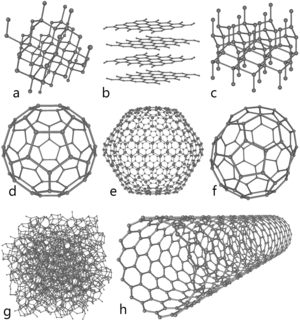

Схемы строения различных модификаций углерода
a: алмаз, b: графит, c: лонсдейлит
d: фуллерен — букибол C60, e: фуллерен C540, f: фуллерен C70
g: аморфный углерод, h: углеродная нанотрубка
Один и тот же химический элемент зачастую может образовывать несколько типов простых веществ (аллотропия), называемых аллотропными модификациями. Явление аллотропии может быть обусловлено либо различным составом молекул данного элемента (аллотропия состава), либо различным строением молекул и способом размещения молекул (атомов) в кристаллах (аллотропия формы). Способность элемента к образованию соответствующих аллотропных модификаций обусловлена строением атома, которое определяет тип химической связи, строение молекул и кристаллов [2] .
Различные аллотропные модификации могут переходить друг в друга. Для данного химического элемента его аллотропные модификации всегда различаются по физическим свойствам и химической активности (например, озон активнее кислорода, температура плавления алмаза больше, чем фуллерена) [4] .
Агрегатное состояние
При нормальных условиях соответствующие простые вещества для 11 элементов являются газами (H, He, N, O, F, Ne, Cl, Ar, Kr, Xe, Rn), для 2 — жидкостями (Br, Hg), для остальных элементов — твёрдыми телами.
При комнатной температуре (либо близкой к ней) 5 металлов находятся в жидком либо полужидком состоянии, так как их температура плавления близка к комнатной:
Отношение понятий
Понятия «атом», «химический элемент» и «простое вещество» не следует смешивать. «Атом» — конкретное понятие, так как атомы существуют реально. «Химический элемент» — это собирательное, абстрактное понятие; в природе химический элемент существует в виде свободных или химически связанных атомов, то есть простых и сложных веществ.
Также нужно различать свойства (характеристики) простого вещества (совокупности частиц) и свойства (характеристики) химического элемента (изолированного атома определенного вида), см. таблицу ниже [4] :
| Характеристики химического элемента | Характеристики простого вещества |
|---|---|
| атомный номер относительная атомная масса изотопный состав распространённость в природе положение в периодической системе строение атома энергия ионизации сродство к электрону электроотрицательность степени окисления валентность аллотропные модификации химический знак … | окраска запах электропроводность теплопроводность растворимость твёрдость температура кипения температура плавления вязкость молярная масса оптические свойства магнитные свойства химическая формула … |
Названия химических элементов и соответствующих простых веществ совпадают в большинстве случаев. Однако существуют и исключения. Например, названия аллотропных модификаций кислорода — кислород (дикислород O2) и озон; углерода — алмаз, графит, карбин, фуллерен.
Каждый химический элемент имеет свое условное обозначение — химический знак (символ). В ряде случаев химический знак может также выражать состав простого вещества (Zn, B, C, Ar). Однако, например, символ O обозначает только химический элемент, простое вещество «кислород» имеет формулу O2.
См. также
Примечания
Литература
Ссылки
- Основные положения и определения в химии
- Простые вещества
Wikimedia Foundation . 2010 .
Полезное
Смотреть что такое "Простые вещества" в других словарях:
Простые эфиры — Простые эфиры органические вещества, имеющие формулу R O R1, где R и R1 углеводородные радикалы. Следует однако учитывать, что такая группа может входить в состав других функциональных групп соединений, не являющихся простыми эфирами… … Википедия
Неорганические вещества — Неорганические вещества это химические вещества, которые не являются органическими, то есть они не содержат углерода (кроме карбидов, цианидов, карбонатов, оксидов углерода и некоторых других соединений, которые традиционно относят к… … Википедия
Молекулярные вещества — Молекулярные и немолекулярные вещества один из признаков химических веществ относительно их строения. Содержание 1 Молекулярные вещества 2 Немолекулярные вещества … Википедия
Сложные вещества — это химические вещества, которые состоят из атомов двух или более химических элементов. Сложными веществами являются большинство неорганических веществ и все органические. (см. также простые вещества) Сложные вещества состоят из атомов разного… … Википедия
Эфиры простые — Простые эфиры органические вещества, имеющие формулу R O R1, где R и R1 углеводородные радикалы. Следует однако учитывать, что такая группа может входить в состав других функциональных групп соединений не являющихся простыми эфирами (см.… … Википедия
Взрывчатые вещества* — будучи при обыкновенных условиях более или менее постоянны, под влиянием накаливания, удара, трения и тому под. способны взрывать , то есть быстро разлагаться, превращаясь в накаленные сжатые газы, стремящиеся занять большой объем. Происходящие… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Взрывчатые вещества — будучи при обыкновенных условиях более или менее постоянны, под влиянием накаливания, удара, трения и тому под. способны взрывать , то есть быстро разлагаться, превращаясь в накаленные сжатые газы, стремящиеся занять большой объем. Происходящие… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
НАРКОТИЧЕСКИЕ ВЕЩЕСТВА — НАРКОТИЧЕСКИЕ ВЕЩЕСТВА, narcoti ca, или stupefacientia (от греч. narcao соот вет. лат. stupefacio цепенею). Отнесение фармакол. агентов в группу Н. в. определялось уже издавна способностью их вызывать либо угнетение чувствительной и двигательной… … Большая медицинская энциклопедия
Органические вещества — Органические соединения, органические вещества класс химических соединений, в состав которых входит углерод (за исключением карбидов, угольной кислоты, карбонатов, оксидов углерода и цианидов).[1] Содержание 1 История 2 Класси … Википедия
Белковые вещества — Б. вещества составляют громадный класс органических, то есть углеродистых, а именно углеродисто азотистых соединений, неизбежно встречаемых в каждом организме до того, что каждая клетка растений содержит Б. вещества, а клетки животных организмов… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
Виды простых и сложных веществ
В неорганической химии вещества по составу делятся на простые и сложные.
- состоят из атомов одного химического элемента: сера S, углерод С, железо Fe, серебро Ag;
- подразделяют на металлы и неметаллы (включая благородные газы).
Сложные вещества — соединения:
- состоят из атомов двух или более химических элементов: N a 2 O , H C l , C u S O 4 ;
- подразделяют на: оксиды, основания, кислоты и соли.
Классификация простых веществ
1. Простые вещества условно делят на две группы: металлы и неметаллы.
Неметаллы в Периодической системе — это все элементы VIII А-группы (благородные газы) и VII А-группы (галогены), элементы VI А-группы (кроме полония), элементы V А-группы: азот, фосфор, мышьяк; углерод, кремний (IV А-группа); бор (III А-группа), а также водород. Остальные элементы относят к металлам.
Отличия свойств металлов и неметаллов приведены в таблице 1:
- газообразные: водород H 2 , азот N 2 , фтор F 2 ;
- жидкие: только бром B r 2 ;
- твёрдые: кремний Si, бор B, мышьяк As.
Амфотерные элементы находятся в А-группах Периодической системы: бериллий Be, алюминий Al, галлий Ga, германий Ge, олово Sn, свинец Pb, сурьма Sb, висмут Bi, полоний Po и др., а также большинство элементов Б-групп: хром Cr, марганец Mn, железо Fe, цинк Zn, кадмий Cd, золото Au и др., проявляют и металлические (оснóвные для соединений), и неметаллические (кислотные для соединений) свойства.
Благородные (инертные) газы (VIII А-группа Периодической системы): гелий He, неон Ne, аргон Ar, криптон Kr, ксенон Xe и радиоактивный радон Rn:
- обнаруживаются в воздухе, в малых количествах — в воде, горных породах, природных газах;
- не имеют цвета, вкуса и запаха;
- крайне химически инертны;
- используются в источниках света для создания освещения различных цветов (Ne — огненно-красный, Xe— синевато-серый, тусклый, Ar — фиолетово-голубой и др).
2. Сложные соединения и их отличия от простых веществ.
Сложные вещества бывают органические, в основе которых лежит углерод, и неорганические (безуглеродные и некоторые углеродсодержащие соединения: карбиды, карбонаты, оксиды углерода и другие). Неорганические чаще всего подразделяют на оксиды, основания, кислоты и соли.
Главные отличия сложных неорганических веществ:
- Свойства элементов, входящих в соединение, не сохраняются. Например, металл кальций Ca и неметалл хлор C l 2 . Каждому из этих простых веществ присущи свои характеристики. А соль C a C l 2 имеет новые, отличные от характеристик простых веществ, свойства, сходные со свойствами класса солей.
- В ходе химических реакций сложное вещество может быть получено или разложено на составные части.
- Количественный состав сложного соединения всегда одинаков, независимо от места нахождения и способа получения (для веществ молекулярного состава).
Классификация неорганических соединений и их основные свойства приведены в таблице 2.
- газы: N O , C O 2
- жидкости: H 2 O
- твёрдые: C u O , S i O 2
- газы: H 2 S , H C l
- жидкости: H N O 3 , H 2 S O 4
- твёрдые: H 3 P O 4 , H 3 B O 3
- оксиды металлов (оснóвные): K 2 O , CaO;
- оксиды неметаллов (кислотные): N 2 O 5 , S O 3 ;
- амфотерные: ZnO, A l 2 O 3 .
- оснóвные: LiOH, C a ( O H ) 2 ;
- амфотерные: B e ( O H ) 2 , C r ( O H ) 3 .
- кислородсодержащие: H 2 S O 4 , H N O 3 ;
- бескислородные: H J , H 2 S .
- средние: N a 3 ( P O 4 ) 2 , C a C l 2 ;
- кислые: K H C O 3 , N a 2 H P O 4 ;
- оснóвные: Mg(OH)Cl, C u 2 ( O H ) 2 C O 3 ;
- комплексные: K 2 [ B e ( C O 3 ) 2 ] .
Классы и номенклатура неорганических веществ
Номенклатура — способ называния веществ.
Химическая формула — представление состава вещества с использованием символов химических элементов, числовых индексов и других знаков. Химическое название определяется составом вещества и изображается с помощью слова или группы слов. Названия строятся по номенклатурным правилам, с использованием русских названий элементов, кроме случаев, когда традиционно употребляются латинские корни (таблица 3):
| Ag — аргент | C — карб, карбон | H — гидр, гидроген | N — нитр | Pb — плюмб, | Si — сил, силик, силиц |
| As — арс, арсен | Cu — купр | Hg — меркур | Ni — никкол | S — сульф | Sn -станн |
| Au — аур | Fe — ферр | Mn — манган | O — окс, оксиген | Sb — стиб | |
| Например, оксид натрия N a 2 O , карбонат кальция C a C O 3 , перманганат калия K M n O 4 | |||||
- Названия простых веществ чаще всего совпадают с русскими названиями соответствующих химических элементов. По необходимости к ним добавляется числовая греческая приставка: моно — 1, ди (латинский) — 2, три — 3, тетра — 4, пента — 5, гекса — 6, гепта — 7, окта — 8, нона (латинский) — 9, дека — 10. Например, (моно) кальций Ca, (моно) медь Cu, дикислород O 2 , трикислород O 3 , тетрафосфор P 4 . Исключение: аллотропные модификации: углерода С — графит, сажа, алмаз; кислорода — озон O3.
- Названия сложных веществ составляют по химической формуле справа налево. Для каждого класса веществ существуют свои правила составления формул и названий:
- формула оксидов: ЭnOm, где n и m — числовые индексы, определяющиеся степенями окисления элементов. Например,
Li+1 и O-2→ L i 2 O ; Al+3 и O-2→ A l 2 O 3 ; N+5 и O-2→ N 2 O 5 .
Название оксида: слово «оксид» в именительном падеже + название элемента Э в родительном падеже: оксид лития L i 2 O , оксид алюминия A l 2 O 3 .
Если элемент образует несколько оксидов, то в конце добавляют степень окисления римскими цифрами, заключая их в скобки:
- P 2 O 5 — пентаоксид (ди)фосфора или оксид фосфора (V), читается: «оксид фосфора пять»;
- F e 2 O 3 — триоксид (ди)железа или оксид железа (III), читается: «оксид железа три».
Оксиды, которым соответствуют кислоты, также называют ангидридами: серный ангидрид S O 3 , азотный ангидрид N 2 O 5 и др.
- формула оснований: Me+n(OH-)n, где нижний индекс n — количество гидроксид-анионов OH-.
K+1 и OH- → KOH, Mg+2 и OH- → M g ( O H ) 2 .
Название: слово «гидроксид» в именительном падеже + название элемента в родительном падеже: гидроксид калия, гидроксид магния.
Если элемент образует несколько гидроксидов, то в конце добавляют степень окисления римскими цифрами, заключая их в скобки:
F e ( O H ) 2 — гидроксид железа (II), C r ( O H ) 3 — гидроксид хрома (III).
- формула кислот HnК, где K — кислотный остаток.
Названия бескислородных кислот: корень русского названия элемента, образующего кислоту + суффикс «о» + «-водородная кислота», например: HBr — бромоводородная кислота, HCl — хлороводородная кислота, H 2 S — сероводородная кислота.
Названия кислородсодержащих кислот: русское название образующего элемента + «кислота», с учетом правил:
- Если элемент находится в высшей степени окисления, то окончание будет «-ная» или «-овая»: H 2 S O 4 — серная кислота, H 3 A s O 4 — мышьяковая кислота. Окончание меняется с понижением степени окисления в последовательности: «-оватая» ( H C l O 3 — хлорноватая кислота), «-истая» ( H C l O 2 — хлористая кислота), «-оватистая» (HClO— хлорноватистая кислота).
- Если оксиду соответствует не одна кислота, то к названию кислоты с минимальным числом атомов кислорода, добавляется приставка «мета», а к названию кислоты с максимальным числом атомов кислорода — «орто», например, H P O 3 — метафосфорная кислота, H 3 P O 4 — ортофосфорная кислота.
Названия наиболее распространенных кислот и их остатков приведены в таблице 4:
| Формула и название кислоты | Название кислотного остатка, образующего соль |
| H A l O 2 метаалюминиевая | метаалюминат |
| H 3 A l O 3 ортоалюминиевая | ортоалюминат |
| H A s O 3 метамышьяковая | метаарсенат |
| H 3 A s O 4 ортомышьяковая | ортоарсенат |
| H 3 B O 3 ортоборная | ортоборат |
| HBr бромоводородная | бромид |
| HBrO бромноватистая | гипобромит |
| H B r O 3 бромноватая | бромат |
| HCN циановодородная | цианид |
| H 2 C O 3 угольная | карбонат |
| HCl хлороводородная | хлорид |
| HClO хлорноватистая | гипохлорит |
| H C l O 2 хлористая | хлорит |
| H C l O 3 хлорноватая | хлорат |
| H C l O 4 хлорная | перхлорат |
| HF фтороводородная | фторид |
| HJ йодоводородная | йодид |
| H M n O 4 марганцовая | перманганат |
| H N O 2 азотистая | нитрит |
| H N O 3 азотная | нитрат |
| H P O 3 метафосфорная | метафосфат |
| H 3 P O 4 ортофосфорная | ортофосфат |
| H 2 S сероводородная | сульфид |
| H 2 S O 3 сернистая | сульфит |
| H 2 S O 4 серная | сульфат |
| H 2 S i O 3 метакремниевая | метасиликат |
| H 3 S i O 4 ортокремниевая | ортосиликат |
Название образуется в зависимости от типа соли.
- Средние соли — наименование кислотного остатка в именительном падеже + наименование катиона в родительном падеже, если необходимо, добавляется степень окисления: хлорид натрия NaCl, сульфат меди (II) C u S O 4 и т.д.
- Кислые (только для многоосновных кислот) — приставка «гидро», при необходимости добавляется числовое значение (ди—, три—, тетра— и т.д.) + название кислотного остатка + название катиона: гидрокарбонат натрия N a H C O 3 , дигидроортофосфат бария B a ( H 2 P O 4 ) 2 .
- Оснóвные — приставка «гидроксо» с числовым значением, если необходимо + название кислотного остатка + название катиона: гидроксохлорид магния MgOHCl, дигидроксохлорид железа (III) F e ( O H ) 2 C l .
- Двойные — анион в именительном падеже + катионы через дефис в родительном падеже: ортофосфат аммония—магния N H 4 M g P O 4 метасиликат алюминия—лития L i A l ( S i O 3 ) 2 .
- Смешанные — название анионов через дефис в именительном падеже + название катиона в родительном падеже: хлорид-гипохлорит кальция Ca(ClO)Cl; нитрат-йодат натрия N a 2 I O 3 ( N O 3 ) .
- Комплексные — название катиона в именительном падеже + название аниона в родительном падеже: хлорид диамминсеребра (I) [ A g ( N H 3 ) 2 ] C l ; тетрагидроксоалюминат натрия N a [ A l ( O H ) 4 ] .
- номенклатура бинарных соединений.
Бинарные соединения — сложные вещества, состоящие из двух элементов. В таких соединениях встречается два типа химической связи: ковалентная полярная (для неметаллов и некоторых амфотерных элементов) или ионная (для солей бескислородных кислот).
Названия строятся по схеме: к корню более электроотрицательного элемента добавляется окончание -ид (оксид, гидрид, карбид и т.д.) в именительном падеже + название второго элемента в родительном падеже, при необходимости добавляется числовое значение степени окисления: C S 2 — дисульфид углерода или сульфид углерода (IV), M n F 4 — тетрафторид марганца или фторид марганца (IV).
Для некоторых есть тривиальные названия: N H 3 — аммиак, S i Н 4 — силан, P H 3 — фосфин и др.
Строение и химические свойства
Простые вещества состоят из атомов одного химического элемента:
- одноатомные: благородные газы — гелий He, неон Ne, аргон Ar, криптон Kr, ксенон Xe и радон Rn;
- двухатомные: водород H 2 , кислород O 2 , азот N 2 и галогены: хлор C l 2 , йод J 2 , бром B r 2 ;
- трех и более атомные: озон O 3 , белый фосфор P 4 , кристаллическая (ромбическая и моноклинная) сера S 8 .
Порядок соединения атомов при образовании из них веществ обусловливает особенности строения веществ. Различают вещества молекулярного и немолекулярного строения. Немолекулярное строение имеют все металлы и большинство их соединений, графит, красный фосфор, алмаз, кремний Si и др. Большинство неметаллов и их соединений состоят из молекул, т. е. имеют молекулярное строение.
Химические свойства металлов и неметаллов
1. Химические свойства металлов определяются способностью отдавать свободные электроны с внешнего уровня. Они являются восстановителями. Взаимодействие идет с:
- неметаллами:
- +кислород O 2 (кроме золота и металлов группы платины) → оксиды: 2 C a + O 2 → 2 C a O ;
- +галогены ( F 2 , C l 2 , B r 2 ) → галогениды (фторид, хлорид, бромид и т.д.): C u + B r 2 → C u B 2 ;
- +азот, фосфор, сера, водород → нитриды, фосфиды, сульфиды, гидриды: 3 C a + N 2 → C a 3 N 2 .
- водой (только щелочные и щелочно-земельные металлы) → гидроксиды: 2 N a + 2 H 2 O → 2 N a O H + H 2 ↑ ;
- кислотами (металлы, стоящие в ряду активности до водорода) → соль: M g + 2 H C l → M g C l 2 + H 2 ↑ ;
- растворами солей менее активных металлов: F e + C u S O 4 → F e S O 4 + C u , при следующих условиях:
- соли, вступающие в реакцию и получающиеся в ходе нее, должны быть растворимы;
- металл вытесняет из соли другой металл, если находится левее в ряду активности;
- щелочные и щелочно-земельные металлы в данном случае будут вступать в реакцию с водой, а не с солью.
- оксидами (более активный металл вытесняет менее активный): F e 2 O 3 + 2 A l → A l 2 O 3 + 2 F e .
2. Химические свойства неметаллов обусловлены свободными электронами (от 3 до 7) на внешнем электронном уровне.
- окислительные свойства наиболее характерны (стремятся присоединять электроны) в реакциях с:
- металлами: O 2 + 2 M g → 2 M g O ; S + 2 N a → N a 2 S ;
- неметаллами:
- кислород O 2 (из галогенов реагирует только фтор): S + O 2 → S O 2 ;
- водород H 2 (кроме кремния, фосфора и бора) : С + 2 H 2 → C 4 ;
- неметалл c меньшей электроотрицательностью: 3 S + 2 P → P 2 S 3 (нагревание без доступа воздуха, сера — окислитель);
- солями (вытесняют менее активные неметаллы): C l 2 + 2 N a B r → 2 N a C l + B r 2 .
- восстановительные свойства (исключение: фтор F — всегда окислитель) в некоторых реакциях с:
- неметаллами, электроотрицательность которых ниже: C + O 2 → C O 2 (углерод — восстановитель);
- сложными веществами — окислителями ( C u O , H N O 3 ) : S + 6 H N O 3 → H 2 S O 4 + 6 N O 2 ↑ + 2 H 2 O .
- и окислительные, и восстановительные свойства проявляют хлор, сера, фосфор, йод и бром в реакциях диспропорционирования:
- C l 2 0 + H 2 O → H C l - 1 + H C l + 1 O ;
- 3 S 0 + 6 N a O H → 2 N a 2 S - 2 + N a 2 S + 6 O 3 + 3 H 2 O .
Химические свойства благородных газов
- плохо растворяются в воде и вступают в реакции с другими веществами только в специально созданных условиях;
- не горят; вытесняют кислород из воздуха, снижая его содержание до критически низких показателей, приводящих к смерти.
Строение и основные химические свойства сложных веществ
Сложные соединения имеют ионную или ковалентную связь между атомами.
- оснóвные + кислоты → соли: C a O + 2 H C l → C a C l 2 + H 2 O ;
- кислотные + основания → соли: S O 3 + 2 N a O H → N a 2 S O 4 + H 2 O ;
- амфотерные реагируют и с кислотами, и с основаниями → соли:
Z n O + H 2 S O 4 → Z n S O 4 + H 2 О ,
Z n O + 2 N a O H + H 2 O → N a 2 [ Z n ( O H ) 4 ] .
Все основания реагируют с кислотами (реакция нейтрализации):
- K O H + 2 H C l → K C l + H 2 O ;
- 2 F e ( O H ) 3 + 3 H 2 S O 4 → F e 2 ( S O 4 ) 3 + 6 H 2 O .
1. Щелочи взаимодействуют с:
- неметаллами: 6 K O H + 3 S → K 2 S O 3 + 2 K 2 S + 3 H 2 O ;
- кислотными оксидами: 2 N a O H + N O 2 → N a N O 2 + N a N O 3 + H 2 O .
2. Нерастворимые основания разлагаются при нагревании: C u ( O H ) 2 → C u O + H 2 O .
- + основания (реакция нейтрализации): 2 F e ( O H ) 3 + 3 H 2 S O 4 → F e 2 ( S O 4 ) 3 + 6 H 2 O ;
- + металлы, стоящие левее водорода в ряду активности: M g + 2 H C l → M g C l 2 + H 2 ↑ ;
- + основные и амфотерные оксиды: C a O + H 2 S O 4 → C a S O 4 + H 2 O ; Z n O + H 2 S O 4 → Z n S O 4 + H 2 O ;
- + соли: B a C l 2 + H 2 S O 4 → B a S O 4 + 2 H C l .
- + кислоты (сильные): N a 2 S i O 3 + 2 H C l → H 2 S i O 3 ↓ + 2 N a C l ;
- + щёлочи, если образуется нерастворимое основание: F e C l 3 + 3 N a O H → F e ( O H ) 3 ↓ + 3 N a C l ;
- + металлы: Z n + P b ( N O 3 ) 2 → P b ↓ + Z n ( N O 3 ) 2 ;
- + соли при условии необратимости реакции: N a 2 C O 3 + C a ( N O 3 ) 2 → C a C O 3 ↓ + 2 N a N O 3 .
Также о химических свойствах неорганических соединений можно почитать в статье «Классы неорганических соединений».
Читайте также:
