Презентация металлическая связь презентация 8 класс
За лето ребенок растерял знания и нахватал плохих оценок? Не беда! Опытные педагоги помогут вспомнить забытое и лучше понять школьную программу. Переходите на сайт и записывайтесь на бесплатный вводный урок с репетитором.
Вводный урок бесплатно, онлайн, 30 минут
Подписи к слайдам:
Условная граница между элементами-металлами и элементами-неметаллами проходит по диагонали: B(бор) – Si(кремний) – As(мышьяк) –Te(теллур) – At (астат)
Из 114 элементов ПСХЭ ~88 являются металлами: выделены голубым, зелёным и розовым цветом (кроме H и He)
Щелочные металлы – это элементы главной подгруппы I группы Периодической системы химических элементов Д.И. Менделеева: литий, натрий, калий, рубидий, цезий, франций.На внешнем энергетическом уровне атомы этих элементов содержат по одному электрону, находящемся на сравнительно большом удалении от ядра. Они легко отдают этот электрон, поэтому являются сильными восстановителями. Во всех соединениях щелочные металлы проявляют степень окисления +1.
e = 19
P = 19
n = 20
39
0
+19
2
8
1
8
Калий
Общая характеристика элементов главной подгруппы I группы
+3Li )2)1 +11Na)2)8)1 +19K)2)8)8)1 +37Rb) ) ) ) ) +55Cs) ) ) ) ) ) +87Fr) ) ) ) ) ) )
R атома растетВосстановительная способность увеличивается
Общая характеристика элементов главной подгруппы II группы
У в е л и ч и в а е т с я R атома
Увеличивается восстановительная способность
+4Be )2)2 +12Mg)2)8)2 +20Ca)2)8)8)2 +38Sr) ) ) ) ) +56Ba) ) ) ) ) ) +88Ra) ) ) ) ) ) )
Увеличиваются металлические свойства
1. Небольшое число ē на последнем энергетическом уровне (1 - 3ē).2. Относительно большой атомный радиус.
Основные особенности строения атомов металлов:
© Осиевская И.А.
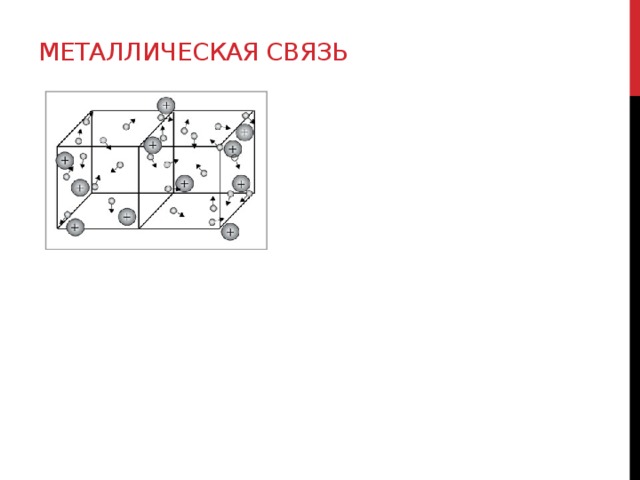
Металлическая связь
e e e e e e e e e е е е
+
+
+
+
Металлическая связь – это связь в металлах и сплавах между атом- ионом посредством обобществления внешних электронов(«электронного газа»)
-
-
1. нейтральные атомы. 2. положительнозаряженные ионы. ē – свободно перемещаются по кристаллической решетке.
Металлическая кристаллическая решетка
-
-
Твердость (кроме ртути)ПластичностьЭлектропроводностьТеплопроводностьПлотностьМеталлический блеск
Для всех металлов (кроме ртути) при обычных условиях характерно твердое агрегатное состояние.Однако твердость их различна. Наиболее твердые – металлы побочной подгруппы VI группы ПС. Самые мягкие – металлы главной подгруппы I группы (Na, K)
Твердость металлов
Плотность металлов
Легкие металлы (плотность меньше 5 г/см3). К ним относятся щелочные, щелочноземельные металлы и алюминий. Самый легкий металл – литий.Тяжелые металлы (плотность больше 5 г/см3). Самый тяжелый металл – осмий.
В самородном виде (Au, Ag, Pt) В виде соединений:оксидов сульфидов карбонатовсульфатов
Индивидуальные вещества, образующие земную кору, называются минералами.Al2O3- корунд SiO2- кварцHgS-киноварь и т.д.
Аметист (SiO2)-сине-фиолетовая разновидность кварца
Корунд - Al2O3
Из минералов сложены горные породы:Мрамор - CaSO4Гранит – смесь кварца, полевого шпата и слюды
Руда – природные образования, содержащие минерал в количестве, пригодном для его производства
Применение меди
Применение железа
Применение алюминия
Презентация к занятию по химии "Металлическая и водородная химическая связь"
презентация к уроку по химии (10 класс) на тему
Презентация к занятию по химии "Металлическая и водородная химическая связь" содержит сведения и механизме образования металлической и водородной химических связей. Представляет собой иллюстративный ряд для лучшего понимания и усвоения нового материала по данной теме. Презентация содержит тест по теме "Ионная и ковалентная химическая связь"
| Вложение | Размер |
|---|---|
| d90d4ef6f595ed5677fd950aae33d1dca1964991.ppt | 1.8 МБ |
Подтяните оценки и знания с репетитором Учи.ру
Предварительный просмотр:
Тест по теме « Ионная и ковалентная химическая связь » 1.Химическая связь в соединении хлора с элементом, в атоме которого распределение электронов по слоям 2е, 8е, 7е: 1) ионная; 3) ковалентная неполярная; 2)металлическая; 4) ковалентная полярная. 2.Ковалентной полярной связью образовано вещество, формула которого: 1)N 2 ; 2) NaBr; 3) Na 2 S; 4) HF. 3. Ионной связью образовано вещество, формула которого: l) Na; 2) СаС I 2 ; 3) SiO2; 4) Н 2 . 4.Соединениями с ковалентной неполярной и ковалентной полярной связью являются соответственно: 1) НВг и Вг 2 ; 2) СI 2 и H 2 S; 3) Na 2 S и SO 3 ; 4) Р 8 и NaF. 5. В соединении калия с кислородом химическая связь: 1) металлическая; 3) ковалентная неполярная; 2) ковалентная полярная; 4) ионная. 6. Ковалентная неполярная связь в веществе: 1) аммиак; 2) сероводород; 3) хлор; 4) железо.
Определить вид химической связи у следующих соединений: Вариант 1 К 2 О , I 2 , H 2 O, Cl 2 , CaO, HBr, CaCl 2 , O 2 , Na 2 O, HCl Вариант 2 Br 2 , NO 2 , CO 2 , Na 2 O, O 2 , HCl, H 2 O CuCl 2 , N 2 , Н 2 O 2
Определите элементы, ставшие не в ту «очередь»: Ca Fe P K Al Mg Na Почему?
Атомы металлов легко отдают валентные электроны и превращаются в положительные заряженные ионы: Ме 0 – n ē =Me n+
Свободные электроны, оторвавшиеся от атома, перемещаются между положительными ионами металлов. Между ними возникает металлическая связь, т. е. электроны как бы цементируют положительные ионы кристаллической решетки металлов.
Металлическая связь Связь, которая образуется в результате взаимодействия относительно свободных электронов с ионами металлов, называются металлической связью.
Водородная связь Связь, которая образуется между атомом водорода одной молекулы и атомом сильно электроотрицательного элемента (O, N, F) другой молекулы, называется водородной связью .
Почему именно водород образует такую специфическую химическую связь? Атомный радиус водорода очень мал, при отдаче своего электрона водород приобретает высокий положительный заряд, за счет которого водород одной молекулы взаимодействует с атомами электроотрицательных элементов (F, O, N) входящих в состав других молекул (HF, H2O, NH3).
Разновидности водородной связи: Межмолекулярная Возникает между молекулами Внутримолекулярная Возникает внутри молекулы
Межмолекулярная водородная связь 1)между молекулами воды
Межмолекулярная водородная связь 2)между молекулами аммиака
Межмолекулярная водородная связь 3)между молекулами спиртов (метанол, этанол, пропанол, этиленгликоль, глицерин)
Межмолекулярная водородная связь 4)между молекулами карбоновых кислот (муравьиная, уксусная)
Межмолекулярная водородная связь 5)Между молекулами фтороводорода Н – F δ - … δ+ H – F δ - … δ+ Н – F δ - …
Особые свойства веществ, образованных межмолекулярной водородной связью 1)вещества с низкой молекулярной массой – жидкости или легко сжижаемые газы (вода, метанол, этанол, муравьиная кислота, уксусная кислота, фтороводород, аммиак)
Особые свойства веществ, образованных межмолекулярной водородной связью 2)некоторые спирты и кислоты неограниченно растворимы в воде
Особые свойства веществ, образованных межмолекулярной водородной связью 3)способствуют образованию кристаллов в виде снежинок или измороси
Внутримолекулярная водородная связь возникает 1)внутри молекул белков (водородная связь удерживает витки спирали пептидной молекулы)
Внутримолекулярная водородная связь возникает 2)внутри молекулы ДНК (между азотистыми основаниями по принципу комплементарности: А – Т , Ц – Г )
Значение внутримолекулярной связи Способствует образованию молекул белков, ДНК и РНК и определяет их функционирование.
Факторы, разрушающие водородную связь в белковой молекуле (денатурирующие факторы) Электромагнитное излучение Вибрации Высокие температуры Химические вещества
1 ) Для какого вещества характерна водородная связь: а) C ₂ H ₆ б) C ₂ H ₅ OH в) CH ₃ - O - CH ₃ г) CH ₃ COOCH ₃ 2 ) Укажите вещество с металлической связью: а) оксид магния б) сера в) медь г) нитрид лития 3 ) Установите соответствие между формулой вещества и видом химической связи в нем: А) CaCl₂ Б) SO₃ В) KOH Г) Fe Д) N₂ Е) H₂O 1)металлическая 2) только ионная 3) только ковал.полярная 4) ков.полярная и ионная 5) ков.полярная и неполярная 6) только ков.неполярная 7) ков.полярная и водородная Т Е С Т ОТВЕТ: 3: А - 1 , Б - 3 , В - 4 , Г - 1 , Д - 6 , Е - 3 б в
4) . Вещество , между молекулами которого существует водородная связь: а) этанол б) метан в) водород г) бензол 5) . Вещество с металлической связью: а) H ₂ O б) Ag в) CO ₂ г) KF а б
Дом. задание: Задача № 1. В растворе массой 100 г содержится хлорид бария массой 20 г. Какова массовая доля хлорида бария в растворе? Задача № 2 . Сахар массой 5 г растворили в воде массой 20 г. Какова массовая доля (%) сахара в растворе?
В растворе массой 100 г содержится хлорид бария массой 20 г. Какова массовая доля хлорида бария в растворе?
Металлическая связь.
презентация к уроку по химии (8 класс)
Рассматривается механизм образования металлической связи.
| Вложение | Размер |
|---|---|
| metallicheskaya_svyaz.ppt | 796.5 КБ |
МЕТАЛЛИЧЕСКАЯ СВЯЗЬ Это связь в металлах и сплавах, которую выполняют относительно свободные электроны между ионами металлов в металлической кристаллической решетке СХЕМА МЕТАЛЛИЧЕСКОЙ СВЯЗИ М ° - nē ↔Mⁿ
ОСОБЕННОСТИ МЕТАЛЛИЧЕСКОЙ СВЯЗИ Небольшое количество электронов (1-3) на внешнем уровне (у атомов Sn, Pb – 4 электрона, у атомов Bi – 5 электронов, у Ро – 6 электронов) Большой радиус атома
ОБРАЗОВАНИЕ МЕТАЛЛИЧЕСКОЙ СВЯЗИ При образовании кристаллической решетки атомы металлов сближаются до касания, а далее валентные орбитали соседних атомов перекрываются, поэтому электроны свободно перемещаются из орбитали одного атома в свободную орбиталь другого атома. В результате этого в кристаллической решетке металлов возникают обобществленные свободные электроны, которые непрерывно перемещаются между положительно заряженными ионами узлов решетки электростатически связывая их в единое целое.
Металлическая связь характеризуется: Небольшим числом валентных электронов Она слабее ковалентной и ионной связи Она определяет все основные свойства металлов
По теме: методические разработки, презентации и конспекты

тестовые задания « Подготовка металлических поверхностей под простую и улучшенную окраску», «Подготовка деревянных поверхностей под штукатурку».
Тестовые задания,которые проводятся в конце четверти.
открытый урок на тему "Металлическая связь"

Презентация "Химическая связь - металлическая,водородная, Ван-дер-Ваальсова"
Презентация для 9 и 11 классов, содержит тестовые задания и сравнительную таблицу для видов химических связей в соединениях.

Конспект урока по теме "Металлическая связь"
Конспект урока по химии по теме «Металлическая химическая связь» (8 класс) с инструктивными картами, лекционным материалом. Урок с использованием технологий проблемного обучения, элементам.
Технологическая карта урока. Тема "Металлическая химическая связь".
Технологическая карта урока. Тема "Металлическая химическая связь".УМК: Химия 8 класс. Учебник для общеобразовательных учреждений. О.С.Габриелян, М. Дрофа 2012г.
Презентация "Положение металлов в периодической системе. Металлическая связь. Металлическая решетка. Общие физические свойства металлов" 9 класс
Презентация "Положение металлов в периодической системе. Металлическая связь. Металлическая решетка. Общие физические свойства металлов" 9 класс.

Презентация к занятию по химии "Металлическая и водородная химическая связь"
Презентация к занятию по химии "Металлическая и водородная химическая связь" содержит сведения и механизме образования металлической и водородной химических связей. Представляет собой иллюстративный р.
Презентация к уроку по химии в 8 классе "Металлическая связь"

Данную презентацию можно использовать при проведении урока химии в 8 классе по теме "Металлическая связь". В презентации предложены тесты в формате ОГЭ для подготовки к экзамену в 9 классе, обобщается материал по типах химических связей, рассматривается металлическая химическая свызь..
Просмотр содержимого документа
«Презентация к уроку по химии в 8 классе "Металлическая связь"»

Типы химических связей. Металлическая связь.

№ 1,№2 (подготовка к ОГЭ по химии)
1. Сколько электронов вращается вокруг ядра в атоме кремния?
А. 28 Б. 2 В. 4 Г. 14
2. Сколько электронов находится на внешнем энергетическом уровне кальция?
А. 2 Б. 20 В. 40 Г. 8
3. Сколько электронов максимально может находиться на первом энергетическом уровне?
А. 32 Б. 8 В. 18 Г. 2

4. В каком ряду элементы расположены в порядке возрастания атомного радиуса?
5. Неметаллические свойства углерода выражены сильнее, чем неметаллические свойства
1) кислорода 2) кремния 3) азота 4) фтора
6. Металлические свойства натрия выражены сильнее, чему у
1) магния 2) калия 3) лития 4)алюминия

Виды химической связи

Определите тип химической связи


В каких соединениях ионный тип связи?
HNO 3
CO 2
ALBr 3
H 2 O
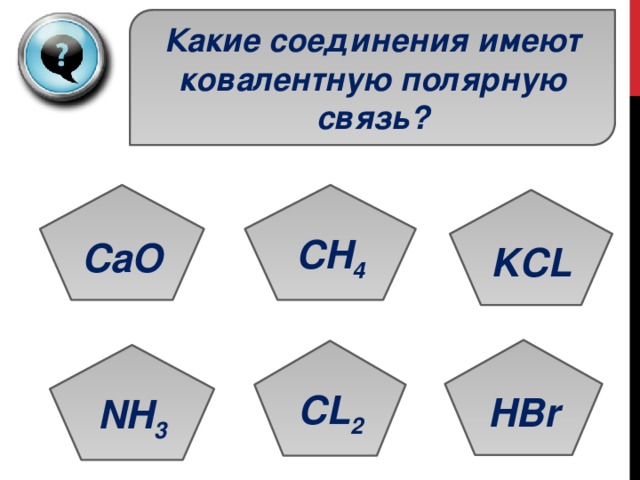
Какие соединения имеют ковалентную полярную связь?
CH 4
CL 2
NH 3
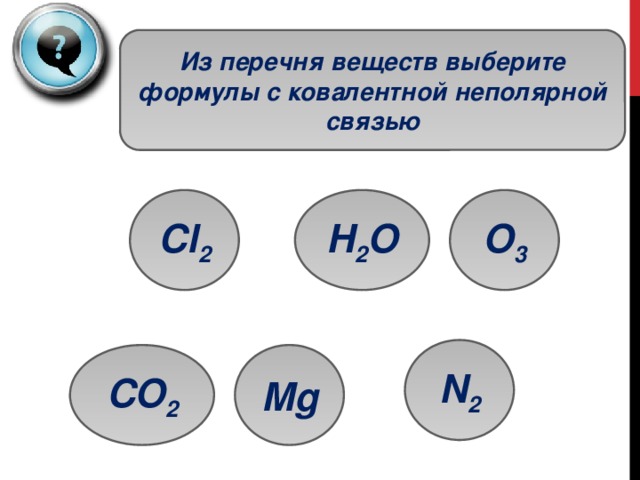
Из перечня веществ выберите формулы с ковалентной неполярной связью

Читайте также:
