Практическая работа по химии решение экспериментальных задач по теме металлы 9 класс рудзитис
Цель урока: научиться решать экспериментальные задачи по теме «Металлы». Определять наличие ионов с помощью качественных реакций.
Задачи урока:
Образовательные : научиться использовать полученные знания в решении экспериментальных задач.
Развивающие: развивать умения ставить несложные проблемы, формулировать гипотезы и проводить их опытную проверку; совершенствовать умения работать с лабораторным оборудованием и реактивами; продолжить формирование умений оформлять результаты учебного эксперимента; развивать способность к само- и взаимоконтролю.
Воспитательные: продолжить формирование научного мировоззрения учащихся, воспитывать культуру общения через работу в парах «ученик – ученик», «учитель – ученик», а также наблюдательность, внимание, пытливость, инициативу.
оборудование: ( для класса из 4 учеников)
штатив для пробирок, пробирки, раствор соляной кислоты, гидроксида натрия,
хлорида железа (III),
для большого класса : еще в дополнение хлорида калия, карбоната калия, хлорида меди ( II ), хлорида железа ( II ) сульфата никеля ( II ), нитрата серебра.
I . Организационный этап.
Приветствие. Отметка отсутствующих. Проверка готовности к уроку.
II .Актуализация и мотивация учебной деятельности.
Сегодня на уроке мы проведем практическую работу, в результате которой выясним, как хорошо вы поняли изученную тему.
Вспомните правила техники безопасности при выполнении химического эксперимента.
Ø В химической лаборатории не пробуют на вкус даже известные вещества, они могут содержать примеси, ядовитые для человека.
Ø Кислоты – едкие вещества. Разрушают и раздражают кожу, слизистые оболочки.
Ø Щёлочи – едкие вещества. Разрушают и раздражают кожу, слизистые оболочки. От них возможна полная потеря зрения.
Ø Если кислота или щёлочь попала на кожу, её надо немедленно промыть большим количеством проточной воды.
Ø Соединения меди в виде пыли при попадании на кожу, особенно в местах микротравм, могут вызвать раздражения, привести к аллергии в лёгкой форме.
Ø Все нитраты оказывают сжигающее действие на кожу и слизистые оболочки. Нитрат серебра (ляпис) разлагается под действием солнечного света. При попадании на кожу вызывает её потемнение.
Ø Роданиды являются соединениями повышенной физиологической активности. При работе с ними следует применять индивидуальные средства защиты, соблюдать правила личной гигиены. Не допускать попадания препаратов внутрь организма!
Ø Стекло – хрупкий материал, имеющий малое сопротивление при ударе и незначительную прочность при изгибе. Категорически запрещается использовать посуду, имеющую трещины и отбитые края.
Ø Пробирку закрепляют в держателе так, чтобы от горлышка пробирки до держателя было расстояние 1 – 1, 5 см.
Ø Опыты проводить с таким количеством веществ, которые указаны в методическом руководстве по проведению каждого опыта.
Ø Без разрешения учителя, ничего на столах не трогать.
Ø Во время проведения эксперимента или оформлении отчёта соблюдайте тишину.
Ø После работы приведи порядок на рабочем месте.
III .Проведение практической работы.
Практическая работа №5: Решение экспериментальных задач по теме: «Металлы».( в тетрадях)
задание 1
Получение гидроксидов железа и изучение их свойств по инструкции учебника Н.Е.Кузнецовой, стр. 252 - 253
опыт1.
Получите гидроксиды железа ( II ) и ( III ) из растворов соответсвующих солей. Для этого к растворам солей Fe 2+ и Fe 3+ прилейте раствор щелочи. Сравните полученные осадки по внешнему виду.
Запишите уравнения реакций.
опыт2.
Исследуйте свойства полученных соединений в соответствии со схемой учебника рис.79 и см. ниже.
ГДЗ по химии за 9 класс к учебнику Рудзитиса. Ответы, решения онлайн

§4. Практическая работа 1. Изучение влияния условий проведения химической реакции на ее скорость. (стр. 16-17):
§11. Практическая работа 2. Решение экспериментальных задач по теме” Свойства кислот, оснований и солей как электролитов”. (стр. 41-42):
Проверка домашнего задания по химии за 9 класс Рудзитиса из ГДЗ
По мере углубления в химию, как в науку и учебный предмет, современные школьники сталкиваются с более сложными темами. Особенно это становится заметным в процессе изучения теоретического материала и на практических занятиях в старших классах. Ответы к упражнениям из учебника Рудзитиса за 9 класс помогают самостоятельно разбираться с трудными задачами, и всегда находить правильное решение, быстро сделать домашнюю работу, готовиться к контрольным, тестовым заданиям, получать качественные знания во время удаленного обучения.
Общее описание решебника
Последнее издание решебника по химии 9 класс Рудзитиса представляет собой подробное пособие с ответами к задачам в учебнике с пошаговым описанием их решения, и это очень важный нюанс. Рассматривая данные алгоритмы, ребенок не будет бездумно списывать. Он начнет обретать понимание предмета. В дальнейшем сможет справляться с упражнениями или вопросом по теме любой главы или параграфа без помощи преподавателя, и в этом смысле ГДЗ является хорошим подспорьем к учебе в школе.
Усилиями авторов в методичке проработана каждая страница. Особое внимание они уделили основным темам, изучаемым на протяжении учебного года в классе. Таким, к примеру, как окислительные и восстановительные реакции, а также использование органических соединений, классификация химических элементов.
Изучая ГДЗ Рудзитиса, девятиклассники научатся выполнять непростые уравнения. Осваивать в короткий срок много полезного материала, получать необходимые знания в полном объеме.
Польза ГДЗ для родителей и учителей
Так как подобного рода пособия содержат готовые ответы на задания, которые ученики решают на уроках и дома, а значит, могут быть полезны родителям и педагогам. Больше не нужно тратить огромное количество времени, чтобы вникать в ту или иную задачу, решить уравнение, чтобы проверить уровень подготовки сына или дочери.
Достаточно скачать ГДЗ по химии 9 класс Рудзитис на ноутбук, декстоптное устройство и пользоваться им по мере необходимости или зайти на сайт онлайн. Таким образом можно осуществлять контроль успеваемости своего ребенка, не углубляясь в содержащуюся в учебниках информацию.
Учителям ГДЗ помогает готовиться к предстоящим занятиям, прорабатывать новые методики обучения, выбирать оптимальные варианты решения уравнений для разбора их на уроке, а так же проверять рабочие тетради. Относительно последнего, можно добавить, что только педагогу известно, сколько доставляет проблем и отнимает времени рутинная работа по проверке письменных контрольных, домашних, тестов, и т.д. Разработанное Гудзитисом Г.Е. и Фельдманом Ф.Г пособие в этом плане, однозначно лучший выход.
Важность науки
Важность этой науки переоценить невозможно. Без знания свойств химических веществ и их соединений сегодня не обходится ни одно производство или промышленность. Будь то газовые, нефтеперерабатывающие комплексы, фармакология или сельское хозяйство.
Предмет обширен и глубок, и что самое главное, важен. Именно по этой причине преподавание его начинается в общеобразовательном учебном заведении, и здесь важно не упустить момент, и вовлечь учащегося в процесс обучения. Увлечь его интересными теориями, теоремами и формулами, при этом дать понять, что при должном старании освоить его не так уж и сложно. Особенно, если это делать с подобными данному решебнику Рудзитиса сборниками, наполненными важной и полезной информацией.
Решебник (гдз) по химии за 9 класс Рудзитис, Фельдман Учебник

Углубленное изучение химии - не редкость для многих профильных учебных заведений. Как правило, по окончании 11 класса учащиеся таких специализированных школ выбирают данный предмет для сдачи в формате ЕГЭ. Также такой уровень подготовки подходит и для тех учеников, которые рассчитывают сдать экзамен на максимально возможное количество баллов.
Именно для таких категорий учеников подходит учебник Рудзитиса для одиннадцатого класса с углубленным уровнем. Он может быть как базовым, так и дополнительным источником информации для выпускника в зависимости от учебной программы, принятой в его школе. В любом случае с его помощью школьник сможет повторить материалы, связанные со следующими понятиями:
- строение соединений;
- энергетика и скорость реакций;
- растворы;
- металлы и неметаллы.
Каким образом пособие по химии за 9 класс Рудзитис может помочь выпускнику и преподавателям
Сборник с ГДЗ предоставляет возможность:
- сократить время на подготовку без потери качества;
- совершить проверку своих знаний без посторонней помощи;
- повторить пройденный материал или восполнить пробелы в знаниях;
- подготовиться к итоговым выпускным испытаниям и увеличить вероятность получения нужного числа баллов.
Пособие по химии за 9 класс по химии (углубленный уровень) от Рудзитиса также может помочь учителям, занимающимся подготовкой детей к ЕГЭ индивидуально или на дополнительных занятиях. На основе приведенных задач учитель имеет шанс составить новые варианты упражнений и тестов для тренировки. Некоторые из таких заданий могут встретиться на экзамене.
Как устроен решебник
Сборник соответствует основному учебнику, где после каждого параграфа имеются вопросы и задания, на которые даны развернутые ответы. Некоторые ключи дополняются химическими формулами превращения веществ. Помимо этого тут есть объяснения к 21 практической работе. Найти нужный номер достаточно легко, вся информация доступна в режиме онлайн круглосуточно.
§11. Практическая работа 2. Решение экспериментальных задач по теме” Свойства кислот, оснований и солей как электролитов”
На протяжении многих лет преподаватели и родители спорят о том, важны ли оценки. Дело в том, что сегодняшняя система подвергла сомнению важность получения аттестата. Из-за этого общество разделилось на два лагеря. Первые считают, что главное – это психическое и физическое здоровье. Другая категория, наоборот, думают, что оценки в журнале – это прямое отражение того, как старался ребенок, какой объем информации усвоил и насколько хорошо знает всю рабочую программу. Эта позиция более близка к современным реалиям, т. к. по аттестату принимают в университеты (устанавливается приоритет). Получать хорошие отметки и развиваться, например, в области естествознания можно с помощью онлайн-сборника Рудзитиса Гунтаса Екабовича издательства «Просвещение» 2016 года
Каким образом помогут ГДЗ по химии для 9 класса (авторы: Г. Е. Рудзитис, Ф. Г. Фельдман)
Отличники и многие хорошисты обычно имеют явное преимущество перед своими сверстниками:
- Они иногда могут пропускать занятия. Происходит это из-за того, что они – любимчики учителей. Их целеустремленность, пунктуальность и умение сосредотачиваться подкупают и служат гарантом, что ни одна тема не будет упущена, а все заданные упражнения будут выполнены;
- Бонусы при поступлении приносит посещение конкурсов и олимпиад. Помимо этого, такая активность позволяет меньше волноваться на контрольных работах, тестах, ЕГЭ и ОГЭ;
- Они почти никогда не подвергаются травле со стороны одноклассников.
Чтобы добиться такого положения, необходимо стараться. Так, требуется не прогуливать учебу без повода, заниматься дополнительно и выявлять все пробелы и упущенные моменты. Особенно это касается науки о веществах. Она нужна для значительного спектра специальностей, но все же большинство не выбирают эту дисциплину в качестве государственного экзамена, однако получить заветную медаль мечтает каждый.
Содержание решебника по химии за 7 класс Рудзитиса
Огромный плюс данного сборника в том, что все разделены, включенные в учебно-методический комплекс с готовыми ответами, полностью соответствуют основному учебнику:
- Классификация химических реакций. Их поведение в водных растворах
- Галогены.
- Кислород. Сера. Азот. Фосфор.
- Углерод и кремний.
- Металлы.
- Первоначальные представления об органических веществах.
Чтобы найти нужное, достаточно выбрать интересующий параграф и кликнуть на номер упражнения. После этого откроется решение, в котором подробно описаны все действия.
Готовые домашние задания –это специальное пособие, которое предназначено для помощи всем школьникам. В нем есть верные ответы на любой номер, а также подробные решения всех заданий.
Практическая работа "Решение экспериментальных задач по теме "Металлы"
Цель: на основе знаний о металлах и их кислородных соединений научиться решать экспериментальные задачи; уметь проводить качественные реакции. соблюдать правила ТБ.
- углубить и систематизировать знания учащихся о металлах и их кислородных соединений; закрепление практических навыков при решении экспериментальных задач, умение составлять уравнения реакций.
- развитие навыков практической работы и развивать познавательный интерес, используя приемы самостоятельной работы, умение проводить лабораторные опыты.
- воспитание аккуратности при выполнении практических работ и соблюдении правил по технике безопасности; бережное отношение к реактивам.
Мысленно закройте глаза. Выполните
10 шагов вперед вверх
5 шагов вправо
5 шагов вниз
5 шагов влево
Какая фигура получилась.
( флажок).
1.На интер. доске предложения( используя названия металлов в переносном смысле образуем предложения)
1. Человек обладает…. здоровьем (железным)
2.Над городом нависли … тучи (свинцовые)
3.Певец обладает уникальным…. голосом (серебряным)
4.Каникулы – это….пора детства (золотая)
2.В эпиграфах найти слова, которые связаны с наукой химией, а затем самим определить цель урока. После формулирования цели легко перейти к теме урока.
«СУХА ТЕОРИЯ, МОЙ ДРУГ, А ДРЕВО ЖИЗНИ ПЫШНО ЗЕЛЕНЕЕТ»
«И ОПЫТ, СЫН ОШИБОК ТРУДНЫХ, И ГЕНИЙ, ПАРДОКСОВ ДРУГ…»
Металлы, теория, опыт.
Практическая работа
Решение экспериментальных задач по теме «Металлы».
Цель: изучить свойства металлов и их соединений.
Оборудование и реактивы:
1 вариант: штатив для пробирок, пробирки, растворы азотной кислоты, соляной кислоты, гидроксида натрия, сульфата никеля ( II ), нитрата серебра. хлорида железа (III), роданида калия, фосфата натрия, сульфата цинка.
Ход работы:
Ø Роданиды являются соединениями повышенной физиологической активности. При работе с ними следует применять индивидуальные средства защиты, соблюдать правила личной гигиены.Не допускать попадания препаратов внутрь организма!
I вариант
Используя необходимые реактивы и оборудование, выполните следующие превращения
Уравнения реакций
1. К раствору хлорида железа (III) добавим несколько капель щелочи.
Образуется осадок бурого цвета.
FeCl 3 + 3 NaOH → Fe ( OH )3↓ + 3 NaCl
Fe 3+ + 3 OH - → Fe ( OH )3↓
2. К полученному осадку добавим раствор азотной кислоты.
Осадок растворяется, образуется раствор желтого цвета.
Fe(OH) 3 + 3 H + → Fe 3 + + 3 H2O
3. К раствору нитрата железа (III) добавим несколько капель роданида калия.
Появление кроваво-красного окрашивания.
Fe 3+ + 3CNS - ↔ Fe(CNS)3
Вывод: Экспериментально осуществили превращения химических реакций.
Задание 2. Приготовьте гидроксид никеля ( II ) и исследуйте его свойства.
1. К раствору сульфата никеля (II) добавим несколько капель щелочи.
Образуется осадок светло-зеленого цвета.
2. Полученный осадок раздел на 2 части. В одну пробирку к полученному осадку добавим раствор соляной кислоты.
Осадок растворяется.
Ni ( OH )2 + 2 HCl → NiCl 2 + 2 H 2 O
Ni ( OH )2 + 2 H + → Ni 2+ + 2 H 2 O
3. В другую пробирку к полученному осадку добавим конц. раствор щелочи.
Изменений нет.
Вывод: Гидроксид никеля ( II ) – осадок светло-зеленого цвета, проявляет основные свойства.
Задание 3. Предложите наиболее рациональный путь определения солей, растворы которых находятся в пронумерованных пробирках: Na 3 PO 4 , FeCl3, ZnS O4, Уравнения реакция запишите в молекулярной и ионной форме.
Вопросы к параграфу 50 — ГДЗ по Химии 9 класс Учебник Рудзитис, Фельдман
Твёрдые вещества растворили в воде, далее прилили соляную кислоту.
В одной пробирке выделяется газ без цвета и запаха:
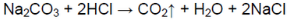
В пробирке — карбонат натрия.
К другим растворам добавили несколько капель фенолфталеина.
Содержимое одной из пробирок окрасилось с малиновый цвет.
В пробирке — гидроксид натрия (образует щелочную среду).
К оставшимся растворам добавили нитрат серебра.
В одной пробирке выпадает белый осадок:
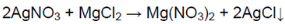
В одной пробирке находится хлорид магния, в пробирке с осадком — нитрат натрия.
2. При помощи характерных реакций докажите, что выданное вам вещество — сульфат алюминия.

3. В одной пробирке дан раствор хлорида натрия, во второй — раствор хлорида стронция, а в третьей — раствор хлорида алюминия. Определите, в какой пробирке находится каждое из выданных веществ.
К растворам добавили сульфат калия.
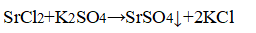
В пробирке — хлорид стронция.
К оставшимся растворам прилили раствор гидроксида натрия.
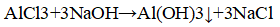
В пробирке — хлорид аллюминия. В пробирке с осадком — хлорид натрия.
4. Практически осуществите следующие превращения:
Fe→FeCl2→Fe(OH)2→Fe(OH)3→Fe(NO3)3
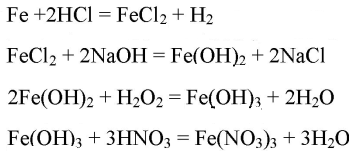
Вариант 2. Распознавание карбоната кальция CaCO3, нитрата стронция Sr(NO3)2, сульфата натрия NaSO4, сульфида натрия Na2S. 1. В четырех пробирках даны следующие твёрдые вещества: а) карбонат кальция; б) нитрат стронция; в) сульфат натрия; г) сульфид натрия. Определите, в какой пробирке находится каждое из перечисленных веществ.
Растворили твёрдые вещества и добавили к растворам соляную кислоту.
В пробирке вещество не растворилось в воде, после добавления соляной кислоты выделился газ без запаха и цвета:

В пробирке — карбонат кальция.
В другой пробирке выделяется газ с характерным запахом тухлых яиц:
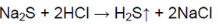
В пробирке — сульфид натрия.
К остальным растворам прилили раствор серной кислоты.
В одной из пробирок выпадает белый осадок:
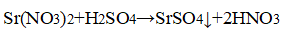
В пробирке — нитрид стронция, в пробирке с осадком — сульфат натрия.
2. Докажите, что кристаллы сульфата железа (III) частично окислились и содержат примеси ионов Fe3+.
Качественным реагентом на присутствие трёхвалентного железа является роданид калия. Появляется красное окрашивание.
Читайте также:
