Получение редкоземельных металлов в домашних условиях
Исторически свое название редкоземельные элементы получили из-за того, что первоначально были получены не металлы, а их оксиды – порошкообразные тугоплавкие вещества плохо растворимые в воде. В XVIII – XIX веке вещества с такими свойствами называли «землями» (Al2O3 – глинозем). Поскольку «земли» встречались в минералах редко (кларки индивидуальных РЗЭ находятся в пределах 10 -3 – 10 -4 %, а для Tm и Lu они еще меньше - 3×10 -5 и 7×10 -5 % соответственно), то их назвали редкими землями, а индивидуальные металлы – редкоземельными металлами или редкоземельными элементами.
История открытия РЗЭ сложна. Вначале смеси оксидов редкоземельных элементов («земли») принимали за один элемент. Первыми были открыты «иттриевые земли» финским химиком Гадолином в 1794 году в минерале найденном в Швеции (близ Иттербрю) и названном позже гадолинитом. В 1803 году Клапрот и одновременно с ним Берцелиус выделили новую «цериевую землю». Далее в течение 100 лет из этих земель были выделены все лантаноиды, кроме прометия. Он оказался радиоактивным и был выделен лишь в 1947 году И. Маринским и Л. Глендениным из осколков деления урана в ядерном реакторе (США).
ОБЛАСТИ ПРИМЕНЕНИЯ РЕДКОЗЕМЕЛЬНЫХ ЭЛЕМЕНТОВ
Начало практического применения РЗЭ относится ко второй половине 19 века - они применялись для газокалильных сеток и колпачков для осветительных газовых фонарей. В последние десятилетия 20 века проведены многочисленные исследования, указывающие на большую перспективность использования лантаноидов и их соединений с различных областях. Широкое применение РЗЭ обеспечило внедрение таких методов как экстракция и ионный обмен, позволяющие получать очень чистые материалы.
Редкоземельные элементы и их соединения присутствуют практически в каждом современном сложном изделии — смартфонах, лазерных установках, чипах компьютерной памяти, ДВД-проигрывателях, перезаряжаемых батареях, каталитических конвертерах, приборах ночного видения, магнитах и источниках флуоресцентного потока света. Поэтому развитие их производства имеет стратегическое значение.
Области применения редкоземельных элементов можно разделить на две большие группы: области применения, для которых нет необходимости глубокого разделения РЗЭ и области применения, требующие и глубокого разделения, и высокой чистоты РЗЭ (>99%).
К первой группе относятся: черная и цветная металлургия, стекольная и керамическая промышленность, производство полирующих материалов, нефтехимическая промышленность.
Вторая группа включает в себя: производство постоянных магнитов, люминофоров, лазерных материалов.
Подробнее о каждом секторе.
- черная и цветная металлургия
На металлургические приложения приходилось около 19% мирового спроса в 2010 году, это связано с тем, что редкоземельные элементы повышают качество нержавеющих и быстрорежущих сталей, кремнистых и жаропрочных сталей, чугуна, поскольку РЗЭ являются раскислителями и десульфуризаторами. В сталь их вводят в виде мишметалла. Сплав железа с большим количеством металлов цериевой группы позволяют создавать материалы, обладающие пирофорными свойствами, которые используют при в трассирующих пулях, снарядах, кремнях для зажигалок. РЗЭ легируют и чугун, так чугун, легированный иттрием, обладает высокими механическими и литейными свойствами, что позволяет его использовать для производства ответственных деталей двигателей внутреннего сгорания. В цветной металлургии это легкие сплавы для авиа- и космической техники Al-Mg и Mg-Zr (добавки РЗЭ в них от сотых долей процента до 3-5%), введение РЗЭ в эти сплавы повышает их прочность, пластичность и устойчивость против окисления при нагревании. Для легирования обычно используют мишметалл, но лучшие результаты достигают при применении неодима Кроме этого сплавы цветных металлов с РЗЭ используют в никель-металлгидридных (NiMH) батареях. NiMH батареи показали самые высокие темпы роста в этом секторе в течение последнего десятилетия, что изначально было обусловлено увеличением спроса на портативное электронное оборудование, а затем использованием этих батарей в энергосистемах гибридных автомобилей (HEV).
- стекольная и керамическая промышленность
Эта отрасль промышленности является достаточно крупным потребителем редкоземельных металлов для производства спецстекол фотооптики и светотехники. Индивидуальные оксиды РЗЭ используют для обесцвечивания и окраски стекол, придания им способности поглощать и пропускать различные излучения (ИК, УФ, рентгеновские и т.д.), повышать их термостойкость. Отрасль потребляет оксиды РЗЭ (Ln2O3= La, Ce, Nd, Eu чистота оксидов 98,5- 99%).
Так стекло с добавкой 2-4% оксида церия используют для защитных очков при стеклодувных и сварочных работах, как не пропускающие УФ излучение. Кроме этого это стекло не тускнеет под действием радиоактивных излучений, что позволяет применять его для боксов в атомной технике.
В керамической промышленности оксиды РЗЭ используют для окраски фарфора, глазурей, эмалей и придания им непрозрачности. Кроме этого оксид иттрия используют для получения стабилизированной керамики на основе диоксида циркония, выдерживающую температуру до 2200°С, которую можно использовать в качестве материала для термобарьерного покрытия.
Хромиты лантана и иттрия, стабилизированные ЩЗЭ используют для изготовления огнеупорной керамики, из которой производят нагревательные элементы электрических печей, работающих в окислительной атмосфере при температурах 1600-1900°С.
- производство полирующих материалов
Полирующие материалы на основе оксидов РЗЭ обеспечивают высокое качество полируемой поверхности при меньшем расходе материала и большей скорости по сравнению с другими материалами (оксиды цинка, циркония, алюминия и т.д.). В качестве полирующих порошков для изготовления оптических стекол и полупроводниковых материалов преимущественно используют оксид церия Ce2O3(полирит).
- химическая, легкая инефтехимическая промышленность
Изготовление лаков, красок, светосоставов, катализаторов синтеза аммиака, фототехника и автокатализаторов
Соли легких редкоземельных металлов и церия используют при производстве катализаторов для каталитического крекинга FCC (крекинг в псевдоожиженном слое с использованием флюидизированного катализатора).
Оксид церия является основным компонентом катализаторов для дожигания токсичных компонентов выхлопных газов двигателей внутреннего сгорания. По эффективности эти катализаторы не уступают платино-палладиевому.
- производство постоянных магнитов
Некоторые интерметаллиды лантаноидов, например, YCo5, SmCo5 являются магнитными материалами с высоким значением произведения величины индукции на максимальную напряженность магнитного поля: для YCo5 – 9550 Т×А/м (1,2млнГс×Э); для SmCo5 – 40290 Т×А/м (5,1млнГс×Э). Это свойство делает эти материалы незаменимыми для производства постоянных магнитов, которые используются во всем спектре производства аудиовидеотехники. На основе неодима и самария выпускаются магниты для ракетной и космической техники, неодимово-ферроборовые магниты, используют в моторах и генераторах особой мощности.
- производство металл - редкоземельных гранатов
Металл – редкоземельные гранаты 3Ln2O3×5Fe2O3 находят свое применение во все более широких областях. Так железо-иттриевые гранаты, обладая ферримагнитными свойствами, одновременно могут быть и полупроводниками и диэлектриками, что позволяет их использовать в высокочастотной технике, микроволновых передатчиках и других электронных приборах. В последние годы находят свое применение галлий-гадолиниевые и галлий-скандиево-гадолиниевые гранаты в качестве активной среды в квантовых парамагнитных усилителях и мощных твердотельных лазерах. Кроме этого они используются в перестраиваемых полосовых фильтрах на магнитостатических волнах и особенно широко в магнитооптике и микроэлектронной технике в качестве подложек для магнитных гранатных пленок в запоминающих устройствах на основе подвижных цилиндрических доменов.
- цветное телевидение
На основе редкоземельных металлов (ортованадаты иттрия, тербия) производят люминофоры. На основе тербия – зеленые люминофоры, на основе иттрия – красные, которые помимо цветного телевидения используют для приборов наведения в Авиапроме.
- лазерная техника
Редкоземельные элементы используют в различных классах лазеров (твердых, жидких), либо в качестве основы лазерных материалов, либо в качестве активирующей добавки. Известны оптические квантовые генераторы, в которых используют растворы хелатов РЗЭ. В качестве основы лазеров возможны фториды церия, оксиды лантана, иттрия, гадолиния, церия. Разработаны лазеры на основе Y-Al, Y-Gd гранатов, легированных неодимом.
-электровакуумная, рентгеновская и радиотехника.
В электровакуумной промышленности РЗЭ используют в качестве геттеров.
Оксид неодима в электронных приборах играет роль диэлектрика с малым коэффициентом линейного расширения.
Важное применение нашел изотоп туллия 170 для изготовления портативных генераторов мягкого рентгеновского излучения медицинского назначения и для дефектоскопии. Эти генераторы могут заменять громоздкие стационарные установки. Изотоп прометия 147 Pm (T1|2=2,7года) используют для изготовления атомных микробатарей, в которых мягкое b-излучение превращается в электроэнергию.
- сельское хозяйство
Соединения РЗЭ используют в сельском хозяйстве в качестве инсектофунгицидов.
- электроосветительная техника
Фториды РЗЭ (CeF3) применяют для изготовления угольных электродов для увеличения интенсивности свечения.
-гидриды – аккумуляторы водорода
Гидриды РЗЭ или их интерметаллидов перспективны в качестве аккумуляторов водорода. Они способны поглощать на единицу массы больше водорода, чем индивидуальные оксиды РЗЭ. Они дешевле и материалы, создаваемые на их основе, могут работать в различных интервалах температур.
Общие объемы потребления РЗЭ в 2010 году составляли 125 тыс. тонн. Если рассматривать по областям, то наибольшее потребление имеют постоянные магниты, на которые приходилось около 27% от общего спроса в 2010 году, по сравнению с только 13% в 2000 году. Это также, безусловно, самый ценный сектор, на который приходилось около 47% от общей валовой стоимости в 2010 году. Высокие темпы роста за последние 20 лет были вызваны увеличением спроса на жесткие диски, персональное звуковое оборудование и небольшие электродвигатели в некоторых автомобилях. Часть из прогнозируемого роста рынка магнитов до 2015 года будет происходить от использования двигателей с постоянными магнитами в ветровых турбинах и гибридных электрических автомобилях (HEV).
Развитие рынка дисплеев с плоским экраном, негативно влияет на использование оксида церия в качестве добавки к стеклу и порошков для полировки. Тем не менее, растущий спрос на плоские экраны в смартфонах и планшетах частично компенсировал снижение удельного расхода полировального порошка на каждый экран. Эффективность суспензии для полировки была улучшена, а переработка используется там, где это уместно, с сопутствующим снижением потребления оксида церия
Люминофоры и пигменты составляют чуть более 6% от общего объема потребления редкоземельных элементов, но почти 15% по стоимости. Люминофоры являются основным рынком для европия и тербия, тяжелых редкоземельных элементов (HREE) с высокой стоимостью, а также иттрия. Основным фактором роста в 2015 году станет распространение законодательства, направленного на поэтапный отказ от ламп накаливания, в результате чего они будут заменяться компактными люминесцентными лампами, при производстве которых применяются редкие земли.
По прогнозам мирового спроса, структура потребления изделий из редкоземельных элементов сильно не изменится (табл. 1)
ТЕХНОЛОГИЯ ПОЛУЧЕНИЯ РЕДКОЗЕМЕЛЬНЫХ МЕТАЛЛОВ
Ввиду высокой химической прочности соединений лантаноидов (оксидов, галогенидов) чистые металлы или их сплавы получают методами металлотермии или электролоиза расплавленных сред.
Исходные соединения для производства металлов
Редкоземельные металлы преимущественно получают из безводных хлоридов или фторидов.
Получение хлоридов. Для получения хлоридов используют способы обезвоживания кристаллогидратов РЗЭ С13 • лН20 (выделяемых в процессе выпаривания растворов) или "сухие" методы хлорирования оксидов.
С. целью предотвращения образования оксихлоридов JL/iOCl (в результате гидролиза) обезвоживание кристаллогидратов проводят в токе сухого хлористого водорода при 400 - 450 °С. В этом случае оксихлориды превращаются в хлориды:
L/iOCl + 2НС1 = L/iCl3 + Н20. (11.10)
Сухие методы основаны на взаимодействии оксидов РЗЭ с различными хлорирующими агентами: хлором в присутствии углерода, хлоридом аммония и хлористым водородом.
Хлор в присутствии углерода и СС14 реагирует с оксидами РЗЭ при 700 - 800 °С. При этом получают расплав хлоридов. Взаимодействие с хлоридом аммония протекает при 200 - 300 °С:
Ьпг Оэ + 6NH4C1 = 21лС13 + 6NH3 + ЗН20. (ll. ll)
После окончания реакции отгоняют избыточный NH4C1 нагреванием смеси в вакууме 66,5 - 267 Па при 300 - 320 °С. Безводные хлориды РЗЭ гигроскопичны. Ввиду этого при работе с ними необходимо исключить контакт материала с влажным воздухом и хранить хлориды в атмосфере инертного газа. 364
Получение фторидов. Фториды РЗЭ получают обезвоживанием гидратированных солей, осажденных из растворов или действием фтористого водорода на оксиды РЗЭ.
Фториды РЗЭ осаждают из азотнокислых или солянокислых растворов плавиковой кислотой. Некоторые РЗЭ (лантан, церий и др.) выделяются в виде полугидратов LnҐ3 • 0,5Н20, другие (празеодим, неодим) - без кристаллизационной воды. При нагревании раствора с осадком фторидов с помощью инфракрасной лампы гидратированные фториды превращаются в безводные. Отфильтрованные и промытые спиртом осадки затем сушат при 400 °С в атмосфере сухого аргона. Полученные этим способом фториды содержат примесь оксифторидов JL/iOF. Исключить их образование можно сушкой в токе HF.
Более чистые фториды получают действием фтористого водорода на оксиды при 550 - 575 °С:
Ln203 + 6HF = 2L/iF3 + ЗН20. (11.12)
Фторирование таблеток оксидов проводят в трубе из никеля или сплава 70% Ni + 30% Си, через которую навстречу потоку газа перемещаются лодочки с оксидами. Можно проводить фторирование оксидов в кипящем слое. Фториды, в отличие от хлоридов, малогигроскопичны, что облегчает работу с ними.
Электролитическое получение редкоземельных металлов
Разработаны различные способы получения лантаноидов электролизом в расплавах солей. Среди них более распространен электролиз безводных хлоридов РЗЭ в расплавах хлоридов щелочных и щелочно-земельных металлов. Этим способом в производственных масштабах получают преимущественно мишметалл (сплав церия, лантана, неодима и др.), а также церий, иногда лантан и неодим и другие металлы цериевой группы. В процессе электролиза эти металлы выделяются на катоде в расплавленном состоянии, поскольку они имеют сравнительно низкие точки плавления.
Более сложным оказалось получение электрлизом металлов группы иттрия, которые, за исключением иттербия, имеют высокие точки плавления (от 1350 до 1700 °С). Проводить электролиз при столь высоких температурах (для получения на катоде жидкого металла) практически невозможно из-за испарения галоидных солей, а также трудностей с подбором материалов для ванны и электродов. В связи с этим металлы подгруппы иттрия не получают электролизом.
Электролиты для получения мишметалла или металлов це - риевой группы большей частью содержат смесь 50% КС1 + 50 % СаС12, отвечающую эвтектике с точкой плавления 660 °С, или смесь 50% КС1 + 50% NaCl, плавящуюся при 658 иС. В расплавах этих солей хлориды лантаноидов хорошо растворимы. Ванна содержит примерно 58 - 60% L/iCl3, остальное - хлориды щелочных и щелочно-земельных металлов. Рекомендуются небольшие добавки фтористого кальция.
Для получения мишметалла используют электролизеры различных конструкций. Одна из них приведена на рис. 87. Внутренняя футеровка ванны - из огнеупоной керамики. Пространство между футеровкой и стальным кожухом заполнено теплоизолирующей засыпкой. У дна ванны введены водоохлаж - даемые катоды. В центре - графитовый анод. Температуру электролита - 800 - 900 °С поддерживают за счет тепла, выделяющегося при прохождении тока через расплав.
Электролиз ведут при напряжении 10 - 15 В и силе тока 1000 - 2000 А (в зависимости от размера электролизера). Выход по току составляет примерно 50 - 70%.
Жидкий мишметалл либо вычерпывают ковшом, либо выпускают все содержимое ванны в стальные изложницы, нагретые до 500 - 550 °С. После расслоения и остывания электролит возвращается в процесс.
Получаемый мишметалл или церий содержит 94 - 99 % суммы РЗЭ и ряд примесей: углерод, кальций, алюминий, до 1% кремния, 1,0 - 2,5 % железа и др. Чистоту металла можно повысить применением для изготовления электродов метал-
Ржс.87. Схема электролизной ванны для получения мишметалла: 1 — графитовый анод; 2 - огнеупорная керамика; 3 - железный кожух; 4 - электролит; 5 - жидкий мишметалл; 6 — железный катод;
Лов, не взаимодействующих с лантаноидами (молибден и особенно тантал), использованием для футеровки тигля чистых оксидов магния и бериллия, а также проведением электролиза в атмосфере инертного газа.
Металлотермические способы получения лантаноидов из галогенидов
Металлотермическим восстановлением галогенидов можно получить все лантаноиды, за исключением самария, европия и иттербия, восстановление которых протекает только до низших галогенидов. Поэтому для получения этих лантаноидов разработаны способы их восстановления из оксидов лантаном или углеродом с вакуумной их возгонкой. Для восстановления фторидов и хлоридов лантаноидов используют преимущественно кальций. Кроме того, для производства тяжелых РЗМ и иттрия используют метод восстановления литием.
Восстановление галогенидов кальцием
Восстановление галогенидов кальцием необходимо проводить при температурах выше точек плавления лантаноидов, чтобы обеспечить выплавку металлического слитка. При этом шлак должен находиться в расплавленном состоянии. Это определяет обличия в условиях восстановления таких сравнительно легкоплавких металлов, как La, Се, Pr, Nd (температуры плавления 800 - 1050 °С) и металлов иттриевой группы, плавящихся в интервале 1350 - 1650 °С (см. табл. 10).
Восстановление хлоридов. Легкоплавкие лантаноиды (La, Се, Pr, Nd) можно получить восстановлением хлоридов и фторидов кальцием. Безводные хлориды этих элементов восстанавливают с получением металлов высокой чистоты в стальных герметичных стаканах (бомбах) небольшого размера, футерованных чистым оксидом магния или доломитовой смесью оксидов кальция и магния.
Кальций высокой чистоты (очищенный дистилляцией в вакууме) в форме зерен размером ~ 0,6 - 1 мм, взятый с избытком 15 - 20%), перемешивают с хлоридом лантаноида в атмосфере сухого аргона в специальной камере. При проведении процесса в малых масштабах теплоты реакции недостаточно для обеспечения расплавления образующегося металла и шлака. С целью повышения термичности процесса в шихту добавляют в качестве подогревающей добавки иод (0,3 - 0,7 моля на 1 моль хлрида) и соответствующее количество кальция для образования Са12 (теплота образования Са12 538 кДж/моль).
Герметично закрытую бомбу с шихтой нагревают до 700 °С для возбуждения реакции. Металлы получаются в виде плотного слитка, хорошо отделяющегося от шлака, при среднем выходе 95%. Они содержат около 2% кальция, который удаляется переплавкой металла в вакууме в тиглях из оксида магния, оксида бериллия или тантала.
В случае необходимости ведения восстановления выше 1200 °С (например, для гадолиния) тигли из оксида магния непригодны. Наиболее инертным материалом по отношению к лантаноидам явяется тантал, практически не реагирующий с большей частью этих металлов вплоть до 1500 - 1600 °С.
Росстановление ведут в сварном танталовом тигле, закрытом дырчатой крышкой, в атмосфере аргона. Тигель нагревают токами высокой частоты (в шихту не добавляют подогревающей добавки). Металлы плотно пристают к танталу и приходится механически отделять от них танталовую оболочку. В целях экономии тантала тигли изготовляют из тонких листов толщиной 0,02 - 0,06 мм.
Восстановление фторидов. Для получения тугоплавких лантаноидов (Tb, Dy, Но, Er, Tu, Lu, Y) способ восстановления хлоридов непригоден. Основное затруднение состоит в высоком давлении пара хлоридов РЗЭ при 1500 - 1600 °С, необходимых для получения слитков. Более высокие точки кипения, чем хлориды, имеют фториды лантаноидов. Кроме того, фториды имеют преимущество перед хлоридами в том отношении, что они малогигроскопичны.
Восстановление фторидов кальцием проводят в танталовых тиглях в атмосфере аргона. Кальций и фторид РЗЭ смешивают при возможно меньшем контакте с атмосферой. В шихту вводят кальций с избытком 10% против необходимого для реакции восстановления:
2L/iF3 + ЗСа = 2Ln + 3CaF2. (11.13)
Шихту набивают в предварительно дегазированный нагреванием в вакууме танталовый тигель, который ставят в кварцевую трубу вакуумной индукционной печи. Для удаления газов из шихты тигель медленно нагревают в вакууме до 600 °С. При этой температуре впускают чистый аргон до давления 66,5 кПа (500 мм рт. ст.) и продолжают нагрев до температуры, при которой начинается активное взаимодействие фторида с кальцием. Эта температура в зависимости от получаемого металла составляет 800 - 1000 °С. Хотя реакция экзотермическая, но тепла не хватает для достижения необходимой конечной температуры и нагрев продолжается. Чтобы получить хороший выход в слиток, температура в конце процесса должна быть выше температуры плавления металла и шлака (точка плавления CaF2 1418 °С). Для легких РЗЭ, а также гадолиния, тербия и диспрозия достаточна температура 1450 °С, для более тугоплавких РЗЭ - на 50 °С выше точки их плавления.
По достижении температуры активного взаимодействия реакция заканчивается за несколько минут; затем максимальную температуру поддерживают в течение 15 мин для хорошего отделения металла от шлака. В этих условиях выход металла в слиток достигает 97 - 99%. После охлаждения хрупкий шлак легко отделяется от слитка. Основная примесь в слитке - кальций, содержание которого составляет 0,1 - 2 %. Для его удаления слиток плавят в вакууме в том же танталовом тигле.
Рис.88. Схема аппарата для восстановления фторидов РЗМ кальцием:
1 - смотровое окошко; 2 - подвижное уплотнение; 3 - загрузочная воронка из стекла пирекс; 4 - отверстия для эвакуации загрузочной воронки и шихты; 5 - затвор; 6 - патрубок для очистки или подачи аргона; 7 - танталовый патрубок для подачи шихты; 8 - танталовая трубка; 9 - теплоизоляция из дробленого графита; 10 - индукционная катушка; И - танталовый тигель; 12 - подставка под тигель; 13 - стакан, ограничивающий теплоизоляцию
Содержание тантала в легких лантаноидах (от лантана до неодима) составляет 0,02 - 0,03 %, в тяжелых лантаноидах 0,1 - 0,5 %. Содержание других примесей, %: Са 0,01 %; N 0,005; О 0,1 - 0,03; С 0,0075; F 0,005.
С целью увеличения количества единовременно получаемого металла можно проводить процесс с догрузкой шихты в танталовий тигель по мере того, как шихта реагирует и плавится (рис. 88).
Литиетермический способ восстановления РЗМ из хлоридов
Метод используют для получения тяжелых РЗМ, иттрия, имеющих высокие точки кипения.
Все щелочные - металлы восстанавливают РЗМ из их хлоридов, однако литий обладает преимуществом по сравнению с натрием и калием - более высокой температурой кипения (у лития, натрия и калия Гкип равны 1370, 833 и 760 °С соответственно).
Полное восстановление хлоридов литием происходит при 800 - 1000 °С. При этом тяжелые РЗМ и иттрий находятся в твердом состоянии, что является преимуществом по сравнению с кальциетермическим способом. Поскольку LiCl плавится при 614 °С, его можно удалить сливом с последующей вакуумной сепарацией оставшегося в губчатом металле хлорида (у LiCl tma = 1380 °С).
Описаны различные варианты литиетермического восстановления хлоридов РЗМ. Для получения металла технической чистоты применяют способ прямого взаимодействия жидкого лития с двойной солью ЗКСІ • L/iClj (соли с YC13, YbCl3, ТЬС13 и LnC\3 имеют точки плавления 780, 825, 810 и 816 °С соответственно). Двойной хлорид в виде кусков помещают в ниобиевый стакан, устанавливаемый в стальной реактор. Герметизированный реактор вакуумируют и заполняют аргоном. Реактор нагревают до 200 °С, затем из бачка - плавильника в реактор подают жидкий литий (їпл = 180,5 °С). Вследствие экзотермичности реакции происходит разогрев реагирующих веществ до 700 °С. Образующийся жидкий LiCl с помощью вакуумного сифона сливают в изложницу.
Оставшийся хлорид (~ 20 %) удаляют вакуумной сепарацией. После охлаждения реторты во избежание возгорания губки РЗМ выдерживают в атмосфере технического аргона для пассивирования поверхности (образование пленки оксида в результате взаимодействия с примесью кислорода в аргоне).
Металл после переплавки в дуговой печи содержит, % (по массе): О 0,3 - 0,4; С1 0,01; С 0,02; Fe 0,01 - 0,03; Nb 0,001.
Восстановление самария, европия и иттербия из оксидов
Выше сказано, что самарий, европий и иттербий не удается получить восстановлением из галогенидов вследствии того, что процесс протекает только до образования дихаль - когенидов. Эти металлы получают восстановлением из оксидов лантаном или углеродом.
Ланганотермический метод. Восстановление оксидов самария, европия и иттербия лантаном проводят в вакууме с одновременной дистиляцией образующихся металлов, которые имеют более высокое давление пара, чем лантан (см. табл. 10):
Sm203 + 2La = 2Sm* + Ьа2Оэ. (11.14)
По одному из описаний восстановление ведут в высоком танталовом тигле, в верхней части которого установлен охлаждаемый воздухом медный конденсатор (для предотвращения загрязнения медью поверхность конденсатора покрывают тонким слоем оксида получаемого металла. Для обмазки используют суспензию оксида в спирте). Смесь оксида с лантано - вой стружкой (взятой с избытком - 20%) помещают в танталовый тигель, нижнюю часть которого нагревают в вакуумной индукционной печи до 1400 °С. В процессе нагрева поддерживают вакуум не ниже 1,33 • 10"2Па. Начало возгонки сопровождается резким падением давления (до 1,33 10~5Па), так как испаряющиеся металлы активно поглощают остаточные газы. Конденсацию ведут при 300 - 400 °С. В этом случае металл получается в форме крупнокристаллической корки. При более низких температурах образуется порошкообразный металл.
Получаемые самарий, европий и иттербий практически не содержат тантала и лантана. Содержание примесей С, N, О и
Н не превышает 0,01 %. Вместо лантана в качестве восстановителя можно использовать церий или мишметалл.
Карботермический способ. Способ включает две стадии:
Восстановление ЬпгОг углеродом при 1600 - 1700 °С с получением карбида:
Ln203 + 7С = 2LnC2 + ЗСО; (11.15)
Диссоциацию карбида в вакууме с возгонкой лантаноида:
Метод применяют для получения самария, европия и иттербия, которые отличаются относительно низкими температурами кипения (1900, 1400 и 1430 °С соответственно).
Процесс ведут в графитовом тигле, куда загружают брикетированную смесь оксида с углеродом (сажей), взятым с 10%-ным избытком. Тигель помещен в вакуумную печь, нагрев индукционный.
Первую стадию ведут при разрежении в печи 13,3 Па при 1600-1700 °С, выдерживая шихту при этой температуре ~3 ч. В результате получают карбид лантаноида. Вторую стадию проводят при остаточном давлении ОДЗПа и температуре 1600-1900 °С. В результате диссоциации карбида самарий летит и осаждается на охлаждаемом конденсаторе, изготовленном из тантала или молибдена. Полученный этим методом самарий содержит, %: С 0,05; О 0,1; Н 0,035, N < 0,1.
Очистка редкоземельных металлов дистилляцией
Рафинирование редкоземельных металлов, полученных одним из описанных способов, можно осуществить дистилляцией в вакууме. Этот метод эффективен для очистки тугоплавких металлов иттриевой группы и самого иттрия.
Металл помещают в танталовый тигель, соединенный с танталовым конденсатором. Тигель с конденсатором помещают в кварцевую трубу, соединенную с вакуумной системой. Тигель нагревают с помощью индуктора. Плавка ведется при вакууме ^0,0013 Па. При плавке диспрозия, гольмия, эрбия поддерживают температуру в тигле 1600-1700 °С, конденсатора - 900-1000 °С. Для более тугоплавких металлов - иттрия, тербия, лютеция - 2000-2200 °С и 1300-1400 °С соответственно. 372
Редкоземельные металлы
К группе редкоземельных элементов (РЗЭ) относится семейство из 14 элементов с порядковыми номерами от 58 (церий) до 71 (лютеций), расположенных в VI периоде системы Д. И.Менделеева за лантаном и сходных с ним по свойствам. Поэтому обычно в эту группу включают и лантан, а элементы называют лантаноидами Ln (т. е. подобные лантану). Кроме того, к лантаноидам примыкают химические анологи лантана - элементы третьей группы скандий и иттрий. Последний ближе по свойствам к лантаноидам, чем скандий, и обычно сопутствует им в минеральном сырье[9]. По физико-химическим свойствам лантаноиды сходны между собой. Это объясняется особенностями строения их электронных оболочек: по мере роста заряда ядра (увеличения порядкового номера) структура двух внеших электронных уровней у атомов лантаноидов одинакова, так как при переходе от одного элемента к другому заполняется электронами глубоко лежащий электронный уровень 4/ (табл.9). Максимально возможное число электронов на /-уровне, равное 14, определяет число элементов семейства лантаноидов.
В нормальном состоянии у атомов лантаноидов (за исключением гадолиния и лютеция) нет электронов на М-оболочке (см. табл.9). Однако для перехода электрона с уровня 4/ на уровень 5d требуется небольшая затрата энергии. Характерная для семейства лантаноидов степень окисления (+3) обусловлена переходом одного электрона с 4/-уровня на Sd-уровень. В этом случае в валентных связях участвуют два внешних электрона оболочки 6s и один электрон оболочки 5d. У некоторых лантаноидов наблюдается, кроме степени окисления +3, также степень окисления +4 или +2. Эти "аномальные" валентности объясняются различиями в прочности связи электронов на 4/-уровне в зависимости от их числа.
Прочность связи электронов возрастает по мере заполнения 4/-уровня наполовину (до семи электронов) или при полном его заполнении до 14 электронов. Поэтому наиболее устойчивой конфигурацией 4/-уровня отличаются атомы гадолиния и лютеция. Степень окисления +4 проявляется у церня и празеодима (первые /-электроны легко переходят на Srf-уровень) и у тербия н диспрозия, следующих за гадолинием. Степень окисления +2 наблюдается у самария, европия и иттербия, т. е. у элементов с числом электронов на /-уровне, близким к 7 или 14.
Лантаноиды (редкоземельные элементы) подразделяются на две подгруппы: цериевую [(La), Се, Pr, Nd, Pm, Sm, Eu] и иттриевую [Gd, Tb, Dy, Ho, Er, Tu. Yb, Lu, (Y)]. Это деление сначала основывалось на различии в растворимости двойных сульфатов, образуемых лантаноидами с сульфатами натрия или калия. В последующем была установлена периодичность в изменении некоторых свойств внутри семейства лантаноидов, соответствующая их разделению на две подгруппы.
Так, наблюдается примерно аналогичное изменение устойчивости валентных состояний в обеих подгруппах, а также в окраске ионов: окраска растворов трехзарядных ионов первых семи элементов близка к окраске последующих семи ионов в обратном порядке (табл. 9). Изменение магнитных свойств трехзарядных ионов также носит периодический характер.
В противоположность перечисленным выше свойствам некоторые свойства элементов изменяются непрерывно. Так, по мере увеличения порядкового номера непрерывно уменьшаются радиусы атомов и ионов (см. табл. 9). Это явление, называемое "лантаноидным сжатием", объясняет постепенное понижение основности элементов от церия к лютецию и обусловливает различия в растворимости солей лантаноидов и устойчивости их комплексных соединений.
Краткие сведения из истории открытия лантаноидов
История открытия РЗЭ сложна. Вначале смеси оксидов лантаноидов ("земли"), выделенные из минералов, принимали за одни элемент. Первыми были открыты "иттриевые земли" финским химиком Гадолнном в 1794 г. в минерале, найденном в Швеции (близ Иттербю) и названном позже гадолинитом. Спустя несколько лет, в 1803 г. немец Клапрот и одновременно швед Берцелнус выделили из "тяжелого камня бастнеза" новую "церитовую землю". Долгое время иттриевую и цериевую земли считали идентичными. В последующем, на протяжении 100 лет были открыты и выделены из иттриевых и цериевых земель все лантаноиды, кроме элемента с порядковым номером 61. Последний, оказавшийся радиоактивным, был получен лишь в 1947 г. Маринским с сотр. из осколков деления урана в ядерном реакторе и назван ими прометием.
Хотя открытие лантаноидов завершилось к началу XX в., многие из них не были выделены в достаточно чистом виде и были мало исследованы. В 50-х годах были разработаны эффективные промышленные методы разделения лантаноидов. В настоящее время все лантаноиды получают не только в виде чистых соединений, но и в виде чистых металлов.
Физические свойства лантаноидов
Лантаноиды - металлы серебристо-белого цвета. Некоторые из них имеют слегка желтоватый цвет (например, празеодим и неодим).
Точки плавления элементов подгруппы церня ниже, чем у элементов подгруппы иттрия. Примечательно, что у самария, европия и иттербия, проявляющих валентность 2+, точки кипения значительно ниже, чем у других лантаноидов. Следует отметить высокие сечения захвата тепловых нейтронов у гадолиния, самария и европия (табл. 10).
Лантаноиды высокой чистоты пластичны и легко поддаются деформации (ковке, прокатке). Механические свойства сильно зависят от содержания примесей, особенно таких элементов, как кислород, сера, азот и углерод. Значения временного сопротивления и модуля упругости металлов иттриевой подгруппы (за исключением иттербия) выше, чем металлои цериевой подгруппы.
Все лантаноиды и лантан парамагнитны, некоторые из них (гадолиний, диспрозий, гольмий) проявляют ферромагнитные свойства. а-лантан переходит в состояние сверхпроводимости при 4,9 К, /3-лантан — при 5,85 К. У других лантаноидов сверхпроводимость не обнаружена даже при температурах ниже десятых долей градуса Кельвина.
Химические свойства лантаноидов
Лантаноиды отличаются высокой химической активностью. Они образуют прочные оксиды, галогениды, сульфиды, реагируют с водородом, углеродом, углеводородами, оксидом и диоксидом углерода, азотом, фосфором. Металлы разлагают воду (медленно на холоду, быстрее при нагревании) и легко растворяются в соляной, серной и азотной кислотах. При температурах выше 180 - 200 °С металлы быстро окисляются на воздухе.
Оксиды лантаноидов отличаются химической прочностью и плавятся при высоких температурах. Так, Се02 плавится при температуре около 2500 °С, La203 - выше 2000 °С.
Гидроксиды лантаноидов 1м(ОН)ъ имеют основный характер н малорастворимы в воде и щелочах. Соответственно понижению основности в ряде лантаноидов от церия к лютецию рН начала осаждения гидроксидов понижается от 7,82 для церия до 6,82 для лютеция.
Хлориды, сульфиты и нитраты трехвалентных лантаноидов растворимы в воде и кристаллизуются большей частью в виде кристаллогидратов различного состава.
Фториды и оксалаты малорастворимы в воде и разбавленных минеральных кислотах. Фториды осаждаются в виде кристаллогидратов состава LnF3 ' 0,5Н20 или безводных солей (например, Рг и Nd). Для оксалатов наиболее характерен состав Z, n2(C204)3 • 10Н20. Растворимость в воде оксалатов элементов иттриевой группы выше, чем цериевой. При нагревании до 500 - 600 °С оксалаты разлагаются с образованием оксидов типа іл203.
К труднорастворимым в воде солям лантаноидов относятся также фосфаты, карбонаты и феррицианиды. Большинство простых солей лантаноидов склонно к образованию двойных или комплексных солей с солями щелочных металлов и аммония, а также рядом солей двухвалентных элементов.
Лантоноиды образуют комплексные соединения со многими органическими веществами. Среди них важное 'значение имеют комплексы, образуемые с лимонной кислотой и рядом аминополиуксусных кислот; нитрилотриуксусной (НТА), ЭДТА и другими "комплексонами". Устойчивость комплексных соединений с органическими кислотами большей частью возрастает в ряду от лантана к лютецию, что широко используют в некоторых методах разделения лантаноидов.

Редкоземельные элементы (в виде металлов, сплавов и химических соединений) нашли применение в различных отраслях техники: черной металлургии, производстве стекла и керамики, атомной, электроосветительной, телевизионной и лазерной технике, химической промышленности, медицине, сельском хозяйстве. Возможности их использования далеко не исчерпаны и расширяются по мере исследования свойств лантаноидов, их сплавов и соединений.
Черная и цветная металлургия. Присадки РЗМ применяют в производстве стали, чугуна и сплавов цветных металлов. В этой области главным образом используют ферроцерий или сплав лантаноидов (мишметалл) с преобладающим содеражани - ем церия или церия и лантана.
Добавки РЗМ повышают Качество нержавеющих, быстрорежущих, жаропрочных сталей, кремнистых сталей для электротехнических целей.
Присадки РЗМ применяют также для повышения качества чугуна (улучшение литейных качеств, горячей ковкости, повышение сопротивления окислению и прочности).
Сплавы железа с высоким содержанием металлов цериевой группы (70 - 75% РЗМ и 25 - 30% Fe)- пирофорны и находят широкое применение для изготовления кремней для зажигалок, а также для пиротехнических составов. Для этих же целей применяют мишметалл или его сплав с оловом и магнием.
Добавки РЗМ к различным сплавам алюминия и магния увеличивают их прочность при высоких температурах. Магниевые сплавы этого типа содержат присадки от 0,5 до 4 % Zn, 0,6- 0,7% Zr и 1,25 -2,75% РЗЭ.
Производство стекла и керамики. Стекольная промышленность - один из крупных потребителей РЗЭ. Так, стекло с добавкой 2-4% Се2Оэ служит для изготовления защитных очков при стеклодувных и сварочных работах. Стекло не пропускает ультрафиолетовые лучи. Стекло, содержащее церий, оказалось устойчивым (не тускнеет) под действием радиоактивных излучений.
Оксиды некоторых лантаноидов используют в производстве оптического стекла, а также для обесцвечивания стекла и его окрасти.
Широкое применение оксиды лантаноидов нашли в оптической промышленности в качестве абразива для полировки стекла. Для этой цели преимущественно используют диоксид церия (под названием "полирит") в виде пророшков различной крупности, регулируемой температурой прокаливания.
В керамике оксиды РЗЭ используют для окраски фарфора, глазурей и эмалей и придания им непрозрачности.
Атомная техника. Для атомной техники наибольший интерес представляют лантаноиды с высоким сечением захвата тепловых нейтронов - гадолиний, самарий, европий (см. табл. 10). Оксиды этих металлов входят в состав регулирующих стержней и защитных керамических покрытий, используемых в ядерных реакторах и атомных двигателях. Наиболее пригоден для этих целей европий, так как у него имеется пять изотопов, поглощающих нейтроны.
Магнитные сплавы и материалы. Некоторые интерметаллиды РЗЭ, например YCo5 и SmCo5, являются • магнитными материалами с высоким значением произведения индукции на максимальную напряженность магнитного поля. Эта величина для SmCo5 40290 Тл • А/м (5,1 мнл. Гс • Э).
Самариево-кобальтовые магниты превосходят другие распространенные материалы (сплавы Fe - Ni - Со - Al, ферриты бария и стронция и др.) в 2 - 4 раза по величине магнитной энергии на единицу объема и в 5 - 10 раз по величине коэрцитивной силы.
Железо-редкоземельные гранаты ЗЬп203 • 5Fe203 (в частности, железо-иттриевые) обладают ферромагнитными свойствами и одновременно являются полупроводниками и диэлектриками. Их используют в высокочастотной технике, в частности в микроволновых передатчиках и других электронных приборах.
Цветное телевидение. Использование РЗЭ в качестве люминофоров для кинескопов цветных телевизоров вызвало значительный рост их производства в последние годы. На основе ортованадата иттрия, активированного европием, создан красный люминофор, на основе тербия - зеленый. Разрабатывают люминофоры голубого цвета.
Лазерная техника. РЗЭ широко используют в различных классах лазеров (на твердых кристаллах, жидкостных и др.). Применяют в качестве основы материалов или как активирующие вещества. Известны оптические квантовые гене - 348 раторы, в которых используют растворы хелатов РЗЭ. В качестве основы лазеров можно применять CeF3 и оксиды РЗЭ (La, Y, Gd, Се). Разработаны и широко используются лазеры на основе Y - Fe, Y - Al, гранатов, легированных неодимом.
Электровакуумная и рентгеновская техника и радиотехника. В электровакуумной технике РЗЭ используют в составе нераспыляющихся поглотителей газов (геттеров).
Оксид неодима применяют в электронных приборах как диэлектрик с малым коэффициентом линейного расширения.
Важное применение нашел изотоп туллия170Ти для изготовления портативных генераторов мягких рентгеновских лучей медицинского назначения и для дефектоскопии, заменяющих громоздкую рентгеновскую аппаратуру.
Изотоп прометия147Рт (период полураспада 2,7 года) применяют для изготовления "атомных микробатарей", в которых мягкое ^-излучение прометия превращается в электроэнергию.
Электроосветительная техника. В этой области давно применяют фториды РЗЭ для изготовления угольных электродов прожекторов и кинопроекционных осветителей в целях увеличения интенсивности свечения. Фториды (преимущественно CeF3) вводят в состав массы для центральной части электрода (фитиля).
Химическая и легкая промышленность. Соединения РЗЭ применяют для изготовления лаков, красок и светящихся составов (люминофоров); катализаторов при синтезе аммиака, крекинге нефти и для окислительных процессов в органической химии; производстве химических реактивов для аналитической химии и фотореагентов.
Сельское хозяйство. Соединения РЗЭ применяют в сельском хозяйстве в качестве инсектофунгицидов (препараты для борьбы с вредителями) и микроудобрений, ускоряющих рост растений.
Общее мировое производство редкоземельной продукции в пересчете на оксиды в 1986 г. находилось на уровне 36,5 тыс. т, в том числе в США 17,3, Австралии 8,0, КНР 6,0 тыс. т.
Суммарное весовое содержание лантаноидов в земной коре, 0,01 %, что равно содержанию меди. Элементы с нечетным атомным номером содержатся в земной коре в меньших количествах, чем их ближайшие соседи с четными номерами.
Известно более 250 минералов, содержащих РЗЭ. К собственным минералам можно отнести 60 - 65 из них, в которых содержание суммы оксидов редких земель выше 5 -8 %. По химической природе минералы представляют собой главным образом фосфаты, фториды или фторокарбонаты, силикаты и силикотитанаты, ниоботанталаты, титанониобаты. Минералы обычно содержат некоторое количество тория, иногда урана.
Наибольшее промышленное значение имеют следующие минералы:
Монацит (Се, La. ) Р04, содержат 50 - 60 % Ьп2Оэ и 4- 12% Th02;
Басгнезит (Се, La. ) FC03, содержит 73 - 77% Ьп203; паризит Са(Се, La. )2 (C03)3F2, содержит 53 - 64,5 % Р3203, от следов до 8% Y (иттропаризит);
Лопарит (NA, Са, Се. )2 (Ті, Nb, Та)206, содержит 39,2 - 40% ТЮ2, 32 - 34% (Се, La. )203, 8 - 10% (Nb, Ta)2Os;
Эвксенит (Y, Се, Са. ) (Ті, Nb, Та)206, содержит 18,2- 27,7% (Y, Ег. )203, 0,2 - 4,3% (Се, La. )203, 16 - 30%, ТЮ2, 4,3 - 41,4% Nb2Os, 1,3 -23% Ta2Os;
Ксенотим YP04, содержит 52 - 62,6 % Y203 и примеси лантаноидов.
Соотношение между отдельными элементами в минералах сильно колеблется. В одних преобладают элементы цериевой группы и только до 5 % иттриевых земель (например, монацит, бастнезит, лопарит), в других - иттриевой группы (ксенотим, эвксенит). До настоящего времени промышленность базируется главным образом на разработке монацитових россыпей, а также месторождений, в которых содержится минерал бастнезит (бастнезит-кальцитовые жилы).
Один из основных источников получения элементов цериевой подгруппы - монацит - обычно встречается в пегматитах, иногда в гранатах и гнейсах. При разрушении коренных пород он переходит в россыпи (речные и морские) вместе с ильменитом, цирконом, магнетитом и другими минералами.
Минимальное содержание монацита в разрабатываемых россыпях - около 1 %. Наиболее крупные месторождения найдены в Индии, Бразилии, США, Австралии, на Мадагаскаре и Цейлоне.
Применяя гравитационные и магнитные способы обогащения, получают монацитовые концентраты с содержанием 58 - 65 % ЬпгОэ. Из них попутно с торием извлекают лантаноиды.
Промышленные месторождения бастнезита находятся в США (Маунтен-Пасс в Колорадо) и в Бурунди.
В результате флотационного обогащения получают концентраты, содержащие ~ 60 % ЬпгОэ. Сочетая обжиг таких концентратов с последующей кислотной обработкой, доводят содержание ЬпгО, в. концентратах до 90%.
В СССР важным промышленным сырьевым источником РЗЭ служит лопарит, месторождения которого расположены на Кольском полуострове.
Лопаритовые руды легко обогащаются с получением концентратов, содержащих 80 - 90 % минерала. При их переработке лантаноиды извлекают попутно с ниобием, танталом и титаном.
К минералам, которые служат богатым сырьем для извлечения редких земель группы иттрия, относятся эвксенит, ксенотим, а также хвосты переработки некоторых урансодер - жащих руд.
Потенциальным источником РЗЭ являются апатиты, которые обычно содержат 0,01 - 0,1 % и более Ьпг03. Лантаноиды могут извлекаться попутно при переработке апатита на фосфорные удобрения.
При переработке редкоземельного сырья любого типа первоначально выделяют смесь редкоземельных элементов (в виде оксидов, гидроксидов), которая затем поступает на разделение с целью получения индивидуальных элементов.
МЕТОДЫ РАЗДЕЛЕНИЯ РЕДКОЗЕМЕЛЬНЫХ ЭЛЕМЕНТОВ
Вследствие близости свойств лантаноидов их разделе - ние - сложная задача. Применявшиеся ранее способы разделения были основаны главным образом на различии в растворимости соединений лантаноидов. В результате большого числа дробных кристаллизаций или дробных осаждений (иногда достигавших нескольких тысяч) получали отдельные элементы большей или меньшей степени чистоты. Для отделения некоторых элементов использовали способность их окислять- ся до четырехвалентного состояния (Се, Pr, Tb) или восстанавливаться до валентности 2+ (Sm, Eu, Yb). В этом случае разделение облегчается благодаря значительным отличиям в свойствах соединений лантаноидов со степенью окисления +4 и +2 и соединений лантаноидов со степенью окисления+3.
Современные схемы разделения лантаноидов основаны на использовании более эффективных методов: жидкостной экстракции и ионного обмена. Старые "классические" методы дробного осаждения и кристаллизации практически не используют в настоящее время.
Методы избирательного окисления и восстановления применяют в некоторых схемах разделения.
Окисление церия до четырехвалентного состояния применяют для отделения его от других лантаноидов. Церий легко окисляется кислородом в процессе сушки смеси гидроксидов РЗЭ на воздухе при 120 - 130 °С или при пропускании воздуха через нагретую суспензию гидроксидов. Применяют также другие окислители: хлор, пероксид водорода. После окисления Се3+ до Се4+ гидроксиды трехвалентных лантаноидов растворяют в разбавленной (5 - 10 %-ной) азотной или соляной кислоте, в то время как гидроксид четырехвалентого церия (Се02 • яН20) остается в осадке. Последний содержит 94 - 96% Се02.
Для получения более чистого продукта используют избирательную экстракцию Ce(N03)4 из 6 - 8 н. раствора азотной кислоты трибутилфосфатом или другими экстрагентами.
Восстановление до степени окисления +2 применяют для отделения самария, европия и иттербия из обогащенных ими фракций. Ионы Sm2+, Eu2+, Yb2+ проявляют сходство с ионами стронция и бария. Так, их сульфаты мало растворимы в отличие от сульфатов лантаноидов (+3). В качестве восстановителей используют цинк, амальгаму цинка, амальгаму натрия.
Окислительно-восстановительные потенциалы Sm, Eu и Yb (по отношению к водородному электроду) приведены ниже, В:
Sm37Sm2+ -1,72; Yb3+/Yb2+ -1,15; Eu3+/Eu2+ -0,43;
Zn2+/Zn -0,76; Na+/Na(Hg) -1,86.
Из приведенных значений потенциалов следует, что ионы Еи3+ можно избирательно восстановить до Еи2+ цинковой пылью, не восстанавливающей ионы Sm3+ или Yb3+. Восстановление ведут в солянокислом растворе. При последующем добавлении в раствор серной кислоты осаждается малорастворимый EuS04.
Совместное восстановление трехзарядных ионов европия и самария возможно амальгамой натрия, с которой перемешивают уксуснокислый раствор, содежащий разделяемую смесь лантаноидов:
L«(CH3COO)3 + 3Na(Hg) = Zn(Hg)+ 3CH3COONa. (11.4)
Восстановленные элементы извлекают из амальгамы обработкой ее соляной кислотой. Последующее разделение европия и самария можно затем осуществить восстановлением европия цинковой пылью.
Эффективный вариант отделения европия от других РЗЭ состоит в избирательной экстракции трехзарядных ионов РЗЭ катионообменным экстрагентом - ди-2-этилгексилфосфорной кислотой (Д2ЭГФК), практически не экстрагирующей ионы Еи2+
Разделение РЗЭ экстракцией
В настоящее время экстракционные методы стали основными в схемах разделения РЗЭ. В промышленной практике для разделения преимущественно используют фосфорорганические экстрагенты - ТБФ, Д2ЭГФК и карбоновые кислоты. Разделение основано на закономерном изменении значений коэффициентов распределения в ряду лантаноидов.
Ниже экстракционное разделение РЗЭ рассмотрено на примере использования наиболее распространенного экстрагента - ТБФ. Характеристика ТБФ как экстрагента дана в гл. 2. В промышленной практике разделение РЗЭ экстракцией ТБФ большей частью осуществляют из азотнокислых растворов,
содержащих нитраты РЗЭ. Экстракция протекает с образованием трисолъвата:
^л(водн) + 3N03(BoaH) + ЗТБФ(0РГ)
L/i(N03)3 • ЗТБФ(0РГ); (ц.5)
D = ^C[N03]^H) • [ТБФ](ОРГ),
Где Кс - константа равновесия реакции экстракции.
Значение коэффициента распределения в сисмете ТБФ - HN03 при высоких концентрациях HN03 (11 - 15м/л) непрерывно возрастают с увеличением атомного номера лантаноида. Однако в растворах с концентрацией HN03 ниже 5м/л происходит инверсия (обращение) закономерности изменения коэффициентов распределения для ряда европий - лютеций (рис. 82). Это объясняется проявляющимся при низкой кис - jj
Лотности возрастанием энергии гидратации в ряду тяжелых РЗЭ, что затрудняет вытеснение молекул воды из гидратной оболочки иона молекулами ТБФ. ft0
Ржс.82. Зависимость коэффициента распре - jq-3 деления (£>) РЗЭ от порядкового номера t
>7 59 61 63 65 67 69 71
При экстракции ТБФ
При высокой кислотности (более 12 м/л) средняя величина коэффициента разделения для соседних элементов от лантана до тербия 0 = Dz+1/Dz = 1,9; для элементов от тербия до лютеция эта величина ниже. Поэтому для всей группы РЗЭ можно принять 0 = 1,5. Для легких РЗЭ (La, Ce(IIl), Рг, Nd, Pm) кэффициенты распределения мало изменяются при увеличении концентрации их в растворах от 5 - 10 до 70 - 100 г/л: для средних P33(Sm, Eu, Gd) и тяжелых элементов
(иттриевая группа) коэффициенты распределения существенно зависят от концентрации РЗЭ в водной фазе.
РЗЭ хорошо экстрагируется ТБФ также из слабокислых нитратных растворов в присутствии высаливателей - нитратов алюминия, натрия, кальция, лития.
При использовании экстракции ТБФ для разделения РЗЭ на подгруппы процесс ведут из нитратных растворов с концентрацией HN03 7 - Юм/л. При этом иттрий попадает в подгруппу тяжелых РЗЭ (Dy - Lu).
Помимо нитратных растворов для разделения РЗЭ экстракцией ТБФ используют роданидно-хлоридные растворы. В них РЗЭ присутствуют в составе комплексов Ln(SCN)3 и Ln(SCN)2Cl, устойчивость которых повышается от лантана к лютецию. Экстрагируемый комплекс имеет состав Ln(SCN)3 ■ • «ТБФ, п = 3-И.
В практике разделения РЗЭ экстракций процесс большей частью проводят в каскаде экстракторов типа смеситель - отстойник. Используют систему полного противотока, которая состоит из экстракционной и промывочной секций и секции реэкстаракции (см. рис. 83). Общее число ступеней каскада 50 - 90.
Исходный раствор, содежащий разделяемую смесь, поступает в среднюю часть каскада. Очевидно, что для разделения п элементов смеси потребуется проведение п - 1 последовательных операций или п - 1 экстракционных каскадов.
Первоначально в режиме полного противотока проводят
Исходный раствор РЗМ (А* в)
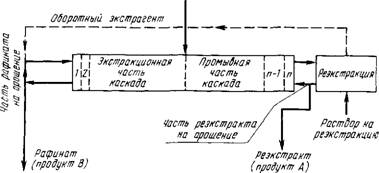
Р«с.83. Схема разделения РЗЭ экстракцией в системе полного противотока
Разделение РЗЭ на подгруппы: легкие РЗЭ (La, Се, Pr, Nd), средние (Sin, Eu, Gd, Tb) и тяжелые (Dy - Lu + Y). Затем ведут дальнейшее разделение в каждой из подгрупп.
Соответственно этому расчет первого каскада проводят, ориентируясь на разделение неодима и самария (используя для расчета значение Psm/Nd)> ПРИ расчете второго каскада ориентируются на разделение по линии тербий - диспрозий (используют значение Рру/тъ)-
При групповом разделении промывным раствором большей частью служит азотная кислота.
В других вариантах разделения РЗЭ, в частности разделении бинарных смесей (А + В), например неодима и самария, используют каскад с обменной промывкой. В этом случае в промывной каскад возвращают часть экстракта, содержащего лучше экстрагируемый компонент, например В. При этом в промывочном каскаде в результате контакта фаз компонент В вытесняет из органической фазы примесь компонента А. Это способствует получению более чистого компонента В, уменьшаются относительные расходы промывочного раствора и экстрагента.
Разделение РЗЭ методом ионообменной хроматографии
Как указано выше, в настоящее время жидкостная экстракция - основной способ разделения РЗЭ. Ионообменная хроматография - дополнительный метод, используемый для получения индивидуальных РЗМ высокой степени чистоты, преимущественно тяжелых.
Для разделения лантаноидов методом ионообменной хроматографии применяют различные типы катионитовых смол (в СССР катионит марки КУ-2). Они представляют собой сильно кислотные катиониты, получаемые совместной полимеризацией стирола и дивинилбензола и содержат активные группы - S03H. Разделение осуществляют большей частью методом элю - ентной хроматографии.
Сродство ионов лантаноидов к смоле убывает от La3+ к Lu3+, т. е. в порядке уменьшения размера гидра тированных ионов. Однако сродство к смоле ионов РЗЭ очень близко, что не обеспечивает достаточно эффективного разделения. Лучшее разделение достигается при использовании элюирую - щих растворов, содержащих органические соединения, образующие с ионами РЗЭ комплексы различной устойчивости.
Вымывание происходит в последовательности, соответствующей прочности анионных комплексов лантаноидов. По мере движения вымывающего раствора вдоль колонки (или ряда последовательно соединенных колонок) смесь катионов разделяется на отдельные сорбционные зоны (полосы), перемещающиеся с определенной скоростью к выходу колонки. Для вымывания применяют различные органические соединения, образующие комплексы с лантаноидами: лимонную кислоту, нит- рилотриуксусную кислоту (НТА) и этилендиаминтетрауксусную кислоту (ЭДТА). Последнюю наиболее широко применяют при хроматографическом разделении РЗЭ. ЭДТА относится к классу а-аминокислот. Она представляет собой четырехосновную кислоту с двумя атомами азота:
НООС - СНА /CHj - соон
N - CHj - СН2 - N НООС - сн/ ЧСНг - СООН.
Сокращенно формулу ЭДТА обозначают H4V. Двунатриевая соль этой кислоты имеет техническое название "трилон-Б".
С трехзарядными ионами лантаноидов ЭДТА образует внут - рикомплексные соединения (хелаты), в которых атомы азота связаны с ионом лантаноида координационными связями
СН2СООН N — СН2СОО -
N — СН2СОО - СН2СОО-
Константу устойчивости этих комплексных соединений определяют из уравнения:
Ln3+ + HV3- z± H(Lnv); (11.9)
[Ln 3 + ] • [HV3-] Как видно из рис. 84, константы устойчивости у комплексов лантаноидов с ЭДТА увеличиваются от лантана к лютецию, т. е. с возрастанием порядкового номера элемента. Константы устойчивости комплексов двух соседних РЗЭ отличаются одна от другой в среднем в 2,4 раза. Это обусловливает большую избирательность действия этилендиаминтет - рауксусной кислоты при ее применении для элюирования катионов РЗЭ со смолы.
РЗЭ разделяют в системе, состоящей из ряда последовательно соединенных колонок, заполненных смолой. Первые одна или две колонки служат для насыщения смолы катионами РЗЭ, последующие колонки - разделительные. В процессе элюирования в них образуются сорбционные полосы.
La Pr Pm Eu ТЬ Элементы
Рис.84. Зависимость констант устойчивости К комплексов РЗЭ с ЭДТА от порядкового номера элемента
Pmc.8S. Кривые вымывания тербия, европия и самария, сорбированных на смоле, 0,26 М раствором ЭДТА; рН = 3,62
В колонках для насыщения смолу сначала заряжают ионами NH+ (т. е. применяют смолу в NHj-форме). В разделительных колонках применяют смолу в Си2+-форме. Ионы Си2+ играют в этом случае роль иона-замедлителя, способствующего лучшему разделению. Ионы меди образуют с ЭДТА более прочные комплексы, чем большинство ионов лантаноидов (см. рис. 84). Поэтому при прохождении вымывающего раствора, содержащего комплексные ионы РЗЭ с ЭДТА, через разделительную колонку ионы меди переходят в раствор, вытесняя ионы РЗЭ из раствора в смолу и этим замедляя их продвижение. Это обеспечивает высокую концентрацию ионов РЗЭ в смоле.
Обычно работают с вымывающим раствором (элюатом), значение рН которого доводят до 3,5 - 8,5 (низкие рН при разделении легких РЗЭ, более высокие - для тяжелых РЗЭ) нейтрализацией гидроксидом аммония. Следовательно, элюант содержит аммонийную соль ЭДТА. Так как аммонийные соли комплексных кислот лантаноидов с ЭДТА и медные комплексы сравнительно малорастворимы, для элюации применяют растворы ЭДТА малой концентрации (5 - 10 г/л). При больших концентрациях выделяются соли, забивающие поры между зернами смолы, что приводит к нарушению нормальной работы. Малая концентрация ЭДТА в элюанте ограничивает производительность процесса разделения, так как в фильтрате, вытекающем из колонки, низкая концентрация РЗЭ.
На выходе из системы колонок фильтрат собирают отдельными фракциями. На рис. 85 показаны кривые вымывания раствором ЭДТА для случая разделения трех элементов. Первая волна соответствует выходу тербия, вторая - европия, третья - самария, что согласуется с убывающей прочностью комплексных соединений в ряду Tb - Eu - Sm.
Для регенерации ЭДТА растворы подкисляют до рН = 0,5 * 1. При этом комплексные соединения лантаноидов разрушаются и осаждается малорастворимая ЭДТА.
Если начальная удельная загрузка (отношение массы сорбированной на смоле смеси разделяемых ионов к общей массе смолы) небольшая (ниже 5 % массы смолы), а общая длина колонок для разделения достаточно велика, то выходящие из колонки фракции фильтрата содержат только один из разделяемых лантаноидов.
Общие схемы полного разделения
Применяют различные схемы полного разделения РЗЭ, в которых сочетаются описанные методы. В качестве примера на рис. 86 приведена схема разделения элементов дериевой группы. На разделение обычно поступает смесь гидроксидов, очищенная от примесей других элементов. Первоначально из смеси может быть выделен церий методом окисления. Затем производят разделение методом противоточной экстракции на три фракции: легкие РЗЭ (La, Се, Pr, Nd), средние РЗЭ (Pr, Nd, Sm, Eu) и фракцию, обогащенную гадолинием и элементами иттриевой группы (Nd, Sm, Eu, Gd+Yb). Из второй и третьей фракций можно выделить самарий и европий восстановлением амальгамой натрия и разделить их, как описано выше. Разделение элементов в каждой из выделенных фракций проводят, используя методы экстракции и ионообменной хроматографии.
При разделении элементов иттриевой подгруппы методом экстракции выделяют иттрий (например, используя экстракцию в хлоридно-роданидной системе) и две фракции: Gd, Tb, Dy, и Но, Er, Tu, Tb, Lu. Дальнейшее разделение ведут с
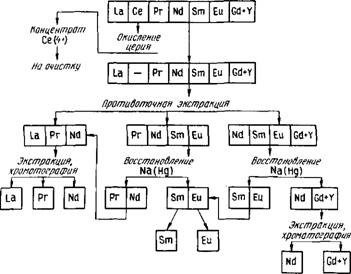
Ркс.86. Принципиальная схема разделения РЗЭ цериевой группы
Использованием экстракции (методы полного противотока или полупротивотока) и ионообменной хроматографии. Иттербий выделяют восстановлением из нитратных растворов амальгамой натрия.
Читайте также:
