Почему щелочные металлы не используют для реакции с растворами кислот и солей
Эти металлы — очень активные! Именно их кидают в ванны с водой, в результате чего происходят мощщные взрывы.
Щелочные металлы
IA группа называется главной подгруппой первой группы, в которую входят щелочные металлы: литий Li, натрий Na, калий K, рубидий Rb, цезий Cs и франций Fr.
Щелочные металлы — серебристо-белые металлы с высокой электро- и теплопроводностью, обладают ковкостью, пластичностью и металлическим блеском.
Главная особенность строения атомов химических элементов IA группы заключается в том, что они содержат один электрон на внешнем энергетическом уровне — их электронная конфигурация ns 1 .
Из этого следует, что атомам щелочных металлов энергетически выгодно отдать электрон и приобрести конфигурацию инертного газа, приобретая при этом степень окисления +1.
Основным способом получения таких металлов является электролиз расплавов солей.
Химические свойства
Их химические свойства крайне логичны:
- как типичные металлы они будут вступать в реакции со своими противоположностями — неметаллами;
- как восстановители — реагировать с окислителями (в том числе восстанавливать металлы и неметаллы из их оксидов);
- как металлы, стоящие в ряду активности до водорода — вступать в реакции вытеснения с водой, кислотами-неокислителями и солями менее активных металлов.
- Реакции с неметаллами
Как типичные восстановители, щелочные металлы могут взаимодействовать со своими противоположностями — неметаллами.
| Гидриды металлов подвергаются необратимому гидролизу |
В реакциях с щелочными металлами кислород образует ряд веществ:
- литий («кандидат от народа»), как и подавляющее большинство металлов, образует оксид;
4Li + O2 = 2Li2O - натрий образует пероксид;
2Na + O2 = Na2O2 - калий и все нижестоящие металлы — надпероксиды/супероксиды.
K + O2 = KO2
- Реакции с водой
В ряду активности щелочные металлы находятся до водорода, поэтому они способны вытеснять водород из воды:
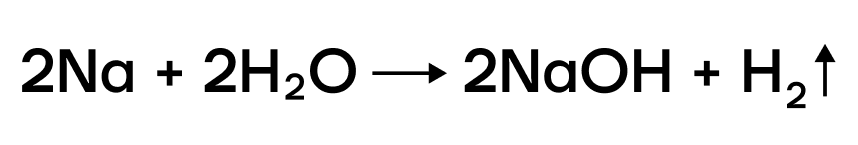
Можно представить воду как HOH, тогда металл (например, натрий) будет замещать один из атомов водорода с образованием NaOH.
За счет крайне низких значений электроотрицательности металлы очень слабо притягивают к себе электроны, а следовательно, у них «легко их украсть». Делаем вывод: в ОВР щелочные металлы проявляют ярко выраженные восстановительные свойства, повышая в реакциях степени окисления.
Оксиды щелочных металлов
По физическим свойствам это — бесцветные кристаллические вещества, хорошо растворимые в воде.
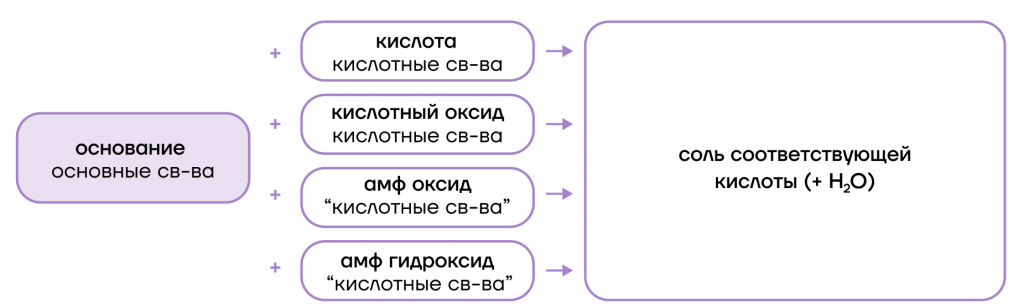
Они являются основными оксидами, поэтому:

- вступают в основно-кислотные взаимодействия со своими противоположностями, обладающими кислотными свойствами: кислотами, кислотными оксидами, амфотерными оксидами и гидроксидами:
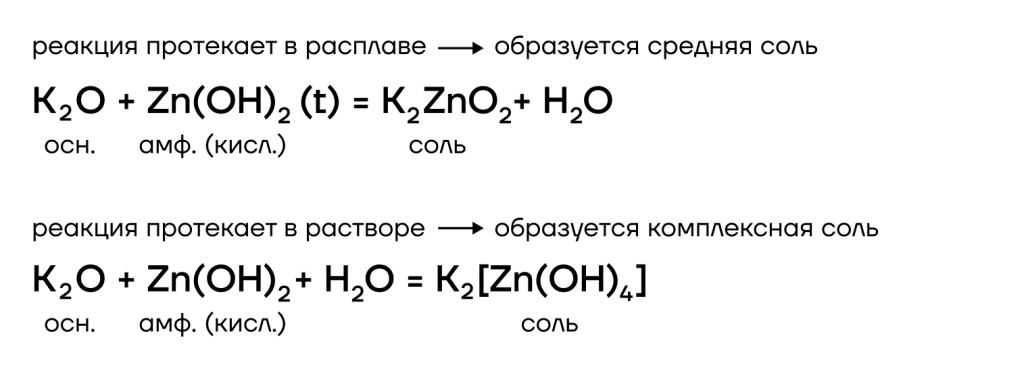
Гидроксиды щелочных металлов
Что же это такое? По-другому их называют щелочами. Они представляют собой бесцветные кристаллические вещества, хорошо растворимые в воде.
По химическим свойствам они являются типичными сильными основаниями, то есть:
- диссоциируют в растворах с образованием гидроксид-анионов. создавая в растворах щелочную среду:
- вступают в основно-кислотные взаимодействия со своими противоположностями (кислотами и кислотными оксидами + амфотерные оксиды и гидроксиды), образуя соли;
- вступают в реакции ионного обмена с кислотами и солями:
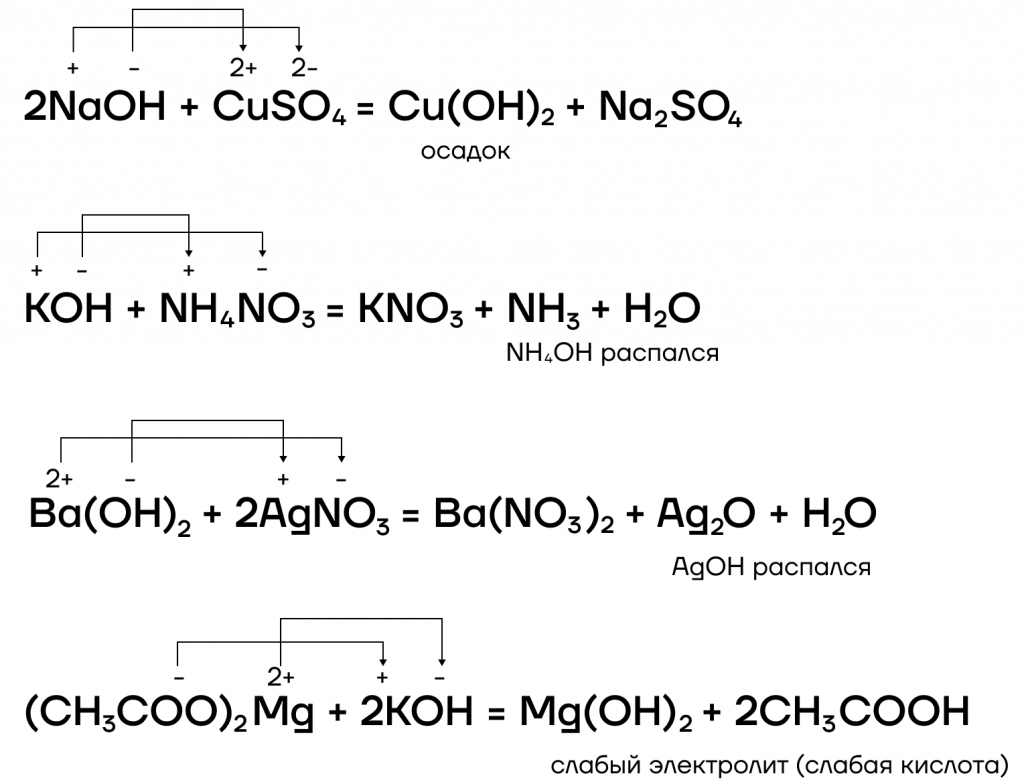
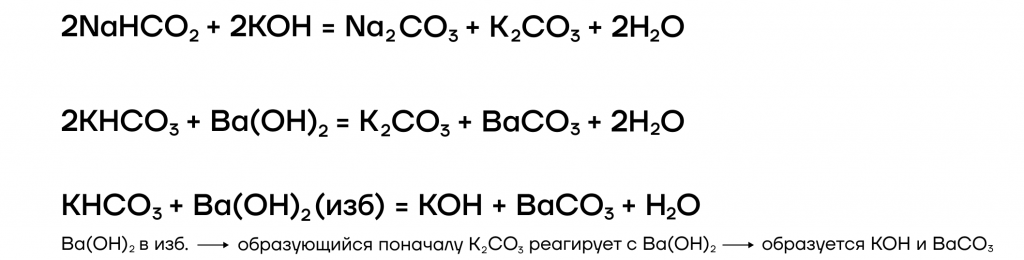
Какие же специфические свойства щелочей существуют? Рассмотрим некоторые из них:
- Окислительно-восстановительные реакции с металлами
Из металлов со щелочами напрямую взаимодействуют только амфотерные бериллий Be, цинк Zn, алюминий Al.
| Эти металлы можно запомнить по аббревиатуре BeZnAl |
А какие соли тогда будут образовываться? В растворе образуются комплексные соли, а в расплаве (t) — средние. В качестве еще одного продукта реакции выделяется газообразный водород.
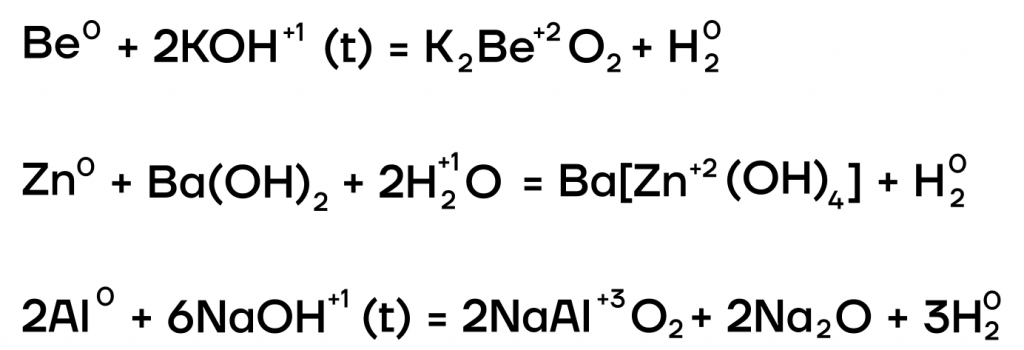
- Окислительно-восстановительные реакции с неметаллами
Неметаллы, которые могут реагировать со щелочами, можно запомнить по «крестообразному» расположению в таблице Менделеева:

Пероксиды щелочных металлов
Что же такое пероксиды? Пероксиды — сложные вещества, которые содержат группу —О—О—, где кислород имеет степень окисления −1.
Фактчек
- Металлы IA группы называются щелочными металлами, которые представлены литием, натрием, калием, рубидием, цезием и францием.
- Постоянная валентность щелочных металлов I, постоянная степень окисления — +1.
- Основной способ получения щелочных металлов — электролиз расплавов солей.
- Щелочные металлы — чрезвычайно активные металлы, могут реагировать с большим рядом простых веществ, с водой.
Проверь себя
Задание 1.
Какой из щелочных металлов имеет самое большое число электронов?
Задание 2.
Щелочные металлы имеют постоянную степень окисления:
Задание 3.
Щелочные металлы образуют с серой соединения, называемые:
- Сульфиты;
- Сульфиды;
- Сульфаты;
- Сульфонаты.
Задание 4.
При реакции калия с кислородом образуется:
- Оксид калия;
- Пероксид калия;
- Супероксид калия;
- Озонид калия
Задание 5.
При внесении солей натрия в пламя оно приобретает окраску:
- Фиолетовую;
- Желтую;
- Небесно-голубую;
- Малиновую
Ответы: 1. — 6; 2. — 1; 3. — 2; 4. — 3; 5. — 2.
Химические свойства и способы получения солей
Перед изучением этого раздела рекомендую прочитать следующую статью:
Соли – это сложные вещества, которые состоят из катионов металлов и анионов кислотных остатков.
Классификация солей

Получение солей
1. Соли можно получить взаимодействием кислотных оксидов с основными.
кислотный оксид + основный оксид = соль
Например , оксид серы (VI) реагирует с оксидом натрия с образованием сульфата натрия:
2. Взаимодействие кислот с основаниями и амфотерными гидроксидами. При этом щелочи взаимодействуют с любыми кислотами: и сильными, и слабыми.
Щелочь + любая кислота = соль + вода
Например , гидроксид натрия реагирует с соляной кислотой:
HCl + NaOH → NaCl + H2O
При взаимодействии щелочей с избытком многоосновной кислоты образуются кислые соли.
Например , гидроксид калия взаимодействует с избытком фосфорной кислоты с образованием гидрофосфата калия или дигидрофосфата калия:
Нерастворимые основания реагируют только с растворимыми кислотами.
Нерастворимое основание + растворимая кислота = соль + вода
Например , гидроксид меди (II) реагирует с серной кислотой:
Все амфотерные гидроксиды — нерастворимые. Следовательно, они ведут себя как нерастворимые основания при взаимодействии с кислотами:
Амфотерный гидроксид + растворимая кислота = соль + вода
Например , гидроксид цинка (II) реагирует с соляной кислотой:
Также соли образуются при взаимодействии аммиака с кислотами (аммиак проявляет основные свойства).
Аммиак + кислота = соль
Например , аммиак реагирует с соляной кислотой:


3. Взаимодействие кислот с основными оксидами и амфотерными оксидами. При этом растворимые кислоты взаимодействуют с любыми основными оксидами.
Растворимая кислота + основный оксид = соль + вода
Растворимая кислота + амфотерный оксид = соль + вода
Например , соляная кислота реагирует с оксидом меди (II):
2HCl + CuO → CuCl2 + H2O

4. Взаимодействие оснований с кислотными оксидами. Сильные основания взаимодействуют с любыми кислотными оксидами.
Щёлочь + кислотный оксид → соль + вода
Например , гидроксид натрия взаимодействует с углекислым газом с образованием карбоната натрия:
При взаимодействии щелочей с избытком кислотных оксидов, которым соответствуют многоосноосновные кислоты, образуются кислые соли.
Например , при взаимодействии гидроксида натрия с избытком углекислого газа образуется гидрокарбонат натрия:
NaOH + CO2 → NaHCO3
Нерастворимые основания взаимодействуют только с кислотными оксидами сильных кислот.
Например , гидроксид меди (II) взаимодействует с оксидом серы (VI), но не вступает в реакцию с углекислым газом:


5. Соли образуются при взаимодействии кислот с солями. Нерастворимые соли взаимодействуют только с более сильными кислотами (более сильная кислота вытесняет менее сильную кислоту из соли). Растворимые соли взаимодействуют с растворимыми кислотами, если в продуктах реакции есть осадок, газ или вода или слабый электролит.
Например: карбонат кальция CaCO3 (нерастворимая соль угольной кислоты) может реагировать с более сильной серной кислотой.
Силикат натрия (растворимая соль кремниевой кислоты) взаимодействует с соляной кислотой, т.к. в ходе реакции образуется нерастворимая кремниевая кислота:

6. Соли можно получить окислением оксидов, других солей, металлов и неметаллов (в щелочной среде) в водном растворе кислородом или другими окислителями.
Например , кислород окисляет сульфит натрия до сульфата натрия:
7. Еще один способ получения солей — взаимодействие металлов с неметаллами . Таким способом можно получить только соли бескислородных кислот.
Например , сера взаимодействует с кальцием с образованием сульфида кальция:
Ca + S → CaS
8. Соли образуются при растворении металлов в кислотах . Минеральные кислоты и кислоты-окислители (азотная кислота, серная концентрированная кислота) реагируют с металлами по-разному.
Кислоты-окислители реагируют с металлами с образованием продуктов восстановления азота и серы. Водород в таких реакциях не выделяется!
Минеральные кислоты реагируют по схеме:
металл + кислота → соль + водород
При этом с кислотами реагируют только металлы, расположенные в ряду активности левее водорода. А образуется соль металла с минимальной степенью окисления.
Например , железо растворяется в соляной кислоте с образованием хлорида железа (II):
Fe + 2HCl → FeCl2 + H2

9. Соли образуются при взаимодействии щелочей с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
! Обратите внимание! С щелочами в растворе реагируют только те металлы, у которых оксид с минимальной положительной степенью окисления металла амфотерный!
Например , железо не реагирует с раствором щёлочи, оксид железа (II) — основный. А алюминий растворяется в водном растворе щелочи, оксид алюминия — амфотерный:
2Al + 2NaOH + 6 H2 + O = 2Na[ Al +3 (OH)4] + 3 H2 0
10. Соли образуются при взаимодействии щелочей с неметаллами. При этом протекают окислительно-восстановительные реакции. Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
NaOH +О2 ≠
NaOH +N2 ≠
NaOH +C ≠
Сера, хлор, бром, йод, фосфор и другие неметаллы диспропорционируют в щелочах (т.е. самоокисляются-самовосстанавливаются).
Например , хлор при взаимодействии с холодной щелочью переходит в степени окисления -1 и +1:
2NaOH + Cl2 0 = NaCl — + NaOCl + + H2O
Хлор при взаимодействии с горячей щелочью переходит в степени окисления -1 и +5:
6NaOH + Cl2 0 = 5NaCl — + NaCl +5 O3 + 3H2O
Кремний окисляется щелочами до степени окисления +4.
Например , в растворе:
2NaOH + Si 0 + H2 + O= Na2Si +4 O3 + 2H2 0
Фтор окисляет щёлочи:
2F2 0 + 4NaO -2 H = O2 0 + 4NaF — + 2H2O
Более подробно про эти реакции можно прочитать в статье Окислительно-восстановительные реакции.
11. Соли образуются при взаимодействии солей с неметалами. При этом протекают окислительно-восстановительные реакции. Один из примеров таких реакций — взаимодействие галогенидов металлов с другими галогенами. При этом более активный галоген вытесняет менее активный из соли.
Например , хлор взаимодействует с бромидом калия:
2KBr + Cl2 = 2KCl + Br2
Но не реагирует с фторидом калия:
KF +Cl2 ≠
Химические свойства солей
1. В водных растворах соли диссоциируют на катионы металлов Ме + и анионы кислотных остатков. При этом растворимые соли диссоциируют почти полностью, а нерастворимые соли практически не диссоциируют, либо диссоциируют только частично.
Например , хлорид кальция диссоциирует почти полностью:
CaCl2 → Ca 2+ + 2Cl –
Кислые и основные соли диссоциируют cтупенчато. При диссоциации кислых солей сначала разрываются ионные связи металла с кислотными остатком, затем диссоциирует кислотный остаток кислой соли на катионы водорода и анион кислотного остатка.
Например , гидрокарбонат натрия диссоциирует в две ступени:
NaHCO3 → Na + + HCO3 –
HCO3 – → H + + CO3 2–
Основные соли также диссоциируют ступенчато.
Например , гидроксокарбонат меди (II) диссоциирует в две ступени:
CuOH + → Cu 2+ + OH –
Двойные соли диссоциируют в одну ступень.
Например , сульфат алюминия-калия диссоциирует в одну ступень:
Смешанные соли диссоциируют также одноступенчато.
Например , хлорид-гипохлорит кальция диссоциирует в одну ступень:
CaCl(OCl) → Ca 2+ + Cl — + ClO –
Комплексные соли диссоциируют на комплексный ион и ионы внешней сферы.
Например , тетрагидроксоалюминат калия распадается на ионы калия и тетрагидроксоалюминат-ион:

2. Соли взаимодействуют с кислотными и амфотерными оксидами . При этом менее летучие оксиды вытесняют более летучие при сплавлении.
соль1 + амфотерный оксид = соль2 + кислотный оксид
соль1 + твердый кислотный оксид = соль2 + кислотный оксид
соль + основный оксид ≠
Например , карбонат калия взаимодействует с оксидом кремния (IV) с образованием силиката калия и углекислого газа:
Карбонат калия также взаимодействует с оксидом алюминия с образованием алюмината калия и углекислого газа:
3. Соли взаимодействуют с кислотами. Закономерности взаимодействия кислот с солями уже рассмотрены в данной статье в разделе «Получение солей».
4. Растворимые соли взаимодействуют с щелочами. Реакция возможна, только если образуется газ, осадок, вода или слабый электролит, поэтому с щелочами взаимодействуют, как правило, соли тяжелых металлов или соли аммония.
Растворимая соль + щелочь = соль2 + основание
Например , сульфат меди (II) взаимодействует с гидроксидом калия, т.к. образуется осадок гидроксида меди (II):
Хлорид аммония взаимодействует с гидроксидом натрия:
Кислые соли взаимодействуют с щелочами с образованием средних солей.
Кислая соль + щелочь = средняя соль + вода
Например , гидрокарбонат калия взаимодействует с гидроксидом калия:

5. Растворимые соли взаимодействуют с солями. Реакция возможна, только если обе соли растворимые, и в результате реакции образуется осадок.
Растворимая соль1 + растворимая соль2 = соль3 + соль4
Растворимая соль + нерастворимая соль ≠
Например , сульфат меди (II) взаимодействует с хлоридом бария, т.к. образуется осадок сульфата бария:
Некоторые кислые соли взаимодействуют с кислыми солями более слабых кислот. При этом более сильные кислоты вытесняют более слабые:
Кислая соль1 + кислая соль2 = соль3 + кислота
Например , гидрокарбонат калия взаимодействует с гидросульфатом калия:
Некоторые кислые соли могут реагировать со своими средними солями.
Например , фосфат калия взаимодействует с дигидрофосфатом калия с образованием гидрофосфата калия:

6. C оли взаимодействуют с металлами. Более активные металлы (расположенные левее в ряду активности металлов) вытесняют из солей менее активные.
Например , железо вытесняет медь из раствора сульфата меди (II):
CuSO4 + Fe = FeSO4 + Cu
А вот серебро вытеснить медь не сможет:
CuSO4 + Ag ≠
Обратите внимание! Если реакция протекает в растворе, то добавляемый металл не должен реагировать с водой в растворе. Если мы добавляем в раствор соли щелочной или щелочноземельный металл, то этот металл будет реагировать преимущественно с водой, а с солью будет реагировать незначительно.
Например , при добавлении натрия в раствор хлорида цинка натрий будет взаимодействовать с водой:
2H2O + 2Na = 2NaOH + H2
Образующийся гидроксид натрия, конечно, будет реагировать с хлоридом цинка:
ZnCl2 + 2NaOH = 2NaCl + Zn(OH)2
Но сам-то натрий с хлоридом цинка, таким образом, взаимодействовать напрямую не будет!
ZnCl2(р-р) + Na ≠
А вот в расплаве эта реакция при определенных условиях уже может протекать, так как в расплаве никакой воды нет.
ZnCl2(р-в) + 2Na = 2NaCl + Zn
И еще один нюанс. Чтобы получить расплав, соль необходимо нагреть. Но многие соли при нагревании разлагаются. И реагировать с металлом, естественно, при этом не могут. Таким образом, реагировать с металлами в расплаве могут только те соли, которые не разлагаются при нагревании. А разлагаются при нагревании почти все нитраты, нерастворимые карбонаты и некоторые другие соли.
Например , нитрат меди (II) в расплаве не реагирует с железом, так как при нагревании нитрат меди разлагается:
Образующийся оксид меди, конечно, будет реагировать с железом:
CuO + Fe = FeO + Cu
Но сам-то нитрат меди, получается, с железом реагировать напрямую не будет!

При добавлении меди (Cu) в раствор соли менее активного металла – серебра (AgNO3) произойдет химическая реакция:
2AgNO3 + Cu = Cu(NO3)2 + 2Ag
При добавлении железа (Fe) в раствор соли меди (CuSO4) на железном гвозде появился розовый налет металлической меди:
При добавлении цинка в раствор нитрата свинца (II) на цинке образуется слой металлического свинца:
7. Некоторые соли при нагревании разлагаются .
Соли, в составе которых есть сильные окислители, разлагаются с окислительно-восстановительной реакцией. К таким солям относятся:
NH4NO3 → N2O + 2H2O
NH4NO2 → N2 + 2H2O
(NH4)2Cr2O7 → N2 + 4H2O + Cr2O3
2AgNO3 → 2Ag +2NO2 + O2
2AgCl → 2Ag + Cl2
Некоторые соли разлагаются без изменения степени окисления элементов. К ним относятся:
MgСO3 → MgO + СО2
2NaНСО3 → Na2СО3 + СО2 + Н2О
- Карбонат, сульфат, сульфит, сульфид, хлорид, фосфат аммония:
NH4Cl → NH3 + HCl
(NH4)2CO3 → 2NH3 + CO2 + H2O
(NH4)2SO4 → NH4HSO4 + NH3

7. Соли проявляют восстановительные свойства . Как правило, восстановительные свойства проявляют либо соли, содержащие неметаллы с низшей степенью окисления, либо соли, содержащие неметаллы или металлы с промежуточной степенью окисления.
Например , йодид калия окисляется хлоридом меди (II):
4KI — + 2Cu +2 Cl2 → 4KCl + 2Cu + l + I2 0

8. Соли проявляют и окислительные свойства . Как правило, окислительные свойства проявляют соли, содержащие атомы металлов или неметаллов с высшей или промежуточной степенью окисления. Окислительные свойства некоторых солей рассмотрены в статье Окислительно-восстановительные реакции.
Основания. Химические свойства и способы получения

Основания – сложные вещества, которые состоят из катиона металла Ме + (или металлоподобного катиона, например, иона аммония NH4 + ) и гидроксид-аниона ОН — .
По растворимости в воде основания делят на растворимые (щелочи) и нерастворимые основания . Также есть неустойчивые основания, которые самопроизвольно разлагаются.

Получение оснований
1. Взаимодействие основных оксидов с водой. При этом с водой реагируют в обычных условиях только те оксиды, которым соответствует растворимое основание (щелочь). Т.е. таким способом можно получить только щёлочи:
основный оксид + вода = основание
Например , оксид натрия в воде образует гидроксид натрия (едкий натр):
Na2O + H2O → 2NaOH
При этом оксид меди (II) с водой не реагирует:
CuO + H2O ≠
2. Взаимодействие металлов с водой. При этом с водой реагируют в обычных условиях только щелочные металлы (литий, натрий, калий. рубидий, цезий) , кальций, стронций и барий. При этом протекает окислительно-восстановительная реакция, окислителем выступает водород, восстановителем является металл.
металл + вода = щёлочь + водород
Например , калий реагирует с водой очень бурно:
2K 0 + 2 H2 + O → 2 K + OH + H2 0


3. Электролиз растворов некоторых солей щелочных металлов . Как правило, для получения щелочей электролизу подвергают растворы солей, образованных щелочными или щелочноземельными металлами и бескилородными кислотами (кроме плавиковой) – хлоридами, бромидами, сульфидами и др. Более подробно этот вопрос рассмотрен в статье Электролиз.
Например , электролиз хлорида натрия:
2NaCl + 2H2O → 2NaOH + H2↑ + Cl2↑
4. Основания образуются при взаимодействии других щелочей с солями. При этом взаимодействуют только растворимые вещества, а в продуктах должна образоваться нерастворимая соль, либо нерастворимое основание:
щелочь + соль1 = соль2↓ + щелочь
Например: карбонат калия реагирует в растворе с гидроксидом кальция:
Например: хлорид меди (II) взаимодействет в растворе с гидроксидом натрия. При этом выпадает голубой осадок гидроксида меди (II):
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl

Химические свойства нерастворимых оснований
1. Нерастворимые основания взаимодействуют с сильными кислотами и их оксидами (и некоторыми средними кислотами). При этом образуются соль и вода.
нерастворимое основание + кислота = соль + вода
нерастворимое основание + кислотный оксид = соль + вода
Например , гидроксид меди (II) взаимодействует с сильной соляной кислотой:
При этом гидроксид меди (II) не взаимодействует с кислотным оксидом слабой угольной кислоты – углекислым газом:
2. Нерастворимые основания разлагаются при нагревании на оксид и воду.
Например , гидроксид железа (III) разлагается на оксид железа (III) и воду при прокаливании:
3. Нерастворимые основания не взаимодействуют с амфотерными оксидами и гидроксидами.
нерастворимое оснвоание + амфотерный оксид ≠
нерастворимое основание + амфотерный гидроксид ≠
4. Некоторые нерастворимые основания могут выступать в качестве восстановителей. Восстановителями являются основания, образованные металлами с минимальной или промежуточной степенью окисления, которые могут повысить свою степень окисления (гидроксид железа (II), гидроксид хрома (II) и др.).
Например , гидроксид железа (II) можно окислить кислородом воздуха в присутствии воды до гидроксида железа (III):
4 Fe +2 (OH)2 + O2 0 + 2H2O → 4 Fe +3 ( O -2 H)3
Химические свойства щелочей
1. Щёлочи взаимодействуют с любыми кислотами – и сильными, и слабыми . При этом образуются средняя соль и вода. Эти реакции называются реакциями нейтрализации . Возможно и образование кислой соли, если кислота многоосновная, при определенном соотношении реагентов, либо в избытке кислоты. В избытке щёлочи образуется средняя соль и вода:
щёлочь(избыток)+ кислота = средняя соль + вода
щёлочь + многоосновная кислота(избыток) = кислая соль + вода
Например , гидроксид натрия при взаимодействии с трёхосновной фосфорной кислотой может образовывать 3 типа солей: дигидрофосфаты, фосфаты или гидрофосфаты.
При этом дигидрофосфаты образуются в избытке кислоты, либо при мольном соотношении (соотношении количеств веществ) реагентов 1:1.
При мольном соотношении количества щелочи и кислоты 2:1 образуются гидрофосфаты:
В избытке щелочи, либо при мольном соотношении количества щелочи и кислоты 3:1 образуется фосфат щелочного металла.


2. Щёлочи взаимодействуют с амфотерными оксидами и гидроксидами. При этом в расплаве образуются обычные соли , а в растворе – комплексные соли .
щёлочь (расплав) + амфотерный оксид = средняя соль + вода
щёлочь (расплав) + амфотерный гидроксид = средняя соль + вода
щёлочь (раствор) + амфотерный оксид = комплексная соль
щёлочь (раствор) + амфотерный гидроксид = комплексная соль
Например , при взаимодействии гидроксида алюминия с гидроксидом натрия в расплаве образуется алюминат натрия. Более кислотный гидроксид образует кислотный остаток:
А в растворе образуется комплексная соль:
Обратите внимание, как составляется формула комплексной соли: сначала мы выбираем центральный атом (как правило, это металл из амфотерного гидроксида). Затем дописываем к нему лиганды — в нашем случае это гидроксид-ионы. Число лигандов, как правило, в 2 раза больше, чем степень окисления центрального атома. Но комплекс алюминия — исключение, у него число лигандов чаще всего равно 4. Заключаем полученный фрагмент в квадртаные скобки — это комплексный ион. Определяем его заряд и снаружи дописываем нужное количество катионов или анионов.

3. Щёлочи взаимодействуют с кислотными оксидами. При этом возможно образование кислой или средней соли, в зависимости от мольного соотношения щёлочи и кислотного оксида. В избытке щёлочи образуется средняя соль, а в избытке кислотного оксида образуется кислая соль:
щёлочь(избыток) + кислотный оксид = средняя соль + вода
щёлочь + кислотный оксид(избыток) = кислая соль
Например , при взаимодействии избытка гидроксида натрия с углекислым газом образуется карбонат натрия и вода:
А при взаимодействии избытка углекислого газа с гидроксидом натрия образуется только гидрокарбонат натрия:
2NaOH + CO2 = NaHCO3
4. Щёлочи взаимодействуют с солями. Щёлочи реагируют только с растворимыми солями в растворе , при условии, что в продуктах образуется газ или осадок . Такие реакции протекают по механизму ионного обмена.
щёлочь + растворимая соль = соль + соответствующий гидроксид
Щёлочи взаимодействуют с растворами солей металлов, которым соответствуют нерастворимые или неустойчивые гидроксиды.
Cu 2+ SO4 2- + 2Na + OH — = Cu 2+ (OH)2 — ↓ + Na2 + SO4 2-
Также щёлочи взаимодействуют с растворами солей аммония.
Например , гидроксид калия взаимодействует с раствором нитрата аммония:
! При взаимодействии солей амфотерных металлов с избытком щёлочи образуется комплексная соль !
Давайте рассмотрим этот вопрос подробнее. Если соль, образованная металлом, которому соответствует амфотерный гидроксид , взаимодействует с небольшим количеством щёлочи, то протекает обычная обменная реакция, и в осадок выпадает гидроксид этого металла .
Например , избыток сульфата цинка реагирует в растворе с гидроксидом калия:
Однако, в данной реакции образуется не основание, а амфотерный гидроксид. А, как мы уже указывали выше, амфотерные гидроксиды растворяются в избытке щелочей с образованием комплексных солей . Т аким образом, при взаимодействии сульфата цинка с избытком раствора щёлочи образуется комплексная соль, осадок не выпадает:
Таким образом, получаем 2 схемы взаимодействия солей металлов, которым соответствуют амфотерные гидроксиды, с щелочами:
соль амф.металла(избыток) + щёлочь = амфотерный гидроксид↓ + соль
соль амф.металла + щёлочь(избыток) = комплексная соль + соль
5. Щёлочи взаимодействуют с кислыми солями. При этом образуются средние соли, либо менее кислые соли.
кислая соль + щёлочь = средняя соль + вода
Например , гидросульфит калия реагирует с гидроксидом калия с образованием сульфита калия и воды:
Свойства кислых солей очень удобно определять, разбивая мысленно кислую соль на 2 вещества — кислоту и соль. Например, гидрокарбонта натрия NaHCO3 мы разбиваем на уольную кислоту H2CO3 и карбонат натрия Na2CO3. Свойства гидрокарбоната в значительной степени определяются свойствами угольной кислоты и свойствами карбоната натрия.
6. Щёлочи взаимодействуют с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
7. Щёлочи взаимодействуют с неметалами. При этом протекают окислительно-восстановительные реакции. Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
2NaOH +Cl2 0 = NaCl — + NaOCl + + H2O
6NaOH +Cl2 0 = 5NaCl — + NaCl +5 O3 + 3H2O
Щелочные металлы. Химия щелочных металлов и их соединений

Щелочные металлы расположены в главной подгруппе первой группы периодической системы химических элементов Д.И. Менделеева (или просто в 1 группе в длиннопериодной форме ПСХЭ). Это литий Li, натрий Na, калий K, цезий Cs, рубидий Rb и франций Fr.
Электронное строение щелочных металлов и основные свойства
Электронная конфигурация внешнего энергетического уровня щелочных металлов: ns 1 , на внешнем энергетическом уровне находится 1 s-электрон. Следовательно, типичная степень окисления щелочных металлов в соединениях +1.
Рассмотрим некоторые закономерности изменения свойств щелочных металлов.
В ряду Li-Na-K-Rb-Cs-Fr, в соответствии с Периодическим законом, увеличивается атомный радиус , усиливаются металлические свойства , ослабевают неметаллические свойства , уменьшается электроотрица-тельность .

Физические свойства
Все щелочные металлы — вещества мягкие, серебристого цвета. Свежесрезанная поверхность их обладает характерным блеском.

Кристаллическая решетка щелочных металлов в твёрдом состоянии — металлическая. Следовательно, щелочные металлы обладают высокой тепло- и электропроводимостью. Кипят и плавятся при низких температурах. Они имеют также небольшую плотность.

Нахождение в природе
Как правило, щелочные металлы в природе присутствуют в виде минеральных солей: хлоридов, бромидов, йодидов, карбонатов, нитратов и др. Основные минералы , в которых присутствуют щелочные металлы:
Поваренная соль, каменная соль, галит — NaCl — хлорид натрия

Сильвин KCl — хлорид калия

Сильвинит NaCl · KCl

Глауберова соль Na2SO4⋅10Н2О – декагидрат сульфата натрия

Едкое кали KOH — гидроксид калия
Поташ K2CO3 – карбонат калия
Поллуцит — алюмосиликат сложного состава с высоким содержанием цезия:

Способы получения
Литий получают в промышленности электролизом расплава хлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
2LiCl = 2Li + Cl2
Натрий получают электролизом расплава хлорида натрия с добавками хлорида кальция:
2NaCl (расплав) → 2Na + Cl2
Электролитом обычно служит смесь NaCl с NaF и КСl (что позволяет проводить процесс при 610–650°С).
Калий получают также электролизом расплавов солей или расплава гидроксида калия. Также распространены методы термохимического восстановления: восстановление калия из расплавов хлоридов или гидроксидов. В качестве восстановителей используют пары натрия, карбид кальция, алюминий, кремний:
KCl + Na = K↑ + NaCl
KOH + Na = K↑ + NaOH
Цезий можно получить нагреванием смеси хлорида цезия и специально подготовленного кальция:
Са + 2CsCl → 2Cs + CaCl2
В промышленности используют преимущественно физико-химические методы выделения чистого цезия: многократную ректификацию в вакууме.
Качественные реакции
Качественная реакция на щелочные металлы — окрашивание пламени солями щелочных металлов .

Цвет пламени:
Li — карминно-красный
Na — жѐлтый
K — фиолетовый
Rb — буро-красный
Cs — фиолетово-красный
Химические свойства
1. Щелочные металлы — сильные восстановители . Поэтому они реагируют почти со всеми неметаллами .
1.1. Щелочные металлы легко реагируют с галогенами с образованием галогенидов:
2K + I2 = 2KI
1.2. Щелочные металлы реагируют с серой с образованием сульфидов:
2Na + S = Na2S
1.3. Щелочные металлы активно реагируют с фосфором и водородом (очень активно). При этом образуются бинарные соединения — фосфиды и гидриды:
3K + P = K3P
2Na + H2 = 2NaH
1.4. С азотом литий реагирует при комнатной температуре с образованием нитрида:
Остальные щелочные металлы реагируют с азотом при нагревании.
1.5. Щелочные металлы реагируют с углеродом с образованием карбидов, преимущественно ацетиленидов:
1.6. При взаимодействии с кислородом каждый щелочной металл проявляет свою индивидуальность: при горении на воздухе литий образует оксид, натрий – преимущественно пероксид, калий и остальные металлы – надпероксид.
Цезий самовозгорается на воздухе, поэтому его хранят в запаянных ампулах. Видеоопыт самовозгорания цезия на воздухе можно посмотреть здесь.
2. Щелочные металлы активно взаимодействуют со сложными веществами:
2.1. Щелочные металлы бурно (со взрывом) реагируют с водой . Взаимодействие щелочных металлов с водой приводит к образованию щелочи и водорода. Литий реагирует бурно, но без взрыва.
2K 0 + H2 + O = 2 K + OH + H2 0
Видеоопыт: взаимодействие щелочных металлов с водой можно посмотреть здесь.
2.2. Щелочные металлы взаимодействуют с минеральными кислотами (с соляной, фосфорной и разбавленной серной кислотой) со взрывом. При этом образуются соль и водород.
Например , натрий бурно реагирует с соляной кислотой :
2Na + 2HCl = 2NaCl + H2↑
2.3. При взаимодействии щелочных металлов с концентрированной серной кислотой выделяется сероводород.
Например , при взаимодействии натрия с концентрированной серной кислотой образуется сульфат натрия, сероводород и вода:
2.4. Щелочные металлы реагируют с азотной кислотой. При взаимодействии с концентрированной азотной кислотой образуется оксид азота (I):
С разбавленной азотной кислотой образуется молекулярный азот:
При взаимодействии щелочных металлов с очень разбавленной азотной кислотой образуется нитрат аммония:
2.5. Щелочные металлы могут реагировать даже с веществами, которые проявляют очень слабые кислотные свойства . Например, с аммиаком, ацетиленом (и прочими терминальными алкинами), спиртами , фенолом и органическими кислотами .
Например , при взаимодействии лития с аммиаком образуются амиды и водород:
Ацетилен с натрием образует ацетиленид натрия и также водород:
Н ─ C ≡ С ─ Н + 2Na → Na ─ C≡C ─ Na + H2
Фенол с натрием реагирует с образованием фенолята натрия и водорода:
Метанол с натрием образуют метилат натрия и водород:
Уксусная кислота с литием образует ацетат лития и водород:
2СH3COOH + 2Li → 2CH3COOLi + H2↑
Щелочные металлы реагируют с галогеналканами (реакция Вюрца).
Например , хлорметан с натрием образует этан и хлорид натрия:
2.6. В расплаве щелочные металлы могут взаимодействовать с некоторыми солями . Обратите внимание! В растворе щелочные металлы будут взаимодействовать с водой, а не с солями других металлов.
Например , натрий взаимодействует в расплаве с хлоридом алюминия :
3Na + AlCl3 → 3NaCl + Al
Оксиды щелочных металлов
Оксиды щелочных металлов (кроме лития) можно получить только к освенными методами : взаимодействием натрия с окислителями в расплаве:
1. О ксид натрия можно получить взаимодействием натрия с нитратом натрия в расплаве:
2. Взаимодействием натрия с пероксидом натрия :
3. Взаимодействием натрия с расплавом щелочи :
2Na + 2NaOН → 2Na2O + Н2↑
4. Оксид лития можно получить разложением гидроксида лития :
2LiOН → Li2O + Н2O
Химические свойства
Оксиды щелочных металлов — типичные основные оксиды . Вступают в реакции с кислотными и амфотерными оксидами, кислотами, водой.
1. Оксиды щелочных металлов взаимодействуют с кислотными и амфотерными оксидами :
Например , оксид натрия взаимодействует с оксидом фосфора (V):
Оксид натрия взаимодействует с амфотерным оксидом алюминия:
2. Оксиды щелочных металлов взаимодействуют с кислотами с образованием средних и кислых солей (с многоосновными кислотами).
Например , оксид калия взаимодействует с соляной кислотой с образованием хлорида калия и воды:
K2O + 2HCl → 2KCl + H2O
3. Оксиды щелочных металлов активно взаимодействуют с водой с образованием щелочей.
Например , оксид лития взаимодействует с водой с образованием гидроксида лития:
Li2O + H2O → 2LiOH
4. Оксиды щелочных металлов окисляются кислородом (кроме оксида лития): оксид натрия — до пероксида, оксиды калия, рубидия и цезия – до надпероксида.
Пероксиды щелочных металлов
Свойства пероксидов очень похожи на свойства оксидов. Однако пероксиды щелочных металлов, в отличие от оксидов, содержат атомы кислорода со степенью окисления -1. Поэтому они могут могут проявлять как окислительные , так и восстановительные свойства.
1. Пероксиды щелочных металлов взаимодействуют с водой . При этом на холоде протекает обменная реакция, образуются щелочь и пероксид водорода:
При нагревании пероксиды диспропорционируют в воде, образуются щелочь и кислород:
2. Пероксиды диспропорционируют при взаимодействии с кислотными оксидами .
Например , пероксид натрия реагирует с углекислым газом с образованием карбоната натрия и кислорода:
3. При взаимодействии с минеральными кислотами на холоде пероксиды вступают в обменную реакцию. При этом образуются соль и перекись водорода:
При нагревании пероксиды, опять-таки, диспропорционируют:
4. Пероксиды щелочных металлов разлагаются при нагревании, с образованием оксида и кислорода:
5. При взаимодействии с восстановителями пероксиды проявляют окислительные свойства.
Например , пероксид натрия с угарным газом реагирует с образованием карбоната натрия:
Пероксид натрия с сернистым газом также вступает в ОВР с образованием сульфата натрия:
6. При взаимодействии с сильными окислителями пероксиды проявляют свойства восстановителей и окисляются, как правило, до молекулярного кислорода.
Например , при взаимодействии с подкисленным раствором перманганата калия пероксид натрия образует соль и молекулярный кислород:
Гидроксиды щелочных металлов (щелочи)
1. Щелочи получают электролизом растворов хлоридов щелочных метал-лов:
2NaCl + 2H2O → 2NaOH + H2 + Cl2
2. При взаимодействии щелочных металлов, их оксидов, пероксидов, гидридов и некоторых других бинарных соединений с водой также образуются щелочи.
Например , натрий, оксид натрия, гидрид натрия и пероксид натрия при растворении в воде образуют щелочи:
2Na + 2H2O → 2NaOH + H2
Na2O + H2O → 2NaOH
2NaH + 2H2O → 2NaOH + H2
3. Некоторые соли щелочных металлов (карбонаты, сульфаты и др.) при взаимодействии с гидроксидами кальция и бария также образуют щелочи.
Например , карбонат калия с гидроксидом кальция образует карбонат кальция и гидроксид калия:
1. Гидроксиды щелочных металлов реагируют со всеми кислотами (и сильными, и слабыми, и растворимыми, и нерастворимыми). При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Например , гидроксид калия с фосфорной кислотой реагирует с образованием фосфатов, гидрофосфатов или дигидрофосфатов:
2. Гидроксиды щелочных металлов реагируют с кислотными оксидами . При этом образуются средние или кислые соли, в зависимости от соотношения реагентов.
Например , гидроксид натрия с углекислым газом реагирует с образованием карбонатов или гидрокарбонатов:
Необычно ведет себя оксид азота (IV) при взаимодействии с щелочами. Дело в том, что этому оксиду соответствуют две кислоты — азотная (HNO3) и азотистая (HNO2). «Своей» одной кислоты у него нет. Поэтому при взаимодействии оксида азота (IV) с щелочами образуются две соли- нитрит и нитрат:
А вот в присутствии окислителя, например, молекулярного кислорода, образуется только одна соль — нитрат, т.к. азот +4 только повышает степень окисления:
3. Гидроксиды щелочных металлов реагируют с амфотерными оксидами и гидроксидами . При этом в расплаве образуются средние соли, а в растворе комплексные соли.
Например , гидроксид натрия с оксидом алюминия реагирует в расплаве с образованием алюминатов:
в растворе образуется комплексная соль — тетрагидроксоалюминат:
Еще пример : гидроксид натрия с гидроксидом алюминия в расплаве образут также комплексную соль:
4. Щелочи также взаимодействуют с кислыми солями. При этом образуются средние соли, или менее кислые соли.
Например : гидроксид калия реагирует с гидрокарбонатом калия с образованием карбоната калия:
5. Щелочи взаимодействуют с простыми веществами-неметаллами (кроме инертных газов, азота, кислорода, водорода и углерода).
При этом кремний окисляется щелочами до силиката и водорода:
Фтор окисляет щелочи. При этом выделяется молекулярный кислород:
Другие галогены, сера и фосфор — диспропорционируют в щелочах:
Сера взаимодействует с щелочами только при нагревании:
6. Щелочи взаимодействуют с амфотерными металлами , кроме железа и хрома . При этом в расплаве образуются соль и водород:
В растворе образуются комплексная соль и водород:
2NaOH + 2Al + 6Н2О = 2Na[Al(OH)4] + 3Н2
7. Гидроксиды щелочных металлов вступают в обменные реакции с растворимыми солями .
С щелочами взаимодействуют соли тяжелых металлов.
Например , хлорид меди (II) реагирует с гидроксидом натрия с образованием хлорида натрия и осадка гидроксида меди (II):
2NaOH + CuCl2 = Cu(OH)2↓+ 2NaCl
Также с щелочами взаимодействуют соли аммония.
Например , при взаимодействии хлорида аммония и гидроксида натрия образуются хлорид натрия, аммиак и вода:
NH4Cl + NaOH = NH3 + H2O + NaCl
8. Гидроксиды всех щелочных металлов плавятся без разложения , гидроксид лития разлагается при нагревании до температуры 600°С:
2LiOH → Li2O + H2O
9. Все гидроксиды щелочных металлов проявляют свойства сильных оснований . В воде практически нацело диссоциируют , образуя щелочную среду и меняя окраску индикаторов.
NaOH ↔ Na + + OH —
10. Гидроксиды щелочных металлов в расплаве подвергаются электролизу . При этом на катоде восстанавливаются сами металлы, а на аноде выделяется молекулярный кислород:
4NaOH → 4Na + O2 + 2H2O
Соли щелочных металлов
Нитраты и нитриты щелочных металлов
Нитраты щелочных металлов при нагревании разлагаются на нитриты и кислород. Исключение — нитрат лития. Он разлагается на оксид лития, оксид азота (IV) и кислород.
Например , нитрат натрия разлагается при нагревании на нитрит натрия и молекулярный кислород:
Нитраты щелочных металлов в реакциях могут выступать в качестве окислителей.
Нитриты щелочных металлов могут быть окислителями или восстановителями.
В щелочной среде нитраты и нитриты — очень мощные окислители.
Например , нитрат натрия с цинком в щелочной среде восстанавливается до аммиака:
Сильные окислители окисляют нитриты до нитратов.
Например , перманганат калия в кислой среде окисляет нитрит натрия до нитрата натрия:
Химические свойства щелочных металлов
При обычных условиях s-металлы находятся в кристаллическом состоянии. Все щелочные металлы легкие (обладают небольшой плотностью), очень мягкие (за исключением Li легко режутся ножом и могут быть раскатаны в фольгу), имеют низкие температуры кипения и плавления (с ростом заряда ядра атома щелочного металла происходит понижение температуры плавления).Щелочные металлы обладают высокой теплопроводностью и электропроводностью, что обусловлено наличием металлической связи и объемоцентрированной кристаллической решетки. Щелочные металлы хранят в запаянных ампулах под слоем керосина или вазелинового масла, поскольку они обладают высокой химической активностью.
Литий, натрий и калий легче воды и плавают на ее поверхности, реагируя с ней.
В свободном состоянии Li, Na, K и Rb – серебристо-белые металлы, Cs – металл золотисто-желтого цвета.
Щелочные металлы образуют соединения с преимущественно ионной связью. Оксиды щелочных металлов - твердые гигроскопичные вещества, легко взаимодействующие с водой. При этом образуются гидроксиды - твердые вещества, хорошо растворимые в воде. Соли щелочных металлов, как правило, тоже хорошо растворяются в воде.
Химические свойства щелочных металлов
Все щелочные металлы взаимодействуют:
- с водой образуя гидроксиды. Из-за высокой химической активности щелочных металлов протекание реакции взаимодействия с водой может сопровождаться взрывом. Наиболее спокойно с водой реагирует литий.
Уравнение реакции в общем виде:
Гидроксиды щелочных металлов разъедают стеклянную и фарфоровую посуду, их нельзя нагревать и в кварцевой посуде:
Гидроксиды натрия и калия не отщепляют воду
-взаимодействуют с кислородом воздуха образую ряд различных соединений – оксиды (Li), пероксиды (Na), надпероксиды (K, Rb, Cs):
-при нагревании реагируют с неметаллами (галогенами, азотом, серой, фосфором, водородом и др.).
- способны взаимодействовать со сложными веществами (растворы кислот, аммиак, соли). Так, при взаимодействии щелочных металлов с аммиаком происходит образование амидов:
- с солями, происходит по следующему принципу – вытесняют менее активные металлы (см. ряд активности металлов, выше) из их солей:
3Na + AlCl3 = 3NaCl + Al
- с кислотами неоднозначно, поскольку при протекании таких реакций металл первоначально будет реагировать с водой раствора кислоты, а образующаяся в результате этого взаимодействия щелочь будет реагировать с кислотой.
- с органическими веществами, такими, как спирты, фенолы, карбоновые кислоты:
| Название | Ат. № | Относит, ат. масса | Электронная формула | Радиус, пм | изотопы (%) | |
| Li | Литий Lithium [от греч. Lithos — камень] | 6,941 | 2s | Li+ 78, | 6Li (7,5) 7Li* (92,5) | |
| Na | Натрий Sodium [англ. Soda; лат. Natrium | 22,9898 | 3s | Na+ 98, | 23Na* (100) | |
| К | Калий Potassium [англ. Potash; лат. Kalium] | 39,0983 | 4s | K+ 133, | 39K* (93,26) 40К (0,012) 41 К* (6,73) | |
| Rb | Рубидий Rubidium [от лат. rubidius — глубокого красного цвета] | 37 | 85,4678 | 5s | Rb+ 1,49, | 185Rb* (72,17) 87Rb* (27,83) |
| Cs | Цезий Cesium [от лат. Caesius — небесно-голубой] | 55 | 132,905 | 6s | Cs+ 165, | 133Сз* (100) |
| Fr | Франций Francium [в честь Франции] | 7s | Fr+ 180 | 223Fr* (следы) |
Литий (Li) имеет среди всех металлов самую низкую плотность — 0,53 г/см3, с небольшой активностью реагирует с кислородом и водой. Является стратегическим металлом оборонной промышленности. Применяется в виде сплавов с Аl и Mg в производстве водородных бомб, в составе смазочных масел, эмалей, аккумуляторов, стекла; используется в медицине. Литий из щелочных металлов наиболее токсичен. Препарат Li2СO3 используют в медицине для лечения маниакально-депрессивного психоза. При длительном воздействии препарат нарушает функции почек и ЦНС. Поэтому повышенное содержание Li в крови и моче считают признаком нарушения функции почек.
Натрий (Na) — мягкий металл, серебристо-белого цвета, на срезе быстро окисляющийся. Бурно реагирует с водой. В больших количествах используется в промышленности, в частности, в теплообменниках ядерных реакторов; в составе NaCl широко применяется в пищевой и химической индустрии. Относится к жизненно необходимым элементам. В организме взрослого человека содержится около 100 г натрия, из них 30% — в костях. Неорганические соли натрия растворимы в воде с образованием соответствующих ионов. Некоторые соли натрия с органическими кислотами, например, соли мочевой и винной кислот (ураты и тартраты) растворимы слабо. Na+ является основным межклеточным катионом, регулирующим электролитный гомеостаз, деятельность натриевых насосов, перенос через биомембраны аминокислот, Сахаров, анионов разной природы; поддерживающим осмотическое давление и рН среды, перенос в крови СO2 (в виде бикарбоната), гидратацию белков, растворимость (солюбилизацию) органических кислот. Избыток натрия в пище вызывает перегрузку систем электролитного гомеостаза и обезвоживание тканей организма.
Калий (К) — мягкий металл белого цвета, активно реагирующий с кислородом и водой. Используется в производстве удобрений, в химической промышленности, для варки стекла. Относится к жизненно необходимым элементам. В организме взрослого человека содержится около 140 г калия, 98% — внутри клеток. К+ является важнейшим внутриклеточным катионом. Он необходим для поддержания нервно-мышечной возбудимости, внутриклеточного осмотического давления и рН, обеспечения сокращения мышц и проницаемости мембран клеток. Внеклеточный К+ стимулирует работу натриевого насоса. В натрий-калиевом насосе при некоторых физиологических процессах ионы К+ могут замещаться Rb+ и Cs+. Значительные количества последнего элемента могут появляться в организме после радиоактивного облучения.
По реакционной способности калий сходен с Na+. Na и К —2 основных металла, обеспечивающие электролитный гомеостаз. Оба элемента в живых организмах определяют осмотическое давление по обе стороны мембраны клеток и являются положительными противоионами для отрицательных анионов (Сl–, НРО42–, HCO3– и органических). В норме у человека соотношение ионов Na+/K+ в крови колеблется около значения 1,5. Снижение концентрации К+ в цельной крови и повышение в плазме связаны с нарушением проницаемости внешней мембраны клеток, обычно непроницаемой для К+, либо с нарушениями деятельности Na+/K+ - обменивающего насоса па внутренней мембране митохондрий. В нервных клетках такое нарушение работы этого насоса сопровождается нарушением мембранного потенциала нейронов и проведения по ним нервных импульсов. Изменения содержания ионов щелочных металлов отмечаются при многих неврологических заболеваниях. Однако К полезен лишь в умеренных дозах; его избыток в крови особенно часто наблюдается при заболеваниях почек. Длительное нарушение нормального соотношения Na+/K+ приводит к сердечнососудистым заболеваниям.
Рубидий (Kb) — примесный микроэлемент. В организме человека содержится около 0,3 мг рубидия, как правило, внутри клеток (аналогично К+). Может образовывать координационные соединения. Поскольку кинетика и механизм поглощения и участия в обмене сходны с К, изотоп 86Rb используют в исследованиях обмена К+. При дефиците К+ прием рубидия восстанавливает кислотно-щелочной баланс. Rb быстро выводится из организма через почки.
Цезий (Cs) — по биологическим свойствам сходен с К+. В организме человека может содержаться до 1,5 мг цезия. В медицине используют в качестве радиоактивной метки изотоп 137Cs (период полураспада t1/2 = 30 лет), а также стабильный изотоп 133Cs при магнитно-резонансной томографии. Считается нетоксичным.
Франций (Fr) — в природе встречается в ничтожных количествах в урановых рудах. Образуется в результате радиоактивного распада актиния (вместе с гелием). Из-за небольшого времени полураспада всех изотопов элемент изучен слабо. Должен быть токсичным из-за радиоактивности, хотя в организме человека не обнаружен.
IIК щелочноземельным металлам относятся металлы IIA группы Периодической системы Д.И. Менделеева – кальций (Ca), стронций (Sr), барий (Ba) и радий (Ra). Кроме них в главную подгруппу II группы входят бериллий (Be) и магний (Mg). На внешнем энергетическом уровне щелочноземельных металлов находится два валентных электрона. Электронная конфигурация внешнего энергетического уровня щелочноземельных металлов – ns 2 . Кроме Ве 1s2 2s2. В своих соединениях они проявляют единственную степень окисления равную +2. В ОВР являются восстановителями, т.е. отдают электрон. Все щелочноземельные металлы характеризуются наличием металлического типа химической связи, что обуславливает их высокую тепло- и электропроводность. Температуры кипения и плавления щелочноземельных металлов выше, чем щелочных металлов.
С увеличением заряда ядра атомов элементов, входящих в группу щелочноземельных металлов, энергия ионизации атомов уменьшается, а радиусы атомов и ионов увеличиваются, металлические признаки химических элементов усиливаются.
Бериллий (Be) — очень легкий, его сплав с медью сходен со сталью. В свободном состоянии Be – металл серо-стального цвета, обладающий плотной гексагональной кристаллической решеткой, достаточно твердый и хрупкий. На воздухе Be покрывается оксидной пленкой, что придает ему матовый оттенок и снижает его химическую активность.В эпоху нанотехнологии он необходим для атомной, электронной, электротехнической, авиационной и нефтегазовой промышленности. Be обладает некомпенсированным спином и высокой латентной токсичностью, хотя его атомная масса среди прочих металлов наименьшая. Он связан диагональным соотношением с Аl, и имеет с ним много общих свойств. Контакт с солями Be вызывает поражение кожи. Ион Ве2+ имеет малые размеры, но высокую плотность заряда. В организме он ингибирует фосфатазы, особенно щелочную, участвующую в процессах образования костей, а также ферменты, активируемые Mg2+ и К+, нарушает репликацию ДНК. Ионы Ве2+ образуют комплексы с тетраэдрическим расположением лигандов (КЧ = 4) с различной стереохимической конфигурацией.
Бериллий в природе находится в связанном состоянии. Важнейшие минералы бериллия: берилл- Be3 Al2 (SiO3 )6 , хризоберилл- Be(AlO2 )2 и фенакит- Be2 SiO4 .
Магний (Mg) в виде простого вещества представляет собой белый металл, который, также, как и Be, при нахождении на воздухе приобретает матовый оттенок за счет образующейся оксидной пленки. Mg мягче и пластичнее бериллия. Кристаллическая решетка Mg – гексагональная. Магний— по свойствам связан диагональным соотношением с Li. Абсолютно необходим для нормальной жизнедеятельности в виде иона Mg2+. Mg2+ необходим для нервно-мышечной передачи и мышечного сокращения. Наиболее часто недостаток магния (в норме содержащегося в плазме крови в концентрации 0,9 мМ) наблюдается при алкоголизме, сопровождаясь также накоплением Са2+. При избытке магния развиваются слабовыраженные токсические реакции. Прием больших количеств солей Mg2+ вызывает рвоту.
| Название | Ат. № | Относит, ат. масса | Электронная формула | Радиус, пм | Основные изотопы (%) |
| Be | Бериллий Beryllium [от греч. Beryllos — берилл] | 9,012 | 2s2 | Be2+ 34 | 9Be*(100) |
| Mg | Магний Magnesium [от Магнезия — полуостров в Греции] | 24,305 | 3s2 | Mg2+ 78 | 24Mg (78,99) 25Mg* (10) 26Mg (11,01) |
Химические свойства
-Получение Be осуществляют по реакции восстановления его фторида. Реакция протекает при нагревании:
Магний, кальций и стронций получают электролизом расплавов солей, чаще всего – хлоридов:
Причем, при получении Mg электролизом расплава дихлорида для понижения температуры плавления в реакционную смесь добавляют NaCl.
Для получения Mg в промышленности используют металло- и углетермические методы:
2(CaO×MgO) (доломит) + Si = Ca2SiO4 + Mg
- Взаимодействие с водой.
В обычных условиях поверхность Be и Mg покрыты инертной оксидной пленкой, поэтому они устойчивы по отношению к воде, но с горячей водой магний образует основание Mg(OH)2
Читайте также:
