Основные способы защиты металлов от коррозии
К данному виду коррозии относится атмосферная, подземная и морская. Атмосферная коррозия – это разрушение поверхности металлов во влажных средах при температуре окружающей среды. Атмосферная коррозия протекает, в основном, с кислородной деполяризацией. В условиях промышленной атмосферы (загрязненной CO2, SO2, NO2 HCl и др.) она может протекать и с водородной деполяризацией.
Коррозионное разрушение металлических конструкций в почвах и грунтах называют подземной коррозией. Ей подвержены различные трубопроводы, кабели, опоры и др. Почва и грунты представляют одну из наиболее сложных по химическому составу и структуре коррозионных сред. К характеристикам почв и грунта относятся влажность, пористость, кислотность, солевой состав и др. Поры занимают электролиты, содержащие минеральные соли и растворенные газы (O2, CO2, N2). Для подземной коррозии характерны язвенные и точечные разрушения. Пористые грунты агрессивнее глинистых, так как легко аэрируются и сохраняют влагу в течение длительного времени. Повышение влажности грунтов до 20 % уменьшает сопротивление, а следовательно, способствует увеличение скорости коррозии.

Максимальные значения наблюдаются при влажности 15…25 %. Дальнейшее увеличение влажности затрудняет доступ кислорода. На скорость коррозии влияет и рН почвы. Особенно велика коррозия в торфяных и болотистых грунтах, имеющих рН3, в которых она протекает с водородной деполяризацией. Как правило, скорость коррозии возрастает с увеличением глубины залегания металлических конструкций и разрушению подвергаются те участки, к которым затруднен доступ кислорода (рис. 7.). Борьбу с подземной коррозией осуществляют либо нанесением защитных и изолирующих покрытий, либо электрохимической (катодной, протекторной) защитой.
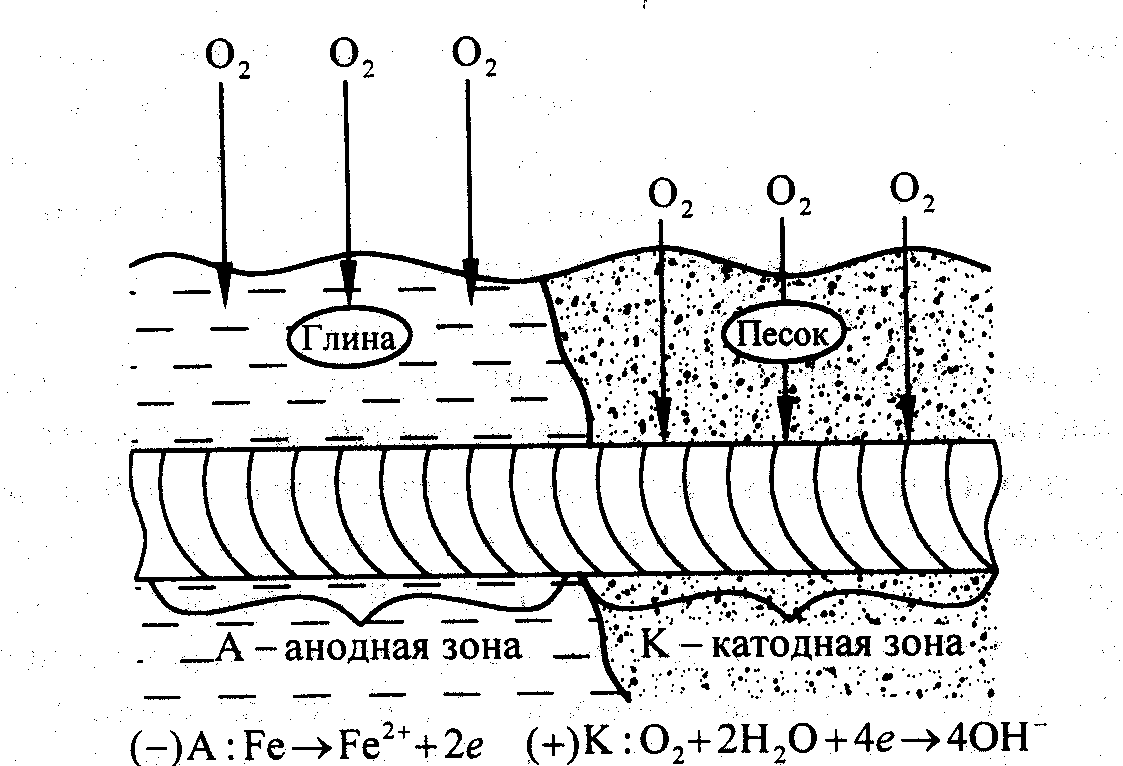
Рис. 1. Схема подземной коррозии при неравномерной аэрации почвы различной пористости.
Коррозия в морской воде. Морская вода обладает хорошей электрической проводимостью из-за содержания в ней растворенных солей и газов; рН морской воды изменяется в пределах 7,2…8,6. Концентрация растворенного кислорода достигает до 8 мг/л. В ней содержится большое количество микроорганизмов, способствующих ускорению коррозии. Наиболее опасным является то, что морская вода содержит значительное количество Cl - - ионов, являющихся ионами-активаторами, препятствующими образованию пассивных пленок на поверхности металла. Коррозия на аэрируемых участках протекает с поглощением кислорода на катодных участках (2Н2О + О2 + 44ОН - ), а на деаэрированных - с водородной деполяризацией (2Н2О + 2Н2+ 2 ОН - ). Коррозия в морской воде наиболее интенсивно развивается в зоне, располагающейся выше ватерлинии, где происходит периодическое смачивание поверхности металла.
Для защиты корпусов морских судов применяют лакокрасочные покрытия на виниловой, фенолформальдегидной, каменноугольной и битумной основах. Подводную часть судов защищают специальными покрытиями, в состав которых входят токсичные для микроорганизмов вещества (CuO, HgO и др. соединения). Для борьбы с морской коррозией используют также протекторную и катодную защиты.
Защита от коррозии – это комплекс мер, закладывающихся на стадии конструирования, осуществляемых в процессе изготовления и проводимых в ходе эксплуатации различных конструкций. В связи с этим защиту можно осуществить путем воздействия либо на материал, либо на конструкцию, либо на коррозионную среду.
Коррозия металлов и способы защиты от нее
Коррозионная стойкость металла зависит от его природы, характера среды и температуры.
- Благородные металлы не подвергаются коррозии из-за химической инертности.
- Металлы Al, Ti, Zn, Cr, Ni имеют плотные газонепроницаемые оксидные плёнки, которые препятствуют коррозии.
- Металлы с рыхлой оксидной плёнкой – Fe, Cu и другие – коррозионно неустойчивы. Особенно сильно ржавеет железо.
Различают химическую и электрохимическую коррозию.
| Химическая коррозия сопровождается химическими реакциями. Как правило, химическая коррозия металлов происходит при действии на металл сухих газов, её также называют газовой. |
При химической коррозии также возможны процессы:
Fe + 2HCl → FeCl2 + H2
2Fe + 3Cl2 → 2FeCl3
Как правило, такие процессы протекают в аппаратах химических производств.
| Электрохимическая коррозия – это процесс разрушения металла, который сопровождается электрохимическими процессами. Как правило, электрохимическая коррозия протекает в присутствии воды и кислорода, либо в растворах электролитов. |
В таких растворах на поверхности металла возникают процессы переноса электронов от металла к окислителю, которым является либо кислород, либо кислота, содержащаяся в растворе.
При этом электродами являются сам металл (например, железо) и содержащиеся в нем примеси (обычно менее активные металлы, например, олово).
В таком загрязнённом металле идёт перенос электронов от железа к олову, при этом железо (анод) растворяется, т.е. подвергается коррозии:
Fe –2e = Fe 2+
На поверхности олова (катод) идёт процесс восстановления водорода из воды или растворённого кислорода:
2H + + 2e → H2
O2 + 2H2O + 4e → 4OH –
| Например, при контакте железа с оловом в растворе соляной кислоты происходят процессы: |
Анод: Fe –2e → Fe 2+
Катод: 2H + + 2e → H2
Суммарная реакция: Fe + 2H + → H2 + Fe 2+
Если реакция проходит в атмосферных условиях в воде, в ней участвует кислород и происходят процессы:
Анод: Fe –2e → Fe 2+
Катод: O2 + 2H2O + 4e → 4OH –
Суммарная реакция:
Fe 2+ + 2OH – → Fe(OH)2
4Fe(OH)2 + O2+ 2H2O → 4Fe(OH)3
При этом образуется ржавчина.
Методы защиты от коррозии
Защитные покрытия
Защитные покрытия предотвращают контакт поверхности металла с окислителями.
- Катодное покрытие – покрытие менее активным металлом (защищает металл только неповреждённое покрытие).
- Покрытие краской, лаками, смазками.
- Создание на поверхности некоторых металлов прочной оксидной плёнки химическим путём (анодирование алюминия, кипячение железа в фосфорной кислоте).
Создание сплавов, стойких к коррозии
Физические свойства сплавов могут существенно отличаться от свойств чистых металлов. Добавление некоторых металлов может приводить к повышению коррозионной стойкости сплава. Например, нержавеющая сталь, новые сплавы с большой коррозионной устойчивостью.
Изменение состава среды
Коррозия замедляется при добавлении в среду, окружающую металлическую конструкцию, ингибиторов коррозии. Ингибиторы коррозии — это вещества, подавляющие процессы коррозии.
Электрохимические методы защиты
Протекторная защита: при присоединении к металлической конструкции пластинок из более активного металла – протектора. В результате идёт разрушение протектора, а металлическая конструкция при этом не разрушается.
Защита металла от коррозии
Металлы используются человеком с доисторических времен, изделия из них широко распространены в нашей жизни. Самым распространенным металлом является железо и его сплавы. К сожалению, они подвержены коррозии, или ржавлению — разрушению в результате окисления. Своевременная защита от коррозии позволяет продлить срок службы металлических изделий и конструкций.

Защита от коррозии
Виды коррозии
Ученые давно борются с коррозией и выделили несколько основных ее типов:
- Атмосферная. Происходит окисление вследствие контакта с кислородом воздуха и содержащимися в нем водяными парами. Присутствие в воздухе загрязнений в виде химически активных веществ ускоряет ржавление.
- Жидкостная. Проходит в водной среде, соли, содержащиеся в воде, особенно морской, многократно ускоряют окисление.
- Почвенная. Этому виду подвержены изделия и конструкции, находящиеся в грунте. Химический состав грунта, грунтовые воды и токи утечки создают особую среду для развития химических процессов.
Исходя из того, в какой среде будет эксплуатироваться изделие, подбираются подходящие методы защиты от коррозии.
Характерные типы поражения ржавчиной
Различают следующие характерные виды поражения коррозией:
- Поверхность покрыта сплошным ржавым слоем или отдельными кусками.
- На детали возникли небольшие участки ржавчины, проникающей в толщину детали.
- В виде глубоких трещин.
- В сплаве окисляется один из компонентов.
- Глубинное проникновение по всему объему.
- Комбинированные.

Виды коррозионных разрушений
По причине возникновения разделяют также:
- Химическую. Химические реакции с активными веществами.
- Электрохимическую. При контакте с электролитическими растворами возникает электрический ток, под действием которого замещаются электроны металлов, и происходит разрушение кристаллической структуры с образованием ржавчины.
Коррозия металла и способы защиты от нее
Ученые и инженеры разработали множество способов защиты металлических конструкций от коррозии.
Защита от коррозии индустриальных и строительных конструкций, различных видов транспорта осуществляется промышленными способами.
Зачастую они достаточно сложные и дорогостоящие. Для защиты металлических изделий в условиях домовладений применяют бытовые методы, более доступные по цене и не связанные со сложными технологиями.
Промышленные
Промышленные методы защиты металлических изделий подразделяются на ряд направлений:
- Пассивация. При выплавке стали в ее состав добавляют легирующие присадки, такие, как Cr, Mo, Nb, Ni. Они способствуют образованию на поверхности детали прочной и химически стойкой пленки окислов, препятствующей доступу агрессивных газов и жидкостей к железу.
- Защитное металлическое покрытие. На поверхность изделия наносят тонкий слой другого металлического элемента — Zn , Al, Co и др. Этот слой защищает железо о т ржавления.
- Электрозащита. Рядом с защищаемой деталью размещают пластины из другого металлического элемента или сплава, так называемые аноды. Токи в электролите текут через эти пластины, а не через деталь. Так защищают подводные детали морского транспорта и буровых платформ.
- Ингибиторы. Специальные вещества, замедляющие или вовсе останавливающие химические реакции.
- Защитное лакокрасочное покрытие.
- Термообработка.

Порошковая покраска для защиты от коррозии
Способы защиты от коррозии, используемые в индустрии, весьма разнообразны. Выбор конкретного метода борьбы с коррозией зависит от условий эксплуатации защищаемой конструкции.
Бытовые
Бытовые методы защиты металлов от коррозии сводятся, как правило, к нанесению защитных лакокрасочных покрытий. Состав их может быть самый разнообразный, включая:
- силиконовые смолы;
- полимерные материалы;
- ингибиторы;
- мелкие металлические опилки.
Отдельной группой стоят преобразователи ржавчины — составы, которые наносят на уже затронутые коррозией конструкции. Они восстанавливают железо из окислов и предотвращают повторную коррозию. Преобразователи делятся на следующие виды:
- Грунты. Наносятся на зачищенную поверхность, обладают высокой адгезией. Содержат в своем составе ингибирующие вещества, позволяют экономить финишную краску.
- Стабилизаторы. Преобразуют оксиды железа в другие вещества.
- Преобразователи оксидов железа в соли.
- Масла и смолы, обволакивающие частички ржавчины и нейтрализующие ее.

При выборе грунта и краски лучше брать их от одного производителя. Так вы избежите проблем совместимости лакокрасочных материалов.
Защитные краски по металлу
По температурному режиму эксплуатации краски делятся на две большие группы:
- обычные, используемые при температурах до 80 °С;
- термостойкие.
По типу связующей основы краски бывают:
- алкидные;
- акриловые;
- эпоксидные.
Лакокрасочные покрытия по металлу имеют следующие достоинства:
- качественная защита поверхности от коррозии;
- легкость нанесения;
- быстрота высыхания;
- много разных цветов;
- долгий срок службы.
Большой популярностью пользуются молотковые эмали, не только защищающие метал, но и создающие эстетичный внешний вид. Для обработки металла распространена также краска-серебрянка. В ее состав добавлена алюминиевая пудра. Защита металла происходит за счет образования тонкой пленки окиси алюминия.

Эпоксидные смеси из двух компонентов отличаются исключительной прочностью покрытия и применяются для узлов, подверженных высоким нагрузкам.
Защита металла в бытовых условиях
Чтобы надежно защитить металлические изделия от коррозии, следует выполнить следующую последовательность действий:
- очистить поверхность от ржавчины и старой краски с помощью проволочной щетки или абразивной бумаги;
- обезжирить поверхность;
- сразу же нанести слой грунта;
- после высыхания грунта нанести два слоя основной краски.
При работе следует использовать средства индивидуальной защиты:
- перчатки;
- респиратор;
- очки или прозрачный щиток.
Способы защиты металлов от коррозии постоянно совершенствуются учеными и инженерами.
Методы противостояния коррозионным процессам
Основные методы, применяемые для противодействия коррозии, приведены ниже:
- повышение способности материалов противостоять окислению за счет изменения его химического состава;
- изоляция защищаемой поверхности от контакта с активными средами;
- снижение активности окружающей изделие среды;
- электрохимические.
Первые две группы способов применяются во время изготовления конструкции, а вторые – во время эксплуатации.
Методы повышения сопротивляемости
В состав сплава добавляют элементы, повышающие его коррозионную устойчивость. Такие стали называют нержавеющими. Они не требуют дополнительных покрытий и отличаются эстетичным внешним видом. В качестве добавок применяют никель, хром, медь, марганец, кобальт в определенных пропорциях.

Нержавеющая сталь AISI 304
Стойкость материалов к ржавлению повышают также, удаляя их состава ускоряющие коррозию компоненты, как, например, кислород и серу — из стальных сплавов, а железо – из магниевых и алюминиевых.
Снижение агрессивности внешней среды и электрохимическая защита
С целью подавления процессов окисления во внешнюю среду добавляют особые составы — ингибиторы. Они замедляют химические реакции в десятки и сотни раз.
Электрохимические способы сводятся к изменению электрохимического потенциала материала путем пропускания электрического тока. В результате коррозионные процессы сильно замедляются или даже вовсе прекращаются.
Пленочная защита
Защитная пленка препятствует доступу молекул активных веществ к молекулам металла и таким образом предотвращают коррозионные явления.
Пленки образуются из лакокрасочных материалов, пластмассы и смолы. Лакокрасочные покрытия недороги и удобны в нанесении. Ими покрывают изделие в несколько слоев. Под краску наносят слой грунта, улучшающего сцепление с поверхностью и позволяющего экономить более дорогую краску. Служат такие покрытия от 5 до 10 лет. В качестве грунта иногда применяют смесь фосфатов марганца и железа.
Защитные покрытия создают также из тонких слоев других металлов: цинка, хрома, никеля. Их наносят гальваническим способом.
Покрытие металлом с более высоким электрохимическим потенциалом, чем у основного материала, называется анодным. Оно продолжает защищать основной материал, отвлекая активные окислители на себя, даже в случае частичного разрушения. Покрытия с более низким потенциалом называют катодными. В случае нарушения такого покрытия оно ускоряет коррозию за счет электрохимических процессов.
Металлическое покрытие также можно наносить также методом распыления в струе плазмы.
Применяется также и совместный прокат нагретых до температуры пластичности листов основного и защищающего металла. Под давлением происходит взаимная диффузия молекул элементов в кристаллические решетки друг друга и образование биметаллического материала. Этот метод называют плакированием.
Способы защиты металлических изделий от коррозии

Способы защиты металлических изделий от коррозии призваны обеспечить стойкость данных элементов в зависимости от среды использования и интенсивности негативных факторов. Очевидно, что для слабоагрессивных сред вполне подойдут более простые методы защиты, а для сильноагрессивных – наиболее технологичные.
При этом не стоит недооценивать проблему коррозии. Данное явление представляет собой значимую проблему, так как из-за коррозионных разрушений примерно одной десятой доли от общего производства металла идет на устранение последствий. В нашей статье мы расскажем, какими методами можно защитить металл от ржавчины и разберем виды и причины ее появления.
Задачи защиты металлических изделий от коррозии
Коррозия представляет собой процесс, сопровождающийся самопроизвольным разрушением поверхностных слоев изделий из стали, сплавов и чугуна, появляющийся в результате электрохимического, химического и физико-химического взаимодействия с окружающей средой. Разложение от физических воздействий не считается коррозией, а характеризуется понятиями «эрозия», «износ» или «истирание». Коррозийным негативным последствием становится порча и разъедание верхних слоев металла, вследствие чего он становится непригодным для эксплуатации.

Эксперты в этой области подтверждают тот факт, что каждый год на планете расходуется около 10 % от общего объема добычи металлов на восстановление потерь от воздействия коррозии, которая служит причиной их расплава и полной потери эксплуатационных свойств металлических изделий.
VT-metall предлагает услуги:
Лазерная резка металла Гибка металла Порошковая покраска металла Сварочные работы
Появление первых признаков коррозийного процесса у изделий из стали и чугуна выражается в уменьшении их герметичности и прочности. К тому же снижаются такие параметры, как коэффициент теплопроводности, пластичности, отражательный потенциал и другие значимые характеристики. Через некоторое время такие конструкции и вовсе становятся непригодными для эксплуатации.
Рекомендовано к прочтению
Кроме того, именно по причине возникновения коррозии происходят многие бытовые и производственные и экологические аварии. Этот процесс может создать угрозу для природы и здоровья людей в результате прорыва нефтяных и газовых магистралей трубопроводов. В любой момент может нарушиться герметичность участков значительной протяженности, пораженных ржавчиной.
К сожалению, нет еще таких технологий, которые бы позволили полностью обеспечить защиту стальных сплавов и металлов от коррозии. Но возможности для приостановки и снижения отрицательных последствий такого процесса существуют. Эту задачу можно решить с помощью применения многих антикоррозионных средств и различных технологических мероприятий.

Виды и причины появления коррозии на металлических изделиях
Выполняя мероприятия по защите от коррозии металлических изделий, необходимо знать, что именно она собой представляет. Существуют следующие виды коррозий:
- Жидкостная. Образуется на металлических поверхностях, контактирующих с влажной средой. Что касается морской воды, то в ней процесс окисления происходит намного быстрее из-за повышенной концентрации в жидкости соли.
- Почвенная. Данный тип характерен для металлических конструкций, находящихся во взаимодействии с грунтом долгое время. При воздействии химических элементов, входящих в состав грунтовых вод, почвы или различных утечек запускаются необратимые химические процессы.
- Атмосферная. Главной причиной окисления является взаимодействие металла с содержащимися в воздушной среде водяными парами и кислородом. Если воздух насыщен загрязнениями химически активных веществ, то ржавчина появляется быстрее.
Проявление коррозии на металлических конструкциях может выражаться:
- образованием сплошного слоя ржавчины или отдельных участков поверхностей;
- появлением глубоких трещин;
- небольшими пораженными участками, направленными внутрь изделия;
- окислением одного из компонентов сплава;
- глубинным распространением по всему объему;
- сразу несколькими признаками.
Одной из двух причин развития такого процесса может быть:
- Химическое взаимодействие – когда металл начинает разрушаться вследствие химической реакции с активными компонентами.
- Электрохимическая природа, обусловленная тем, что при контакте с электролитическими растворами зарождаются электрические токи, при воздействии которых происходит замещение электронов в металле. Это приводит к разрушению кристаллической решетки и образованию ржавчины.
7 промышленных способов защиты металлических изделий от коррозии
1. Метод пассивации.
Пассивация означает переход поверхности металла в невосприимчивое (пассивное, неактивное) состояние взаимодействия с кислородом. Практически это придание сталям свойств нержавеющих материалов.
Такие результаты достигаются посредством добавления к стальным сплавам никеля или хрома. С помощью этих элементов образуются устойчивые соединения, которые при воздействии с кислородом не превращаются в ржавчину, а создают сплошную пленку на поверхности металла, которая и защищает его от негативного воздействия.
2. Защитное покрытие.
Все наверняка слышали про процесс хромирования деталей или оцинковки. В обоих случаях это способы защиты от коррозии. Просто наносим на поверхность металла слой материала, к примеру, никель или цинк, который не коррозирует.

Такая защитная прослойка предохранит от агрессивного воздействия кислорода и сохранит металл. Но с течением времени покрытие все равно будет отслаиваться. Под ним начнет появляться ржавчина, а остатки слоя усугубят процесс. Показательный пример – старый автомобильный бампер.
Но, несмотря на наличие такого недостатка, эта технология повсеместно применяется и является в разы более экономичной, чем производство нержавеющей стали.
3. Электрозащита от коррозии.
При любой химической реакции, к которой принадлежит и коррозия, происходит электронное взаимодействие. Процесс окисления – это отдача электронов, а восстановление – их прием. Препятствуя его развитию при помощи электрического воздействия, можно фактически приостановить коррозионный процесс. На этом основан сам принцип электрозащиты от такого разрушения.
Различают защиту активную и пассивную:
- Принцип активной (или катодной) защиты основан на пропускании токов через деталь, что упорядочивает блуждающие токи и препятствует свободному перемещению электронов, и, следовательно, из-за их нехватки не остановится активное взаимодействие с кислородом.
- Суть пассивной (протекторной) защиты заключается в сочетании основного сплава с некоторым более активным металлом. Пример: на днища морских судов обычно прикрепляют цинковые заклепки, которые обладают свойством притягивать к себе эти свободные электроны и приостанавливают процесс коррозии.
4. Ингибиторы коррозии.
Ингибиторы – это химические соединения или их композиции, которые замедляют коррозию. Существует большое количество их разновидностей. Присутствие даже небольшого количества ингибиторов в агрессивной среде способствует замедлению процесса коррозии.
К примеру, если разрушение металла происходит в кислой среде, то целесообразно было бы выравнивать ее pH до нейтрального значения.
5. Использование термической обработки.
Суть термической обработки любого металла заключается в том, что при воздействии определенной температуры происходит изменение структуры в момент перехода из одного фазового состояния в другое.
Каждая фаза по-своему реагирует на внешние воздействия, в частности, на кислород. Следовательно, если фазовое превращение произошло, то и деталь станет менее чувствительна к внешним агрессивным воздействиям.
В этом и состоит принцип улучшения свойств антикоррозионной защиты с помощью термической обработки. Безусловно, такой процесс невозможно осуществить в домашних условиях.
6. Нанесение лакокрасочного покрытия.
Является самым простым и экономичным способом защиты деталей от коррозийного разрушения. Если говорить техническим языком, то это процесс нанесения специального защитного полимерного покрытия на поверхность детали, которое защищает металл от взаимодействия с кислородом в любом его виде. Существует большое количество разновидностей лакокрасочных покрытий, поэтому нет смысла их все перечислять.
Стоит, правда, отметить, что все ЛКП со временем также разрушаются от агрессивных факторов, а под ними металл начинает «цвести». Именно по этой причине на всех машинах появляются зоны поражения металлических поверхностей.

7. Химическое покрытие.
При методе химической или электрохимической обработки на поверхности металла создается особая пленка, препятствующая негативному воздействию коррозии. В основном, для таких целей используют оксидные или фосфатные пленки, при нанесении которых учитывают требования строительных норм и правил, потому что такие соединения различаются по принципу защиты для различного типа сооружений.
Создание фосфатной пленки рекомендуется при необходимости гарантии защиты от коррозии изделий из черных и цветных металлов. Суть данной технологии – в выдерживании изделия определенное время в растворах железа, марганца или цинка, предварительно смешанными с кислыми фосфорными солями, нагретыми до температуры +97 °С. Нанесенная пленка будет служить также отличной основой для дальнейшего нанесения на нее лакокрасочного материала.
Важно, что фосфатное покрытие недолговечно. Кроме того, оно имеет низкую прочность и эластичность. Операцию фосфатирования применяют в качестве способа защиты от коррозии тех металлических деталей, эксплуатация которых проводится в условиях высокой температуры или соленой агрессивной водной среде.
Использование защитной оксидной пленки также имеет свою сферу применения. Она образуется посредством воздействия на металл раствора щелочи и электрического тока. Чаще всего для оксидирования металлов применяют раствор едкого натра. Специалисты в этой сфере обычно называют такой процесс воронением. Характеризуется он созданием на поверхности высоко- и малоуглеродистых сталей пленки, обладающей привлекательным черным цветом.
Метод оксидирования особо необходим, когда есть потребность сохранить первоначальные геометрические размеры. Преимущественно такое защитное покрытие применяется в стрелковом вооружении и при изготовлении точных приборов. Толщина пленки обычно не превышает 1,5 мкм.

Бытовые методы антикоррозионной защиты
На сегодняшний день существует много вариантов антикоррозийных средств, которые могут существенно различаться по цене. Разброс в стоимости объясняется, прежде всего, такими их свойствами, как долговечность, надежность и т. д., которые определяются химическим составом. Если не принимать во внимание незначительную разницу в составе, то при их выборе стоит учитывать и будущие условия эксплуатации, что нередко становится самым важным фактором.
Классифицировать краски можно и по видам связующих материалов: акриловые, эпоксидные и алкидные. По термической стойкости их разделяют на два основных типа: обычные и термостойкие, которые обладают способностью выдерживать высокие температуры без потери качества. Помимо этого, краски характеризуются и такими параметрами, как срок службы и скорость высыхания.
Кроме красок, можно применять и другие разновидности антикоррозийных средств:
- Различные смазки и пасты, в основе которых минеральные масла с добавлением парафина или воска. В зависимости от вида обрабатываемого металла, в них добавляются и другие компоненты. Например, в смазки для стальных покрытий добавляют щелочи.
Пасты и смазки применяются в большинстве случаев для консервации металлических поверхностей изделий при долговременной транспортировке. В этих случаях они могут обеспечивать идеальную защиту, но для металлических изделий, эксплуатируемых в ежедневном режиме они не применимы по причине низкой устойчивости даже к незначительным механическим воздействиям.
В бытовых условиях чаще всего используют лакокрасочные материалы. Особо популярными являются алкидные эмали, в то числе и отечественного производства. На сегодняшний день такие антикоррозийные составы можно купить даже в виде спреев, что значительно упрощает их применение. Они удобно и равномерно наносятся, позволяют нанести защиту даже в самых труднодоступных местах.
Необходимо сказать, что для надежного и эффективного предохранения изделий от коррозии наносят не только защитные покрытия, но и слой грунтовки, который проникает в структуру металла. Отметим, что использование грунтового покрытия требует дополнительных расходов, но в некоторых случаях без грунтовки просто не обойтись.
Почему следует обращаться именно к нам
Мы с уважением относимся ко всем клиентам и одинаково скрупулезно выполняем задания любого объема.
Наши производственные мощности позволяют обрабатывать различные материалы:
- цветные металлы;
- чугун;
- нержавеющую сталь.
При выполнении заказа наши специалисты применяют все известные способы механической обработки металла. Современное оборудование последнего поколения дает возможность добиваться максимального соответствия изначальным чертежам.
Для того чтобы приблизить заготовку к предъявленному заказчиком эскизу, наши специалисты используют универсальное оборудование, предназначенное для ювелирной заточки инструмента для особо сложных операций. В наших производственных цехах металл становится пластичным материалом, из которого можно выполнить любую заготовку.
Преимуществом обращения к нашим специалистам является соблюдение ими ГОСТа и всех технологических нормативов. На каждом этапе работы ведется жесткий контроль качества, поэтому мы гарантируем клиентам добросовестно выполненный продукт.
Благодаря опыту наших мастеров на выходе получается образцовое изделие, отвечающее самым взыскательным требованиям. При этом мы отталкиваемся от мощной материальной базы и ориентируемся на инновационные технологические наработки.
Мы работаем с заказчиками со всех регионов России. Если вы хотите сделать заказ на металлообработку, наши менеджеры готовы выслушать все условия. В случае необходимости клиенту предоставляется бесплатная профильная консультация.
Защита металлических изделий от коррозии

Человек с глубокой древности использует предметы из металлов. До сих пор они остаются важной составляющей нашей жизни, причем самыми востребованными являются изделия из железа и его сплавов. Однако все они имеют один серьезный минус, а именно подверженность коррозии, то есть способность разрушаться в процессе окисления. Своевременная защита металлических изделий от коррозии дает возможность увеличить их срок службы.
Почему так важна защита металлических изделий от коррозии

Коррозия оказывает негативное электрохимическое, химическое воздействие на целостность поверхности предметов из стали, чугуна. В результате происходит разъедание металлических изделий, они портятся и не могут использоваться по назначению.
По статистике экспертов, каждый год примерно 10 % от объема всех добываемых на планете металлов приходится расходовать на устранение потерь, вызванных коррозией. Ведь последняя приводит к полной утрате металлическими предметами своих эксплуатационных свойств.
Как только на изделиях из чугуна или стали появляются признаки коррозии, у них снижается герметичность, прочность. Параллельно падает их способность проводить тепло, пластичность, отражательный потенциал, иными словами, утрачивается целый ряд немаловажных свойств. Все это приводит к тому, что конструкции оказываются непригодны для использования по назначению. Вот почему так важно грамотно и своевременно применять существующие способы защиты металлических изделий от коррозии, о которых далее пойдет речь.
Основные виды коррозии
Прежде чем приступать к защите металлических изделий от коррозии, важно понять природу этого процесса. Принято выделять такие типы коррозии:
- Атмосферная. Причиной окисления становится контакт металлического предмета с кислородом и содержащимися в воздухе водяными парами. Ржавчина образуется быстрее, когда в воздухе присутствуют загрязнения в виде химически активных веществ.
- Жидкостная. Формируется на металлических предметах, находящихся в водной среде. Если речь идет о морской воде, то в ней окисление значительно ускоряется за счет содержащегося в жидкости большого объема солей.
- Почвенная. Данному типу подвержены металлические изделия, конструкции, находящиеся в грунте. Химические реакции запускаются и протекают под действием химических элементов, входящих в состав грунта, грунтовых вод, разного рода утечек.
Коррозия на металлических изделиях может проявляться по-разному:
- формируется сплошной ржавый слой или его отдельные фрагменты;
- появляются небольшие участки ржавчины, проникающей внутрь детали;
- образуются глубокие трещины;
- окисляется один из компонентов сплава;
- происходит глубинное проникновение по всему объему;
- сочетаются сразу несколько симптомов.
Причины возникновения могут иметь природу двух видов:
- Химическую, то есть металл разрушается в результате химических реакций с активными веществами.
- Электрохимическую, связанную с тем, что при контакте с электролитическими растворами возникает электрический ток, под его действием замещаются электроны металлов. Это приводит к тому, что страдает кристаллическая структура, образуется ржавчина.
Можно выделить несколько основных способов защиты металлических изделий от коррозии:
- легирование металлов;
- защитные покрытия (металлические, неметаллические);
- электрохимическая защита;
- изменение свойств коррозионной среды;
- рациональное конструирование изделий.

1. Легирование металлов.
Это один из действительно эффективных способов, позволяющих увеличить стойкость металлов к ржавчине. В процессе легирования в состав сплава или металла вносят легирующие элементы, такие как хром, никель, молибден, пр. Они приводят к пассивации металла, то есть металл или сплав переходит в состояние повышенной коррозионной устойчивости за счет торможения анодного процесса. Пассивное состояние металла достигается благодаря тому, что на его поверхности формируется совершенная по структуре оксидная пленка. Она обеспечивает защиту изделия лишь при условии, что кристаллические решетки металла и образующегося оксида имеют между собой максимальное сходство.
Рекомендуем статьи по металлообработке
Легирование активно используется для защиты, например, закладных деталей от коррозии. Такую обработку проводят для железа, алюминия, меди, магния, цинка и сплавов на их основе. Получившиеся сплавы, по сравнению с исходными металлами, отличаются повышенной коррозионной стойкостью, а также жаростойкостью и жаропрочностью.
Жаростойкость – способность металла сохранять свои свойства даже при высоких температурах, когда повышается вероятность газовой коррозии.
Жаропрочность – сохранение конструкционным материалом высокой механической прочности при значительном повышении температуры. Этого свойства обычно достигают легированием металлов и сплавов. Так, сталь легируется хромом, алюминием и кремнием. При высоких температурах они окисляются первыми, в результате чего формируются плотные защитные оксидные пленки, например Al2O3 и Cr2O3.
Кроме того, легирование позволяет снизить скорость электрохимической коррозии, особенно когда она сопровождается выделением водорода. Ярким примером коррозионностойких сплавов являются нержавеющие стали, где роль легирующих компонентов играют хром, никель и ряд прочих металлов.
2. Защитные покрытия.

В этом случае на поверхности металлического изделия искусственно формируются дополнительные слои для защиты. На самом деле, этот подход является наиболее распространенным среди существующих способов борьбы с коррозией. Мало того, что подобные покрытия оберегают предмет от появления ржавчины, они придают поверхностям ценные физико-химические характеристики. Речь идет об износостойкости, электрической проводимости и еще ряде свойств. Такие покрытия могут быть металлическими и неметаллическими. Однако, вне зависимости от состава, к ним предъявляются единые требования: хорошие адгезионные качества, сплошность и способность сохранять свои свойства в агрессивной среде.
Металлические покрытия выделяются на фоне других способов защиты металлических изделий от коррозии тем, что обладают неоднозначным действием. Пока защитный слой сохраняет свою целостность, он изолирует поверхность изделия от воздействия окружающей среды. То есть по своему действию близок к любой механической обработке, например, окраске, оксидной пленке, пр. В целом, металлические покрытия не должны пропускать коррозионные агенты.
Если такое покрытие повреждается либо в нем есть поры, образуется гальванический элемент. Нужно понимать, что характер коррозионного разрушения материала во многом зависит от электрохимических характеристик обоих металлов. Защитные антикоррозионные покрытия бывают катодными или анодными. В число первых входят покрытия, потенциалы которых в данной среде являются более положительными, чем у основного металла. Анодные покрытия обладают наиболее отрицательным потенциалом, чем потенциал материала изделия.
Если повреждается никелевое покрытие, на анодных участках железо окисляется за счет образования микрокоррозионных гальванических элементов. На катодных участках происходит восстановление водорода. Таким образом, катодные покрытия обеспечивают защиту металлических изделий от коррозии только при условии, что в покрытии нет пор и повреждений.
Если в цинковом слое появляется местное повреждение, защита продолжит разрушаться, но поверхность железа не пострадает от коррозии. На анодных участках происходит процесс окисления цинка, а на катодных участках – восстановление водорода.
Электродные потенциалы металлов зависят от компонентов и их доли в растворах, поэтому характер используемого для защиты покрытия может быть изменен за счет изменения состава.

Защита деталей от коррозии горячим методом осуществляется при помощи разных металлов и подходов. Сформировать металлические защитные покрытия позволяют несколько способов: электрохимический (гальванические покрытия); погружение в расплавленный металл (горячее цинкование, лужение); металлизация (нанесение расплавленного металла на защищаемую поверхность струей сжатого воздуха); химический (защита изделия посредством восстановителей, таких как гидразин).
Материалами для металлических защитных покрытий могут быть как чистые металлы (цинк, кадмий, алюминий, никель, медь, хром, серебро и др.), так и их сплавы (бронза, латунь и др.).
Неметаллические защитные покрытия делятся на неорганические и органические. Суть такой обработки состоит преимущественно в изоляции металла от окружающей среды.
Для защиты металлических изделий от коррозии неметаллическими покрытиями используют неорганические эмали, оксиды металлов, соединение хрома, фосфора, пр. В число органических входят лакокрасочные покрытия, смолы, пластмассы, полимерные пленки, резина.
По своему составу неорганические эмали являются силикатами, иначе говоря, это соединения кремния. Нужно понимать, что подобные покрытия хрупкие и растрескиваются из-за тепловых и механических ударов.
Лакокрасочные покрытия встречаются более часто. Главные условия для защиты металлических изделий от коррозии с помощью лакокрасочных покрытий: покрытие должно быть сплошным, газо- и водонепроницаемым, химически стойким, эластичным, обладать высоким сцеплением с материалом, механической прочностью, твердостью.
3. Химические способы.
Существует множество методов защиты металла, относящихся к этой группе. Одним из них является обработка поверхности веществами, вступающими с ней в химическую реакцию, в результате чего формируется пленка устойчивого химического соединения. Речь идет о таких способах как оксидирование, фосфатирование, сульфидирование, пр.
Оксидирование представляет собой способ защиты за счет образования оксидных пленок на поверхности металлических изделий.
Наиболее современным вариантом этого метода является химическая и электрохимическая обработка деталей в щелочных растворах.

Для железа и его сплавов наиболее часто используется щелочное оксидирование в растворе, содержащем NaOH, NaNO3, NaNO2 при температуре +135…+140 °С. Оксидирование черных металлов называется воронением.
Фосфатирование является методом формирования фосфатных пленок на изделиях из цветных и черных металлов. Для фосфатирования металлическое изделие погружают в растворы фосфорной кислоты и ее кислых солей (H3PO4 + Mn(H2PO4)2) при температуре +96…+98 °С.
Фосфатная пленка оказывается химически связана с материалом изделия и состоит из сросшихся между собой кристаллов, разделенных порами ультрамикроскопических размеров. Главными достоинствами фосфатных пленок являются хорошая адгезия и развитая шероховатая поверхность. Благодаря этому, такие пленки становятся отличной основой для лакокрасочных покрытий и пропитывающих смазок. Обычно данный подход выбирают для защиты деталей от коррозии, когда те будут использоваться в закрытых помещениях, либо если изделие подвергнется последующей окраске или покрытию лаком. Однако у таких пленок есть свои минусы, в первую очередь к ним относятся низкая прочность и эластичность, хрупкость.
Анодированием называется защита поверхности металла при помощи формирования оксидных пленок, обычно данный способ используется для защиты алюминия. На поверхности этого металла всегда есть тонкая оксидная пленка Al2O3 или Al2O3 ×∙(H2O)n. Однако она не способна противостоять появлению ржавчины, поэтому в результате воздействия окружающей среды на алюминии постепенно образуется слой продуктов коррозии.
Для искусственного формирования оксидных пленок используют химический и электрохимический способы. Во втором случае алюминиевое изделие используется в качестве анода электролизера. Тогда как роль электролита играет раствор серной, ортофосфорной, хромовой, борной или щавелевой кислот. Катодом может быть металл, не вступающий в реакцию с раствором электролита, допустим, нержавеющая сталь. На катоде выделяется водород, за счет чего на аноде формируется оксид алюминия.
От точного выполнения при защите деталей от коррозии требований ГОСТа зависят надежность, сроки эксплуатации изделий. Не менее важно правильно выбрать метод обработки, принимая во внимание условия эксплуатации изделий, а также их изначальные характеристики. В результате удастся обеспечить надежную защиту от ржавчины, а изделие сможет служить значительно дольше, при этом использоваться по своему прямому назначению.
Читайте также:
