Оксид металла который взаимодействует и с основанием и с кислотой является
Основания являются классом неорганических веществ, применяемым в жизни с давних времен за счет ощущения мылкости. Главное отличие этого класса неорганических веществ от остальных - наличие гидроксогруппы, которая придает особые физические и химические свойства.
Основания бывают растворимыми (щелочи) и нерастворимыми. Растворимые основания мылкие на ощупь. Все основания вступают в реакцию нейтрализации - взаимодействие с кислотой. С развитием химии и изучением физических и химических свойств основания расширили круг своего применения: бытовые моющие средства, промышленные чистящие средства, очистка нефти, строительство, краски, удобрения, батарейки. Также стало широко использоваться одно из химических свойств оснований - взаимодействие с кислотами, которое называется реакцией нейтрализацией. Однако основания таят в себе опасность: с растворами щелочей надо работать аккуратно и осторожно, чтобы не получить химических ожогов.
Определение, номенклатура и классификация оснований
Основания – сложные вещества, в состав которых входят атомы металлов, соединенные с одним или несколькими гидроксогруппами (-ОН).
Гидроксид-ион(гидроксогруппа) – сложный ион, состоящий из кислорода и водорода и имеющий суммарный заряд 1- : О -2 Н +1 . Валентность гидроксогруппы равна 1.
Общая формула оснований : М(ОН)n, где М – металл, n- число групп ОН - и в то же время численное значение заряда иона (степени окисления) металла.
Слово «гидроксид» (им.падеж) + название металла (род.падеж) + указание степени окисления, если она переменная, римскими цифрами в скобках
NaOH – гидроксид натрия
Ca(OH)2 – гидроксид кальция
Fe(OH)2 – гидроксид железа (II) (читается «гидроксид железа два»)
Fe(OH)3 – гидроксид железа (III) (читается «гидроксид железа 3»)
Наличие кислорода;Кислородсодержащие;\(KOH, Sr(OH)_<2>\) ;Бескислородные;\(NH_\) как аммиачная вода Кислотность (число групп \(ОН^\) в составе или число присоединяемых \(Н^\));Однокислотные;\(NaOH, TlOH, NH_\) ;Двухкислотные;\(Ca(OH)_<2>, Mg(OH)_<2>\) ;Трёхкислотные;\(La(OH)_, TI(OH)_\) Растворимость в воде;Растворимые (щелочи);\(NaOH, KOH, Ca(OH)_<2>^\), \(Ba(OH)_<2>\) ;Нерастворимые;\(Cr(OH)_<2>, Mn(OH)_<2>\) Степень электролитической диссоциации;Сильные (α→1);\(Щелочи^ LiOH-CsOH\), \(Ca(OH)_<2>-Ra(OH)_<2>\) , \(TlOH\) ;Слабые (α→0);Нерастворимые основания Летучесть;Летучие;\(NH_∙H_<2>O\) ;Нелетучие;Щелочи, нерастворимые основания Стабильность;Стабильные;\(NaOH, Ba(OH)_<2>\) ;Нестабильные;\(NH_∙H_<2>O→ NH_↑+H_<2>O\)
Ca(OH)2 – в таблице растворимости малорастворим (м), но его относят к растворимым основаниям. К малорастворимым веществам относятся вещества, которые растворяются ограниченно – менее 1 г в 100 г воды. Это означает следующее: если в стакан, содержащий 100 г воды, поместить 10 г кристаллического гидроксида кальция, то 1 г вещества растворится, а остальные 9 г – нет. Прозрачная жидкость над осадком будет представлять собой раствор щелочи – гидроксида кальция Ca(OH)2.
Щелочи – растворимые основания. Их образуют элементы-металлы главной подгруппы первой группы (А-группы) периодической системы, а также элементы главной подгруппы второй группы (A-группы): кальций, барий и стронций. Свойства растворимых и нерастворимых оснований существенно различаются.
Получение оснований
Основания получают разными способами. Выбор способа получения зависит от того, к какой группе данное соединение относится, является щёлочью или нерастворимым основанием.
Взаимодействием щелочных и щелочноземельных металлов с водой . Протекает реакция замещения, в ходе которой кроме щёлочи образуется водород. Активные металлы энергично взаимодействуют с водой при обычных условиях.
М + Н2О = Растворимое основание (Щелочь) + Н2↑
Где М – щелочные и щелочноземельные металлы.
Взаимодействием оксидов щелочных и щелочноземельных металлов с водой . При этом протекает реакция соединения. Именно так получают гидроксид кальция в промышленных условиях.
В промышленности гидроксид натрия и калия получают путём электролиза : пропускают постоянный электрический ток через раствор хлорида натрия или калия.
Действием щелочей на растворимые соли металлов.
Раствор щелочи + раствор соли = нерастворимое основание + соль
Свойства основания
Все неорганические основания – твердые вещества (кроме гидроксида аммония NH4OH), которые характеризуются разной растворимостью в воде.
Гидроксиды щелочных металлов при обычных условиях представляют собой твердые белые кристаллические вещества, гигроскопичные, мылкие на ощупь, очень хорошо растворимы в воде (их растворение идет с выделением тепла), легкоплавки.
Гидроксиды щелочноземельных металлов (Ca(OH)2, Ba(OH)2, Sr(OH)2) – белые порошкообразные вещества, гораздо менее растворимые в воде по сравнению с гидроксидами щелочных металлов.
Нерастворимые в воде основания обычно образуются в виде гелеобразных (студенистых) осадков, разлагающихся при хранении.
Нерастворимые в воде основания могут иметь различную окраску, например: гидроксид железа (III) – бурого цвета, гидроксид алюминия - белого цвета, гидроксид меди (II) – голубого цвета.
Оксиды

Знакомство с оксидами обычно начинается на уроках химии в 8 классе. Из этой статьи вы узнаете, что такое оксиды в химии, их классификацию и свойства, а также способы получения.
О чем эта статья:
Определение оксидов
Оксиды — это сложные вещества, состоящие из двух химических элементов (т. е. бинарные соединения), один из которых — кислород в степени окисления −2.
Общая формула оксидов: ЭxOy, где Э – химический элемент, а x и y — индексы, определяемые степенью окисления химических элементов.
Виды оксидов
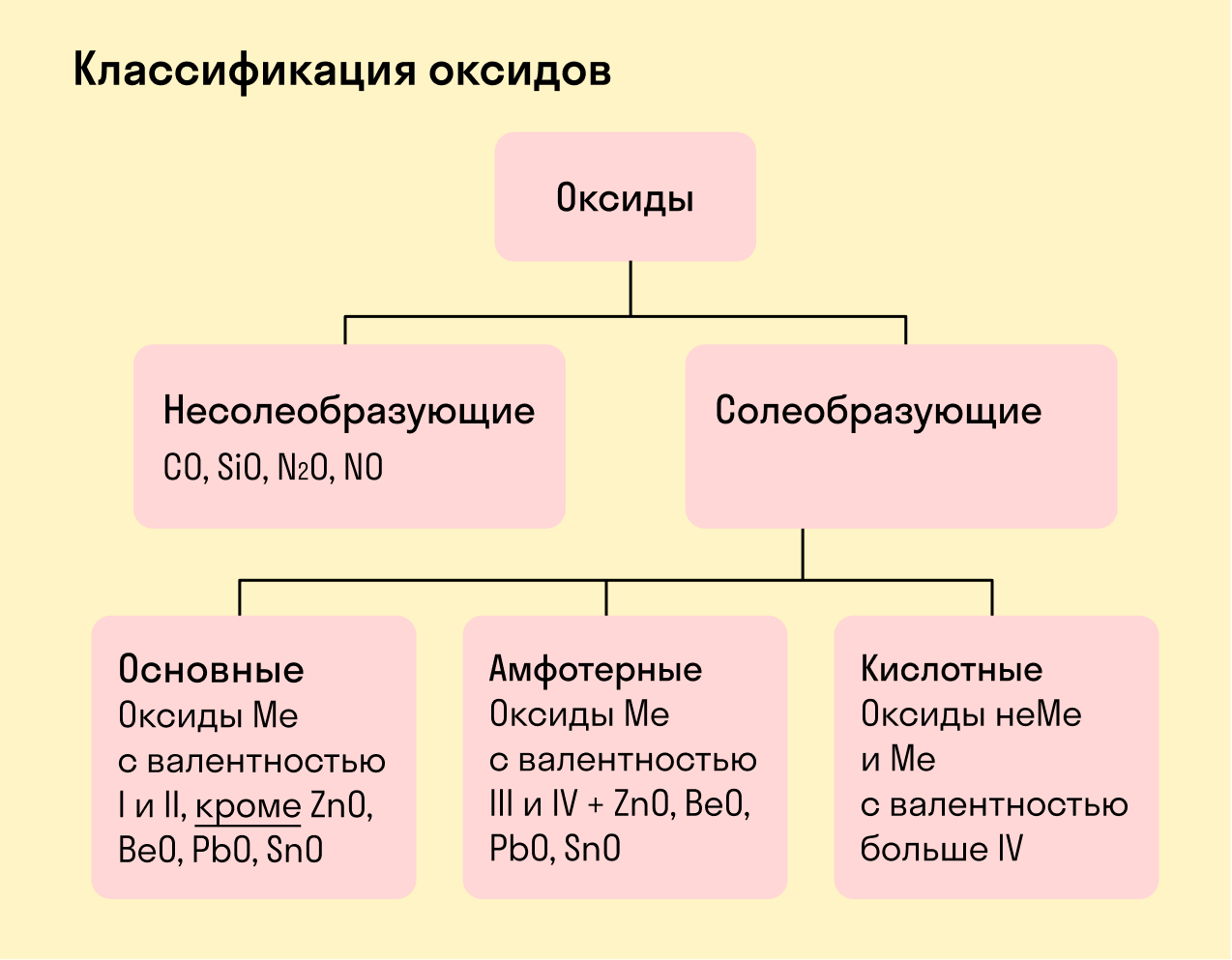
Все оксиды делятся на солеобразующие и несолеобразующие.
Несолеобразующие оксиды — это оксиды, которые не взаимодействуют с кислотами и щелочами, то есть не способны образовать соли.
К несолеобразующим оксидам относят: CO, SiO, N2O, NO.
Солеобразующие оксиды — это оксиды, которые взаимодействуют с кислотами и щелочами с образованием солей.
Солеобразующие оксиды делятся на три группы:
Основные оксиды — это оксиды, образованные металлами со степенью окисления +1 или +2.
Примеры основных оксидов: Na +1 2O, Ca +2 O, Ba +2 O.
Амфотерные оксиды — оксиды, образованные металлами со степенью окисления +3 или +4.
К амфотерным оксидам относят также: ZnO, BeO, PbO, SnO.
Несмотря на то, что эти металлы проявляют степень окисления +2 в данных соединениях, их оксиды проявляют амфотерные свойства.
Примеры амфотерных оксидов: Al +3 2O3, Fe2 +3 O3.
Кислотные оксиды — оксиды, образованные металлами с валентностью V и более или неметаллами с любой валентностью (за исключением несолеобразующих оксидов, то есть CO, SiO, N2O, NO).
Если один и тот же химический элемент образовывает несколько оксидов, то с увеличением степени окисления основные свойства оксидов ослабевают и усиливаются кислотные.
CrO (оксид хрома (II)) — проявляет основные свойства;
Cr2O3 (оксид хрома (III)) — проявляет амфотерные свойства;
CrO3 (оксид хрома (VI)) — проявляет кислотные свойства.
Закрепим знания о типах оксидов, изучив схему:
Номенклатура оксидов
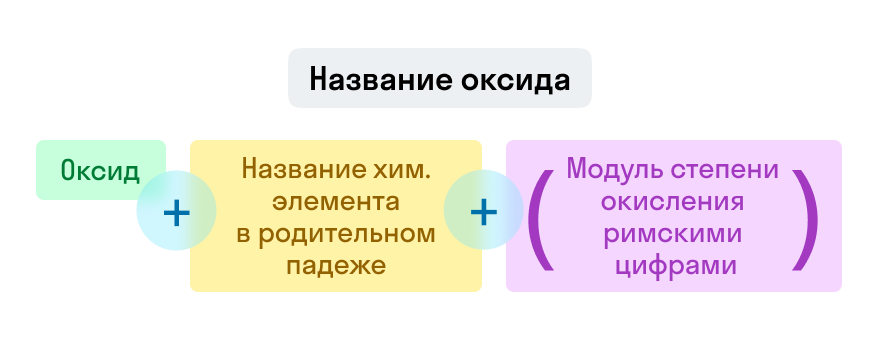
Названия оксидов строятся по систематической номенклатуре следующим образом:
Пишем слово «оксид».
Указываем название второго химического элемента в родительном падеже.
Если этот элемент имеет переменную валентность, то указываем валентность элемента в этом соединении в скобках римской цифрой.
Примеры названий оксидов:
Fe2O3 — оксид железа (III). Читается: феррум два о три.
Na2O — оксид натрия. Читается: натрия два о.
SO3 — оксид серы (VI). Читается: эс о три.
До появления систематической номенклатуры вещества называли по присущим им специфическим свойства (цвету, запаху и т. д.). Такой способ названия веществ — тривиальная номенклатура. Некоторые названия используются и сейчас.
Названия некоторых оксидов: таблица
Химическая формула оксида
Бытовое (тривиальное название)
Возможное научное название
Химические свойства основных оксидов
1. Взаимодействие с водой
С водой способны реагировать оксиды тех металлов, которым соответствуют растворимые гидроксиды. То есть с водой реагируют только оксиды щелочных и щелочноземельных металлов.
Основный оксид + вода = основание
Оксид магния взаимодействует с водой только при нагревании.
2. Взаимодействие с кислотными оксидами и кислотами
Основные оксиды, соответствующие щелочам, взаимодействуют со всеми кислотными оксидами и кислотами. Оксиды неактивных металлов взаимодействуют только с кислотными оксидами, соответствующими сильным кислотам, или с сильными кислотами.
Основный оксид + кислотный оксид = соль
Основный оксид + кислота = соль + вода
3. Взаимодействие с амфотерными оксидами
В эту реакцию могут вступать только основные оксиды щелочных или щелочноземельных металлов. При сплавлении двух оксидов образуется соль.
Основный оксид + амфотерный оксид = соль
Как составлять такие соли: металл в этой соли берем из основного оксида, а кислотный остаток из амфотерного оксида (они проявляют более кислотные свойства).
Химические свойства кислотных оксидов
Кислотные оксиды взаимодействуют с водой с образованием соответствующих кислот. За исключением SiO2, которому соответствует нерастворимая кремниевая кислота.
Кислотный оксид + вода = кислота
2. Взаимодействие с основными оксидами и щелочами
Кислотные оксиды сильных кислот способны взаимодействовать с любыми основными оксидами или основаниями.
Кислотный оксид + основный оксид = соль
Кислотный оксид + основание = соль + вода
Кислотные оксиды, соответствующие слабым кислотам (такие как CO2, SO2), способны взаимодействовать с основными оксидами, соответствующим щелочам, а также с щелочами.
3. Взаимодействие с амфотерными оксидами и гидроксидами
С амфотерными оксидами в реакцию вступают кислотные оксиды — как правило, сильных кислот.
Кислотный оксид + амфотерный оксид = соль
Кислотный оксид + амфотерный оксид = соль + вода
Химические свойства амфотерных оксидов
Амфотерные оксиды не взаимодействуют с водой — даже при нагревании!
Амфотерный оксид + вода ≠
2. Взаимодействие с кислотными оксидами и кислотой
Амфотерные оксиды взаимодействуют только с сильными и средними кислотами и их оксидами.
Амфотерный оксид + кислотный оксид = соль
Амфотерный оксид + кислота = соль + вода
3. Взаимодействие с основными оксидами
Амфотерные оксиды взаимодействуют только с теми оксидами, которые соответствуют щелочам. Реакция протекает только в расплаве, так как в растворе такие оксиды взаимодействуют преимущественно с водой с образованием щелочей.
Амфотерный оксид + основный оксид (расплав) = соль
4. Взаимодействие со щелочами
Продукты взаимодействия амфотерных оксидов со щелочами зависят от условий проведения реакции. В растворе образуются комплексные соли, а при сплавлении – средние соли.
Амфотерный оксид + щелочь (раствор) + вода = комплексная соль
Амфотерный оксид + щелочь (расплав) = средняя соль + вода
Получение оксидов
1. Окисление металлов
Почти все металлы окисляются кислородом до устойчивых степеней окисления.
Металлы с переменной степенью окисления, как правило, образуют соединения в степени окисления +3:
При взаимодействии щелочных металлов (элемента IA группы) образуются пероксиды Me2O2 или надпероксиды MeO2, где Ме — щелочной металл.
2. Окисление простых веществ — неметаллов
При окислении неметаллов в избытке кислорода, как правило, образуются высшие оксиды (это оксиды, в которых неметалл проявляют высшую степень окисления):
При недостаточном количестве кислорода образуются оксиды неметаллов в промежуточной степени окисления:
Существуют и исключения. Например, сера окисляется лишь до оксида серы (IV) даже в избытке кислорода:
Или азот, который взаимодействует с кислородом только при температуре 2 000̊С или под действием электрического разряда с образованием оксида азота (II):
Галогены (элементы VIIA группы) вовсе не взаимодействуют с кислородом, так же как и инертные газы (элементы VIIIA группы).
3. Разложение гидроксидов
Некоторые кислоты и гидроксиды неустойчивы и самопроизвольно разлагаются по схеме:
Гидроксид (кислота) = оксид + вода
Оксиды тяжелых металлов (нерастворимые гидроксиды) и кремниевая кислота разлагаются при нагревании по той же самой схеме.
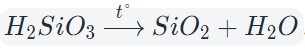
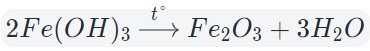
4. Окисление сложных веществ
Сложные бинарные (состоящие из двух химических элементов) соединения окисляются с образованием двух оксидов этих элементов в устойчивых степенях окисления.
Также оксиды получают разложением солей, например, карбонатов, нитратов сульфатов и т. д.
Мы узнали, какие вещества в химии называют оксидами, какие бывают оксиды, а также разобрали свойства каждого вида. Осталось подкрепить теорию практикой — а сделать это можно на курсах по химии в онлайн-школе Skysmart!
Химические свойства кислот
От производства лекарств до приготовления пищи — кислоты помогают человеку во многих областях жизни. В этом материале мы рассмотрим типичные свойства и реакции кислот с другими химическими веществами.
8 класс, 9 класс, ЕГЭ/ОГЭ
Кислоты — это сложные химические вещества, состоящие из одного или нескольких атомов водорода, способных замещаться атомами металла, и кислотных остатков.
Кислоты проявляют ряд общих химических свойств: диссоциацию и разложение, взаимодействуют с металлами, основаниями, солями, основными и амфотерными оксидами.
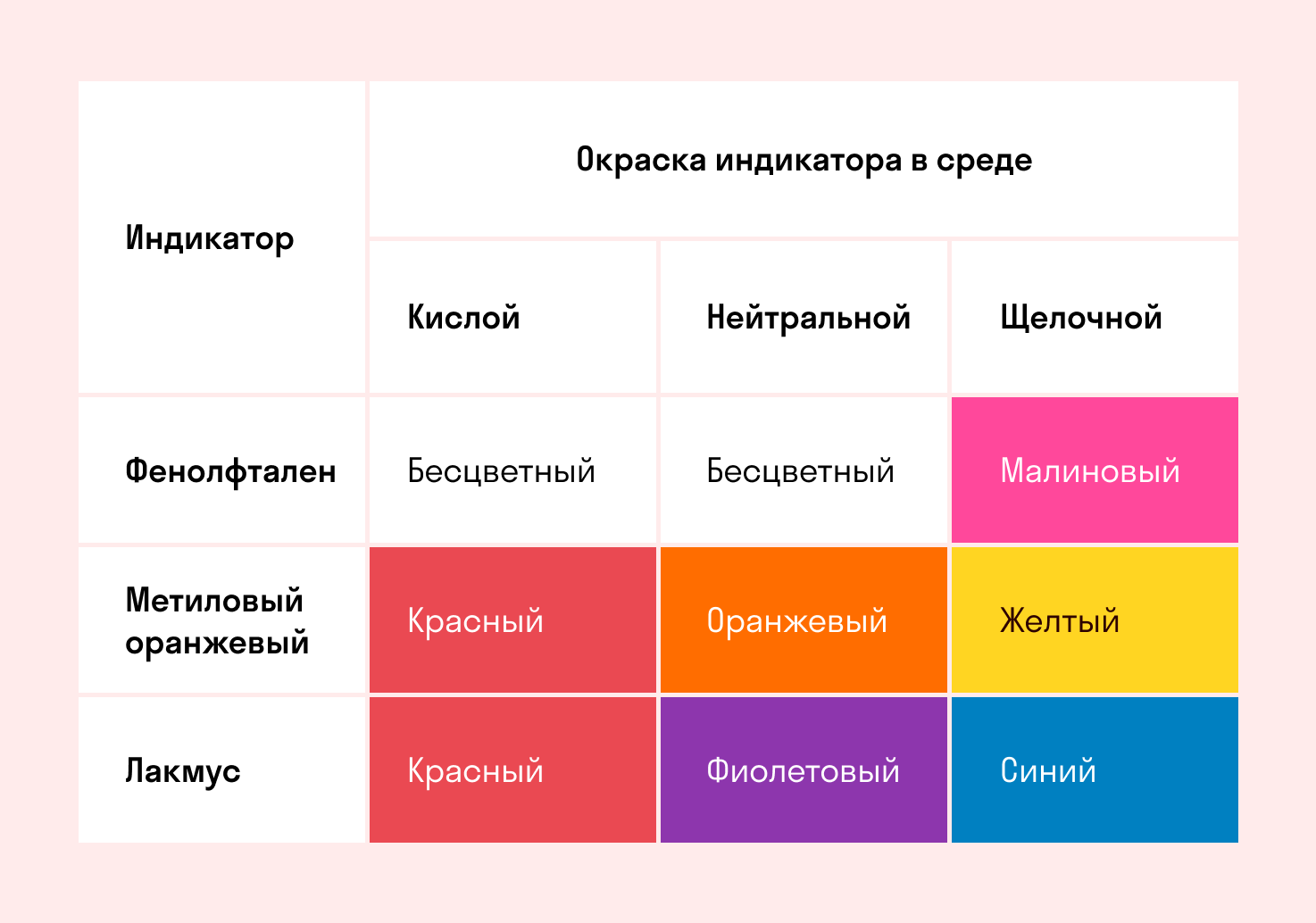
Для ряда кислот характерны специфические свойства. Все кислоты имеют определенную окраску в индикаторах.
Рассмотрим подробнее общие свойства кислот.
Диссоциация
Кислоты — это электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка. Диссоциация кислот происходит ступенчато. По способности к диссоциации кислоты разделяют на две группы:
Хорошо диссоциирующие (сильные): H2SO4, HCl, HBr, HNO3, HClO4, HI.
Разложение
В результате реакций разложения кислородсодержащих кислот образуются кислотный оксид и вода. Бескислородные кислоты образуют простые вещества. Для разложения некоторых кислот необходимо нагревание или излучение (HCl, HNO3, H3PO4) другие же разлагаются самопроизвольно в момент образования (H2CO3, H2SO3, HNO2).
Взаимодействие кислот с металлами
Металл может вытеснять водород из кислоты только в том случае, если металл стоит левее водорода в ряду активности металлов. Продукты реакции — соль и водород.

При взаимодействии с кислотами-окислителями, например, азотной, образуется продукт восстановления кислоты, хотя протекание реакции также неоднозначно.
Высокая окислительная способность серной и азотной кислот позволяет им вступать в реакции с металлами. Продукты реакции будут зависеть от активности металла и от концентрации кислот.
Таблица: химические свойства кислот-окислителей
На холоду — пассивация
Реакция не проходит
Взаимодействие кислот с основаниями
Кислоты реагируют с основаниями и амфотерными гидроксидами, в результате образуются соль и вода. Взаимодействие кислот с основаниями называют реакцией нейтрализации.
NaOH + HCl = NaCl + H2O
Взаимодействие кислот с солями
Сильные кислоты вытесняют слабые из растворов их солей, при этом образуются новая соль и новая кислота. Условие протекания реакции кислот с солями — одним из продуктов реакции должны быть нерастворимая соль или слабая кислота, вода, газ.
Взаимодействие кислот с основными и амфотерными оксидами
Кислоты вступают в реакцию с основными и амфотерными оксидами (последние ведут себя как основные оксиды). В результате реакции образуется соль и вода.
Восстановительные свойства бескислородных кислот
Бескислородные кислоты (кроме HF) проявляют восстановительные свойства за счет химического элемента, который входит в состав аниона, при действии на них различных окислителей.
Например, в качестве окислителей для всех галогеноводородных кислот выступают диоксид марганца MnO2, перманганат калия KMnO4, дихромат калия K2Cr2O7.
Результат этих реакций — образование свободных галогенов.
Из галогеноводородных кислот наибольшая восстановительная активность — у йодоводородной. Ее могут окислять оксид железа (III) и соль трехвалентного железа.
Высокая восстановительная активность характерна для сероводородной кислоты, она может быть окислена диоксидом серы.
Способность окрашивать индикаторы
Индикаторы кислот — это специальные вещества, при помощи которых определяют наличие кислот в растворе.
Вопросы для самоконтроля
С чем реагируют кислоты?
При каких условиях кислоты взаимодействуют с солями? Приведите пример.
Составьте уравнения реакций и назовите продукты реакций:
Разбавленный раствор серной кислоты реагирует с: медью, хлоридом меди, сульфатом меди, цинком?
1. Общая характеристика оксидов
Оксидами называют сложные вещества, состоящие из двух химических элементов, одним из которых является кислород.
Оксиды — весьма распространённый в природе класс соединений. Они находятся в воздухе, распространены в гидросфере и литосфере.
На Земле вода встречается во всех трёх агрегатных состояниях — газообразном (водяной пар), жидком и твёрдом (лёд, снег). На долю воды также приходится большая часть массы живых организмов.


Примесь этого очень ядовитого вещества может содержаться в воздухе. Основным источником загрязнения является транспорт. Угарный газ образуется в результате неполного сгорания топлива. Этот же оксид образуется и во время пожаров.
В природе этот оксид встречается в виде минерала гематита. Он составляет основу руды, называемой красным железняком.

Оксиды принято группировать в зависимости от их способности реагировать с кислотами и основаниями. Различают три важнейшие группы оксидов: основные, кислотные и амфотерные. Их относят к солеобразующим оксидам. Существуют также оксиды, которые называют несолеобразующими.
Основные оксиды образуются химическими элементами — металлами. Как правило, степень окисления элемента, образующего основный оксид, является невысокой: \(+1\) или \(+2\).
Кислотные оксиды образуют элементы — неметаллы. Например, оксид серы(\(VI\)) SO 3 , оксид азота(\(IV\)) NO 2 .
Если металлический элемент имеет переменную валентность (проявляет несколько степеней окисления), то из всех образуемых им оксидов амфотерными свойствами обладают те, в которых этот элемент имеет промежуточную валентность (промежуточную степень окисления).
К ним относятся: оксид углерода(\(II\)) CO , оксид кремния(\(II\)) SiO ,оксид азота(\(I\)) N 2 O , оксид азота(\(II\)) NO .
В соответствии с номенклатурой ИЮПАК, оксиды называют словом «оксид», после которого следует наименование химического элемента в родительном падеже.
Если элемент, образующий оксид, имеет переменную степень окисления (или валентность), то в названии оксида указывается его степень окисления римской цифрой в скобках сразу после названия (без пробела).
Например: Cu 2 O — оксид меди(\(I\)), CuO — оксид меди(\(II\)), FeO — оксид железа(\(II\)), Fe 2 O 3 — оксид железа(\(III\)), Cl 2 O 7 — оксид хлора(\(VII\)).
Часто используют и другие наименования оксидов по числу атомов кислорода: если оксид содержит только один атом кислорода, то его называют монооксидом, или моноокисью, если два — диоксидом, или двуокисью, если три — то триоксидом, или трёхокисью и т. д.
Также распространены исторически сложившиеся (тривиальные) названия оксидов, например, угарный газ CO , серный ангидрид SO 3 и т. д.
Читайте также:
