Общая характеристика металлов 1 а группы
Атомы элементов IА–IIIА групп имеют сходство в строении электронных оболочек и закономерностях изменения свойств, что приводит к некоторому сходству их химических свойств и свойств их соединений.
Металлы IA (первой группы главной подгруппы) также называются «щелочные металлы«. К ним относятся литий, натрий, калий, рубидий, цезий. Франций – радиоактивный элемент, в природе практически не встречается. У всех металлов IA группы на внешнем энергетическом уровне, на s-подуровне в основном состоянии есть один неспаренный электрон:
… ns 1 — электронное строение внешнего энергетического уровня щелочных металлов
Металлы IA группы — s-элементы. В химических реакциях они отдают один валентный электрон, поэтому для них характерна постоянная степень окисления +1.
Рассмотрим характеристики элементов IA группы:
Все щелочные металлы — сильные восстановители. Это самые активные металлы, которые могут непосредственно взаимодействовать с неметаллами. С ростом порядкового номера и уменьшением энергии ионизации металлические свойства элементов усиливаются. Щелочные металлы образуют с кислородом оксиды Э2О. Оксиды щелочных металлов реагируют с водой с образованием основания (щелочи):
Водородные соединения щелочных металлов — это гидриды с общей формулой ЭН. Степень окисления водорода в гидридах равна -1.
Металлы IIA (второй группы главной подгруппы) — щелочноземельные. Раньше к щелочноземельным металлам относили только кальций, стронций, барий и радий, но по решению ИЮПАК бериллий и магний также называются щелочноземельными.
У щелочноземельных металлов на внешнем энергетическом уровне расположены два электрона. В основном состоянии это два спаренных электрона на s-подуровне:
… ns 2 — электронное строение внешнего энергетического уровня элементов IIA группы
Щелочноземельные металлы — s-элементы. Отдавая два валентных электрона, они проявляют постоянную степень окисления +2. Все элементы подгруппы бериллия — сильные восстановители, но восстановительные свойства выражены слабее, чем у щелочных металлов.
Характеристики элементов IIA группы:
Металлы подгруппы бериллия довольно активны. На воздухе они легко окисляются, образуя основные оксиды с общей формулой ЭО. Этим оксидам соответствуют гидроксиды Э(ОН)2.
Первый элемент IIA группы, бериллий, по большинству свойств гораздо ближе к алюминию (диагональное сходство). Это проявляется в свойствах бериллия. Например, он не взаимодействует с водой. Магний взаимодействует с водой только при нагревании. Кальций, стронций и барий — это типичные металлы. Они реагируют с водой при обычных условиях.
Элементам IIA группы соответствуют гидриды с общей формулой ЭН2.
Элементы IIIA (третьей группы главной подгруппы) — это бор, алюминий, галлий, индий, таллий и нихоний. В основном состоянии содержат на внешнем энергетическом уровне три электрона, которые распределены по s- и р-подуровням:
… ns 2 nр 1 — электронное строение внешнего энергетического уровня элементов IIIA группы
Все элементы подгруппы бора относятся к р-элементам. В химических соединениях проявляются степень окисления +3. Хотя для таллия более устойчивая степень окисления +1.
Металлические свойства у элементов подгруппы бора выражены слабее, чем у элементов IIA подгруппы. Элмент бор относится к неметаллам. Энергия ионизации атома у бора наибольшая среди элментов IIIA подгруппы. Алюминий относится к типичным металлам, но оксид и гидроксид алюминия проявляют амфотерные свойства. У таллия более сильно выражены металлические свойства, в степени окисления +1 он близок по свойствам к щелочным металлам. Наибольшее практическое значение среди элементов IIIA подгруппы имеет алюминий.
Общая характеристика подгруппы
Групповое сходство элементов обусловлено наличием 2-х спаренных электронов на внешнем электронном слое и заключается в следующем:
- постоянная валентность II
- постоянная степень окисления +2
- легкость образования 2-зарядных ионов Me +2
С ростом заряда ядра и радиуса атомов свойства элементов закономерно изменяются:
- энергия ионизации Еион уменьшается
- сродство атомов к электрону уменьшается
- металлические свойства усиливаются
По важнейшим атомным характеристикам и по физико-химическим свойствам металлов и их соединений наибольшим сходством между собой обладают Са, Sr , Ba , имеющие общее название - щелочноземельные металлы. Эти элементы имеют практически одинаковые значения ЭО, находятся рядом в электрохимическом ряду напряжений; химическая активность в целом от Са к Ва возрастает незначительно; они во многих отношениях сходны со щелочными металлами.
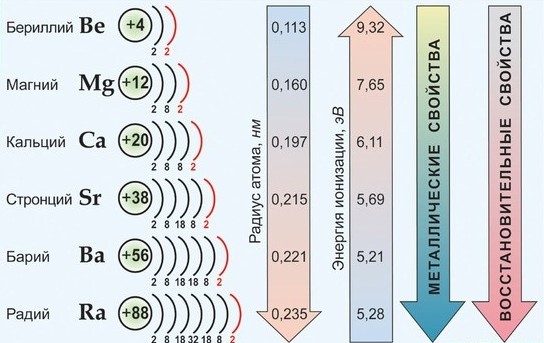
Среди s 2 -элементов резко выделяется бериллий, который обнаруживает более значительное сходство с алюминием (диагональное сходство). По распространенности в природе и по практической значимости важнейшими элементами являются Са и Mg.
В свободном состоянии в виде простых веществ все s 2 -элементы - белые твердые вещества с металлическим блеском на срезе, обладающие всеми общими свойствами металлов. Лишь бериллий хрупкий и плохо поддается обработке.
Характеристические соединения
отношение к воде
не растворимый, не взаимодействует
хорошо растворимые, взаимодействуют
Магний
Изотопы 24 Mg (78.60 %)
Кларк в земной коре 2,35 % по массе. В свободном виде не встречается. Является одним из самых распространенных породообразующих элементов (более 200 минералов). Основные из них:
- магнезит MgCO3 - доломит СаСО3 • МgСО3
- карналлит КСl • МgСl2 • 6Н2O
- горькая (английская) соль MgS04• 7H2O В виде катионов Mg 2+ находится в природных водах (в 1 м 3 морской воды содержится около 1 кг Mg 2+ ). Наряду с ионами Са 2+ обусловливает жесткость воды.
Магний и его соединения играют важную роль в биологических процессах. В качестве комплексообразователя Mg входит в молекулы хлорофилла, а также в другие важные биокомплексы.
Магний - единственный элемент гл. подгр. II группы, применяемый в сравнительно больших количествах в металлическом состоянии (как свободный металл).
Физические свойства
В чистом виде магний - блестящий серебристобелый металл, быстро тускнеющий на воздухе вследствие окисления. Это легкий, относительно мягкий и пластичный металл, легкоплавкий и обладающий хорошей электропроводностью. В сплавах с Al является основным конструкционным материалом в авиа-, судо- и ракетостроении.
Способы получения
1. Электролитический (основной). Электролизу подвергают тщательно обезвоженный расплав хлорида магния (t ≈ 800°C):
2. Карботермический (t ˃ 2000°C)
MgO + С = Mg↑(пары) + СО ↑
Химические свойства
Mg - химически активный металл, особенно в порошкообразном состоянии или в виде ленты. Во всех реакциях магний ведет себя как очень сильный восстановитель:
Как и другие активные металлы, Mg взаимодействует с кислотами, растворами солей менее активных металлов, со многими неметаллами. Ниже приведены реакции, в которых проявляются некоторые особенности химического поведения магния.
Взаимодействие с кислородом и азотом при горении на воздухе
Реакция сопровождается выделением болышого количества энергии. в т. ч в виде света. При этом ослепительно белое пламя обогащено фотохимически активными лучами (магниевая вспышка).
Происходит одновременное образование оксида и нитрида:
Взаимодействие с водой
При обычной температуре Мg с водой не реагирует, так как сразу покрывается плотной пленкой - нерастворимым в воде Мg(ОН)2
1) Мg активно реагирует с кипящей водой:
2) особенно активно реагирует с водяным паром (Т > 380°С), поэтому совершенно недопустимо тушить горящий Мg водой - это может привести к взрыву.
3) Мд легко растворяется в воде в присутствии NH4CI:
Протеканию реакции способствует кислая среда, образующаяся в результате гидролиза NH4Cl
Взаимодействие с углекислым газом и др. оксидами
Благодаря сильному сродству к кислороду Мg отнимает его у многих оксидов, например, зажженный Мg продолжает гореть в атмосфере CO2 восстанавливая его до свободного углерода:
2Мg + CO2 = 2МgО + С
Взаимодействие с оксидами и солями металлов
См. «Основные способы получения металлов. Магнийтермия».
Взаимодействие с галогенопроизводными УВ (в среде безводного эфира)
Образующиеся Мg-органические соединения носят общее название реактивов Гриньяра и широко используются в органическом синтезе.
С ростом заряда ядра многие важнейшие характеристики элементов изменяются немонотонно, в том числе и атомный радиус. Соответственно, свойства простых веществ, оксидов, гидроксидов и других соединений этих элементов имеют неоднозначный характер изменения. Особенно резко выделяется первый элемент подгруппы - бор, являющийся единственным неметаллом среди s 2 p 1 -элементов. Бор проявляет диагональное сходство с элементом главной подгруппы IV группы - кремнием Si.
Алюминий - важнейший элемент подгруппы, также имеет целый ряд специфических особенностей, отличающих его от бора, с одной стороны, и от подгруппы галлия, с другой стороны.
слабая кислота 1-основная
амфотерный (идеальный амфолит)
основный со слабыми признаками амфотерности
амфотерный (основные свойства преобладают)
основание (подобен щелочам)
Алюминий
13Аl [Ne] 3s 2 3p 1
1 стабильный изотоп 27 Al
Кларк в земной коре 8,8 % по массе, самый распространенный металл. В свободном виде не встречается.
Основная форма нахождения в природе - Аl2O3 (в составе различных силикатов, полевых шпатов и глин). Встречается также в виде двойных солей: KAl(SO4)2, Na3[AlF6] и др.

Простое вещество алюминий - лёгкий, парамагнитный металл серебристо-белого цвета, легко поддающийся формовке, литью, механической обработке. Алюминий обладает высокой тепло- и электропроводностью, стойкостью к коррозии за счёт быстрого образования прочных оксидных плёнок, защищающих поверхность от дальнейшего взаимодействия. Алюминий обладает высокой электропроводностью и теплопроводностью, обладает высокой светоотражательной способностью. По электропроводности занимает 4-е место после Сu, Аg, Аu.
1. Электролиз расплава AlCl3:
2. Основной промышленный способ - электролиз расплава Al2O3 (глинозема) в криолите 3NaF • AlF3:
AlCl3 + ЗК = Al + 3KCl
Аl - очень химически активный металл, однако при обычных условиях ведет себя довольно инертно - имеет высокую температуру воспламенения, со многими веществами реагирует только при высокой температуре; все реакции с участием Al проходят через первоначальный замедленный период. Такое химическое поведение алюминия объясняется наличием на его поверхности очень тонкой, прочной, газо- и водонепроницаемой пленки Al2O3. При нарушении цельности этой пленки AI реагирует со многими веществами как активный восстановитель:
Al 0 - Зе - → Аl 3+
В подавляющем большинстве соединений атомы алюминия связаны с соседними атомами ионными связями.
1. Взаимодействие с кислородом и другими неметаллами (галогенами, серой, азотом, углеродом).
Наиболее активно реагирует порошкообразный Al (алюминиевая пудра).
При обычной температуре реакция протекает только на поверхности. После нагревания до температуры воспламенения измельченный Аl сгорает с высоким экзотермичным эффектом.
б) 2Al + 3Cl2 = 2АlСl3 хлорид
Реакция с I2 протекает в присутствии воды. С F2 реакции нет. т. к. в первый же момент образуется прочный поверхностный слой AlF3.
2Al + N2 = 2AlN нитрид
4Al + ЗС = АlС3 карбид
г) C Н2 алюминий непосредственно не соединяется.
2. Взаимодействие с водой в присутствии щелочи.
1) растворение оксидной пленки Al2O3;
2) предотвращение образования нерастворимого гидроксида Аl(ОН)3.
Na[Al(OH)4] - тетрагидроксо-алюминат натрия
В отсутствие щелочи алюминий может вытеснять Н2 из воды в следующих условиях:
1) если его поверхность амальгамировать (покрыть ртутью);
2) в вакууме или в среде инертного газа после предварительной очистки поверхности металла от оксидной пленки.
3. Взаимодействие с «неокисляющими» кислотами (HCl, H2SO4 разб. и др.)
2Al + 6Н + → 2Al 3+ + 3H2↑
4. Взаимодействие с очень концентрированными HNO3 и H2SO4
При обычной Т реакции не протекают, т. к. происходит пассивирование поверхности Al, связанное с внедрением в нее атомарного или молекулярного кислорода, а также образованием его нерастворимых соединений с Al.
При нагревании реакции протекают довольно активно:
5. Взаимодействие с разбавленной HNO3
Реакция медленно протекает при обычной Т, при нагревании - более быстро.
6. Взаимодействие с органическими кислотами
Реакции протекают с разбавленными уксусной и лимонной кислотами при нагревании, ускоряются в присутствии NaCl:
I группа главная подгруппа Периодической системы Менделеева (щелочные металлы)
I группа главная подгруппа Периодической системы Менделеева представляет собой щелочные металлы. К щелочным металлам относят химические элементы:
Литий Li,
Натрий Na,
Калий K,
Цезий Cs,
Рубидий Rb
Франций Fr
Эти металлы очень активны, поэтому их хранят под слоем вазелина или керосина.
Общая характеристика щелочных металлов
От Li к Fr (сверху вниз в периодической таблице) происходит увеличение:
- атомного радиуса,
- металлических, основных, восстановительных свойств,
- реакционной способности.
Уменьшается
- электроотрицательность,
- энергия ионизация,
- сродство к электрону.

Электронные конфигурации у данных элементов схожи, все они содержат 1 электрон на внешнем уровне ns 1 :
Следовательно, типичная степень окисления щелочных металлов в соединениях +1.
Нахождение щелочных металлов в природе

Способы получения щелочных металлов
Литий
- Литий получают в промышленности электролизом расплавахлорида лития в смеси с KCl или BaCl2 (эти соли служат для понижения температуры плавления смеси):
- Известен также способ получения лития из его оксида в вакууме при 300°С:
Натрий
- Натрий получают электролизом расплава хлорида натрия с добавками хлорида кальция:
2NaCl (расплав) → 2Na + Cl2
Электролитом обычно служит смесь NaCl с NaF и КСl (что позволяет проводить процесс при 610–650°С).
- Натрий можно получить, прокаливая соду с углем в закрытых тиглях, пары металла конденсируются на крышке тигля, выход реакции невысокий:
Калий
- Калий получают также электролизом расплавов солей или расплава гидроксида калия, однако на практике таким способом их не получают из-за высокой химической активности
- Наиболее распространены методы термохимического восстановления: восстановление калия из расплавов хлоридов или гидроксидов.:
KCl + Na = K + NaCl
KOH + Na = K + NaOH
В качестве восстановителей используют пары натрия, карбид кальция, алюминий, кремний
Цезий, Рубидий
- Цезий и рубидий получают восстановлением их хлоридов специально подготовленным кальцием при 700–800 °С:
Са + 2CsCl → 2Cs + CaCl2
- В качестве восстановителя также используют цирконий, реакция протекает при 650 °С:
- В промышленности используют преимущественно физико-химические методы выделения чистого цезия: многократную ректификацию в вакууме
Химические свойства щелочных металлов
Качественные реакции — окрашивание пламени солями щелочных металлов

Цвет пламени:
Li — карминно-красный
Na — желтый
K — фиолетовый
Rb — буро-красный
Cs — фиолетово-красный
Взаимодействие щелочных металлов с простыми веществами — неметаллами
С кислородом
С галогенами (F, Cl, Br, I)
Щелочные металлы образуют галогениды:
С водородом
Щелочные металлы образуют гидриды:
С серой
Щелочные металлы образуют сульфиды:
С азотом
При комнатной температуре взаимодействует только литий:
Остальные щелочные металлы реагируют с азотом при нагревании:
С углеродом
Щелочные металлы при нагревании образуют карбиды, преимущественно ацетилениды:
С фосфором
Щелочные металлы активно реагируют с фосфором образуя фосфиды:
Взаимодействие щелочных металлов со сложными веществами
С водой
Щелочные металлы реагируют с водой при обычных условиях:
С кислотами
- С растворами HCl, H2SO4щелочные металлы взаимодействуют с образованием соли и выделением водорода:
с концентрированной серной:
с разбавленной азотной
с концентрированной азотной
С солями
В расплаве щелочные металлы могут взаимодействовать с некоторыми солями:
3Na + AlCl3 → 3NaCl + Al
Запомните! В растворе щелочные металлы взаимодействуют с водой, а не с солями других металлов.
НЕОРГАНИЧЕСКАЯ ХИМИЯ
I группа главная подгруппа Периодической системы Менделеева представляет собой щелочные металлы. К щелочным металлам относят химические элементы: Литий Li, Натрий Na, Калий K, Цезий Cs, Рубидий Rb Франций Fr Эти металлы очень активны, поэтому их хранят под слоем вазелина или керосина. Общая характеристика щелочных металлов От Li к Fr (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств, реакционной способности. Уменьшается электроотрицательность, энергия ионизация, сродство к…
II группа главная подгруппа Периодической таблицы Менделеева (щелочноземельные металлы)
К щелочноземельным металлам относят химические элементы: двувалентные металлы, составляющие IIА группу: Бериллий Be магний Mg кальций Ca, стронций Sr, барий Ba и радий Ra. Хотя бериллий Be по свойствам больше похож на алюминий, а магний Mg проявляет некоторые свойства щелочноземельных металлов, но в целом отличается от них. Все щелочноземельные металлы — вещества серого цвета и гораздо более твердые, чем щелочные металлы. Бериллий Be устойчив на воздухе. Магний и кальций (Mg и Ca) устойчивы в сухом воздухе. Стронций Sr и барий Ba хранят под слоем керосина. Общая характеристка щелочноземельных металлов От Be к Ra (сверху…
III группа главная подгруппа периодической таблицы Менделеева (Алюминий)
Общая характеристика алюминия Алюминий – лёгкий серебристо-белый металл, легко поддающийся формовке, литью, механической обработке. Обладает высокой тепло- и электропроводностью. Аl — довольно активный металл, однако при обычных условиях ведет себя инертно — имеет высокую температуру воспламенения, со многими веществами реагирует только при высокой температуре; Все реакции с участием Al проходят через первоначальный замедленный период из-за наличия на его поверхности очень тонкой, прочной, газо- и водонепроницаемой пленки Al2O3. При нарушении цельности этой пленки…
IV группа главная подгруппа периодической таблицы Менделеева (углерод, кремний)
К элементам главной подгруппы IV группы относятся Углерод С Кремний Si Германий Ge Олово Sn Свинец Pb Общая характеристика элементов 4 группы главной подгруппы От С к Pb (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств, Уменьшается электроотрицательность, энергия ионизация, сродство к электрону. Электронные конфигурации у данных элементов схожи, все они содержат 4 электрона на внешнем слое ns2np2: С – 2s22p2 Si – 3s23p2 Ge…
Соединения углерода
Монооксид углерода (угарный газ) Способы получения угарного газа В промышленности угарный газ получают: при пропускании воздуха через раскаленный уголь: C + O2 → CO2 CO2 + C → 2CO паровая конверсия метана – взаимодействие перегретого водяного пара (температура – 800-900ºС) с метаном. В качестве катализаторов используют Ni, MgO, Al2O3: СН4 + Н2O → СО + 3Н2 взаимодействие метана с углекислым газом (температура – 800-900ºС, кат. – Ni, MgO, Al2O3): СН4 +…
Соединения кремния
Силан (моносилан, гидрид кремния) Способы получения силана Разложение силицида магния соляной кислотой – наиболее распространенный способ получения силана: Mg2Si + 4HCl → 2MgCl2 + SiH4↑ Восстановление галогенидов кремния алюмогидридом лития: SiCl4 + LiAlH4 = SiH4↑ + LiCl + AlCl3 Разложение триэтоксисилана при нагревании до 80ºС в присутствии натрия: 4SiH(OC2H5)3 = SiH4↑ + 3Si(OC2H5)4 Химические свойства силана Силаны (кремневодороды) имеют общую формулу SinH2n+2, где n = 1-8. Цепи -Si-Si- неустойчивы. Моносилан SiH4…
V группа главная подгруппа периодической таблицы Менделеева (азот, фосфор)
К элементам главной подгруппы V группы периодической таблицы Менделеева относятся: Азот N Фосфор P Мышьяк As Сурьма Sb Висмут Bi Общая характеристика элементов 5 группы главной подгруппы От N к Bi (сверху вниз в периодической таблице) Увеличивается атомного радиуса, металлических, основных, восстановительных свойств, Уменьшается электроотрицательность, энергия ионизация, сродство к электрону. Электронные конфигурации у данных элементов схожи, все они содержат 5 электронов на внешнем слое ns2np3: N – 2s2 2p3; P…
Соединения азота
Аммиак (NH3) Способы получения аммиака Промышленный синтез — один из важнейших процессов в химическом производстве. В промышленности аммиак получают прямым синтезом из водорода и азота. Для смещения равновесия в сторону образования аммиака реакцию проводят в присутствии катализатора, при высоком давлении (до 1000 атм.) и высокой температуре (500-550оС): N2 + ЗН2 ⇄ 2NH3+ Q Лабораторный способ В лабораторных условиях аммиак получают при воздействии твердых щелочей на твердые соли аммония: 2NH4Cl +…
Соединения фосфора
Фосфин (PH3) Способы получения фосфина Прямым синтезом PH3 получить нельзя. Фосфин получают путем водного или кислотного гидролиза фосфидов: Ca3P2 + 6H2O → 3Са(ОН)2 + 2PH3↑ Mg3P2 + 6HCl → 3MgCl2 + 2PH3↑ Реакция диспропорционирования фосфора в щелочах: 4P + 3KOH + 3H2O → 3KH2PO2 + PH3↑ Разложение солей фосфония (Температура выше 80ºС): P4I ↔ HI+ PH3↑ Физические свойства фосфина При нормальной температуре фосфин является бесцветным газом с резким чесночным запахом….
VI группа главная подгруппа периодической таблицы Менделеева (кислород, сера)
К элементам главной подгруппы VI группы периодической таблицы Менделеева относятся: Кислород O Сера S Селен Se Теллур Te Полоний Po Общая характеристика элементов 6 группы главной подгруппы От O к Po (сверху вниз в периодической таблице) Увеличивается атомного радиуса, металлических, основных, восстановительных свойств, Уменьшается электроотрицательность, энергия ионизация, сродство к электрону. Электронные конфигурации у данных элементов схожи, все они содержат 6 электронов на внешнем слое ns2np4: O – 2s2 2p4; S…
Читайте также:
